Как устроен сухой гальванический элемент кратко
Обновлено: 05.07.2024

Сухой элемент – тип электрических батарей, часто используемый в портативных электронных устройствах. Он был создан немецким ученым Карлом Гасснером в 1886 году после изобретения влажных марганцево-цинковых элементов Жоржем Лекланше.
Говоря простыми словами, сухой элемент — это батарейка.
Типы сухих элементов
1. Первичный элемент:
- Марганцево-цинковый элемент;
- Щелочной элемент;
- Литиевый элемент;
- Ртутно-цинковый элемент;
- Серебряно-цинковый элемент.
2. Вторичный элемент
- Никель-кадмиевый аккумулятор;
- Литий-ионный аккумулятор;
- Никель-металлгидридный аккумулятор.
Первичные элементы не являются перезаряжаемыми, и, в основном, перерабатываются после того, как внутренняя реакция в элементе потребляет реактивные стартовые химикаты.
Вторичные элементы являются перезаряжаемыми и могут использоваться многократно.
Принцип работы сухого элемента, батарейки
Сухой элемент использует активную пасту в качестве электролита, влажности которой достаточно только для движения тока. В отличие от влажного элемента, сухой элемент может работать в любом положении без протечек, так как не содержит свободной жидкости, что делает его подходящим для портативной электроники.
Для сравнения, первые влажные элементы представляли собой хрупкие стеклянные контейнеры со свинцовыми стержнями, свисающими с открытой верхушки и требующими тщательного ухода во избежание утечек. Свинцово-кислые батареи не смогли дать той безопасности и портативности сухих элементов до момента создания гелевых батареи.
Влажные элементы продолжали использовать для высокозатратных отраслей, к примеру – старт двигателей внутреннего сгорания, так как ухудшение тока в электролите приводит к уменьшению возможностей тока.
Распространенным примером сухого элемента является марганцево-цинковый элемент, иногда называемый сухим Элементом Лекланше, стандартное напряжение которого составляет 1,5 В, как и у щелочных элементов (так как у них используется то же сочетание цинка и оксида марганца (IV)).
В состав стандартного сухого элемента входит цинковый анод, обычно – в виде цилиндрического бака, и угольный катод в виде центрального резервуара. Электролитом служит хлорид аммония в виде активной пасты, расположенной сразу после цинкового анода.
Оставшееся между электролитом и угольным катодом пространство занято вторым видом активной пасты, состоящей из хлорида аммония и оксида марганца (IV), где последний выступает в роли деполяризатора. В некоторых конструкциях оксид марганца (IV) заменяется хлоридом цинка.
Видео
История

Многие экспериментаторы пытались лишить подвижности электролит в электрохимическом элементе, чтобы сделать его более удобным для использования. Замбониев столб, созданный в 1812 году, представлял собой сухую батарею высокого давления, способную передавать ток всего лишь несколько минут.
Различные эксперименты проводились с целлюлозой, древесными опилками, стеклянным волокном, асбестом, волокном и желатином.
В 1886 году Карл Гасснер получил немецкий патент (№ 37758) на модификацию (влажного) Элемента Лекланше, который стал известен, как сухой элемент, так как не содержал свободного жидкого электролита.
Вместо него для создания активной пасты были смешаны хлорид аммония и гипс, а для продления срока жизни было добавлено немного хлорида цинка. Катод из оксида марганца (IV) был погружен в эту активную пасту, и все это было запечатано в цинковую оболочку, также выполняющую функцию анода.
В отличие от прежних влажных элементов, сухой элемент Гасснера был гораздо прочнее, не требовал технического обслуживания, не протекал и мог использоваться в любом положении. Он выдавал напряжение в 1,5 В.
Компания улучшила модель Гасснера за счет замены гипса свернутым картоном, что оставило больше места для катода и сделало батарею более легкой в сборке. Эта батарея стала первой стандартной батареей для массового потребления, и сделала портативную электронику реальной.
Марганцево-цинковый элемент (который стал известен под этим названием) все еще производится.
1. Что такое электрический ток?
Электрическим током называется упорядоченное (направленное) движение заряженных частиц.
2 Что нужно создать в проводнике, чтобы в нём возник и существовал ток?
Для получения электрического тока в проводнике необходимо создать электрическое поле.
Для создания электрического поля в проводнике используются источники электрического тока.
3. Какие превращения энергии происходят внутри источника тока?
В источниках электрического тока происходит превращение механической, внутренней или других видов энергии в электрическую энергию.
В любом из них совершается работа по разделению положительно и отрицательно заряженных частиц.
Разделенные частицы накапливаются на полюсах источника тока.
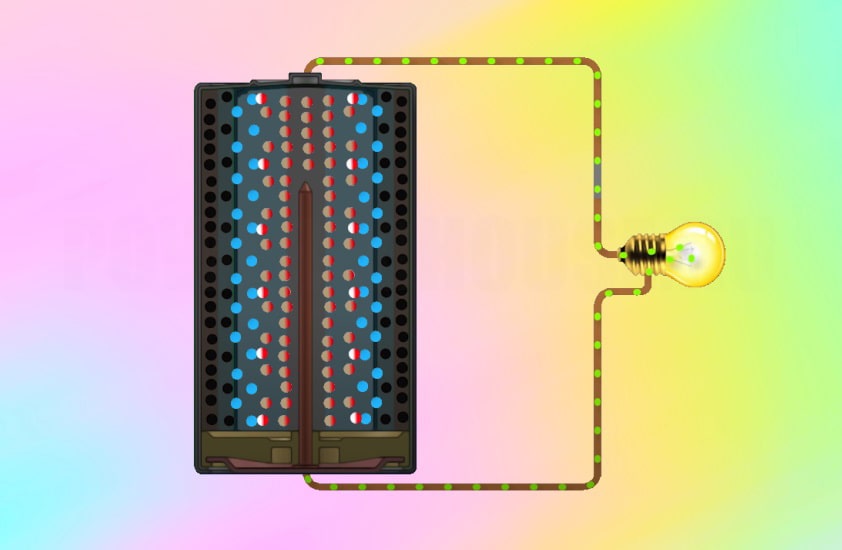
4. Как устроен сухой гальванический элемент?

Гальванический элемент состоит из цинкового сосуда, в который вставлен угольный стержень.
Стержень помещен в полотняный мешочек, наполненный смесью оксида марганца с углем.
В этом элементе используют густой клейстер из муки на растворе нашатыря.
В ходе химической реакции цинка с хлоридом аммония цинковый сосуд заряжается отрицательно, а стержень — положительно.
5. Что происходит внутри гальванического элемента?
В гальваническом элементе происходят химические реакции.
Внутренняя энергия, выделяющаяся при этих реакциях, превращается в электрическую.
5. Что является положительным и отрицательным полюсами батареи?
В результате химической реакции:
- от цинка отделяются положительные ионы, и цинковый сосуд становится отрицательно заряженным.
- угольный стержень становится положительно заряженным.
Между заряженными угольным стержнем и цинковым сосудом, которые называются электродами, возникает электрическое поле.
6. Что такое электрическая батарея?
Из нескольких гальванических элементов можно составить батарею для увеличения мощности источника тока.
Положительные и отрицательные электроды гальванических элементов соединяют между собой.
Здесь угольный стержень первого элемента соединен с цинковым сосудом второго, а угольный стержень второго - с сосудом третьего элемента и т.д.
7. Что такое электрический аккумулятор?
Электрический аккумулятор - это источник тока, аналогичный электрической батарее, но который можно многократно перезаряжать.
Сначала, чтобы аккумулятор стал источником тока, его надо зарядить.
Для этого через него пропускают постоянный электрический ток от какого-нибудь источника тока.
8. Как устроен аккумулятор?
Аккумулятор — это устройство, состоящее из двух электродов (металлических пластин), опущенных в раствор кислоты либо щелочи.
9. С какими полюсами источника тока соединяют полюсы аккумулятора при его зарядке?
При зарядке аккумулятора:
его положительный полюс соединяют с положительным полюсом источника тока,
а его отрицательный полюс- с отрицательным полюсом источника тока.
10. Где применяются аккумуляторы?
Аккумуляторы применяются в автомобилях, железнодорожных вагонах, на подводных лодках, на искусственных спутниках Земли, в мобильных телефонах, плеерах, ноутбуках,и многих других современных устройствах.
Батарейка это прижившееся и не совсем корректное название одиночного гальванического элемента. А уже их соединение в источниках питания для создания нужного напряжения — это батарея. Поэтому не стоит путать эти определения. И если называя гальванический элемент батарейкой, мы поступаем не совсем верно (но смысл понятен), то слово батарея абсолютно никакого отношения не имеет к одиночным химическим источникам электрического тока.
Данный обзор посвящен гальваническому элементу (батарейке) — химическому источнику электрического тока, основанному на взаимодействии двух металлов и (или) их оксидов в электролите, приводящих к возникновению в замкнутой цепи электрического тока. Мы подробно рассмотрим конструктивные особенности элемента, определимся с классификацией и разберемся, как работает батарейка.
История батарейки — гальванического элемента
Александро Вольта предложил разделить все проводники на два рода:
- Сухие — металлы и уголь.
- Влажные — электролиты(влажные).
Шведский ученый Сванте Аррениус, изучая электропроводимость растворов различных веществ, в 1877 году пришел к выводу, что причиной электропроводимости является наличие в растворе ионов, которые образуются при растворении электролита в воде.
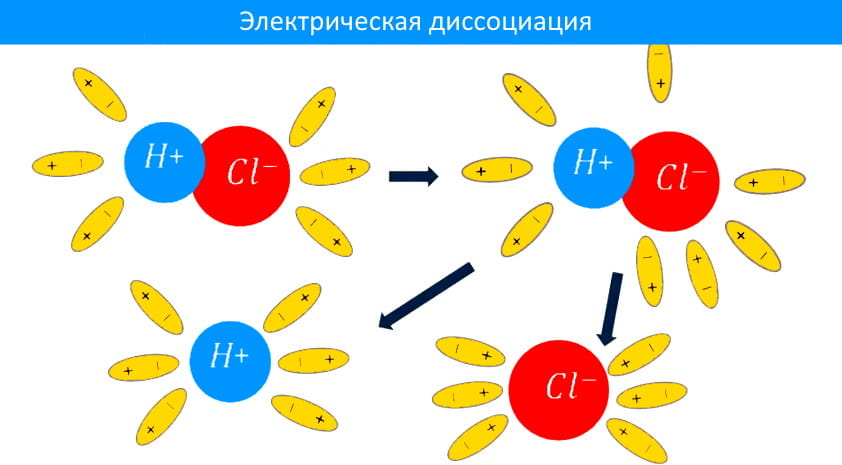
Процесс распада электролита на ионы называется электрической диссоциацией. При диссоциации в воде электролиты диссоциируют на положительно и отрицательно заряженные ионы. Под действием электрического поля, положительно заряженные ионы движутся к отрицательному полюсу источника тока (катоду) и называются катионами, а отрицательно заряженные – к положительному полюсу (аноду) и называются анионами. Таким образом электролиты обладают электронной проводимостью.
Примеры гальванических элементов:
| Название элемента | Отрицательный электрод | Положительный электрод | Электролит |
| Вольтов столб | Цинк | Медь | Раствор щелочи |
| Первый элемент Вольта | Цинк | Медь | Раствор серной кислоты |
| Элемент Даниэля | Цинк | Медь | Раствор сульфата цинка |
| Элемент Грине | Цинк | Угольный стержень | Раствор сульфата меди и бихромата калия |
| Элемент Лекланше | Цинковый цилиндр | Угольный стержень | Раствор нашатыря и оксид марганца |
| Сухой элемент | Цинковый цилиндр | Угольный стержень | Густой клейстер, приготовленный из муки на растворе нашатыря |
Эволюция батарейки — солевой гальванический элемент
Одним из первых гальванических элементов, которым можно было пользоваться вне лабораторий, была конструкция Жоржа Лекланше (1866 год). Она состояла из цинкового анода, катода из диоксида марганца с углем и электролита из хлорида аммония. Со временем элемент Лекланше эволюционировал в солевой (сухой) гальванический элемент следующим образом:
- Цинковый анод стал делаться в виде цинкового стаканчика.
- В стаканчике разместился катод из смеси диоксида марганца и графита.
- В центре катода находится угольный стержень, являющийся токосъемником (в некоторых источниках именно он неправильно называется катодом).
- Катод окружен электролитом из хлорида аммония с добавкой хлорида цинка.
- Электролит уже не в жидком виде, как у Лекланше, а в загущенном (гель). Это происходит путем добавления крахмала и муки, и необходимо для того, чтобы электролит не мог вытечь или высохнуть при хранении и эксплуатации элемента.
Конструкция сухой батареи:
 | 1 — воздушная прослойка |
| 2 — цинковый стакан | |
| 3 — электролит (NH4CL + ZnCl2) | |
| 4 — смесь графита и MnO2 | |
| 5 — угольный стержень | |
| 6 — защитный корпус |
Как работает сухая батарейка (солевой гальванический элемент)
Рассмотрим процессы, происходящие в сухом элементе. При потреблении тока электроны поступают через внешнюю электрическую цепь с цинкового электрода на угольный стержень. Происходят следующие реакции:
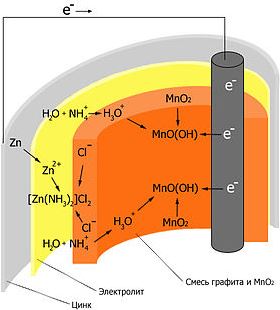
- Анод: Zn → Zn 2+ + 2e − .
- На угольном стержне электроны расходуются на восстановление H3O + — ионов. Катод: 2H3O + + 2e − → H2 + 2H2O.
- Ионы H3O + образуются в результате частичного протолиза NH4 + — ионов электролита: NH4 + + H2O ↔ H3O + + NH3.
- При восстановлении H3O + — ионов образуется водород, который не может удалиться (корпус герметичен) и образует вокруг угольного стержня прослойку газа (поляризация угольного электрода). Ток медленно затухает. Чтобы избежать образования водорода, угольный электрод окружают слоем диоксида марганца (MnO2). В присутствии диоксида марганца H3O + — ионы восстанавливаются с образованием воды. 2MnO2 + 2H3O + + 2e − → 2MnO (OH) + 2H2O. Таким способом избегают поляризации электрода, а диоксид марганца называют деполяризатором. Электролит NH4Cl диссоциирует и частично протолизируется.
- В общем: 2NH4Cl + 2H2O ↔ 2NH3 + 2H3O + + 2Cl − .
- Образующиеся на аноде ионы Zn 2+ поступают в раствор и образуют труднорастворимую соль Zn 2+ + 2NH3 + 2Cl − → [Zn (NH3)2]Cl2.
- Анод: Zn — 2e − → Zn 2+ .
- Катод: 2MnO2 + 2H3O + + 2e − → 2MnO (OH) + 2H2O.
- Раствор электролита: Zn 2+ + 2NH4 + + 2Cl − + 2H2O ↔ [Zn (NH3)2]Cl2 + 2H3O + .
- Общая реакция: Zn + 2MnO2 + 2NH4Cl → 2MnO (OH) + [Zn (NH3)2]Cl2.
Во время разрядки цинковый стакан растворяется. Во избежание вытекания электролита или продуктов реакции цинковый стакан имеет запас по толщине или окружен железной защитной оболочкой.
Что находится внутри щелочной батарейки
Впервые щелочные (алкалайновые) батарейки выпустила компания Eveready (Energizer) в 1959 году. Ее принципиальное отличие от сухой батарейки — состав электролита и конструкция. Электролит состоит не из соли аммония, как в солевой, а из раствора щелочи (обычно гидроксида калия). Конструкция элемента вывернута наизнанку по сравнению с конструкцией солевого элемента. То есть, если у солевого элемента корпус (-), а центральный токоотвод (+), то у щелочного элемента наоборот, корпус (+), а центральный токоотвод (-).
В солевых элементах при химической реакции расходуются все реагенты, составляющие этот элемент — анод, катод, электролит. А в щелочном элементе при химической реакции расходуется только анод и катод, электролит не расходуется. Поэтому электролита там совсем мало, и освободившееся место электролита заполнено увеличенным количеством анода и катода, что значительно увеличивает электроемкость щелочного элемента.
Типичная щелочная батарея выполнена в форме стального цилиндра, покрытого изолирующей пластиковой оболочкой. Положительный конец батарейки (катод) имеет выступающую наружу поверхность. Отрицательный конец (анод) — плоский. Эти две клеммы батарейки электрически изолированы друг от друга.
| 1 — никелированный стальной стакан | 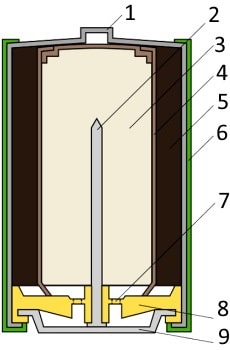 |
| 2 — латунный токосъемник | |
| 3 — анодная паста | |
| 4 — сепаратор | |
| 5 — катодная паста | |
| 6 — защитная оболочка | |
| 7 — предохранительная мембрана | |
| 8 — прокладка | |
| 9 — стальная тарелка |
Корпус батарейки обычно делается из стали с никелевым покрытием. Внутри находится несколько слоев различных материалов, химические реакции которых создают определенные уровни напряжений и токов:
- Первый слой — это катод, представляющий собой смесь оксида марганца (MnO₂) и графита. Этот материал находится в контакте с металлом положительной клеммы. Графит добавляется для улучшения проводимости смеси и увеличения плотности энергии.
- Затем идет сепаратор — слой пористого материала, который образует барьер, предотвращающий прямой контакт анодного и катодного материалов друг с другом. В процессе производства на сепаратор распыляется щелочной электролит — гидроксид калия.
- С другой стороны барьера находится анод, который представляет собой пасту, изготовленную из цинкового порошка (Zn), а также желирующего агента. Желирующий агент поддерживает цинк во взвешенном состоянии, чтобы он не накапливался в одном месте.
Как работает батарейка
Рассмотрим как работает электрическая батарейка и какие реакции взаимодействия происходят между ее химическими компонентами:
- Отрицательно заряженные ионы гидроксида (2OH-) взаимодействуют с цинком (Zn) в анодной секции. В результате химической реакции окисления получается гидроксид цинка (Zn(OH)2) и высвобождаются молекула воды и отрицательно заряженные электроны. Эти электроны теперь свободны для перемещения, и они собираются на латунном штыре (токоотводе отрицательного электрода).
- В то же время диоксида марганца (2MnO2) соединяется с молекулой воды (H2O) из электролита, а также со свободным электроном. Во время такой химической реакции восстановления диоксид марганца превращается в оксид марганца (Mn2O3). Оксид марганца больше не нуждается в атоме гидроксид-иона, поэтому он будет выбрасывать его в электролит.
- Таким образом, появляется скопление электронов на отрицательном конце батарейки. Поскольку больше отрицательно заряженных электронов на отрицательном полюсе по сравнению с положительным, образуется разность напряжений между ними, и эту разность можно измерить с помощью мультиметра.
- Электроны отталкиваются друг от друга и хотят переместиться в область с меньшим количеством электронов. Но сепаратор не позволяет им течь внутри батареи, чтобы достичь положительной клеммы. Если обеспечить электронам внешний путь (например подключив лампочку), то электроны будут течь через него и выполнять работу (заставлять лампу светится).
Пока есть полная цепь между выводами батарейки, химическая реакция будет продолжаться, и электроны будут течь от отрицательного клеммника к положительному. Если разорвать цепь, то химическая реакция прекратится.
Наглядно понять, как работает батарейка и что у нее происходит внутри, можно, ознакомившись с представленной ниже видео демонстрацией.
Как работает батарейка — видео
Химическая реакция в батарейке, к которой подключен потребитель:
- Свободные электроны поступают в батарею через положительную клемму.
- Они соединяются с оксидом марганца и молекулой воды на катоде, которая высвобождает ион гидроксида в электролит.
- Ион гидроксида проходит через сепаратор и соединяется с атомом цинка, образуя гидроксид цинка, и при этом высвобождаются электроны и молекула воды.
- Электроны хотят попасть в область с меньшим количеством электронов, так как положительная клемма имеет меньше электронов, поэтому они будут течь по проводу, чтобы достичь ее.
- Химическая реакция повторяется снова и снова до тех пор, пока не иссякнет ресурс батарейки.
Форм-фактор распространенных гальванических элементов
| Название | Напряжение, V | Диаметр, мм | Высота, мм | Стандарт (щелочные/солевые) | |
| ANSI | IEC | ||||
| Пальчиковая | 1,5 | 14,5 | 50,5 | AA | LR6/R6 |
| Мизинчиковая | 1,5 | 10,5 | 44,5 | AAA | LR03/R03 |
| Baby | 1,5 | 26,2 | 50 | C | LR14/R14 |
| Mono | 1,5 | 34,2 | 61,5 | D | LR20/R20 |
| 9 V Bloc, Крона | 9 | 26 × 22 ×67 | 1604D | 6LR61/6F22 | |
| CR2032 (монета) | 3 | 20 | 3,2 | 5004LC | CR2032 |
Гальванические элементы - устройство, принцип работы, виды и основные характеристики
После смерти Гальвани, его современник Алессандро Вольта, будучи химиком и физиком, опишет и публично продемонстрирует более реальный механизм возникновения электрического тока при контакте разных металлов.

В одном из первых экспериментов Вольта опустил в банку с кислотой две пластинки — цинковую и медную — и соединил их проволокой. После этого цинковая пластина начала растворяться, а на медной стали выделяться пузырьки газа. Вольта предположил и доказал, что по проволоке протекает электрический ток.
Поскольку начало исследованиям положил Луиджи Гальвани, то и название химического источника тока сохранило память о нем в своем названии.
Гальванический элемент — это химический источник электрического тока, основанный на взаимодействии двух металлов и/или их оксидов в электролите, приводящем к возникновению в замкнутой цепи электрического тока. Таким образом, в гальванических элементах химическая энергия переходит в электрическую.
Гальванические элементы сегодня


Щелочные и солевые элементы (батарейки) широко применяются для питания разнообразных электронных устройств, радиоаппаратуры, игрушек, а литиевые чаще всего можно встретить в портативных медицинских приборах типа глюкометров или в цифровой технике вроде фотоаппаратов.

Солевые батарейки
Цинковый электрод (+) — это катод в форме стакана, а анодом служит порошкообразная смесь из диоксида марганца с графитом. Ток течет через графитовый стержень. В качестве электролита используется паста из раствора хлорида аммония с добавлением крахмала или муки для загущения, чтобы ничего не текло.
Обычно производители батареек не указывают точный состав солевых элементов, тем не менее, солевые батарейки являются самыми дешевыми, их обычно используют в тех устройствах, где энергопотребление крайне низко: в часах, в пультах дистанционного управления, в электронных термометрах и т. п.

Понятие "номинальная емкость" редко употребляется для характеристики марганцево-цинковых батареек, так как их емкость сильно зависит от режимов и условий эксплуатации. Основными недостатками этих элементов являются значительная скорость снижения напряжения на всем протяжении разряда и значительное уменьшение отдаваемой емкости при увеличении тока разряда. Конечное разрядное напряжение устанавливают в зависимости от нагрузки в интервале 0,7-1,0 В.
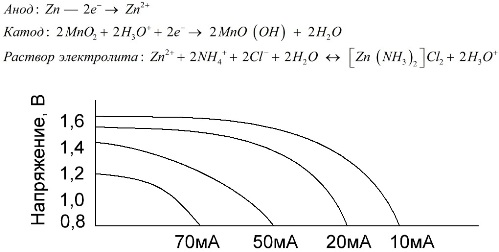
Важна не только величина тока разряда, но и временной график нагрузки. При прерывистом разряде большими и средними токами работоспособность батареек заметно увеличивается по сравнению с непрерывным режимом работы. Однако при малых разрядных токах и многомесячных перерывах в работе емкость их может снижаться в следствии саморазряда.
Выше на графике изображены разрядные кривые для средней солевой батарейки за 4, 10, 20 и 40 часов для сравнения с щелочной, о которой речь пойдет далее.
Щелочные (алкалиновые) батарейки
Щелочной элемент питания — марганцево-цинковый гальванический элемент питания, в котором в качестве катода используется диоксид марганца, в качестве анода — порошкообразный цинк, а в качестве электролита — раствор щёлочи, обычно в виде пасты гидроксида калия.
Эти батарейки обладают целым рядом преимуществ (в частности, существенно большей ёмкостью, лучшей работой при низких температурах и при больших токах нагрузки).

Щелочные батарейки, в сравнении с солевыми, могут обеспечивать больший ток в течение длительного времени. Больший ток становится возможным, поскольку цинк здесь используется не в виде стакана, а в виде порошка, обладающего большей площадью соприкосновения с электролитом. В качестве электролита применяется гидрооксид калия в виде пасты.
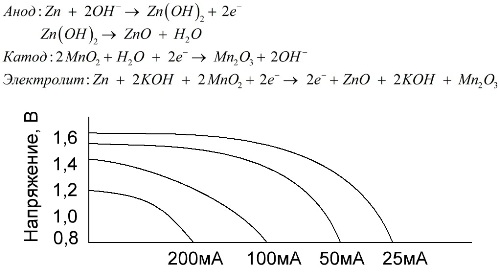
Именно благодаря способности данного вида гальванических элементов в течение длительного времени отдавать значительный ток (до 1 A), щелочные батарейки наиболее распространены в настоящее время.
В электрических игрушках, в портативной медицинской технике, в электронных приборах, в фотоаппаратах — всюду применяются щелочные батарейки. Они служат в 1,5 раза дольше солевых, если разряд идет малым током. На графике изображены разрядные кривые при различных токах для сравнения с солевой батарейкой (график был приведен выше) за 4, 10, 20 и 40 часов.
Литиевые батарейки
Еще одним достаточно распространенным видом гальванических элементов являются литиевые батарейки - одиночные неперезаряжаемые гальванические элементы, в которых в качестве анода используется литий или его соединения. Благодаря использованию щелочного металла они обладают высокой разностью потенциалов.

Литиевые батарейки отличается от других элементов питания высокой продолжительностью работы и высокой стоимостью. В зависимости от выбранного типоразмера и используемых химических материалов, литиевый элемент питания может производить напряжение от 1,5 В (совместим с щелочными батареями) до 3,7 В.
Эти элементы питания обладают наивысшей емкостью на единицу массы и длительным временем хранения. Литиевые элементы широко применяются в современной портативной электронной технике: для питания часов на материнских платах компьютеров, для питания портативных медицинских приборов, наручных часов, калькуляторов, в фототехнике и т. д.
На графике выше приведены разрядные кривые для двух литиевых батареек от двух популярных производителей. Начальный ток составлял 120 мА (на резистор порядка 24 Ома).
Читайте также:

