Химическое и фазовое равновесие кратко
Обновлено: 05.07.2024
Химические реакции делятся на обратимые и необратимые. К обратимым относятся такие химические реакции, при которых продукты реакции взаимодействуют между собой, образуя исходные вещества (идут в прямом и обратном направлениях). Характерной особенностью обратимой химической реакции является то, что она не доходит до конца, а идет до известного предела, после чего не наблюдается изменения концентраций реагирующих веществ.
Например, реакция между водородом и йодом - реакция Боденштейна (1900). Суть опытов состояла в том, что заполненные смесью I2 и Н2 или НI стеклянные ампулы помещали в термостат. Через определенные промежутки времени ампулы быстро охлаждали и проводили анализ на содержание в каждой Н2, I2 и НI. Оказалось, что примерно через 20 ч при 445°С и нормальном давлении реакции прекращались при достижении содержания НI 0,78 М в прямом и обратном направлениях.
При постоянных температуре и давлении скорости прямой и обратной реакций в результате изменений концентраций реагирующих веществ постепенно выравниваются. Химическая реакция протекает самопроизвольно до тех пор, пока не достигнуто химическое равновесие между реагирующими веществами. Химическое равновесие является динамическим равновесием, при котором скорости прямой и обратной реакций равны друг другу, а концентрации всех участвующих в реакции веществ остаются постоянными.
Между понятиями "обратимая реакция" и "термодинамический обратимый процесс" нет ничего общего. Все реальные процессы, в том числе и обратимые химические реакции, являются термодинамически необратимыми процессами.
Пределом протекания обратимых реакций при заданных условиях является достижение состояния химического равновесия.
Состояние химического равновесия определяется общими признаками:
1) если система находится в состоянии равновесия, то состав ее с течением времени при постоянных внешних условиях не изменяется;
2) если система, находящаяся в равновесии, будет выведена из этого состояния вследствие внешних воздействий, то с прекращением их действия она возвратится к прежнему состоянию.
При практическом определении равновесия химических реакций, протекающих сравнительно быстро, часто руководствуются только первым признаком. Количественное описание обратимых реакций проводят с помощью закона действующих масс (з.д.м.), который был открыт в 1867 г. норвежскими учеными - математиком Гульдбергом и химиком Вааге.
Применительно к гомогенным реакциям типа аА + вВ сС + дД з.д.м. формулируется так: химическая реакция находится в состоянии равновесия, если отношение произведения концентраций продуктов к произведению концентраций реагентов достигает постоянного значения, характерного для реакции при данной температуре.
Для реакций, протекающих в растворах, - запись закона через молярные концентрации или активности выглядит следующим образом:
Для описания реакций между газообразными веществами используют выражения через равновесные мольные доли х или равновесныепарциальные давления р:
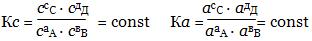
Соотношения, вытекающие из II закона термодинамики, могут быть применены к химическим процессам для принципиального решения вопроса о направленности химических реакций, состоянии равновесия и возможности его смещения.
Для решения вопроса о возможности протекания химической реакции в том или ином направлении необходимо, прежде всего, установить количественный критерий способности различных веществ вступать в химические реакции. В качестве такого критерия Гиббсом и Гельмгольцем было предложено считать ту максимальную работу (Аmax), которую можно получить при обратимом протекании химической реакции. Так как большинство химических реакций протекают при постоянных р и Т, Аmax химической реакции будет численно равна изменению изобарно-изотермического потенциала G: Аmax = - ΔG. Поэтому величину ΔGр,Т, являющуюся мерой химического взаимодействия реагентов, называют химическим сродством.
Для самопроизвольно протекающей химической реакции критерием протекания реакции в прямом направлении будет являться убыль ΔG, т.е. условие
ΔGр,Т 0, что противоречит II закону термодинамики.
Химическая реакция протекает самопроизвольно до тех пор, пока не установится состояние химического равновесия, которому соответствует условие ΔG = 0.
Таким образом, величина ΔGр,Т играет роль движущей силы химической реакции. Чем меньше ΔGр,Т , т.е. чем дальше система от состояния химического равновесия, тем более она реакционноспособна.

Для реакции аА + вВ сС + дД
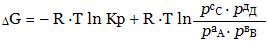
Это выражение впервые было выведено Вант-Гоффом и называется уравнением изотермы реакции.
Уравнение изотермы позволяет вычислить ΔG, а также предсказать направление протекания реакции при заданных условиях, если известны относительные парциальные давления реагирующих веществ в момент смешивания.
Если оба слагаемых в правой части уравнения равны между собой, то ΔG = 0, что отвечает состоянию химического равновесия в закрытой системе.
Если ΔG 0, то самопроизвольное протекание реакции возможно в направлении образования исходных веществ, т.е. справа налево.
В условиях V,Т = const в качестве количественного критерия способности веществ вступать в реакции используют ΔF.
Константы химического равновесия Кс и Кр являются постоянными при данной температуре. С повышением или понижением Т они изменяются. Зависимость Кс (Кр) от температуры отражена в уравнениях изобары и изохоры, выведенных Вант-Гоффом.

Эти уравнения показывают, что при положительных значениях ΔH (эндотермическая реакция) или ΔU левая часть уравнения положительна, и Кр увеличивается с повышением Т. Для экзотермической реакции ΔH отрицательна, и Кр уменьшается с повышением Т. В тех случаях, когда ΔH очень небольшое, Кр не зависит от Т.
В небольшом температурном интервале ΔH и ΔU не изменяются. Поэтому уравнения изобары и изохоры можно проинтегрировать, получив следующие уравнения:
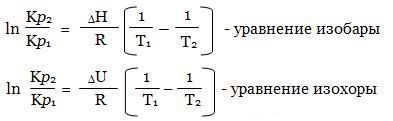
Уравнения в интегрированной форме позволяют определять Кр при заданной Т, если Кр известна для другой Т, а также известен тепловой эффект реакции ΔH или ΔU.
Такие же качественные выводы о влиянии Т на химическое равновесие могут быть получены из общего принципа смещения равновесия, сформулированного Ле Шателье и Брауном: если на систему, находящуюся в устойчивом равновесии, оказывать воздействие извне, изменяя какое-нибудь из условий, например, температуру, то в системе усилится то из направлений процесса, протекание которого ослабляет влияние воздействия.
Влияние Т на смещение химического равновесия: при повышении Т Кр уменьшается для экзотермических реакций и увеличивается для эндотермических.
Влияние р на смещение химического равновесия: если соотношение неравновесных парциальных давлений (в соответствии с з.д.м.) меньше Кр, то равновесие сдвигается в сторону образования продуктов, если больше Кр, то равновесие сдвигается в сторону образования реагентов.
Как и в случае гомогенной химической реакции, константа гетерогенного химического равновесия равна отношению произведения равновесных концентраций (активностей) или парциальных давлений продуктов реакций к произведению равновесных концентраций (активностей) или парциальных давлений исходных веществ в степенях, равных стехиометрическим коэффициентам соответственно продуктов реакций и исходных веществ.
Примерами гетерогенных химических равновесий могут быть равновесия при пароводяной конверсии углерода

С(т) + 2Н2О СО2 + 2Н2
или при термическом разложении карбоната кальция

СаСО3 (т) СаО (т) + СО2.
Для указанных реакций константы гетерогенного химического равновесия выражаются с помощью следующих уравнений:
• для пароводяной конверсии углерода
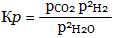
• для термического разложения карбоната кальция
Как видно, в уравнения констант гетерогенного химического равновесия не входят члены, относящиеся к твердым веществам, участвующим в прямой и обратной реакциях.
Константа гетерогенного химического равновесия зависит от температуры. Она возрастает с увеличением температуры в случае эндотермической прямой реакции (ΔH > 0) и уменьшается с увеличением температуры в случае экзотермической прямой реакции (ΔH + и Сl - составляющими веществами не являются.
Составляющие вещества, наименьшее число которых необходимо для однозначного выражения состава каждой фазы при любых условиях существования системы, называются компонентами (К). По числу компонентов различают одно-, двух-, трех- и многокомпонентные системы. Если в системе между составляющими веществами нет химического взаимодействия, то число компонентов равно числу составляющих веществ. При химическом взаимодействии в системе число компонентов находится как разность между числом составляющих веществ и числом уравнений, связывающих равновесные концентрации этих веществ.
Любая термодинамическая система обладает определенными свойствами. Термодинамические свойства, наименьшее количество которых необходимо для описания состояния данной системы, называются параметрами состояния. В качестве параметров состояния выбирают такие термодинамические свойства, которые легко могут быть измерены: Т, р, с.
Число независимых термодинамических параметров состояния фаз равновесной системы, произвольное изменение которых в определенных пределах не вызывает исчезновения одних и образования других фаз, называется числом термодинамических степеней свободы или вариантностью системы (С). По числу термодинамических степеней свободы системы подразделяются на инвариантные (С=0), моновариантные (С=1), дивариантные (С=2) и т.д.
Фазовыми равновесиями называются равновесия, которые устанавливаются между отдельными фазами при физических процессах перехода веществ из одной фазы в другую. Примерами фазовых переходов являются плавление и кристаллизация веществ, испарение и конденсация растворов, аллотропные превращения веществ (Т1 Т2, Т Ж, Ж1 Ж2, Ж Г).
Основной закон гомогенных систем - з.д.м., основной закон гетерогенных систем - закон равновесия фаз, называемый правилом фаз Гиббса: число степеней свободы равновесной гетерогенной системы, на которую влияют только Т и р, равно числу компонентов минус число фаз плюс 2 .
Поскольку число степеней свободы не может быть отрицательным, число фаз в равновесной системе не может превышать К + 2.
Если из внешних факторов на систему оказывает влияние только р или Т, число степеней свободы уменьшается на 1:
Если состояние системы определяется и такими внешними факторами, как электрическое или магнитное поле, поле тяготения и др., то
где n - число факторов.
Рассмотрим примеры систем различной вариантности.
Закономерности, связанные с превращением одной фазы чистого вещества в другую, определяются уравнением Клапейрона - Клаузиуса:
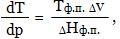
где dT/dp - изменение Т фазового перехода с изменением давления; ΔHф.п. - молярная теплота фазового перехода (изменение энтальпии, отнесенное к 1 моль вещества); Tф.п. - температура фазового перехода.
Уравнение характеризует зависимость Tф.п. от внешнего давления в однокомпонентной системе.
Для равновесия между конденсированными фазами (плавление) уравнение Клапейрона - Клаузиуса выглядит следующим образом:
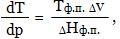
а для процесса испарения -
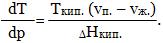
Растворение веществ в воде, взаимодействие одних веществ с образованием других с достижением в системе равновесного состояния - это вопросы, которые изучает статическая химия. В наши дни мы можем говорить о новой, динамической химии, которой свойственно движение и изменение.
Колебательные реакции - реакции, в ходе которых концентрации промежуточных соединений и скорость испытывают колебания. Они являются примером диссипативной структуры, т.е. самоорганизующейся системы (И. Пригожин).
Реакция Белоусова - Жаботинского демонстрирует почти все свойства диссипативных структур, предсказанные теоретическими исследованиями. В 1958 г. Белоусов изучал реакцию взаимодействия лимонной кислоты, бромата калия и серной кислоты в присутствии ионов церия Се 3+ . Оказалось, что гомогенный раствор с большой точностью периодически изменяет окраску с бледно-желтой на бесцветную (Се 4+ /Се 3+ ). Несколькими годами позже Жаботинский повторил и подтвердил опыты Белоусова, заменив лимонную кислоту на малоновую, а в качестве катализатора использовал ионы Fe 2+ . Цвет теперь менялся от красного к синему. Реакция БЖ была первыми химическими часами, число которых продолжает расти. Время действия химических часов может быть неограниченно в проточных реакторах постоянного перемешивания.
Механизм реакций - окислительно-восстановительный, окислитель - BrO3 - , восстановитель - органическая кислота.
Изменение цвета раствора происходит под действием Kt - Ce 3+ , Fe 2+ , Mn 2+ , которые в ходе реакции меняют степень окисления, но до определенной концентрации иона, после чего идет обратный процесс.
Примеры решения задач

Задача 1. В системе А + В С, ΔH 0 0 2 = 2,5.
Для нахождения исходных концентраций веществ А и В учтем, что, согласно уравнению реакции, из 1 моля А и 2 молей В образуется 1 моль С. Поскольку по условию задачи в каждом литре системы образовалось 0,216 моля вещества С, то при этом было израсходовано 0,216 моля А и 0,216 · 2 = 0,432 моля В. Таким образом, искомые исходные концентрации равны:
[А]0 = 0,06 + 0,216 = 0,276 моль/л;
[В]0 = 0,12 + 0,432 = 0,552 моль/л.
Задача 3. Определить число степеней свободы в системе частично замерзшей воды.
В системе существует равновесие: лед вода пар, поэтому система имеет 3 фазы и одну составную часть. Так как эта система физическая, то число составных частей равно числу компонентов, т.е. система однокомпонентная. Отсюда по уравнению С = К - Ф + 2 находим С = 1 - 3 + 2 = 0. Система безвариантна. Это значит, что такая система может существовать только при строго определенных условиях (Т = 0,01°С и р = 6,1 гПа).
Задача 4. В водном растворе содержится смесь хлорида магния и сульфата натрия. Определить количество составных частей и компонентов в данной системе.
Между хлоридом магния и сульфатом натрия в воде возможно одно обратимое химическое взаимодействие:

MgCl2 + Na2SO4 MgSO4 + 2NaCl
Каждое из этих веществ способно к самостоятельному существованию. Таким образом, система состоит из пяти составных частей: четырех солей и воды. Для определения числа компонентов нужно из числа составных частей системы вычесть число возможных химических взаимодействий. Их будет 4.
Вопросы и задачи для самоконтроля
- Что означает состояние химического равновесия? Как можно определить, что в системе наступило равновесие?
- В какую сторону сместится равновесие реакции

СО2 + С 2СО, ΔH° = 172,6 кДж
при повышении температуры? Что произойдет в системе при увеличении давления?

Н2 + Br2 2HBr
Установилось при некоторой температуре при следующих равновесных концентрациях: [Н2] = 0,5 моль/л; [Br2] = 0,1 моль/л; [НBr] = 1,6 моль/л. Найдите Кс. Определите исходные концентрации водорода и брома.
- Как можно увеличить процентное содержание PCl3 в равновесной системе, выраженной уравнением:

PCl5 PCl3 + Cl2, ΔH° = 92,5 кДж?
- Дайте определение понятиям "фаза", "составные части системы", "компонент", "степень свободы равновесной системы".
- В водном растворе содержится смесь хлоридов натрия и кальция. Определите количество составных частей и компонентов в данной системе.
- Взаимодействие карбида кальция с водой выражается уравнением:

СаС2 (т.) + 2Н2О (ж.) С2Н2 (г.) + Са(ОН)2 (т.).
Большинство химических реакций является обратимыми, т.е. они протекают одновременно в двух противоположных направлениях – прямом (®) и обратном (¬), например:
N2(г) + 3Н2(г) « 2NH3(г)
Состояние системы, при котором скорости прямой и обратной реакций равны, называется химическим равновесием. В состоянии равновесия концентрации реагентов и продуктов постоянны; их называют равновесными и обозначают квадратными скобками [ ].
Для приведенной реакции условие химического равновесия запишется так:
Любое химическое равновесие количественно характеризуется константой равновесия – это отношение произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ, возведенных в степени, равные стехиометрическим коэффициентам. Для реакции в общем виде:
константа химического равновесия, выраженная через молярные концентрации веществ, запишется так:
Уравнение (1) является выражением закона действия масс для обратимых реакций.
Если реакция протекает в газовой фазе, то константа равновесия рассчитывается через равновесные парциальные давления. Например, для вышеприведенной реакции синтеза аммиака:
Константа равновесия зависит от природы реагирующих веществ, температуры, но не зависит от концентрации реагентов. Значение константы равновесия определяет глубину превращения исходных веществ в продукты реакции. При Кс>>1 равновесие обратимой реакции смещено в сторону прямой реакции, т.е. реакция дает большой выход продуктов. При Kc правилом Ле Шателье : если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие системы сместится в сторону той реакции, которая ослабляет это воздействие.
1. При уменьшении концентрации одного из веществ равновесие смещается в сторону реакции, которая образует это вещество. При увеличении концентрации вещества равновесие смещается в сторону реакции, которая расходует это вещество.
2. Повышение температуры смещает равновесие в сторону эндотермической реакции, а понижение – в сторону экзотермической реакции.
3. Изменение давления оказывает влияние на равновесие в том случае, если в реакции участвуют газообразные вещества. При повышении внешнего давления равновесие смещается в сторону той реакции, которая сопровождается уменьшением количества газообразных веществ, т.е. уменьшением объема. Наоборот, при понижении внешнего давления равновесие смещается в сторону увеличения количества газообразных веществ, т.е. увеличения объема.
Пример 1. При синтезе аммиака
N2(г) + 3Н2(г) « 2NH3(г)
Равновесие установилось при следующих концентрациях реагирующих веществ, моль/л:
Рассчитайте константу равновесия этой реакции и начальные концентрации азота и водорода.
1. Рассчитаем Кс:
Начальные концентрации азота и водорода найдем исходя из стехиометрии реакции
2. Найдем количество прореагировавшего азота
3. Найдем начальную концентрацию азота:
4. Найдем количество прореагировавшего водорода
5. Найдем начальную концентрацию водорода
Ответ. Кс=0,89;
Пример 2. Объемный состав реакционной смеси в момент равновесия для реакции
2СО2(г) « 2СО(г) + О2(г)
был следующий: 88,72% СО2; 7,52% СО; 3,76% О2. Вычислите константу равновесия для этой реакции, если общее давление в системе равно 1,083×105 Па.
1. Определим парциальное давление реагирующих веществ:
2. Рассчитаем Кр:
Ответ. Кр=27,35.
Пример 3. Реакция протекает по уравнению
4HCl(г) + O2(г) « 2Н2О(г) + 2Cl2(г)
В каком направлении сместится химическое равновесие, если концентрации всех реагирующих веществ увеличить в 2 раза?
1. Скорости прямой и обратной реакций в момент равновесия были следующие:
2. Найдем скорость прямой и обратной реакций после увеличения концентраций в 2 раза
Скорость прямой реакции возросла в 32 раза, а обратной – в 16 раз. Следовательно, равновесие сместится в сторону прямой реакции.
Ответ. При увеличении концентраций всех веществ в 2 раза равновесие сместится в сторону прямой реакции.
Пример 4. Равновесие реакции
2NO(г) + О2(г) « 2NO2(г)
установилось при следующих концентрациях реагирующих веществ, моль/л: [NO]=0,5; [O2]=0,7; [NO2]=2,1. В сторону какой реакции сместится равновесие, если в системе уменьшить общее давление в 2 раза?
1. Найдем скорости прямой и обратной реакций в момент равновесия:
2. При уменьшении давления в 2 раза концентрации всех реагирующих веществ уменьшатся в 2 раза. Найдем скорости прямой и обратной реакций после уменьшения давления:
3. Найдем, как изменятся скорости прямой и обратной реакций после уменьшения давления:
, т.е. скорость прямой реакции уменьшится в 8 раз.
, т.е. скорость обратной реакции уменьшится в 4 раза.
Ответ. Равновесие реакции сместится в сторону обратной реакции.
Пример 5. В какую сторону сместится равновесие реакции
если повысить температуру на 30 градусов? Температурные коэффициенты прямой и обратной реакций, соответственно, равны 2 и 3.
В соответствии с правилом Вант-Гоффа при повышении температуры на 30° скорость прямой реакции возрастет в
а скорость обратной реакции возрастет в
Ответ. При повышении температуры на 30° равновесие сместится в сторону обратной реакции.
Химическое равновесие - состояние химической системы, при котором скорость прямой реакции равна скорости обратной.
В большом количестве заданий, которые мне довелось увидеть, я ни один раз видел, как коверкают это определение. Например, в заданиях верно-неверно предлагают похожий вариант, однако говорят о "равенстве концентраций исходных веществ и продуктов" - это грубая ошибка. Химическое равновесие - равенство скоростей.

Принцип Ле Шателье
В 1884 году французским химиком Анри Ле Шателье был предложен принцип, согласно которому, если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие (изменить температуру, давление, концентрацию), то система будет стремиться компенсировать внешнее воздействие.

Это принцип обоснован термодинамически и доказан. Однако в такой абстрактной формулировке его сложно применить для решения конкретных задач по химическому равновесию. В этой статье я покажу конкретные примеры и обозначу алгоритм действия, чтобы вы могли успешно справляться с заданиями.
Влияние изменения концентрации на химическое равновесие
При увеличении концентрации какого-либо компонента химической реакции, система будет стремиться восстановить равновесие: равновесие будет смещаться в сторону расходования добавленного компонента.
Объясню проще: если вы увеличиваете концентрацию вещества, которое находится в левой части, равновесие сместится в правую сторону. Если добавляете вещество из левой части (продуктов реакции) - смещается в сторону исходных веществ. Посмотрите на пример ниже.
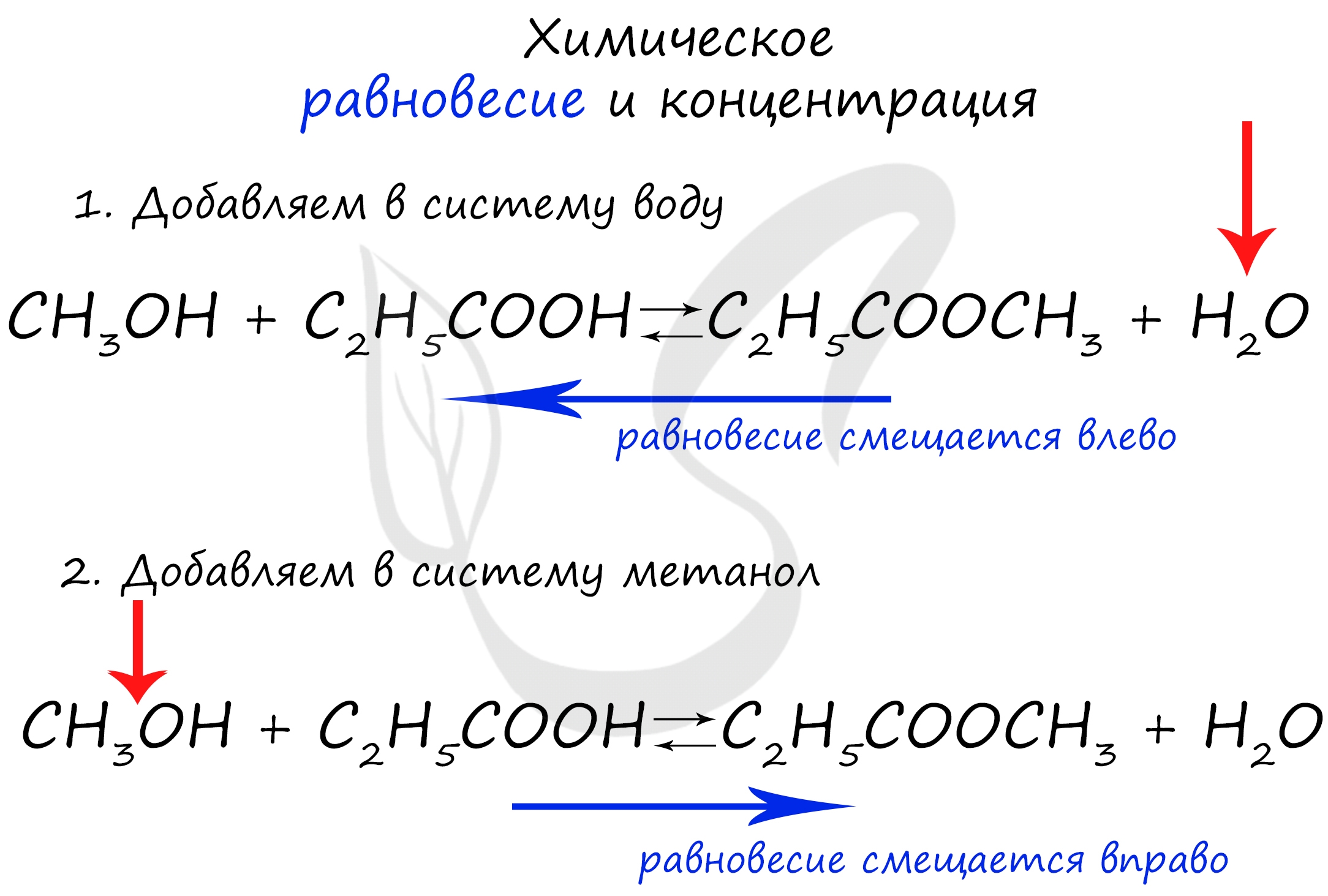
Если мы попытаемся удалить какое-либо вещество из системы (уменьшить его концентрацию), то система будет стремиться заполнить "пустое" место, которые мы создали. Наглядно демонстрирую на примере:
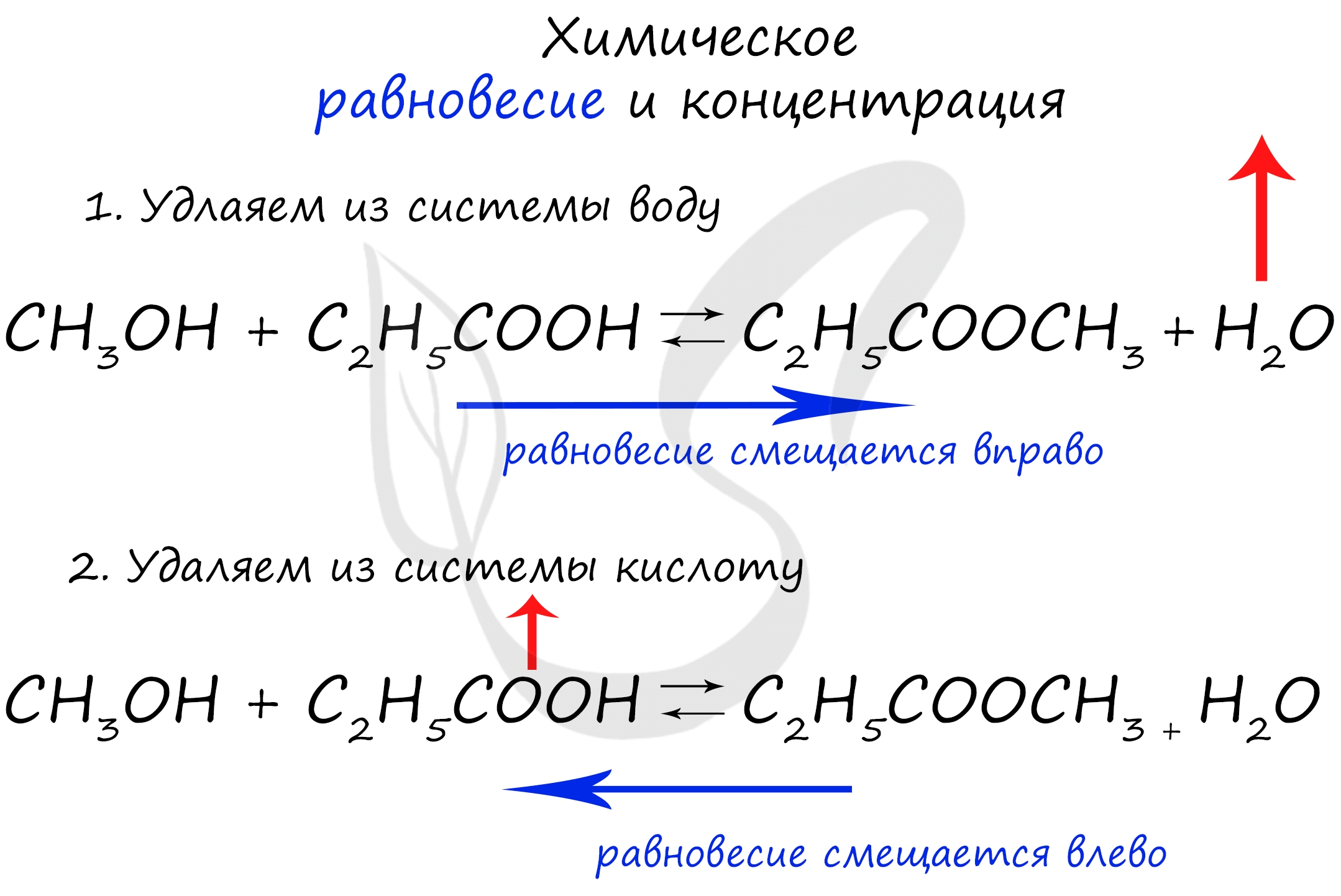
Можно подвести итог полученным знаниям таким образом: "Куда добавляем - оттуда смещается, откуда берем - туда смещается". Воспользуйтесь этой или придумайте свое правило для запоминания этой закономерности ;)
Изменения давления и химическое равновесие
Если речь в задании идет об изменении давления, то первое, что нужно сделать, это посчитать количество газов в уравнении слева и справа. Твердые вещества и жидкости считать не нужно. Например:
В приведенном уравнении количество молекул газа в левой части - 1, в правой - 2.
Запомните правило: "При увеличении давления равновесие смещается в сторону меньших газов, при уменьшении давления - в сторону больших газов". Для нашей системы правило действует таким образом:

В случае, если слева и справа количество молекул газа одинаково, например, в реакции:
Слева - 2 газа, и справа - 2. В такой реакции увеличение или уменьшение давления не повлияет на химическое равновесие.
Изменение температуры и химическое равновесие
Если в задании увеличивают или уменьшают температуру, то первое, что вы должны оценить: экзотермическая это реакция или эндотермическая.
Следуйте следующему правилу: "При увеличении температуры равновесие смещается в сторону эндотермической реакции, при уменьшении - в сторону экзотермической реакции". У любой обратимой реакции есть экзо- и эндотермические части:
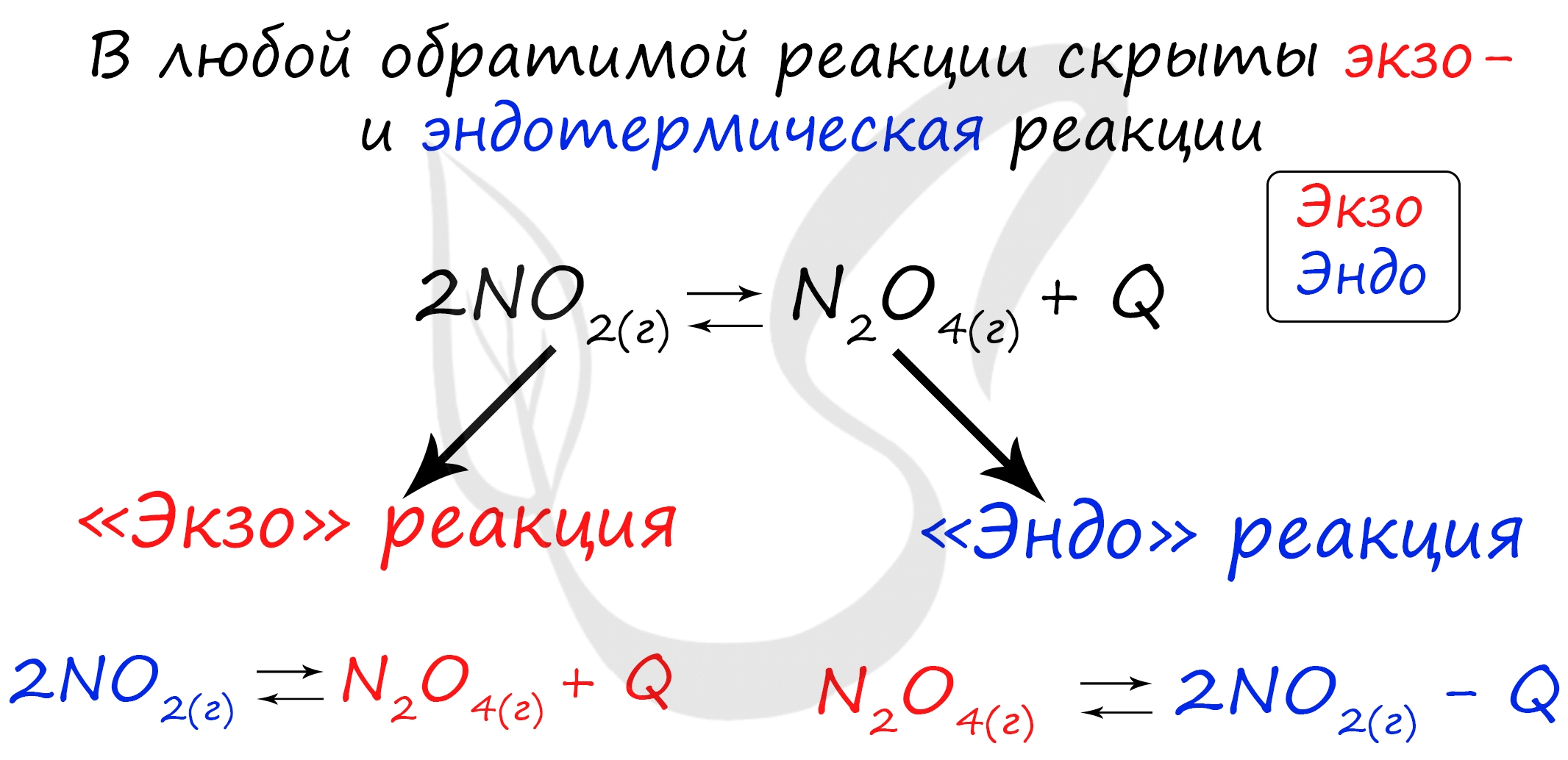
Поэтому данное правило универсально и применимо для всех реакций. Для примера разберем следующие задачи:

Чтобы не осталось белых пятен, возьмем экзотермическую реакцию и повторим с ней подобный эксперимент.

Катализатор и ингибитор
Действие катализатора и ингибитора соответственно касается только ускорения и замедления химической реакции. Они никоим образом не влияют на равновесие.
Константа равновесия
Константой равновесия называют отношения скоростей прямой и обратной реакции. Для реакции типа aA + bB = cC + dD константа равновесия будет записана следующим образом:

Решим задачу. Дана реакция: 2NO + Cl2 ⇄ 2NOCl . Вычислите константу равновесия, если равновесные концентрации веществ для данной реакции: c(NO) = 1.8 моль/л , c(Cl2) = 1.2 моль/л , c(NOCl) = 0.8 моль/л.

Константу равновесия для данной задачи можно представить в виде 1.64 * 10 -1 .
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Химические реакции по направлению делятся на обратимые и необратимые.
Необратимые реакции - это реакции, которые протекают только в одном направлении и завершаются полным превращением исходных веществ в конечные продукты.
Признаками необратимых реакций являются :
– выпадение осадка AgNO3 + NaCl = AgCl↓ + NaNO3
– образование малодиссоциирующего вещества (воды)
HCl + NaOH = H2O + NaCl
Большинство химических реакций обратимы, т.е. могут протекать в прямом и обратном направлении.
Обратимые реакции – это реакции, которые одновременно протекают в противоположных (прямом и обратном) направлениях.
В уравнениях обратимых реакции между левой и правой частными ставятся две стрелки, направленные в противоположные стороны
прямая реакция

N2 + 3H2 2NH3
обратная реакция
Обратимые реакции отличаются от необратимых тем, что не доходят до конца, одновременно идут в обе стороны: в сторону образования продуктов реакции (прямая реакция) и их разложения (обратная реакция).
В обратимых реакциях концентрации исходных веществ уменьшаются, что приводит к уменьшению скорости прямой реакции, а скорость обратной реакции постоянно возрастает, поскольку увеличиваются концентрации продуктов. Когда скорости прямой и обратной реакций становятся одинаковыми, наступает состояние химического равновесия.
Химическое равновесие – это такое состояние системы реагирующих веществ, при котором скорости прямой и обратной реакция равны.
При установившихся условиях (постоянной температуре, давлении) концентрации компонентов остаются неизменными как угодно долго, и называются равновесными. Обозначаются [Н2]
Константа равновесия К – количественная характеристика химического равновесия, она показывает во сколько раз скорость прямой реакции больше обратной.
В общем случае константа равновесия равна отношению произведения концентраций образующихся веществ к произведению концентраций исходных веществ возведенных в степени их стехиометрических коэффициентов.
Для обратимой реакции:

mA + nB pC + qD
Константа равновесия будет иметь вид:
Если К 1, то быстрее идет прямая реакция, если К1, быстрее идет обратная реакция.
Константа равновесия величина постоянная для данной реакции при данной температуре; она зависит от природы реагирующих веществ, но не зависит от концентрации.
2. Смещение химического равновесия
Химическое равновесие является подвижным. При изменении внешних условий (концентрации, температуры, давления) скорости прямой и обратной реакций могут стать неодинаковыми, что обуславливает смещение химического равновесия.
Если в результате внешнего воздействия Vпрямой становится больше Vобратной реакции, то равновесие сместилось вправо (в сторону прямой реакции). Если Vобратной > Vпрямой, то равновесие сместилось влево (в сторону обратной реакции).
Направление смещение равновесия определяется принципом (правилом) Ле Шателье (1884 г.).
Анри–Луи Ле Шателье родился 8 октября 1850 года в Париже. Будущий открыватель знаменитого принципа был широко образованным и эрудированным человеком. Его интересовали и техника, и естественные науки, и общественная жизнь. Много времени он посвятил изучению религии и древних языков. В возрасте 27 лет Ле Шателье стал уже профессором Высшей горной школы, а тридцать лет спустя – Парижского университета. Тогда же он был избран в действительные члены Парижской Академии наук.
Наиболее важный вклад французского ученого в науку был связан с изучением химического равновесия, исследованием смещения равновесия под действием температуры и давления.
Принцип (правилом) Ле Шателье:
Если на систему, находящуюся в равновесии, оказывается какое-либо внешнее воздействие (изменение С, t 0 , р ), то равновесие смещается в сторону той реакции, которая противодействует данному воздействию.
3. Влияние факторов на смещение химического равновесия

На примере реакции N2 + 3H2 2NH3, Δ H= - 46 кДж/моль
1 моль 3 моль 2 моль
Влияние
При увеличении концентраций исходных веществ (N2 и H2) равновесие смещается в сторону прямой реакции; при увеличении концентраций продуктов реакции (NH3) – в сторону обратной реакции.
При уменьшении концентрации продуктов реакции (NH3) (выпадение осадка, выделение газа, образование малодиссоциируемого вещества) равновесие смещается в сторону прямой реакции, образования продуктов реакции.
При увеличении давления равновесие смещается в сторону реакции, которая сопровождается образованием меньшего количества молей газообразных веществ, то есть с уменьшением объема (в данной реакции вправо).
При уменьшении давления – в сторону образования большего количества молей газообразных веществ, то есть с увеличением объема (в данной реакции влево).
Если число молекул в левой части уравнения равно числу молекул в правой части, то изменение давления не вызывает смещения равновесия
В 1901 году был получен первый патент на способ получения аммиака NH3 из азота N2 и водорода H2 в присутствии катализатора, и владельцем этого патента стал Анри–Луи Ле Шателье.
Первая промышленная установка синтеза аммиака была создана немецкими учеными химиком Фрицем Габером и инженером Карлом Бошем только в 1913 году.
С 1903 до 1919 года проводилась работа по подбору (испытывалось более 4 тысяч (20 тыс.) различных веществ). Сейчас в колоннах синтеза аммиака используется катализатор на основе губчатого железа с добавками оксидов калия и алюминия. Практически весь аммиак в промышленности всего мира сейчас получают методом Габера и Боша.
Впоследствии и Габер, и Бош, правда, с интервалом в 13 лет – были удостоены за эту работу Нобелевской премии.
4. Фазовое равновесие
Принцип Ле Шателье применим не только к гомогенным, но и к гетерогенным системам. Любая гетерогенная система состоит из нескольких фаз.
Фаза (Ф) – часть системы, обладающая одинаковым составом, физическими и химическими свойствами, ограниченная от другой части системы поверхностью раздела.
Фазовыми равновесиями называются равновесия, которые устанавливаются между отдельными фазами при физических процессах перехода веществ из одной фазы в другую. Примерами фазовых переходов являются плавление и кристаллизация веществ, испарение и конденсация растворов, аллотропные превращения веществ (Т1 Т2, Т Ж, Ж1 Ж2, Ж Г).
Фазовое равновесие характеризуется некоторым числом фаз, компонентов и числом степеней термодинамической свободы системы.
Каждая система состоит из одного или нескольких веществ. Индивидуальные химические вещества, которые могут быть выделены из системы простыми препаративными методами (кристаллизация, осаждение, испарение) и существовать вне её самостоятельно, называются составляющими веществами системы. Например, в водном растворе KCl составляющие вещества – KCl и Н2О.
Составляющие вещества, наименьшее число которых необходимо для однозначного выражения состава каждой фазы при любых условиях существования системы, называются компонентами (К).
По числу компонентов различают одно-, двух-, трех- и многокомпонентные системы. Если в системе между составляющими веществами нет химического взаимодействия (физические системы), то число компонентов равно числу составляющих веществ. При химическом взаимодействии в системе число компонентов находится как разность между числом составляющих веществ и числом уравнений, связывающих равновесные концентрации этих веществ. Например, возьмем равновесную гетерогенную систему

СаСО3 СаО + СО2
Составляющих веществ – 3.
Число уравнений химических реакций – 1.
Число компонентов в системе равно 3–1=2. Значит система двухкомпонентная.
Число степеней свободы (С) – число параметров состояния системы (давление, температура и концентрация компонентов), которые могут быть одновременно произвольно изменены в некоторых пределах без изменения числа и природы фаз в системе.
По числу термодинамических степеней свободы системы подразделяются на инвариантные (С=0), моновариантные (С=1), дивариантные (С=2) и т.д.
Основной закон гомогенных систем – закон действующих масс, основной закон гетерогенных систем – закон равновесия фаз, называемый правилом фаз Гиббса (1878):
Число степеней свободы равновесной термодинамической системы (С) равно числу независимых компонентов системы (К) минус число фаз (Ф) плюс число внешних факторов, влияющих на равновесие.
Для системы, на которую из внешних факторов влияют только температура и давление, можно записать:
С = К – Ф + 2
Если из внешних факторов на систему оказывает влияние только Р или Т, число степеней свободы уменьшается на 1:
С = К – Ф + 1
Если состояние системы определяется и такими внешними факторами, как электрическое или магнитное поле, поле тяготения и др., то
С = К – Ф + n,
где n – число факторов.
Ненасыщенный раствор поваренной соли
Насыщенный раствор поваренной соли
лед вода пар
Читайте также:

