Вторая группа главная подгруппа конспект
Обновлено: 02.07.2024
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Урок по теме: Общая характеристика элементов главной II группы
Цель: создать условия для формирования знаний об элементах II группы главной подгруппы.
Образовательные:
рассмотреть положение элементов II группы главной подгруппы в Периодической системе;
изучить физические, химические свойства, способы получения и применение водорода.
Развивающие:
- развитие аналитического, творческого, критического, ориентированного на применение проблем осознанного мышления.
Воспитательные:
-воспитывать умение работать в коллективе,
-воспитывать умение оценивать свои знания;
-прививать интерес к предмету химия, к процессам, происходящим в окружающем мире.
Предметные результаты:
- строение атомов элементов II группы;
-положение их в ПСХЭ;
- свойства простых веществ образованных элементами II группы;
-характеризовать химические элементы II группы главной подгруппы по положению в ПСХЭ Д.И.Менделеева и строению атома;
-составлять и записывать уравнения реакций, характеризующих химические свойства металлов и способы их получения;
-на основании физических свойств указывать области применения металлов.
умение соотносить свои действия с планируемыми результатами;
умение организовывать учебное сотрудничество и совместную деятельность с учителем и сверстниками.
Личностные результаты:
развитие ответственного отношения к учению;
развитие осознанного, уважительного и доброжелательного отношения к другому человеку
Тип урока: комбинированный.
Методы: частично-поисковый.
Формы работы учащихся: фронтальная, групповая.
Необходимое техническое оборудование: компьютеры, подключенные к интернету, мультимедийный проектор, интерактивная доска.
Дидактические средства : ресурсы ЦК ЭОР и ФЦИОР.
1. Организационный момент (1 мин.)
Приветствие учителя и учащихся
Определение отсутствующих
2. Этап подготовки учащихся к активному сознательному усвоению знаний.
Перед тем как приступить к изучению нового материала, давайте посмотрим, как вы справились с домашним заданием.
1.Число электронов на внешнем уровне в атомах щелочных металлов:
А – 2 электрона
Б – 1 электрон
В – 3 электрона
2. Степень окисления щелочных металлов в соединениях:
А – (-1)
Б – (+2)
В – (+1)
3. Радиус атомов щелочных металлов от лития к францию:
А – не изменяется
Б – увеличивается
В – уменьшается
4. Металлические и восстановительные свойства щелочных металлов от лития к францию:
А – усиливаются
Б – ослабевают
В – не изменяются
5. К щелочным металлам относятся все металлы в ряду:
А – Mg, Ca, Ba
Б – Li, Na, K
B – B, Al, Ga
Учащиеся обмениваются работами и проводят взаимопроверку .
3. Изучение нового материала.
В этом отрывке есть химическая ошибка, изучая тему нашего сегодняшнего урока, мы ее исправим. Что необходимо знать для разрешения этой задачи. Учащиеся делают предположения: химические и физические свойства веществ.
Учитель. Правильно, а сейчас вы разделитесь на группы, каждая получит свое задание в ходе выполнения, которого, мы и решим нашу проблему.
Класс делится на четыре группы и выполняет работу по выданным им мини-кейсам с заданиями, каждая группа имеет компьютер, на который загружены модули ФЦИОР.
Первая группа.
Изучите свойства Ве
Дайте его характеристику по следующему плану:
Положение в ПСХЭ Д.И.Менделеева.
Нахождение в природе.
Вторая группа.
Изучите свойства Mg . Дайте его характеристику по плану.
Третья группа.
Изучите свойства Са. Дайте его характеристику по плану.
Четвертая группа.
Изучите свойства Sr . Дайте его характеристику по плану.
Пятая группа.
Изучите свойства Ва. Дайте его характеристику по плану.
Работа длится 10 минут, затем обучающиеся делают краткое выступление по изучаемому вопросу, результаты заносятся в сводную таблицу.
Во время отчета второй группы проводится демонстрационный эксперимент.
Итак, ребята давайте ответим на вопрос, какую же ошибку допустил ученик в своем рассказе? Учащиеся отвечают на вопрос.
4. Закрепление полученных знаний.
Посмотрите на таблицу и объясните, почему Mg можно хранить без керосина?
Учащиеся, отвечая на вопрос, рассматривают отличие этого вещества по строению его атома, по химической активности.

5. Итог урока.
1. Оценить степень реализации поставленных на занятии целей.
2.Оценить работу обучающихся во время занятий.
6. Домашнее задание.
Информационный кейс.
К щелочноземельным металлам относятся следующие элементы главной подгруппы II группы Периодической системы: кальций, стронций, барий и радий. Магний имеет ряд сходных со щелочными металлами свойств, бериллий по химическим свойствам ближе к алюминию. Щелочноземельные металлы являются электронными аналогами, внешний электронный уровень имеет строение ns 2 , в соединениях наиболее характерная степень окисления +2. В соединениях с неметаллами основой тип связи – ионный. Соединения щелочноземельных металлов окрашивают бесцветное пламя газовой горелки: кальция – в оранжево-красный, стронция – в темно-красный, бария – в светло-зеленый цвет. В природе щелочноземельные металлы встречаются только в виде соединений, основные минералы кальция – кальцит (известковый шпат, известняк, мрамор, мел) СаСО3, доломит CaMg(CO3)2, гипс CaSO42H2O, флюорит CaF2, гидроксиапатит (фосфорит) Ca5(PO4)3(OH), апатит Ca5(PO4)3F,Cl. Основные минералы стронция – стронцианит SrCO3 и целестин SrSO4, бария – витерит BaCO3 и барит BaSO4.
Физические свойства. Внешне – серебристо-белые блестящие металлы, твердость значительно выше, чем у щелочных металлов. Твердость по группе уменьшается сверху вниз, барий по твердости близок к свинцу. Температуры плавления щелочноземельных металлов выше, чем у щелочных и составляют: для кальция 851 о С, стронция 770 о С, бария 710 о С. Плотности щелочноземельных металлов в подгруппе сверху вниз увеличиваются и равны для Са, Sr и Ва, соответственно 1,54, 2,63 и 3,76 г/см 3 .
Химические свойства щелочноземельных металлов
Щелочноземельные металлы химически весьма активны, в реакциях проявляют свойства восстановителей. Взаимодействуют с
1. Кислородом (горят на воздухе)
При этом образуются и нитриды состава Me3N2. При контакте щелочноземельных металлов с воздухом при комнатной температуре на поверхности металлов образуетсяжелтоватая пленка, состоящая из оксидов, гидроксидов и нитридов.
Оксид бария при нагреваии до 500 о С образуeт пероксид:
который разлагается при температуре выше 800 о С:
2. С водородом при нагревании образуют гидриды
3. С серой реагируют в обычных условиях, образуя сульфиды
4. С азотом – при нагревании образуют нитриды
5. C фосфором – фосфиды
6. С углеродом – при нагревании образуются карбиды, которые являются производными ацетилена:
7. С водой – растворяются с выделением водорода, реакция протекает спокойнее, чем со щелочными металлами:
8. Восстанавливают другие металлы из их соединений, например:
Активность взаимодействия с водой возрастает от кальция к барию.
Получение щелочноземельных металлов
Кальций получают электролизом расплaва хлорида кальция СаCl2, к которому добавляют 5-7% CaF2 для снижения температуры плавления:
Стронций и барий получают методом алюмотермии из оксидов:
Применение щелочноземельных металлов
Металлический кальций применяется как восстановитель и легирующая добавка к сплавам.
Урок химии в 9 классе по программе О.С. Габриеляна, с использованием информационных кейсов и модулей ФЦИОР.
| Вложение | Размер |
|---|---|
| urok_po_teme.docx | 344.59 КБ |
Предварительный просмотр:
Урок по теме: Общая характеристика элементов главной II группы
Цель: создать условия для формирования знаний об элементах II группы главной подгруппы.
рассмотреть положение элементов II группы главной подгруппы в Периодической системе;
изучить физические, химические свойства, способы получения и применение водорода.
- развитие аналитического, творческого, критического, ориентированного на применение проблем осознанного мышления.
-воспитывать умение работать в коллективе,
-воспитывать умение оценивать свои знания;
-прививать интерес к предмету химия, к процессам, происходящим в окружающем мире.
- строение атомов элементов II группы;
-положение их в ПСХЭ;
- свойства простых веществ образованных элементами II группы;
-характеризовать химические элементы II группы главной подгруппы по положению в ПСХЭ Д.И.Менделеева и строению атома;
-составлять и записывать уравнения реакций, характеризующих химические свойства металлов и способы их получения;
-на основании физических свойств указывать области применения металлов.
умение соотносить свои действия с планируемыми результатами;
умение организовывать учебное сотрудничество и совместную деятельность с учителем и сверстниками.
развитие ответственного отношения к учению;
развитие осознанного, уважительного и доброжелательного отношения к другому человеку
Тип урока: комбинированный.
Формы работы учащихся: фронтальная, групповая.
Необходимое техническое оборудование: компьютеры, подключенные к интернету, мультимедийный проектор, интерактивная доска.
Дидактические средства : ресурсы ЦК ЭОР и ФЦИОР.
1. Организационный момент (1 мин.)
Приветствие учителя и учащихся
Определение отсутствующих
2. Этап подготовки учащихся к активному сознательному усвоению знаний.
Перед тем как приступить к изучению нового материала, давайте посмотрим, как вы справились с домашним заданием.
1.Число электронов на внешнем уровне в атомах щелочных металлов:
А – 2 электрона
Б – 1 электрон
В – 3 электрона
2. Степень окисления щелочных металлов в соединениях:
А – (-1)
Б – (+2)
В – (+1)
3. Радиус атомов щелочных металлов от лития к францию:
А – не изменяется
Б – увеличивается
В – уменьшается
4. Металлические и восстановительные свойства щелочных металлов от лития к францию:
А – усиливаются
Б – ослабевают
В – не изменяются
5. К щелочным металлам относятся все металлы в ряду:
А – Mg, Ca, Ba
Б – Li, Na, K
B – B, Al, Ga
Учащиеся обмениваются работами и проводят взаимопроверку .
3. Изучение нового материала.
В этом отрывке есть химическая ошибка, изучая тему нашего сегодняшнего урока, мы ее исправим. Что необходимо знать для разрешения этой задачи. Учащиеся делают предположения: химические и физические свойства веществ.
Учитель. Правильно, а сейчас вы разделитесь на группы, каждая получит свое задание в ходе выполнения, которого, мы и решим нашу проблему.
Класс делится на четыре группы и выполняет работу по выданным им мини-кейсам с заданиями, каждая группа имеет компьютер, на который загружены модули ФЦИОР.
Изучите свойства Ве
Дайте его характеристику по следующему плану:
- Положение в ПСХЭ Д.И.Менделеева.
- Строение атома.
- Нахождение в природе.
- Физические свойства.
- Химические свойства.
Изучите свойства Mg . Дайте его характеристику по плану.
Изучите свойства Са. Дайте его характеристику по плану.
Изучите свойства Sr. Дайте его характеристику по плану.
Изучите свойства Ва. Дайте его характеристику по плану.
Работа длится 10 минут, затем обучающиеся делают краткое выступление по изучаемому вопросу, результаты заносятся в сводную таблицу.
Во время отчета второй группы проводится демонстрационный эксперимент.
Итак, ребята давайте ответим на вопрос, какую же ошибку допустил ученик в своем рассказе? Учащиеся отвечают на вопрос.
4. Закрепление полученных знаний.
Посмотрите на таблицу и объясните, почему Mg можно хранить без керосина?
Учащиеся, отвечая на вопрос, рассматривают отличие этого вещества по строению его атома, по химической активности.
1. Оценить степень реализации поставленных на занятии целей.
2.Оценить работу обучающихся во время занятий.
6. Домашнее задание.
К щелочноземельным металлам относятся следующие элементы главной подгруппы II группы Периодической системы: кальций, стронций, барий и радий. Магний имеет ряд сходных со щелочными металлами свойств, бериллий по химическим свойствам ближе к алюминию. Щелочноземельные металлы являются электронными аналогами, внешний электронный уровень имеет строение ns 2 , в соединениях наиболее характерная степень окисления +2. В соединениях с неметаллами основой тип связи – ионный. Соединения щелочноземельных металлов окрашивают бесцветное пламя газовой горелки: кальция – в оранжево-красный, стронция – в темно-красный, бария – в светло-зеленый цвет. В природе щелочноземельные металлы встречаются только в виде соединений, основные минералы кальция – кальцит (известковый шпат, известняк, мрамор, мел) СаСО 3 , доломит CaMg(CO 3 ) 2 , гипс CaSO 4 2H 2 O, флюорит CaF 2 , гидроксиапатит (фосфорит) Ca 5 (PO 4 ) 3 (OH), апатит Ca 5 (PO 4 ) 3 F,Cl. Основные минералы стронция – стронцианит SrCO 3 и целестин SrSO 4 , бария – витерит BaCO 3 и барит BaSO 4 .
Физические свойства. Внешне – серебристо-белые блестящие металлы, твердость значительно выше, чем у щелочных металлов. Твердость по группе уменьшается сверху вниз, барий по твердости близок к свинцу. Температуры плавления щелочноземельных металлов выше, чем у щелочных и составляют: для кальция 851 о С, стронция 770 о С, бария 710 о С. Плотности щелочноземельных металлов в подгруппе сверху вниз увеличиваются и равны для Са, Sr и Ва, соответственно 1,54, 2,63 и 3,76 г/см 3 .
Химические свойства щелочноземельных металлов
Щелочноземельные металлы химически весьма активны, в реакциях проявляют свойства восстановителей. Взаимодействуют с
1. Кислородом (горят на воздухе)
При этом образуются и нитриды состава Me 3 N 2 . При контакте щелочноземельных металлов с воздухом при комнатной температуре на поверхности металлов образуетсяжелтоватая пленка, состоящая из оксидов, гидроксидов и нитридов.
Оксид бария при нагреваии до 500 о С образуeт пероксид:
2BaO + O 2 = 2BaO 2
который разлагается при температуре выше 800 о С:
2BaO 2 = 2BaO + O 2
2. С водородом при нагревании образуют гидриды
3. С серой реагируют в обычных условиях, образуя сульфиды
4. С азотом – при нагревании образуют нитриды
3Ca + N 2 = Ca 3 N 2
5. C фосфором – фосфиды
3Ca + 2Р = Ca 3 Р 2
6. С углеродом – при нагревании образуются карбиды, которые являются производными ацетилена:
7. С водой – растворяются с выделением водорода, реакция протекает спокойнее, чем со щелочными металлами:
Са + 2Н 2 О = Са(ОН) 2 + Н 2
8. Восстанавливают другие металлы из их соединений, например:
UF 4 + 2Ca = U + 2CaF 2
Активность взаимодействия с водой возрастает от кальция к барию.
Получение щелочноземельных металлов
Кальций получают электролизом расплaва хлорида кальция СаCl 2 , к которому добавляют 5-7% CaF 2 для снижения температуры плавления:
СаCl 2 = Са(катод) + Cl 2 (анод)
Стронций и барий получают методом алюмотермии из оксидов:
3BaO + 2Al = 3Ba + Al 2 O 3
Применение щелочноземельных металлов
Металлический кальций применяется как восстановитель и легирующая добавка к сплавам.
К щелочноземельным металлам относят химические элементы: двувалентные металлы, составляющие IIА группу:
Бериллий Be
магний Mg
кальций Ca,
стронций Sr,
барий Ba и
радий Ra.
Хотя бериллий Be по свойствам больше похож на алюминий, а магний Mg проявляет некоторые свойства щелочноземельных металлов, но в целом отличается от них.
Все щелочноземельные металлы — вещества серого цвета и гораздо более твердые, чем щелочные металлы.
Бериллий Be устойчив на воздухе. Магний и кальций (Mg и Ca) устойчивы в сухом воздухе. Стронций Sr и барий Ba хранят под слоем керосина.
Общая характеристка щелочноземельных металлов
От Be к Ra (сверху вниз в периодической таблице) происходит увеличение:
- атомного радиуса,
- металлических, основных, восстановительных свойств,
- реакционной способности.
Уменьшается
- электроотрицательность,
- энергия ионизация,
- сродство к электрону.

Электронные конфигурации у данных элементов схожи, все они содержат 2 электрона на внешнем уровне ns 2 :
Be — 2s 2
Mg —3s 2
Ca — 4s 2
Sr — 5s 2
Ba — 6s 2
Ra — 7s 2
Нахождение в природе щелочноземельных металлов
Как правило, щелочноземельные металлы в природе присутствуют в виде минеральных солей: хлоридов, бромидов, йодидов, карбонатов, нитратов и др.
Основные минералы, в которых присутствуют щелочноземельные металлы:

Способы получения щелочноземельных металлов
Магний
- Магний получают электролизом солей, чаще всего хлоридов: расплавленного карналлита (KCl·MgCl26H2O) или хлорида магния с добавками хлорида натрия при 720–750°С:
- восстановлением прокаленного доломита в электропечах при 1200–1300°С:
2(CaO · MgO) + Si → 2Mg + Ca2SiO4
Кальций
Кальций получают электролизом расплавленного хлорида кальция с добавками фторида кальция:
Барий
Барий получают алюмотермическим способом — восстановление оксида бария алюминием в вакууме при 1200 °C:
Химические свойства щелочноземельных металлов
Качественные реакции
- Окрашивание пламени солями щелочных металлов
Цвет пламени:

Sr — карминово-красный (алый)

Взаимодействие с простыми веществами — неметаллами
С кислородом
С кислородом взаимодействуют при нагревании с образованием оксидов
С галогенами
Щелочноземельные металлы реагируют с галогенами при нагревании с образованием галогенидов .
С водородом
Щелочноземельные металлы реагируют с водородом при нагревании с образованием гидридов:
Бериллий с водородом не взаимодействует.
Магний реагирует только при повышенном давлении:
С серой
Щелочноземельные металлы при нагревании взаимодействуют с серой с образованием сульфидов сульфидов:
Ca + 2C → CaC2 (карбиды)
С азотом
При комнатной температуре с азотом взаимодействует только магний с образованием нитрида:
Остальные щелочноземельные металлы реагируют с азотом при нагревании.
С углеродом
Щелочноземельные металлы реагируют с углеродом с образованием карбидов, преимущественно ацетиленидов:
Бериллий при нагревании с углеродом с образует карбид — метанид:
С фосфором
Щелочноземельные металлы при нагревании взаимодействуют с фосфором с образованием фосфидов:
Взаимодействие со сложными веществами
С водой
Кальций, стронций и барий взаимодействуют с водой при комнатной температуре с образованием щелочи и водорода:
Магний реагирует с водой при кипячении, а бериллий с водой не реагирует.
С кислотами
с концентрированной серной:
с разбавленной и концентрированной азотной:
С водными растворами щелочей
В водных растворах щелочей растворяется только бериллий:
С солями
В расплаве щелочноземельные металлы могут взаимодействовать с некоторыми солями:
Запомните! В растворе щелочноземельные металлы взаимодействуют с водой, а не с солями других металлов.
С оксидами
Щелочноземельные металлы могут восстанавливать из оксидов такие неметаллы как кремний, бор, углерод:
2Ca + SiO2 → 2CaO + Si
Магний сгорает в атмосфере углекислого газа с образованием оксида магния и сажи (С):
Групповое сходство элементов обусловлено наличием 2-х спаренных электронов на внешнем электронном слое и заключается в следующем:
- постоянная валентность II
- постоянная степень окисления +2
- легкость образования 2-зарядных ионов Me +2
С ростом заряда ядра и радиуса атомов свойства элементов закономерно изменяются:
- энергия ионизации Еион уменьшается
- сродство атомов к электрону уменьшается
- металлические свойства усиливаются
По важнейшим атомным характеристикам и по физико-химическим свойствам металлов и их соединений наибольшим сходством между собой обладают Са, Sr , Ba , имеющие общее название - щелочноземельные металлы. Эти элементы имеют практически одинаковые значения ЭО, находятся рядом в электрохимическом ряду напряжений; химическая активность в целом от Са к Ва возрастает незначительно; они во многих отношениях сходны со щелочными металлами.
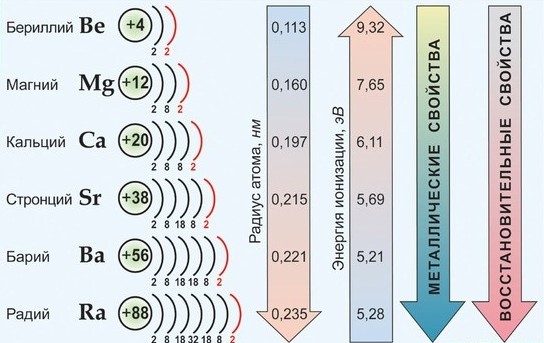
Среди s 2 -элементов резко выделяется бериллий, который обнаруживает более значительное сходство с алюминием (диагональное сходство). По распространенности в природе и по практической значимости важнейшими элементами являются Са и Mg.
В свободном состоянии в виде простых веществ все s 2 -элементы - белые твердые вещества с металлическим блеском на срезе, обладающие всеми общими свойствами металлов. Лишь бериллий хрупкий и плохо поддается обработке.
отношение к воде
отношение к воде
не растворимый, не взаимодействует
не растворимый, не взаимодействует
хорошо растворимые, взаимодействуют
Магний
Изотопы 24 Mg (78.60 %)
Кларк в земной коре 2,35 % по массе. В свободном виде не встречается. Является одним из самых распространенных породообразующих элементов (более 200 минералов). Основные из них:
- магнезит MgCO3 - доломит СаСО3 • МgСО3
- карналлит КСl • МgСl2 • 6Н2O
- горькая (английская) соль MgS04• 7H2O В виде катионов Mg 2+ находится в природных водах (в 1 м 3 морской воды содержится около 1 кг Mg 2+ ). Наряду с ионами Са 2+ обусловливает жесткость воды.
Магний и его соединения играют важную роль в биологических процессах. В качестве комплексообразователя Mg входит в молекулы хлорофилла, а также в другие важные биокомплексы.
Магний - единственный элемент гл. подгр. II группы, применяемый в сравнительно больших количествах в металлическом состоянии (как свободный металл).
В чистом виде магний - блестящий серебристобелый металл, быстро тускнеющий на воздухе вследствие окисления. Это легкий, относительно мягкий и пластичный металл, легкоплавкий и обладающий хорошей электропроводностью. В сплавах с Al является основным конструкционным материалом в авиа-, судо- и ракетостроении.
1. Электролитический (основной). Электролизу подвергают тщательно обезвоженный расплав хлорида магния (t ≈ 800°C):
2. Карботермический (t ˃ 2000°C)
MgO + С = Mg↑(пары) + СО ↑
Mg - химически активный металл, особенно в порошкообразном состоянии или в виде ленты. Во всех реакциях магний ведет себя как очень сильный восстановитель:
Как и другие активные металлы, Mg взаимодействует с кислотами, растворами солей менее активных металлов, со многими неметаллами. Ниже приведены реакции, в которых проявляются некоторые особенности химического поведения магния.
Реакция сопровождается выделением болышого количества энергии. в т. ч в виде света. При этом ослепительно белое пламя обогащено фотохимически активными лучами (магниевая вспышка).
Происходит одновременное образование оксида и нитрида:
При обычной температуре Мg с водой не реагирует, так как сразу покрывается плотной пленкой - нерастворимым в воде Мg(ОН)2
1) Мg активно реагирует с кипящей водой:
2) особенно активно реагирует с водяным паром (Т > 380°С), поэтому совершенно недопустимо тушить горящий Мg водой - это может привести к взрыву.
3) Мд легко растворяется в воде в присутствии NH4CI:
Протеканию реакции способствует кислая среда, образующаяся в результате гидролиза NH4Cl
Благодаря сильному сродству к кислороду Мg отнимает его у многих оксидов, например, зажженный Мg продолжает гореть в атмосфере CO2 восстанавливая его до свободного углерода:
2Мg + CO2 = 2МgО + С
Образующиеся Мg-органические соединения носят общее название реактивов Гриньяра и широко используются в органическом синтезе.

Цель урока: дать характеристику металлов II группы главной подгруппы.
Характеристика металлов II группы главной подгруппы.
Цель урока: дать характеристику металлов II группы главной подгруппы.
обучающая: - изучить общую характеристику металлов главной
подгруппы II группы;
- основные физические и
химические свойства простых веществ, образованных
развивающая: - использовать знания, полученные на уроках, при
подготовке к экзаменам по химии и биологии;
воспитательная: - воспитание осторожности при проведении опытов,
- осознание необходимости использования знаний
разных предметов при подготовке к экзаменам.
Оборудование и реактивы: пробирки, штативы для пробирок,
образцы металлов – магний, кальций;
Проверка домашнего задания:
а) Тестовые задания (из вариантов ГИА по химии)
1. Заряд ядра атома калия равен 1) 39 2) 20 3) 40 4) 19
2. В уравнении реакции натрия с водой коэффициент перед формулой водорода равен: 1) 1 2) 2 3) 3 4) 4
3. К щелочам относится:
1) гидрокарбонат кальция, 3) гидроксид алюминия
2) гидроксид калия 4) оксид натрия
4. Химическая связь в оксиде калия
1) ковалентная полярная 3) ионная
2) ковалентная неполярная 4) металлическая
5. Раствор гидроксида натрия реагирует с
1) оксидом серы ( IV) 3) углеродом
2) нитратом кальция 4) оксидом меди (II)
6. В ряду химических элементов Rb – K – Na
1) уменьшаются радиусы атомов
2) увеличивается электроотрицательность
3) увеличивается число электронов во внешнем электронном слое
4) усиливаются металлические свойства
5) увеличивается число заполненных электронных слоев в атомах
( 1 – 4, 2 – 1, 3 – 2, 4 – 3, 5 – 1, 6 – 1,2 )
б) Составьте уравнения химических реакций, о которых идет
Литий активно соединяется с водородом: небольшое количество металла может связать большой объем этого газа. Таблетки гидрида лития используют как портативный источник водорода при авариях над морем: под действием воды они быстро разлагаются, наполняя водородом спасательные лодки и жилеты.
в) Запишите формулы или названия веществ: (подобное задание будет в контрольной работе)
1) кристаллическая сода –
3) каустическая сода –
г) Задания из ГИА по биологии.
1. Процесс свертывания крови у человека может нарушиться при недостатке в организме 1) магния, 2) железа, 3) натрия, 4) кальция ?
2. Какие вещества придают костям твердость?
1) белки и жиры, 3) глюкоза и гликоген
2) соли кальция и фосфора 4) аминокислоты и нуклеиновые кислоты
Уверенно ответить на эти вопросы поможет тема сегодняшнего урока.
II. Изучение новой темы.
Тема урока: Характеристика металлов II группы главной подгруппы.
Цель урока: изучить общую характеристику металлов главной
подгруппы II группы; основные физические и химические
свойства этих элементов.
Учащиеся вспоминают и называют план изучения щелочных металлов:
1) Положение элементов в ПСХЭ. Состав подгруппы.
2) Строение атома.
3) Простые вещества: физические свойства, химические свойства.
4) Важнейшие соединения металлов. (изучим на следующем уроке).
1) Положение элементов в ПСХЭ. Состав подгруппы.
Ученики записывают и называют элементы II группы главной подгруппы Ве, Mg, Са, Sr, Ba, Ra.
Учитель сообщает , что в отличии от металлов главной подгруппы 1 группы, которые все относят к группе ЩМ, не все элементы главной подгруппы II группы относят к естественному семейству - ЩЗМ. Причины этого состоят в определенном различии свойств этих элементов. К ЩЗМ относят элементы: Са и следующие за ним элементы в подгруппе (учащиеся перечисляют их сами – Sr, Ba, Ra.) Происхождение названия этого семейства связано с тем, что гидроксиды кальция, стронция, бария, так же, как и гидроксиды натрия и калия, обладают щелочными свойствами, оксиды же этих Ме по их тугоплавкости сходны с оксидами алюминия и тяжелых металлов, носившими прежде общее название земель.
2) Строение атомов
Ребята составляют схемы строения атомов Ве, Mg, Са и указывают сходство (одинаковое строение внешнего электронного слоя – 2 электрона). Отсюда можно сделать вывод, что элементы II группы главной подгруппы проявляют постоянную степень окисления +2 (восстановительные свойства).
3) А. Учитель демонстрирует классу образцы металлов магния и кальция (в ампулах). Как видим условия хранения магния и кальция различны. Как это можно объяснить?
Читайте также:

