Типы химических реакций конспект 10 класс
Обновлено: 02.07.2024
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Цели урока: создать условия для формирования знаний об особенностях протекания химических реакций с участием органических веществ.
Задачи урока :
Обучающие: изучить типы реакций в органической химии, основываясь на знания обучающихся о типах реакций в неорганической химии и их сравнении с типами реакций в органической химии.
Развивающие: способствовать развитию логического мышления и интеллектуальных умений (анализировать, сравнивать, устанавливать причинно-следственные связи).
Воспитательные: продолжить формирование культуры умственного труда; коммуникационных навыков: прислушиваться к чужому мнению, доказывать свою точку зрения.
Химия – это особенная наука. Главным объектом ее изучения является химическая реакция. Я предлагаю вам сегодня окунуться в мир химических реакций, которые мы уже изучили на прошлом уроке. Попробуем определить цель у рока.
Сегодня здесь работают три команды , главными организаторами которых являются: Жукова Д., Стороженко К., Сергеева Д. Желаю вам продемонстрировать слаженность в работе и хорошие знания. За работу вы будете получать молекулы – это ваши баллы, по наибольшему количеству которых и будут присуждены места. А начнем мы с разминки.
1. Разминка
Вам предстоит ответить на 7 вопросов. Здесь нужно не только знание, но и скорость. На обдумывание – секунды.
Реакция, обратная реакции присоединения (элиминирования).
Основное органическое соединение, участвующее в реакции (субстрат).
Реакция присоединения молекулы водорода по кратной связи (гидрирования).
Процессы соединения множества молекул в крупные макромолекулы (присоединения-полимеризации).
Реакция отщепления водорода от алкана (элиминирования-дегидрирования).
В этих реакциях относительная молекулярная масса исходного вещества увеличивается (присоединения).
Из метана получается хлорметан в реакции (замещения).
Реакции, в результате которых, качественный и количественный состав вещества не меняется, изменяется лишь строение молекул (изомеризации-перегруппировки).
Компонент химической реакции, взаимодействующий с субстратом (реагент).
Реакции присоединения галогеноводорода (гидрогалогенирование).
Правило, по которому водород присоединяется к более гидрированному атому углерода при двойной связи (Марковникова).
Реакции отщепления воды от спирта (дегидратации).
В этих реакциях относительная молекулярная масса исходного вещества уменьшается (элиминирования).
В данной реакции этанол получают из бромэтана (замещения).
Реакции, в результате которых осуществляется замена одного атома или группы атомов в субстрате на другие атомы или группы атомов (замещения).
Эта реакция способна протекать лишь под действием солнечного света (хлорирование).
Реакции присоединения галогена (галогенирование).
Правило, по которому водород в молекулах спиртов отщепляется от менее гидрированного атома углерода (Зайцева).
Реакции отщепления хлороводорода (дегидрохлорирования).
В этих реакциях в зависимости от реагента относительная молекулярная масса исходного вещества увеличивается или уменьшается (замещения).
Реакция, в которой бутан превращается в изобутан (изомеризации-перегруппировки).
2. Экологическая справка: в ней звучат некоторые экологические данные
Командиры должны дать исчерпывающий ответ о каком-либо типе химической реакции, подготовив ответ у доски, выбрав тип реакции, находящейся в цилиндре. Команды в это время определить типы реакций , описанные в экологической справке. Ответ написать на отдельном листе. Всем на работу четыре минуты.
1. В растениеводстве для протравливания семян , для борьбы с вредителями овощных культур применяют гексахлор цикло гексан , который получают в результате реакции :
Какой тип реакции для этого используют? (присоединения-хлорирования)
2. В основе производства некоторых лекарственных препаратов , таких, как аспирин, лежит использование фенола. Его получают из веществ, галоген о производных бензола. С 6 Н 5 С1 + НОН → С 6 Н 5 ОН + НС1
Какой тип реакции лежит в основе этого производства ? (Гидратации-обмена).
3. Этилен у растений является своеобразным растительным гормоном , ускоряющим процесс созревания помидоров и фруктов, распускание бутонов цветов в лаборатории можно получить из спирта следующей реакцией:
Определите тип реакции. ( Элиминирования – дегидратации)
4. Для повышения качества низкосортного бензина увеличивают октановое число в результате промышленного процесса превращения алканов с неразветвленной цепью в углеводороды с разветвленным углеродным скелетом. Например,
Какой тип реакции для этого используют? ( Изомеризации-перегруппировки)
(присоединения-хлорирования)
(Гидратации-обмена).
( Элиминирования – дегидратации)
( Изомеризации-перегруппировки)
3. Отвечают командиры. Команды отслеживают полноту, правильность, логичность изложения. При необходимости задают вопросы.
4. День самоуправления
Реакции изомеризации
элиминирования
Реакции присоединения
5. Экспериментальная задача
Мы переходим сейчас к новому творческому конкурсу. Перед вами экспериментальная видеозадача. Сейчас вам будут продемонстрированы видео реакций. Ваша задача: внимательно просмотреть, пользоваться черновиком, слушать и определить, о каком типе химической реакции идет речь, и составить уравнение реакции в ваших тетрадях . И хотя вы только начинаете изучать реакции, попробуйте
Взаимодействие этилена с бромной водой;
Какие типы химических реакций изучены в органической химии?
6. Тест для контроля усвоения материала
Установите соответствие, занесите цифры-номера реакций в соответствующую графу таблицы
Вспомните, чем отличаются химические явления или химические реакции от физических (Конспект).

Химические реакции, протекающие
без изменения состава веществ.
Одно из положений теории химического строения утверждает, что свойства веществ зависят не только от их качественного и количественного состава, но и от строения. Следовательно, можно сделать вывод, что некоторые химические реакции могут сопровождаться изменением только качественного или только количественного состава исходных и образующихся веществ или же изменением их строения.
На примере кислорода и озона можно проиллюстрировать философский закон о переходе количественных отношений в качественные. Вспомните и сравните физические, химические и физиологические свойства кислорода и озона.
Влияние строения простых веществ, образованных одним химическим элементом на их свойства, иллюстрируют аллотропные модификации углерода.
Процесс получения искусственных алмазов моделирует природные экстремальные явления: проводится при очень высоких давлениях и температурах.
Первые сведения об аллотропии и аллотропных модификациях связаны с фосфором. В 1669 г. алхимик Хеннинг Брант, прокаливая сухой остаток мочи в попытке получить философский камень, получил белый фосфор (от греч. phos — свет и phoros — несущий), который затем превратился в красный.
Химические реакции, протекающие
с изменением состава веществ
(по признаку числа и состава реагентов и продуктов реакции).
Из курса химии основной школы вы знаете четыре типа реакций по этому признаку: соединения, разложения, замещения и обмена.
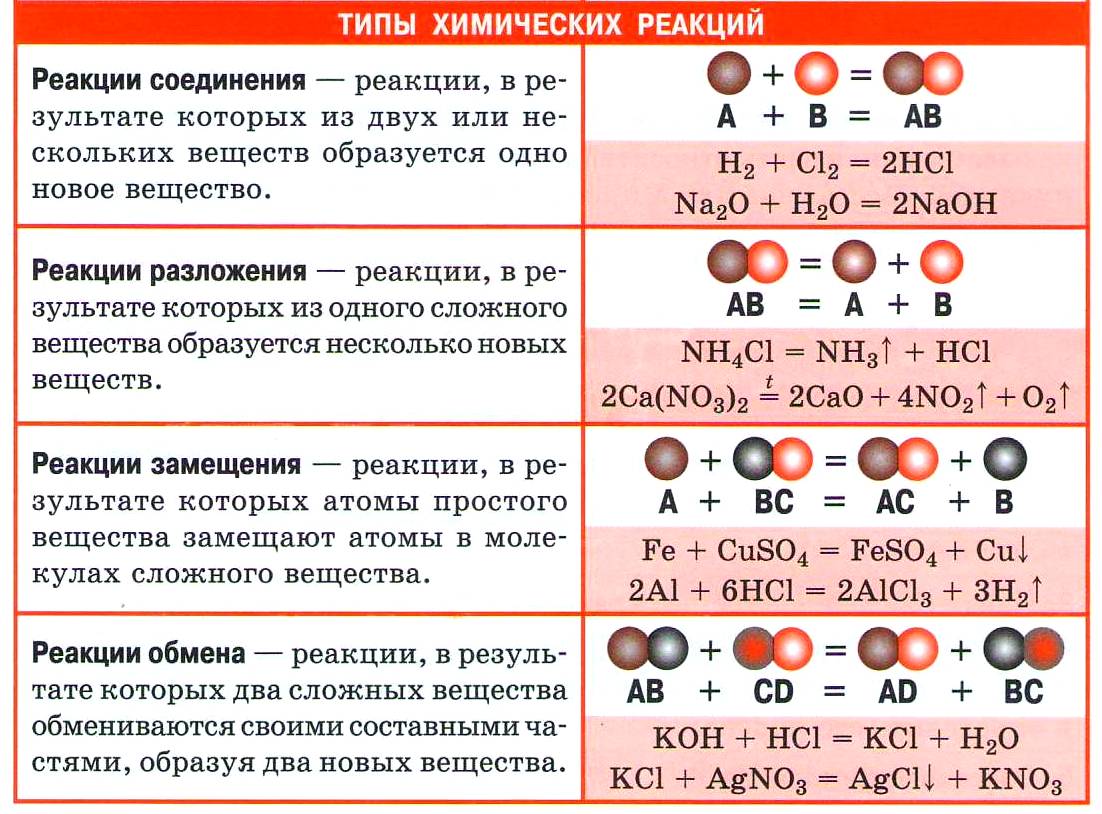
1. Реакции соединения (присоединения)
В неорганической химии весь спектр разнообразных реакций можно проиллюстрировать примерами промышленных процессов:
- Реакция горения фосфора — первая стадия получения чистой фосфорной кислоты: 4Р + 5O2 = 2Р2O5
В этом процессе участвуют два простых вещества и получается одно сложное.
- Заключительная стадия получения фосфорной кислоты описывается уравнением Р2O5 + 3Н2O = 2Н3РO4(сложное вещество образуется в результате взаимодействия двух сложных веществ).
- На заключительной стадии получения азотной кислоты в реакцию вступают три вещества (одно простое и два сложных): 4NO2 +O2 + 2Н2O = 4HNO3
В органической химии реакции соединения называются реакциями присоединения, так как к основному веществу (субстрату) присоединяется дополнительное вещество (реагент). Такие реакции характерны для непредельных углеводородов и в зависимости от реагента носят видовые названия:
- гидрирование — присоединение водорода;
- галогенирование — присоединение галогенов;
- гидрогалогенирование — присоединение галогеноводородов;
- гидратация — присоединение воды.
Частным случаем реакции присоединения является реакция полимеризации — соединение множества одинаковых молекул мономера в макромолекулу полимера.
2. Реакции разложения (отщепления)
Рассмотрим реакции разложения на примере реакций получения кислорода лабораторными способами.
Последняя реакция используется не для получения кислорода, а в медицинских целях. Полученное при разложении серебро прижигает ранки или удаляет бородавки, если используется особый ляписный (от лат. lapis infernalis — адский камень) карандаш.
В органической химии реакции разложения называют реакциями отщепления. Так, для получения этилена используются реакции дегидратации этанола, деполимеризации полиэтилена, дегидрирования этана (запишите уравнения реакций).
3. Реакции замещения
Как видно из определения, эти реакции характеризуют свойства классов простых веществ. Например, такое важное свойство галогенов, как их способность вытеснять менее активные галогены из растворов галогеноводородных кислот или их солей: Сl2 > Вг2 > I2.
Аналогично, этот тип реакций характеризует химические свойства металлов:
- Щелочные и щёлочноземельные металлы активно взаимодействуют с водой: 2Na + 2Н2O = 2NaOH + Н2↑
- С растворами кислот взаимодействуют металлы, стоящие в ряду напряжений до водорода: Zn + 2НСl = ZnCl2 + H2↑
- Металлы, стоящие в ряду напряжений до металла соли, вытесняют его из раствора соли: Fe +CuSO4 = Сu +FeSO4
- Более активные металлы вытесняют менее активные из их оксидов с выделением большого количества теплоты — металлотермия: 2Аl +Fe2O3 = Аl2O3 + 2Fe
Реакции замещения характерны для предельных соединений, например галогенирование метана, согласно цепочке переходов: СН4 –> СН3Сl –> СН2Сl2 –> СНСl3 –> ССl4.
Нитрование бензола относится к реакциям замещения, но протекает между двумя сложными веществами: С6Н6 + HNO3 —> C6H5NO2 + Н2O
В органической химии продуктами реакций этого типа являются не простое и сложное вещества, а два сложных. Кроме этого, в реакцию замещения могут вступать и сложные вещества.
4. Реакции обмена
Для растворов электролитов такие реакции протекают в соответствии с правилом Бертолле (названным по имени предложившего его французского химика Клода Бертолле) и возможны в том случае, если образуется осадок, газ или малодиссоциирующее вещество (например, вода).
- Золотисто–жёлтый осадок иодида свинца выпадает при взаимодействии растворов иодида натрия и нитрата свинца:
2NH4Cl + Са(ОН)2 = СаСl2 + 2NH3↑ + 2Н2O
NH4 + + ОН – = NH3↑ + Н2O
- Частным случаем реакции обмена является реакция нейтрализации — она протекает между растворами кислот и щелочей:
NaOH + НСl = NaCl + Н2O
OH – + H + = H2O
Химические реакции, протекающие
с тепловым эффектом.
Важный классификационный признак реакций — выделение или поглощение теплоты. Как правило, реакции соединения сопровождаются выделением теплоты. Такие реакции называются экзотермическими.
Если экзотермическая реакция сопровождается выделением света, то она называется реакцией горения: 2Mg + О2 = 2MgO + Q
Важным источником теплоты и энергии является горение углеводородов: СН4 + 2О2 –> СО2↑ + 2Н2О + Q
Но нет правил без исключения: реакция взаимодействия азота с кислородом сопровождается поглощением теплоты: N2 + О2 2NO – Q
Схематично экзо- и эндотермические реакции отражает рисунок.
Если в уравнении реакции указывается тепловой эффект, то уравнение называется термохимическим.
Например:
СН4 + 2О2 —> СO2 + 2Н2O + 800 кДж — реакция экзотермическая;
СаСO3 = СаО + СO2 – 187 кДж — реакция эндотермическая.
Классификация реакций по другим критериям
Классификация реакций — многоплановый процесс. Их можно классифицировать также:
- по направлению (обратимые и необратимые реакции);
- по использованию катализатора (каталитические и некаталитические реакции);
- по агрегатному состоянию реагентов и продуктов реакции (гомогенные и гетерогенные реакции);
- по изменению степеней окисления элементов, образующих реагенты и продукты реакции (окислительно–восстановительные и реакции, протекающие без изменения степеней окисления).


Обучающая: закрепить умение определять степени окисления элементов, окислитель и восстановитель, расставлять коэффициенты методом электронного баланса. Совершенствовать умение определять окислительно-восстановительные свойства веществ, прогнозировать продукты реакций в зависимости от активности металлов, концентрации кислот и реакции среды раствора. Выработать умение составлять уравнения химических реакций, протекающих в различных средах на примере соединений марганца. Показать разнообразие и значение ОВР в природе и повседневной жизни.
Развивающая: развивать умения делать выводы на основе проведенных экспериментов
Воспитательная: воспитывать интерес к предмету, умение целенаправленно работать на уроке.
Тип урока лекция
Средства обучения: рассказ, беседа, сравнение, химический эксперимент, самостоятельная работа.
Межпредметные связи: ОДБ. 07, ОДБ.09, ОДП.03.
Самостоятельная работа:
Учебная литература: Химия. 10 класс: Учебник для общеобразовательных учреждений / О.С. Габриелян, Ф.Н. Маскаев, С.Ю. Пономарев, В.И. Теренин; под ред. В. И. Теренина – М.: Дрофа, 2002. – 304 с.
Ход урока:
1.Организационная часть: приветствие учащихся, подготовка к уроку, психологический настрой.
Добрый день! Хорошего вам настроения!
Тема нашего урока: «Окислительно – восстановительные реакции
Окислительно-восстановительные реакции принадлежат к числу наиболее распространенных химических реакций и имеют огромное значение в теории и практике. Важнейшие процессы на планете связаны с этим типом химических реакций. Человечество давно пользовалось ОВР, вначале не понимая их сущности. Лишь к началу XX века была создана электронная теория окислительно-восстановительных процессов. На уроке предстоит вспомнить основные положения этой теории, метод электронного баланса, научиться составлять уравнения химических реакций, протекающих в растворах, и выяснить от чего зависит механизм таких реакций.
2. Опрос учащихся по домашнему заданию:
3. Изложение нового материала:
Для вас тема ОВР не нова, она проходит красной нитью через весь курс химии. Поэтому предлагаю повторить некоторые понятия и умения по данной теме.
/Степень окисления – это условный заряд атома химического элемента в соединении, вычисленный на основе предположения, что все соединения состоят только из ионов. Степень окисления может быть положительной, отрицательной или равняться нулю, что зависит от природы соответствующих соединений./
Одни элементы имеют постоянные степени окисления, другие — переменные.
Например, к элементам с постоянной положительной степенью окисления относят щелочные металлы: Li +1 , Na +1 , K +1 , Rb +1 , Cs +1 , Fr +1 , следующие элементы II группы периодической системы: Ве +2 , Mg +2 , Ca +2 , Sr +2 , Ва +2 , Ra +2 , Zn +2 , а также элемент III А группы - А1 +3 и некоторые другие. Металлы в соединениях всегда имеют положительную степень окисления.
Из неметаллов постоянную отрицательную степень окисления (-1) имеет F.
В простых веществах, образованных атомами металлов или неметаллов, степени окисления элементов равны нулю, например: Na°, Al°, Fe°, Н2 0 , О2 0 , F2 0 , Cl2 0 , Br2 0 .
Для водорода характерны степени окисления: +1 (Н20), -1 (NaH).
Для кислорода характерны степени окисления: -2 (Н20), -1 (Н2О2), +2 (OF2).
Следует помнить, что в целом молекула электронейтральна, поэтому в любой молекуле алгебраическая сумма степеней окисления равна нулю, а в сложном ионе – заряду иона.
Например, рассчитаем степень окисления хрома в дихромате калия K2Cr2O7.
Степень окисления калия +1, кислорода -2.
Подсчитаем число отрицательных зарядов: 7 • (-2) = -14
Число положительных зарядов должно быть + 14. На калий приходится два положительных заряда, следовательно, на хром – 12.
Так как в формуле два атома хрома, 12 делим на два: 12 : 2 = 6.
+ 6 – это степень окисления хрома.
Проверка: алгебраическая сумма положительных и отрицательных степеней окисления элементов равна нулю, молекула электронейтральна.
Самостоятельная работа № 1 по инструктивной карте: пользуясь приведенными сведениями, рассчитайте степени окисления элементов в соединениях: MnO2, H2SO4, K2SO3, H2S, KMnO4.
/Окислительно-восстановительные реакции – это такие реакции, в которых одновременно протекают процессы окисления и восстановления и, как правило, изменяются степени окисления элементов./
Рассмотрим процесс на примере взаимодействия цинка с разбавленной серной кислотой:
При составлении этого уравнения используется метод электронного баланса. Метод основан на сравнении степеней окисления атомов в исходных веществах и продуктах реакции. Основное требование при составлении уравнений этим методом: число отданных электронов должно быть равно числу принятых электронов.
Окислительно-восстановительные реакции – это такие реакции, при которых происходит переход электронов от одних атомов, молекул или ионов к другим.
Окисление – это процесс отдачи электронов, степень окисления при этом повышается.
Восстановление – это процесс присоединения электронов, степень окисления при этом понижается.
Атомы, молекулы или ионы, отдающие электроны, окисляются; являются восстановителями.
Атомы, ионы или молекулы, принимающие электроны, восстанавливаются; являются окислителями.
Окисление всегда сопровождается восстановлением, восстановление связано с окислением.
Окислительно-восстановительные реакции – единство двух противоположных процессов: окисления и восстановления.
Самостоятельная работа № 2 по инструктивной карте: методом электронного баланса найдите и поставьте коэффициенты в следующей схеме окислительно –восстановительной реакции:
Однако научиться находить коэффициенты в ОВР еще не значит уметь их составлять. Нужно знать поведение веществ в ОВР, предусматривать ход реакций, определять состав образующихся продуктов в зависимости от условий реакции.
Для того чтобы разобраться, в каких случаях элементы ведут себя как окислители, а в каких – как восстановители, нужно обратиться к периодической системе Д.И.Менделеева. Если речь идет о простых веществах, то восстановительные свойства должны быть присущи тем элементам, которые имеют больший по сравнению с остальными атомный радиус и небольшое (1-3) число электронов на внешнем энергетическом уровне. Поэтому они могут сравнительно легко их отдавать. Это в основном металлы. Наиболее сильными восстановительными свойствами из них обладают щелочные и щелочноземельные металлы, расположенные в главных подгруппах I и II групп (например, натрий, калий, кальций и др.).
Наиболее типичные неметаллы, имеющие близкую к завершению структуру внешнего электронного слоя и значительно меньший по сравнению с металлами того же периода атомный радиус, довольно легко принимают электроны и ведут себя в окислительно-восстановительных реакциях как окислители. Наиболее сильными окислителями являются легкие элементы главных подгрупп VI – VII групп, например фтор, хлор, бром, кислород, сера и др.
Вместе с тем надо помнить, что деление простых веществ на окислители и восстановители так же относительно, как и деление на металлы и неметаллы. Если неметаллы попадают в среду, где присутствует более сильный окислитель, то они могут проявлять восстановительные свойства. Элементы в разных степенях окисления могут вести себя по-разному.
Если элемент имеет свою высшую степень окисления, то он может быть только окислителем. Например, в HN +5 O3 азот в состоянии + 5 может быть только окислителем и принимать электроны.
Только восстановителем может быть элемент, находящийся в низшей степени окисления. Например, в N -3 Н3 азот в состоянии -3 может отдавать электроны, т.е. является восстановителем.
Элементы в промежуточных положительных степенях окисления могут, как отдавать, так и принимать электроны и, следовательно, способны вести себя как окислители или восстановители в зависимости от условий. Например, N +3 , S +4 . Попадая в среду с сильным окислителем, ведут себя как восстановители. И, наоборот, в восстановительной среде они ведут себя как окислители.
По окислительно-восстановительным свойствам вещества можно разделить на три группы:
Самостоятельная работа №3 по инструктивной карте: в какой из приведенных схем уравнений реакций MnO2 проявляет свойства окислителя, а в какой – свойства восстановителя:
MnO2 + 4HCI = MnCI2 + CI2 + 2H2O (MnO2 – окислитель)
3. Углубление и расширение знаний
Важнейшие окислители и продукты их восстановления
1. Серная кислота - Н2SO4 является окислителем
А) Уравнение взаимодействия цинка с разбавленной Н2SO4
Какой ион является окислителем в данной реакции? (H + )
Продуктом восстановления металлом, стоящим в ряду напряжения до водорода, является H2.
Б) Рассмотрим другую реакцию – взаимодействие цинка с концентрированной Н2SO4
Какие атомы меняют степень окисления? (цинк и сера)
Концентрированная серная кислота (98%) содержит 2% воды, и соль получается в растворе. В реакции участвуют фактически сульфат – ионы. Продуктом восстановления является сероводород.
В зависимости от активности металла продукты восстановления концентрированной Н2SO4 разные: H2S, S, SO2.
Чем выше активность металла, тем дальше (глубже) идет восстановление серы (вплоть до низшей степени окисления - 2)
На схемах указаны продукты, содержание которых максимально среди возможных продуктов восстановления кислот
2. Другая кислота – азотная – также окислитель за счет нитрат – иона NO3 - . Окислительная способность нитрат – иона значительно выше иона H + , и ион водорода не восстанавливается до атома, поэтому при взаимодействии азотной кислоты с металлами, никогда не выделяется водород, а образуются различные соединения азота. Это зависит от концентрации кислоты и активности металла. Разбавленная азотная кислота восстанавливается глубже, чем концентрированная (для одного и того же металла)
На схемах указаны продукты, содержание которых максимально среди возможных продуктов восстановления кислот
Au + 3HCI (конц.) + HNO3 (конц.) = AuCI3 + NO + 2H2O
3. Наиболее сильным окислителем из числа простых веществ является фтор. Но он слишком активен, и его трудно получить в свободном виде. Поэтому в лабораториях в качестве окислителя используют перманганат калия KMnO4. Его окислительная способность зависит от концентрации раствора, температуры и среды.
Реакции окисления – восстановления могут протекать в различных средах. В зависимости от среды может изменяться характер протекания реакции между одними и теми же веществами: среда влияет на изменение степеней окисления атомов.
Обычно для создания кислотной среды добавляют серную кислоту. Соляную и азотную применяют реже, т.к. первая способна окисляться, а вторая сама является сильным окислителем и может вызвать побочные процессы. Для создания щелочной среды применяют гидроксид калия или натрия, нейтральной – воду.
Лабораторный опыт: (правила ТБ)
В четыре пронумерованные пробирки налито по 1-2 мл разбавленного раствора перманганата калия. В первую пробирку добавьте несколько капель раствора серной кислоты, во вторую – воду, в третью – гидроксид калия, четвертую пробирку оставьте в качестве контрольной. Затем в первые три пробирки прилейте, осторожно взбалтывая, раствор сульфита натрия. Отметьте. Как изменяется окраска раствора в каждой пробирке.
Результаты лабораторного опыта:
Продукты восстановления KMnO4 (MnO4 - ):
в кислой среде – Mn +2 (соль), бесцветный раствор;
в нейтральной среде – MnO2, бурый осадок;
в щелочной среде - MnO4 2- , раствор зеленого цвета.
К схемам реакций:
Подберите коэффициенты методом электронного баланса. Укажите окислитель и восстановитель
(Задание разноуровневое: сильные учащиеся записывают продукты реакции самостоятельно)
Вы проделали лабораторный опыт, предложите вещество, с помощью которого можно очистить халат.
Демонстрационный опыт:
Пятна от раствора перманганата калия быстро выводятся раствором пероксида водорода, подкисленным уксусной кислотой:
Старые пятна перманганата калия содержат оксид марганца (IV), поэтому будет протекать еще одна реакция:
После выведения пятен кусок ткани необходимо промыть водой.
Значение окислительно-восстановительных реакций
В рамках одного урока невозможно рассмотреть все многообразие окислительно-восстановительных реакций. Но их значение в химии, технологии, повседневной жизни человека трудно переоценить.
Ученик: Окислительно-восстановительные реакции лежат в основе получения металлов и сплавов, водорода и галогенов, щелочей и лекарственных препаратов.
С окислительно-восстановительными реакциями связано функционирование биологических мембран, многие природные процессы: обмен веществ, брожение, дыхание, фотосинтез. Без понимания сущности и механизмов протекания окислительно-восстановительных реакций невозможно представить работу химических источников тока (аккумуляторов и батареек), получение защитных покрытий, виртуозную обработку металлических поверхностей изделий.
Для целей отбеливания и дезинфекции пользуются окислительными свойствами таких наиболее известных средств, как пероксид водорода, перманганат калия, хлор и хлорная, или белильная, известь.
Хлор как сильный окислитель используют для стерилизации чистой воды и обеззараживания сточных вод.
4. Подведение итогов по уроку, комментирование выставленных оценок.
Тест:
В кислой среде KMnO4 восстанавливается до:
Концентрированная H2SO4 при обычной температуре пассивирует:

Мир химических реакций весьма разнообразен. Самые различные химические реакции постоянно происходят в природе, осуществляются человеком. Можно ли классифицировать химические реакции? Что положить в основу их классификации? Сущность всякой химической реакции состоит в превращении веществ: разрушаются исходные вещества и образуются продукты реакций, меняется число и состав исходных веществ и продуктов реакции. Характер этих изменений и положен в основу классификации химических реакций.
Реакции соединения
Рассмотрим уравнения следующих реакций (рис. 62):
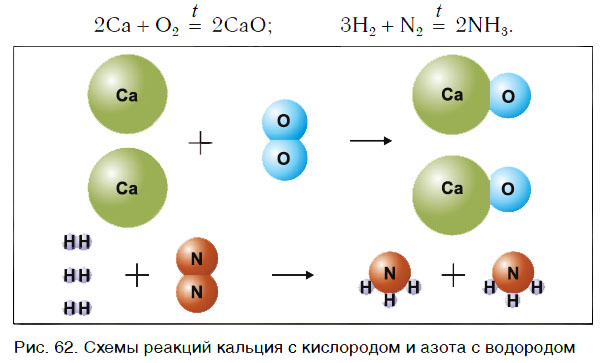
Чем сходны данные реакции между собой? Тем, что в результате взаимодействия двух веществ получается только одно вещество. Такие реакции получили название реакций соединения.
Реакции соединения — это реакции, в результате которых из двух или нескольких веществ образуется одно новое сложное вещество.
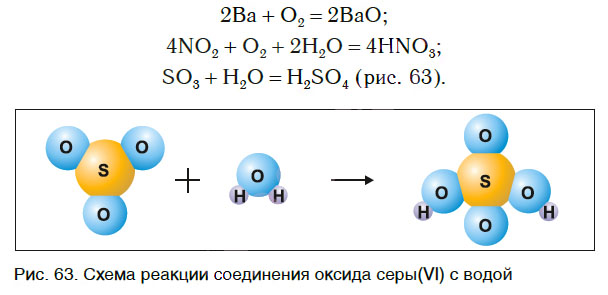
В одних случаях из двух простых веществ получается одно сложное, в других — соединяются два и более простых или сложных веществ:
Реакции разложения
Рассмотрим уравнения следующих реакций:
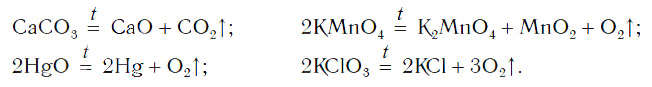
Можно заметить, что из одного сложного вещества получается два или более новых веществ. Это реакции разложения. В них могут образовываться как простые, так и сложные вещества.
Реакции разложения — это реакции, в результате которых из одного сложного вещества образуется несколько новых веществ.
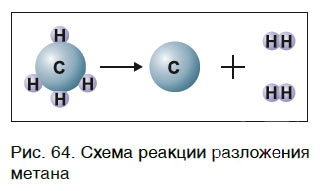
Для начала реакции разложения обычно необходимо нагреть исходные вещества. Например, негашеную известь CaO в промышленности получают нагреванием известняка CaCO3, реакция разложения происходит при температуре около 1000 °С. К такому типу реакций относится и реакция разложения метана CH4 (рис. 64) — составной части природного газа:
Реакции замещения
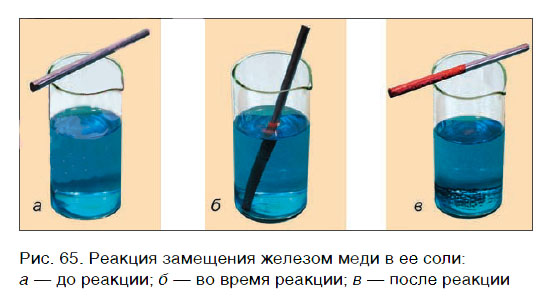
А могут ли взаимодействовать между собой два вещества: одно простое и одно сложное? Проверим это на опыте. В раствор медного купороса опустим небольшой кусочек железа — кнопку, гвоздь, канцелярскую скрепку с хорошо очищенной поверхностью. Через 2—3 мин извлечем железо из раствора и увидим, что на его поверхности образовался темно-красный налет меди. В химическую реакцию вступили простое (Fe) и сложное (CuSO4) вещества, и образовались новое простое (Cu) и новое сложное (FeSO4) вещества:
![]()
Из опыта и уравнения химической реакции хорошо видно, что атомы железа заместили атомы меди в сложном веществе (рис. 65). Такие химические реакции относятся к реакциям замещения.
Реакции замещения — это реакции, в результате которых атомы простого вещества замещают атомы одного из элементов в сложном веществе.
Для протекания таких реакций необходимо соблюдать некоторые особые условия. Не все простые вещества обязательно должны взаимодействовать со сложными веществами. В дальнейшем при изучении химии вы познакомитесь с этими условиями, а также с другими типами химических реакций.
Краткие выводы урока:
- Реакции соединения — это реакции, в результате которых из двух или нескольких веществ образуется одно новое сложное вещество.
- Реакции разложения — это реакции, в результате которых из одного сложного вещества образуется несколько новых веществ.
- Реакции замещения — это реакции, в которых атомы простого вещества замещают атомы одного из элементов в сложном веществе.
Читайте также:

