Строение атома радиоактивность конспект
Обновлено: 04.07.2024
Физика атома и атомного ядра весьма сложна ввиду базирования на законах квантовой механики, основы которой начали формироваться только в первой половине 20-го века. Поэтому мы ограничимся кратким описанием современных представлений о строении атома и атомного ядра, а также некоторых установленных к настоящему времени закономерностей.
Известно, что вещество состоит из молекул, представляющих собой комбинации атомов различных химических элементов.
До 19 века считалось, что атом представляет собой наименьшую неделимую частицу вещества. Благодаря исследованию явления протекания электрического тока через растворы щелочей, кислот и солей стало известно, что модуль заряда, переносимого ионом, кратен некоторому минимальному заряду.
Модуль этого минимального заряда с точностью до второго знака равен минимальному заряду 1,6×10-19 Кл. В 1897 году Джозеф Томсон опытным путем установил, что электрон — частица в составе атома, имеющая отрицательный заряд, модуль которого равен минимальному заряду. Томсон предположил, что электроны в атоме располагаются внутри положительно заряженной области, как изюм в булочке.
Размер атома в модели Томсона — это размер положительно заряженной области, который равен примерно 10-10 м. Дальнейшие исследования показали несостоятельность данной модели, однако проведение этих исследований стало возможным только после открытия явления радиоактивности.
Резерфорд предложил исследовать ядро атома, бомбардируя вещество альфа-частицами. Масса такой частицы в несколько тысяч раз больше массы электрона, ее заряд положителен и равен удвоенному элементарному заряду.
Идея опытов Резерфорда состояла в невозможности легкими электронами существенно изменить характер движения налетающей на атом тяжелой альфа-частицы. Поэтому по изменению характера движения альфа-частицы, которая взаимодействовала с атомом, можно сделать выводы о размерах положительно заряженной части атома.
Эксперимент показал, что большинство альфа-частиц, вылетая из контейнера К, проходит сквозь фольгу, практически не изменяя направления движения. Небольшая доля частиц отклонялась на углы порядка 50°, и только одна из примерно 20 000 альфа-частиц отклонялась на угол, близкий к 180°, т.е. возвращалась назад.
В ходе экспериментов был сделан вывод, что размер положительно заряженной области в атоме значительно меньше — 10-15м.
Результаты экспериментов позволили Резерфорду предложить ядерную (планетарную) модель атома. Согласно ей атом состоит из положительно заряженного ядра, вокруг которого движутся электроны. Ядро занимает 10-15 объема всего атома. При этом на ядро приходится 99,9 % массы атома. Плотность вещества в ядре атома колоссальна: ~ 1017 кг/м3.
Предложенную Резерфордом планетарную модель до сих пор используют при объяснении многих явлений и свойств вещества.
Атом состоит из атомного ядра, в котором сосредоточен весь положительный заряд атома и практически вся его масса. Вокруг положительно заряженного ядра движутся отрицательно заряженные электроны. Заряд атомного ядра равен с обратным знаком суммарному заряду всех его электронов.
Радиоактивность. Излучения. Распад
Явление радиоактивности было обнаружено в 1896 году французским физиком Анри Беккерелем. Он установил, что соли урана испускают невидимое глазу излучение, засвечивающее даже завернутую в темную плотную бумагу фотопластинку.
Аналогичные свойства были обнаружены французским физиком Пьером Кюри и его супругой Марией Склодовской-Кюри у выделенных ими из урановой руды двух новых химических элементов — радия и полония. Поэтому явление испускания некоторыми веществами излучения было названо радиоактивностью.
Исследования британского физика Эрнеста Резерфорда и его учеников показали, что излучение радиоактивных веществ имеет сложный состав. Это удалось установить, пропустив излучение радия через магнитное поле. Оказалось, что в магнитном поле излучение радия разделяется на три части. При этом две части отклоняются в разные стороны, а одна не изменяет направление своего распространения. Такие виды излучения назвали альфа-, бета- и гамма-лучами.
Последующие эксперименты показали, что при излучении радия происходят процессы, приводящие к появлению в излучении других компонентов.
Для объяснения поведения разных видов радиоактивного излучения радия в магнитном поле, достаточно вспомнить о действии магнитного поля на проводник, по которому течет электрический ток. При этом направление силы, действующей на проводник, зависит от направления тока, следовательно — от направления упорядоченного движения заряженных частиц.
Поэтому можно предложить, что альфа- и бета-лучи, отклоняющиеся в магнитном поле в разные стороны, представляют собой потоки движущихся частиц с зарядами разного знака. Из направлений отклонения альфа- и бета-лучей следует, что альфа-частицы имеют положительный заряд, а бета-частицы — отрицательный. Поскольку гамма-лучи не отклоняются в магнитном поле, можно сделать выводы, что они состоят из незаряженных частиц.
Позднее было экспериментально установлено, что альфа-частицы — это положительно заряженные ядра гелия, бета-частицы — электроны, а гамма-частицы — фотоны (коротковолновое электромагнитное излучение).
Атомы излучают электромагнитные волны только при определенных условиях. Нильс Бор сделал предложение, что электроны, движущиеся вокруг ядра по определенным — стационарным — орбитам, не излучают энергии. При переходе электрона с одной стационарной орбиты на другую атом может излучать или поглощать энергию в виде электромагнитной волны.
При поглощении атомом электромагнитного излучения (фотона) его электрон переходит с орбиты, характеризуемой меньшей энергией En атома, на орбиту, характеризуемую большей энергией Em. Напротив, при переходе электрона с орбиты, характеризуемой большей энергией Em атома, на орбиту, характеризуемую меньшей энергией En, атом излучает фотон. При этом уносимая или излучаемая энергия излучения (энергия фотона) равна разности Em— En.
Эксперименты показали, что эта энергия прямо пропорциональна частоте υ излучения (фотона). Согласно теории Бора она равна h × υ, где h = 6.63 × 10-34 (Дж × с) — постоянная Планка. Таким образом, Em— En= h × υ.
Атом каждого химического элемента имеет свой уникальный набор стационарных орбит. Поэтому атом данного химического элемента может излучать электромагнитные волны строго определенного набора частот.
Набор частот электромагнитных волн (фотонов), излучаемых атомом данного химического элемента, называют спектром излучения этого элемента.
Спектр излучения уединенного атома (не взаимодействующего с другими) на шкале электромагнитных волн представляет собой определенный набор линий. Поэтому такой спектр называют линейчатым.
Набор частот электромагнитных волн (фотонов), поглощаемых атомом данного химического элемента, называют спектром поглощения этого элемента.
Движение и взаимодействие атомов друг с другом приводит к изменению спектров излучения и поглощения. Наблюдаемые в спектре уединенного атома линии становятся шире. Это связано с движением и взаимодействием с соседями каждого атома по-разному.
Поэтому разность энергий для каждого из атомов данного химического элемента несколько отличается от других. Результатом этого будет наблюдаемое расширение спектральных линий, получаемых от набора атомов данного химического элемента. При больших скоростях движений атомов и молекул, а также сильном взаимодействии их друг с другом, расширенные линии в спектре сливаются. Спектр становится сплошным.
Различие в спектрах излучения и поглощения разных атомов и молекул позволяет не только обнаружить наличие атомов определенного химического элемента, содержащегося в исследуемом объекте, но и изучить особенности их движения и взаимодействия как между собой, так и с окружающими их атомами и молекулами.
Минимальную энергию, которую надо сообщить атомному ядру для разделения его на отдельные нуклоны, называют энергией связи атомного ядра.
Чтобы найти энергию связи атомного ядра, нужно умножить его дефект масс на квадрат скорости света в вакууме:
E с в = Δ M × c 2 = ( Z × m p + N × m n — M я ) × с 2 .
Удельной энергией связи атомного ядра называют отношение энергии связи этого ядра к числу нуклонов в нем: Е у д = E с в / А .
Радиоактивностью называют самопроизвольное превращение атомных ядер, которое сопровождается испусканием различных частиц (электронов, протонов, фотонов и пр.).
То, что энергия образовавшихся ядер меньше, чем энергия исходного ядра, объясняет, почему явление радиоактивности сопровождается выделением энергии. Например, эксперимент показывает, что 1 г радия выделяет за час около 580 Дж энергии.
В процессе радиоактивного распада с течением времени число оставшихся неизменными радиоактивных ядер уменьшается. Поэтому интенсивность излучения тоже должна уменьшаться. Иногда интенсивность регистрируемого излучения может и увеличиваться. Это происходит в случае, если при распаде образуются ядра, так же способные к распаду.
Периодом полураспада данного изотопа называют промежуток времени, по истечении которого распадается половина от начального числа ядер.
Данная величина зависит от свойств вещества.
Закон радиоактивного распада:
Формула показывает, сколько радиоактивных ядер данного изотопа останется к моменту времени t, если в начальный момент времени их число было равно N0.
Вид зависимости N(t)
Стоит отметить, что закон радиоактивного распада справедлив лишь при наличии достаточно большого количества радиоактивных ядер. Это связано с вероятностным характером распада каждого ядра.
Альфа- и бета-распады. Правила смещения
Как уже известно, в радиоактивном излучении присутствуют альфа- и бета-частицы. Альфа-частицы — ядра гелия, имеющие положительный заряд. Ясно, что ядро гелия вылетает из распадающегося радиоактивного ядра. При этом в породившем альфа-частицу ядре число протонов и нейтронов уменьшается на 2. Формула превращения выглядит так:
Где X — радиоактивное ядро, U — новое ядро, получившееся после вылета альфа-частицы из ядра X.
Распадающееся ядро называют материнским, а новое — дочерним.
При альфа-распаде одного химического элемента образуется другой химический элемент, который в таблице Менделеева расположен на 2 клетки ближе к ее началу, чем исходный.
При альфа-распаде сохраняются общие числа протонов и нейтронов.
Находящиеся в атомном ядре нейтроны могут превращаться в протоны. В результате такого превращения нейтрона получается электрон, протон и еще одна частица — электронное антинейтрино:
Получаемый электрон ничем не отличается от электронов, движущихся в атоме вокруг его ядра. В результате превращения нейтрона в протон атомное ядро покидают электрон и антинейтрино, число протонов Z в атомном ядре увеличивается на единицу, а число нейтронов уменьшается на единицу. Общее число нуклонов при этом не изменяется.
Бета-превращение атомного ядра можно записать так:
Получающийся в результате бета-радиоактивности элемент расположен на одну клетку ближе к концу Периодической системы химических элементов таблицы Менделеева, чем исходный. Это правило называется правилом смещения при бета-распаде.
Следует отметить, что при альфа- и бета-распада удельная энергия связи дочерних ядер всегда больше удельной энергии связи распадающегося ядра. Поэтому дочерние ядра оказываются устойчивее по отношению к радиоактивным превращениям.
В результате альфа- или бета-превращения продукты радиоактивного распада движутся ускоренно, что приводит к появлению электромагнитного излучения.
Виды радиоактивного излучения
- α-излучение — это поток тяжелых положительно заряженных частиц (ядер гелия). Вследствие положительного заряда α-частицы отклоняются электрическим и магнитным полями;
- β-излучение — это поток быстрых электронов. Электроны значительно меньше альфа-частиц и могут проникать вглубь тела на несколько сантиметров. Из-за наличия отрицательного заряда электроны отклоняются электрическим и магнитным полями в противоположную сторону по сравнению с α-частицами;
- γ-излучение — это фотоны, т. е. электромагнитное излучение, несущее энергию. Оно не отклоняется электрическим и магнитным полями. Параметры ядра при излучении не меняются, ядро лишь переходит в состояние с меньшей энергией. Распавшееся ядро тоже радиоактивно, т. е. происходит цепочка последовательных радиоактивных превращений. Процесс распада всех радиоактивных элементов идет до свинца. Свинец — конечный продукт распада.
Примеры применения в технике
В настоящее время радиоактивные изотопы широко применяют в различных сферах научной и практической деятельности: технике, медицине, сельском хозяйстве, средствах связи, военной области и в некоторых других. При этом часто используют так называемый метод меченых атомов.
Интересным применением радиоактивности является метод датирования археологических и геологических находок по концентрации радиоактивных изотопов. Наиболее часто используется радиоуглеродный метод датирования.
Нестабильный изотоп углерода возникает в атмосфере вследствие ядерных реакций, вызываемых космическими лучами. Небольшой процент этого изотопа содержится в воздухе наряду с обычным стабильным изотопом. Растения и другие организмы потребляют углерод из воздуха, и в них накапливаются оба изотопа в той же пропорции, как и в воздухе.
После гибели растений они перестают потреблять углерод, и нестабильный изотоп в результате β-распада постепенно превращается в азот с периодом полураспада 5730 лет. Путем точного измерения относительной концентрации радиоактивного углерода в останках древних организмов можно определить время их гибели.
Ядерное оружие считается наиболее эффективным в истории человечества по соотношению стоимости и эффективности: годовые затраты на разработку, испытания, изготовление и поддержание в эксплуатации такого оружия составляют от 5 до 10 % военного бюджета России — страны с уже сформированным ядерным производственным комплексом, развитой атомной энергетикой и наличием парка суперкомпьютеров для математического моделирования ядерных взрывов.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Тема: Строение атома. Радиоактивность.
Цель урока: формирование представлений о явлении радиоактивности, о физической природе и свойствах α-, β-, γ-излучений; углубление знаний учащихся о структуре атома.
Дидактический тип урока: изучение нового материала.
1. Организационный момент
У природы много тайн и загадок, раскрывает она их не охотно, поэтому каждая очередная разгадка – важный шаг человечества на путь к познанию мира. Вот и мы сегодня приоткроем занавес тайны…
2. Мотивация
Ядро, протон, нейтрон, электрон…. Что объединяет все эти слова? (Это составляющие атома)
Верно, значит тема урока будет связана со строением атома.
Задание: выберите из списка слова, обозначающие явления. Дайте определения этим явлениям.
Ион, атом, протон, электризация, нейтрон, проводник, напряжённость, диэлектрик, электроскоп, заземление, поле, оптика, линза, сопротивление, напряжение, вольтметр, амперметр, заряд, мощность, радиоактивность, магнит, генератор, телеграф, компас, намагничивание.
Электризация – способность тела после натирания притягивать другие тела.
Заземление – передача заряда земле.
Намагничивание – это явление, при котором образуются постоянные магниты.
Для какого явления мы ещё не можем дать определение?
(Мы не знаем явление радиоактивность)
3. Актуализация знаний
Но с середины XIX в. стали появляться экспериментальные факты, которые ставили под сомнение представления о неделимости атомов. Результаты этих экспериментов наводили на мысль о том, что атомы имеют сложную структуру и что в их состав входят электрически заряженные частицы.
4. Изучение нового материала – 25 мин.
- Английский физик Джозеф Джон Томсон предложил модель атома, которая объясняла известные к тому времени физические явления.
Томсон предложил в 1903 г. одну из первых моделей строения атома . По предположению Томсона, атом представляет собой шар, по всему объёму которого равномерно распределён положительный заряд. Внутри этого шара находятся электроны. Каждый электрон может совершать колебательные движения около своего положения равновесия. Положительный заряд шара равен по модулю суммарному отрицательному заряду электронов, поэтому электрический заряд атома в целом равен нулю.
- Модель атома Томсона нуждалась в экспериментальной проверке.
Поэтому в 1911 г. Резерфорд совместно со своими сотрудниками провёл ряд опытов по исследованию состава и строения атомов.
Опыт: В опытах использовался свинцовый сосуд с радиоактивным веществом, излучающим α-частицы. Из этого сосуда α-частицы вылетают через узкий канал со скоростью.
Так как α-частицы непосредственно увидеть невозможно, то для их обнаружения служит стеклянный экран.
Экран покрыт тонким слоем специального вещества, благодаря чему в местах попадания в экран α-частиц возникают вспышки, которые наблюдаются с помощью микроскопа.
Такой метод регистрации частиц называется методом вспышек.
Вся эта установка помещается в сосуд, из которого откачан воздух (чтобы устранить рассеяние α-частиц за счёт их столкновений с молекулами воздуха).
Если на пути α-частиц нет никаких препятствий, то они падают на экран узким, слегка расширяющимся пучком. При этом все возникающие на экране вспышки сливаются в одно небольшое световое пятно.
Если же на пути α-частиц поместить тонкую фольгу из исследуемого металла, то при взаимодействии с веществом α-частицы рассеиваются по всем направлениям на разные углы.
Наибольшее количество вспышек расположено в центре экрана .
Значит, основная часть всех α-частиц прошла сквозь фольгу, почти не изменив первоначального направления (рассеялась на малые углы). При удалении от центра экрана количество вспышек становится меньше. Следовательно, с увеличением угла рассеяния количество рассеянных на эти углы частиц резко уменьшается.
Некоторое (очень небольшое) число частиц рассеялось на углы, близкие к 90°, а некоторые единичные частицы - на углы порядка 180°, т. е. в результате взаимодействия с фольгой были отброшены назад.
Именно эти случаи рассеяния α-частиц на большие углы дали Резерфорду наиболее важную информацию для понимания того, как устроены атомы веществ.
Почему α-частицы отклонялись на большие углы?
Сильное отклонение α-частиц возможно только в том случае, если внутри атома имеется сильное электрическое поле. Такое поле могло быть создано зарядом, сконцентрированным в очень малом объёме (по сравнению с объёмом атома).
Т. к. масса электрона намного меньше массы α-частицы, электроны не могли существенным образом изменить направление движения α-частиц. Поэтому α-частицы могут отталкиваться от одноимённо заряженной части атома, масса которой значительно больше массы α-частицы. Значит в центре атомы сосредоточен положительный заряд.
РЕЗУЛЬТАТ: В центре атома находится положительно заряженное ядро, занимающее очень малый объём атома. Вокруг ядра движутся электроны, масса которых значительно меньше массы ядра. Атом электрически нейтрален, поскольку заряд ядра равен модулю суммарного заряда электронов.
Такая модель атома была названа ПЛАНЕТАРНОЙ МОДЕЛЬЮ АТОМА. (Так как в центре расположена положительно заряженная частица, а вокруг нее вращаются электроны)
Резерфорд оценил размеры атомных ядер. Оказалось, что в зависимости от массы атома его ядро имеет диаметр порядка 10 -14 – 10 -15 м, т. е. оно в десятки и даже сотни тысяч раз меньше атома (атом имеет диаметр около 10 -10 м). (ПРИМЕР С РАЗМЕРОМ АТОМА: ПРЕДСТАВЬТЕ, ЧТО ВАШ КУЛАК, ЕСТЬ АТОМ, ТОГДА ВАШ КУЛАК ВЫРАСТЕТ ДО РАЗМЕРОВ НАШЕЙ ПЛАНЕТЫ, настолько атом мал)
В результате опытов по рассеянию α -частиц была доказана несостоятельность модели атома Томсона, выдвинута ядерная модель строения атома и проведена оценка диаметров атомных ядер.
- Атом имеет сложное строение.
- Свидетельсвом сложного строения атома явилось открытие явления радиоактивности, сделанное французским физиком Анри Беккерелем в 1896 г.
Беккерель обнаружил, что химический элемент уран самопроизвольно (т. е. без внешних воздействий) излучает ранее неизвестные невидимые лучи, которые позже были названы радиоактивным излучением. Поскольку радиоактивное излучение обладало необычными свойствами, многие учёные занялись его исследованием. Оказалось, что не только уран, но и некоторые другие химические элементы (например, радий) тоже самопроизвольно испускают радиоактивные лучи.
Способность атомов некоторых химических элементов к самопроизвольному излучению стали называть радиоактивностью (от лат. radio - излучаю и activus -действенный).
В 1899 г. в результате опыта , проведённого под руководством английского физика Эрнеста Резерфорда, было обнаружено, что радиоактивное излучение радия неоднородно, т. е имеет сложный состав. Рассмотрим, как проводился этот опыт.
Крупицу радия помещали на дно толстостенного свинцового сосуда. Пучок радиоактивного излучения радия выходил сквозь узкое отверстие и попадал на фотопластинку (излучение радия происходит во все стороны, но сквозь толстый слой свинца оно пройти не может). После проявления фотопластинки на ней обнаруживалось одно тёмное пятно - как раз в том месте, куда попадал пучок.
Потом опыт изменяли: создавали сильное магнитное поле, действовавшее на пучок. В этом случае на проявленной пластинке возникало три пятна: одно, центральное было на том же месте, что и раньше, а два других - по разные стороны от центрального.
Какой вывод можно сделать из опыта?
Если два потока отклонились в магнитном поле от прежнего направления, значит, они представляют собой потоки заряженных частиц.
Отклонение в разные стороны свидетельствует о разных знаках электрических зарядов частиц.
В магнитном поле на движущиеся заряженные частицы действует сила Лоренца и по правилу левой руки в одном потоке присутствовали только положительно заряженные частицы, в другом - отрицательно заряженные.
А центральный поток представлял собой излучение , не имеющее электрического заряда, так как на него не действовала сила Лоренца.
Положительно заряженные частицы назвали альфа-частицами, отрицательно заряженные - бета-частицами, а нейтральные – гамма-частицами или гамма-квантами.
Таким образом,
Радиоактивность – это способность атомов некоторых химических элементов к самопроизвольному излучению альфа, бета и гамма-излучения.
Что доказало явление радиоактивности?
Явление радиоактивности доказывало, что атомы вещества имеют сложное строение. А так как атом в целом нейтрален, это явление позволило сделать предположение, что в состав атома входят отрицательно и положительно заряженные частицы.
1896 г. Французский физик А. Беккерель, изучая явление люминесценции солей урана, установил, что урановая соль испускает лучи неизвестного типа, которые проходят через бумагу, дерево, тонкие металлические пластины, ионизируют воздух.
1897-98 г. Мария Склодовская-Кюри и Пьер Кюри, исследуя урановые руды, обнаружила новые химические элементы: полоний, радий. Явление самопроизвольного превращения неустойчивых изотопов в устойчивые, сопровождающееся испусканием частиц и излучением энергии, называется естественной радиоактивностью. Все химические элементы, начиная с порядкового номера 83, являются радиоактивными.
Виды радиоактивных излучений
1898 г. подвергая радиоактивное излучение действию магнитного поля, Э. Резерфорд выделил два вида лучей: α-лучи — тяжелые положительно заряженные частицы (ядра атомов гелия) и β-лучи — легкие отрицательно заряженные частицы (тождественны электронам).
В 1900 г. П. Виллард открыл гамма-лучи — нейтральное излучение, где масса покоя равна нулю (аналогично свойствам света, но ). После установления Резерфордом структуры атома стало ясно, что радиоактивность представляет собой ядерный процесс.1902 г. Э. Резерфорд и Ф. Содди доказали, что в результате радиоактивного распада происходит превращение атомов одного химического элемента в атомы другого химического элемента, сопровождаемое испусканием различных частиц и сформулировали правила смещения.
Строение атома
Гипотеза о том, что все вещества состоят из большого числа атомов, зародилась свыше двух тысячелетий тому назад. Сторонники атомистической теории (Демокрит, Левкипп, Анаксагор, Анаксимандр, Эпикур, Лукреций Кар) рассматривали атом как мельчайшую неделимую частицу и считали, что все многообразие мира есть не что иное, как сочетание неизменных частиц — атомов. Демокрит: существует предел деления атома. Аристотель: делимость вещества бесконечна. Париж, 1626 г.: учение об атоме запрещено под страхом смерти. Сторонниками атомистической теории были М.В. Ломоносов, Ж. Гей-Люссак, Д. Дальтон и др.
Толчком к подробному изучению строения атома послужили:
- открытие рентгеновского излучения (1895 г., В.К. Рентген);
- открытие радиоактивности и новых радиоактивных элементов (1896 г., А. Беккерель, М. и П. Кюри);
- открытие электрона (1896 г., Дж. Дж. Томсон).
Мысль об электронном строении атома, впервые высказанную В. Вебером в 1896 г., развил X. Лоренц: электроны входят в состав атома. Опираясь на эти открытия, Дж. Томсон в 1898 г. предложил модель атома в виде положительно заряженного шара радиусом 10 -10 м. в котором плавают электроны, нейтрализующие положительный заряд.
Ядерная модель атома
Экспериментальная проверка модели Томсона была осуществлена в 1911 г. английским физиком Э. Резерфордом.
Идея опыта заключалась в изучении рассеяния α-частиц (заряд +2е, масса 6,64 . 10 -27 кг) на атомах. α-частицы были выбраны, т.к. их кинетическая энергия много больше кинетической энергии электронов (β-лучи) и, в отличие от γ-лучей они имеют электрический заряд.
Пучок α-частиц пропускался через тонкую золотую фольгу. Золото было выбрано как очень пластичный материал, из которого можно получить фольгу толщиной практически в один атомный слой. Опыты были повторены и на других материалах
Э. Резерфорд и его помощники Г. Гейгер и Э. Марсден обнаружили, что какая-то частьa-частиц отклоняется на довольно значительный угол от своего первоначального направления, а небольшая часть отражается от фольги. Но согласно модели атома Томсона эти a-частицы при взаимодействии с атомами фольги отклоняются на малые углы, порядка 2°.
Резерфорд показал, что модель Томсона находится в противоречии с его опытами. Обобщая результаты своих опытов, Резерфорд предложил ядерную (планетарную) модель строения атома:
- Атом имеет ядро, размеры которого малы по сравнению с размерами самого атома (~10 -15 м).
- В ядре сконцентрирована почти вся масса атома.
- Отрицательный заряд всех электронов распределен по всему объему атома и компенсирует положительный заряд ядра.
Расчеты показали, что a-частицы, которые взаимодействуют с электронами в веществе, почти не отклоняются.
Только некоторые a-частицы проходят вблизи ядра и испытывают резкие отклонения. Если между зарядами действует кулоновская сила или потенциальная энергия системыa-частица - ядро и , то α-частица будет отброшена назад.
При расчете учитывают, что , где e - заряд электрона; , где Z - зарядовое число, равное количеству электронов в атоме; диаметр ядра 10 -15 - 10 -14 м, атома 10 -10 м.
Однако предложенная модель строения атома не позволила объяснить устойчивость атома:
- ускоренное движение электрона согласно теории Максвелла сопровождается электромагнитным излучением, поэтому энергия электрона уменьшается, и он движется по спирали, приближаясь к ядру. Казалось бы, электрон должен упасть на ядро (расчет показывает, что это должно произойти за 10 -8 с), так как при движении по спирали уменьшается энергия электрона, в действительности атомы являются устойчивыми системами;
- спектр излучения при этом должен быть непрерывным (должны присутствовать все длины волн). На опыте спектр получается линейчатым;
- нет ответа на вопрос о строении ядра. Если в него входят только положительные частицы, то почему они не отталкиваются?

На данном уроке мы поговорим о таком явлении, как радиоактивность и истории её открытия. Рассмотрим опыт Эрнеста Резерфорда по изучению явления радиоактивности и узнаем, каков состав радиоактивного излучения. А также познакомимся с некоторыми первыми моделями строения атомов.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Радиоактивность. Модели атомов"
Но примерно с середины 19 века стали появляться экспериментальные факты, которые ставили под сомнение представления о неделимости атомов. Одним из первых таких доказательств стало открытие в тысяча восемьсот девяносто шестом году Анри Беккерелем естественной радиоактивности. Это открытие оказалось случайным, поскольку на самом деле Беккерель изучал воздействие солнечного излучения на различные соли и минералы.
В это время уже было известно такое явление, как фосфоресценция, то есть свечение некоторых веществ, возникающее после их облучения солнечными лучами. Так вот, экспериментируя с солями урана, Беккерель завернул фотопластинку в плотную чёрную бумагу, положил на неё сверху маленький кусочек урановой соли и выставил всё это на солнечный свет. После проявления фотопластинки на ней обнаружилось тёмное пятно на том месте, где лежала крупинка соли. Беккерель полагал, что это следствие явления фосфоресценции. Но однажды из-за облачной погоды опыт пришлось отложить, и пластинка с солью урана была помещена в светонепроницаемый ящик стола. Несколько дней спустя Беккерель на всякий случай проявил фотопластинку и с удивлением обнаружил на ней тёмное пятно. Учёный понял, что соли урана самопроизвольно без всякого освещения излучают какие-то неизвестные лучи.
Многие учёные стали повторять опыты Беккереля, и прежде всего супруги Пьер и Мария Кюри. Они пытались проверить, нет ли среди веществ, не исследованных Беккерелем, таких, которые обладают таинственными свойствами урана.
В первых экспериментах поиски велись с помощью электроскопа. Вам уже известно, что воздух — это изолятор, поэтому положение листочков заряженного электроскопа не должно меняться. Но если воздух подвергнуть действию излучения, тогда он становится проводником.

Радиоактивность — это способность атомов некоторых химических элементов к самопроизвольному излучению.
Такую радиоактивность ещё называют естественной радиоактивностью.
В 1899 году английский физик Эрне́ст Резерфорд провёл серию опытов, в результате которых было обнаружено, что радиоактивное излучение имеет сложный состав. Суть его опытов такова. Резерфорд построил установку, которая представляла собой толстостенный свинцовый ящик с прорезью. Внутрь ящика помещались крупицы радия.

Из ящика сквозь узкое отверстие выходил направленный и сфокусированный пучок радиоактивного излучения и попадал на фотопластинку. После проявления фотопластинки на ней обнаруживалось одно тёмное пятно в том месте, куда попадал пучок.
Затем всю установку Резерфорд поместил в сильное магнитное поле. Он рассуждал так: если радиоактивное излучение является потоком частиц с положительным зарядом, то под действием сил магнитного поля поток частиц отклонится вверх. Если радиоактивное излучение — это поток частиц, имеющих отрицательный заряд, то он отклонится вниз. Ну а если это поток частиц, не имеющих заряда, то пучок не будет отклоняться.

Каково же было удивление Резерфорда, когда после проявления на фотопластинке были обнаружены три пятна: центральное, которое было и раньше, и два дополнительных — по разные стороны от центрального. Отсюда следовало, что в пучке излучения действительно присутствовали частицы, обладающие зарядами противоположных знаков.
Положительно заряженные частицы были названы α-частицами, а отрицательно заряженные — β-частицами. Центральный поток, очевидно, представлял собой излучение, не содержащее заряженных частиц. Это излучение получило название γ-излучения.
Также Резерфорду удалось доказать, что α-излучение является потоком атомов гелия, потерявших оба своих электрона. При этом путь α-частиц в воздухе не велик, и он полностью задерживается простым листом бумаги.

В том же году Беккерель доказал, что β-лучи являются потоком электронов. Этот поток имеет большую проникающую способность и задерживается лишь цинковой пластинкой толщиной несколько миллиметров.

В 1900 году французский физик Поль Виллар установил, что третья составляющая радиоактивного излучения представляет собой электромагнитное излучение с очень малой длиной волны. Гамма-лучи легко проходят через вещество, и чтобы их остановить, нужна либо свинцовая пластинка, толщиной в 5 сантиметров, либо 30 сантиметров бетона, или же 60 сантиметров грунта.

Явление радиоактивности, то есть самопроизвольное излучение веществом α-, β- и γ-излучений, наряду с другими экспериментальными фактами, послужило основанием для предположения о том, что атомы вещества имеют сложный состав. И что скорее всего, в состав атома входят отрицательно и положительно заряженные частицы. Кроме того, было известно, что атом в целом электрически нейтрален.
Опираясь на эти и некоторые другие факты англичанин Джозеф Джон Томсон в тысяча девятьсот третьем году предложил одну из первых моделей атома. Согласно его модели, атом представляет собой однородный шар из положительно заряженного вещества, внутри которого находятся электроны.

Однако модель строения атома по Томсону нуждалась в проверке, в частности важно было проверить, действительно ли положительный заряд распределён по всему объёму атома.
Поэтому в тысяча девятьсот одиннадцатом году Эрнестом Резерфордом была проведена серия опытов по изучению состава и строения атома. Суть опыта достаточно проста. Резерфорд брал свинцовый сосуд, внутри которого находился радиоактивный элемент, испускающий α-частицы через узкое отверстие в сосуде.
Для регистрации этих самых частиц учёный использовал экран, на который была нанесена тонкая плёнка специального вещества. α-частицы, взаимодействуя с этим веществом, вызывали кратковременные вспышки, которые можно было наблюдать в микроскоп. Такой метод регистрации частиц называется методом сцинциляций (то есть вспышек).
Итак, чтобы устранить рассеяние альфа-частиц на молекулах воздуха, Резерфорд поместил всю установку в сосуд, из которого был откачан воздух. Если на пути частиц нет никаких препятствий, то они попадают на экран узким пучком, а возникающие вспышки сливаются в одно небольшое световое пятно.

Однако если на пути α-частиц поместить тонкую золотую фольгу, то при взаимодействии с ней, площадь пятна увеличивалась. Это свидетельствовало о рассеянии α-частиц.

Но Резерфорд на этом не остановился. Он немного модифицировал исходную установку, с целью выяснить: могут ли α-частицы отклоняться на ещё большие углы. Для этого, он окружил фольгу экранами и повторил опыт. К его великому удивлению, некоторые частицы отклонились на углы, превышающие 90 о . То есть, фактически небольшое число частиц были отброшены назад.

Действительно, такой результат предвидеть было очень сложно, поскольку расчёты говорили о том, что электрическое поле положительного заряда, распределённого по всему атому, не может быть достаточно сильным, чтобы отбросить α-частицу назад. А поскольку масса электрона почти в 8000 раз меньше массы α -частицы, то и они не могли существенно поменять траекторию α -частиц. Это навело учёного на мысли о том, что более 99,9 % массы и весь положительный заряд атома сосредоточены в чрезвычайно малой области в его центре. Эта область была названа ядром атома.

И только те немногие частицы, которые пролетают рядом с ядром атома, отклоняются на большие углы.
На основании своих опытов Резерфорд смог оценить размеры атома и его ядра.

Все эти данные привели Резерфорда к созданию ядерной (или планетарной) модели атома, о которой вы уже не раз слышали. Напомним, что в этой модели в центре атома находится положительно заряженное ядро, а вокруг него, подобно планетам вокруг Солнца, вращаются электроны.
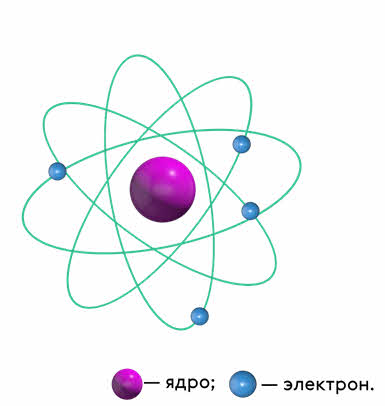
После открытия Резерфордом атомного ядра многочисленные эксперименты подтвердили, что атомные ядра, так же, как и сами атомы, имеют сложную структуру.
Читайте также:

