Составление уравнений окислительно восстановительных реакций методом электронного баланса конспект
Обновлено: 03.07.2024
образовательные: закрепить умение определять степени окисления, окислительно-восстановительные свойства веществ, отработать умение составлять уравнения окислительно-восстановительных реакций методом электронного баланса;
воспитательные: воспитание познавательной активности, формирование умения преодолевать трудности в учебном процессе;
развивающие: формирование умения применять теоретические знания для решения практических заданий, развитие внимания, памяти, логического мышления.
Оъявление темы и постановка целей урока.
Проверка домашнего задания
Подведение итогов урока
- Организационный момент
- Оъявление темы и постановка целей урока.
- Домашнее задание §3, зад № 1, с. 16.
- Проверка домашнего задания
- минимальная степень окисления;
- высшая степень окисления;
Каждое из этих определений проговаривается учащимися.
I вариант - записывает в тетрадь первый столбик веществ с указанием их роли в ОВР.
II вариант - записывает в тетрадь второй столбик веществ с указанием их роли в ОВР.
4Al + 3O 2 →2Al 2 O 3
2Al 0 - 6е →2Al +3 4 2 ок - ние, Al 0 - в - тель
O 2 0 + 4е → 2O -2 6 3 в- ние, O 0 2 – ок - тель
2SO 2 + O 2 →2SO 3
S +4 - 2е →S +6 4 2 ок - ние, S 0+4 - в - тель
O 2 0 + 4е → 2O -2 2 1 в - ние, O 0 2 – ок - тель
2Na + 2H 2 O →2NaOH + H 2 ↑
2H +1 + 2е → H 2 0 1 в - ние, H +1 – ок - тель
Na 0 - 1е → Na +1 2 ок - ние, Na 0 - в – тель
Работа по карточкам:
для уверенных в себе – задания № 7, 8, 9.
для сомневающихся - задания № 4, 5, 6.
- Рефлексия. Мы с вами сегодня на уроке выполнили большой объем работы. Поднимите, пожалуйста, руку те, кому было комфортно и уютно на уроке, кто остался доволен своей работой. Спасибо. А теперь те, у кого что-то не получалось, и поэтому часть работы придется сделать дома. Спасибо.
- Подведение итогов урока. Мы изучили очень важный вопрос - метод электронного баланса, который будет вам верным помощником при составлении уравнений химических реакций в неорганической и органической химии.
Спасибо за урок.
Степень окисления (СО) - это условный заряд, который приобрели бы атомы в результате полного перехода электронов.
СО простых веществ и свободных атомов = 0, например О 2 0 , Н 2 0 , Р 0 , Na 0
В сложных веществах:
СО (Н) = +1, исключения – гидриды металлов Na +1 H -1 , Ca +2 H -1
СО (О) = -2, исключения О +2 F 2 -1 , пероксиды Н 2 +1 О 2 -1
только для атомов неМе
СО промежуточная СО
для атомов неМе и Ме
ОВР (окислительно-восстановительные реакции) – реакции, протекающие с изменением СО атомов, входящих в состав реагирующих веществ
ВОССТАНОВЛЕНИЕ – процесс присоединения электронов
2H +1 + 2е → H 2 0
ОКИСЛЕНИЕ - процесс отдачи электронов
ОКИСЛИТЕЛИ – частицы, которые присоединяют электроны
К ним относятся: F 0 , O o , соединения, в состав которых входят атомы в высшей степени окисления
По периоду слева направо ОКИСЛИТЕЛЬНЫЕ свойства увеличиваются,
по группе сверху вниз - уменьшаются
ВОССТАНОВИТЕЛИ - частицы, которые отдают электроны
К ним относятся: металлы в свободном состоянии, чаще всего Н, соединения, в состав которых входят атомы в низшей степени окисления
По периоду слева направо ВОССТАНОВИТЕЛЬНЫЕ свойства уменьшаются ,
по группе сверху вниз - увеличиваются
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНУЮ ДВОЙСТВЕННОСТЬ проявляют вещества, которые в своем составе содержат атомы в промежуточной степени окисления
N -3 H 3 +1 – восстановитель за счет атома азота в минимальной степени окисления
H 2 +1 S +6 O 4 -2 – окислитель за счет атомов водорода и серы в высшей степени окисления
S 0 – обладает ОВД за счет атома серы в промежуточной степени окисления
МЕТОД ЭЛЕКТРОННОГО БАЛАНСА
Алгоритм составления уравнений ОВР методом электронного баланса
- Составить схему реакции.
- Расставить СО.
- Выписать атомы, которые поменяли СО:
- если простое вещество, писать полностью О 2 0 , Н 2 0 ,
- если в сложном веществе атомов больше, чем два, писать один
- Уравнять число выписанных атомов.
- Показать переход электронов
- если СО повышается, электроны отнимаем,
- если СО понижается, электроны прибавляем
- Находим дополнительные множители.
- Определяем процессы и названия частиц.
- Переносим дополнительные множители в основное уравнение*.
*если атом с данной СО встречается в уравнении несколько раз, коэффициент перед ним может отличаться от найденного методом электронного баланса (его уравнивают позже)
Уравниваем атомы, не изменившие СО в следующем порядке:
N 2 0 + 3H 2 0 → 2N -3 H 3 +1
N 0 2 + 6е →2N -3 2 1 в - ние, N 0 2 – ок - тель
H 2 0 - 2е → 2H +1 6 3 ок - ние, H 2 0 - в - тель
Zn 0 + 2H +1 Cl -1 →Zn +2 Cl 2 -1 + H 2 0
2H +1 + 2е → H 2 0 2 1 в - ние, H +1 – ок - тель
Zn 0 - 2е → Zn +2 2 1 ок - ние, Zn 0 - в – тель
Карточка для самостоятельной работы
Составить уравнения ОВР методом электронного баланса
- O 2 + CO→CO 2
- CH 4 →C + H 2
- Fe 2 O 3 + CO→FeO + CO 2
- Al + CuCl 2 →AlCl 3 + Cu
- Ca + O 2 →CaO
- H 2 SO 4 + Mg→Mg SO 4 + H 2
- SiO 2 + C→CO + Si
- C + HNO 3 → CO 2 + NO + H 2 O
- Si + HNO 3 + HF→SiF 4 + NO + H 2 O
- SO 2 + Cl 2 + H 2 O→ H 2 SO 4 +HCl
По теме: методические разработки, презентации и конспекты
Уравнивание окислительно-восстановительных реакций с участием органических веществ методом электронного баланса.
В статье обсуждается возможность описания ОВР с участием органических веществ с помощью метода электронного баланса. Также даны рекомендации по составлению уравнений реакций.

Составление уравнений окислительно-восстановительных реакций
Тема урока: "Составление уравнений окислительно-восстановительных реакций". Рассказ нового материала с использованием интерактивной доски.
Конспект урока "Составление уравнений окислительно-восстановительных реакций методом электронного баланса" (Химия, 8 класс)
Цель урока: обеспечение условий для самостоятельного вывода учащимися и применения ими на практике алгоритма по составлению ОВР методом электронного баланса. Прилагается презентация.
Составление уравнений окислительно – восстановительных реакций методом электронного баланса.
Конспект урока по теме "Составление уравнений окислительно- восстановительных реакций методом электронного баланса".
Составление уравнений окислительно-восстановительных реакций (дифференцированный алгоритм)
Дифференцированный алгоритм составления уравнений ОВР.

8 класс Составление уравнений окислительно-восстановительных реакций

Составление уравнений окислительно-восстановительных реакций
Презентацию можно использовать при изучении темы "Окислительно -восстановительные реакции. Расстановка коэффициентов методом электронного баланса" в 8 классе.

МЕТОД ЭЛЕКТРОННОГО БАЛАНСА
Ключевые слова конспекта: окислительно-восстановительные реакции, метод электронного баланса, окисление, восстановление.
Окислительно-восстановительные реакции (ОВР) – реакции, в ходе которых изменяются степени окисления элементов вследствие перехода электронов от восстановителя к окислителю. Окисление – процесс отдачи электронов атомом, молекулой или ионом, степень окисления элемента повышается. Восстановление – процесс приёма электронов атомом, молекулой или ионом, степень окисления элемента понижается.
Темы, связанные с настоящим конспектом:
МЕТОД ЭЛЕКТРОННОГО БАЛАНСА
Рассмотрим составление схем электронного баланса на примере горения фосфора (а) и взаимодействия перманганата калия с концентрированной соляной кислотой (б).
- Запишем схемы реакций, вычислим степени окисления элементов и определим элементы, у которых они меняются:
- Составим схемы, отражающие процессы перехода электронов:

- Определим, какой процесс является окислением, а какой – восстановлением; какой элемент является окислителем, а какой – восстановителем:

- Уравняем число отданных и принятых электронов. Для этого найдём наименьшее общее кратное для числа отданных и числа принятых электронов. В результате деления наименьшего общего кратного на число отданных и принятых электронов находим коэффициенты:
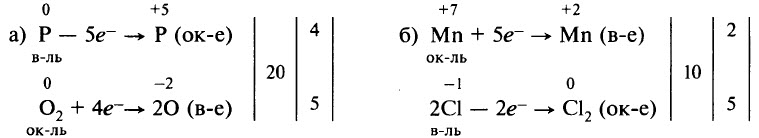
- Перенесём коэффициенты в исходную схему (п. 1), преобразуя её в уравнение реакции:
Перед формулой HCl мы не поставили коэффициент, так как не все ионы Cl – участвовали в окислительно-восстановительном процессе, часть из них участвовала в образовании солей.
В уравнении (б) требуется уравнять количество атомов элементов, не участвующих в окислительно-восстановительном процессе (К, Н, частично Cl). Получаем уравнение:
При правильной расстановке коэффициентов количество атомов кислорода в левой и правой частях уравнения будет одинаково (в случае (б) – 8).


В природе постоянно происходят превращения разных веществ, которые можно выразить с помощью химических уравнений. Жизнь на нашей планете невозможна без химических реакций, постоянно происходящих вокруг нас.
Муниципальное бюджетное общеобразовательное учреждение
средняя общеобразовательная школа № 25 имени И.А. Копылова ГОЩ (корпус 2)
141146 Московская область, городской округ Щёлково, п. Фряново, ул. Первомайская, д. 12
Методическая разработка урока химии в 8 классе
на тему:

Казаринова Марина Сергеевна,
Тип урока: комбинированный урок с использованием презентации.
Педагогические технологии: технология проблемного диалога на этапе изучения нового материала, технология развития мотивации достижений, элементы здоровьесберегающих технологий.
сформировать представление у учащихся об окислительно-восстановительных процессах, окислителях и восстановителях.
Задачи урока:
Обучающие:
рассмотреть сущность окислительно-восстановительных процессов;
создать условия для самостоятельного решения учебных и познавательных задач (понимания процессов окисления и восстановления, их взаимосвязи);
формировать ключевые компетенции, т.е. универсальные способы деятельности, применимые в различных ситуациях (анализировать, планировать, делать выводы);
закрепить навыки в составлении уравнений окислительно-восстановительных реакций методом электронного баланса.
Развивающие:
совершенствовать умения высказывать суждение о типе химической реакции, анализируя степень окисления атомов в веществах;
продолжить развитие логического мышления, умений наблюдать, делать выводы, работать с алгоритмами, формировать интерес к предмету.
Воспитательные:
формировать потребность в познавательной деятельности и ценностное отношение к знаниям, совершенствовать трудовые навыки;
научить слушать учителя и своих одноклассников, быть внимательным к себе и окружающим, оценивать себя и других, вести беседу;
воспитать культуру общения через работу в парах "ученик - ученик", "учитель - ученик".
Планируемые образовательные результаты:
Предметные - сформировать умение определять окислительно-восстновительные реакции, окислитель, восстановитель, окисление, восстановление, составлять уравнения окислительно-восстановительных реакций, используя метод электронного баланса.
Личностные - понимание единства естественнонаучной картины мира. Понимание значимости естественнонаучных знаний в повседневной жизни, технике, медицине, для решения практических задач.
Основные понятия, изучаемые на уроке: окислительно-восстановительные реакции, окислитель, восстановитель, окисление, восстановление.
Средства обучения:
периодическая система Д. И. Менделеева;
Хронологическая карта урока:
Организационный момент – 1 мин.
Актуализация знаний – 9 мин.
Изучение нового материала – 25 мин.
Закрепление полученных знаний – 5 мин.
Рефлексия учебной деятельности – 2 мин.
Домашнее задание – 2 мин.
Организационный момент.
Добрый день, ребята! Как мы с вами уже знаем, в природе постоянно происходят превращения разных веществ, которые можно выразить с помощью химических уравнений. Жизнь на нашей планете невозможна без химических реакций, постоянно происходящих вокруг нас.
Актуализация знаний.
Дыхание у человека – это одна из главных загадок жизни человека, ключ к множеству факторов жизни: здоровью, продолжительности жизни, развитию необычных высоких способностей человека.
Человек может прожить неделю без воды, месяц - без пищи, несколько дней - без сна, но через 5 – 7 минут он умрёт, если не будет дышать.
Дыхание позволяет человеку лучше познать себя, восстанавливать энергетические запасы организма. У человека 100 триллионов клеток и все они должны дышать.
А что использует для дыхания человек? (ответ учеников: - Кислород).
Какую степень окисления почти всегда имеет кислород – (-2).
Что такое степень окисления – (условный заряд элемента, рассчитанный исходя из условий, что все связи в соединении ионные).
А кто является его главным поставщиком кислорода в воздух? – (Растения).
Как называется процесс, протекающий в зеленых частях растений? – (Фотосинтез).
Какой процесс мы наблюдаем? – (Горение).
Реакции горения применяются для получения тепла, света, механической энергии. Именно с их помощью ракеты и самолеты поднимаются в космос.
Процессы дыхания, фотосинтеза, горения, брожения, извержения вулканов, грозового разряда, образования перегноя, коррозии металлов и многие другие – все это окислительно-восстановительные реакции.
Как вы считаете, возможно, ли было возникновение жизни на нашей планете без участия окислительно-восстановительных процессов? – (Нет)
Поэтому окислительно-восстановительные реакции требуют к себе особого уважения.
Изучение нового материала.
Сегодня на уроке мы будет рассматривать процессы, в основе которых лежат … (окислительно-восстановительные реакции).
Многообразие классификаций химических реакций по различным признакам (направлению, числу и составу реагирующих и образующих веществ, использованию катализатора, тепловому эффекту) можно дополнить еще одним признаком. Это признак – изменение степени окисления атомов химических элементов, образующих реагирующие вещества. (учебник стр.229)
По этому признаку различают химические реакции
Химические реакции
(запись на доске, ученики в тетрадь)


реакции, протекающие с изменением реакции, протекающие без изменения степени окисления элементов степени окисления элементов
Например, в реакции
+1 +5 -2 +1 -1 +1 -1 +1 +5 -2

AgNO3 + HCl AgCl + HNO3
Степени окисления атомов химических элементов после реакции не изменились.
А вот в другой реакции – взаимодействие соляной кислоты с цинком

2HCl + Zn ZnCl2 + H2
Атомы двух элементов, водорода и цинка, изменили свои степени окисления: водород с +1 на 0, а цинк – с 0 на +2. Следовательно, в этой реакции каждый атом водорода получил по одному электрону, а каждый атом цинка – отдал два электрона.

2H + 2e H2

Zn - 2е Zn
Определив степени окисления элементов в уравнении реакции, можно определить, какой атом является окислителем, какой — восстановителем.
Итак, мы должны усвоить основные понятия нашего урока:
Окислительно-восстановительные реакции – это химические реакции, которые протекают с изменением степени окисления атомов химических элементов или ионов, образующих реагирующие вещества.
(Учебник, стр. 230)
Восстановитель — атом или ион, который отдает электрон, а сам окисляется. Его степень окисления при этом понижается.
(Учебник, стр. 230)
Окислитель — атом или ион, который принимает электрон, а сам восстанавливается.
(Учебник, стр. 230)
Восстановление — процесс присоединения электронов, который сопровождается понижением степени окисления.
(Учебник, стр. 231)
Окисление — процесс отдачи электрона, который сопровождается повышением степени окисления.
(Учебник, стр. 231).
Физкультминутка.
Мы на химии писали и немножечко устали,
Мы немножко отдохнем и учиться вновь начнем - (встаем).
Электрон изображаем, путь его мы повторяем,
Как электроны по кругу перемещаются,
Наши головы вращаются - (круговые движения головой).
Пробирку все изображаем, руки вверх мы поднимаем - (руки вверх).
Реакция осуществляется, осадок вниз весь опускается - (руки вниз).
Упражнение повторим, пробирку вновь изобразим - (руки вверх, вниз).
Теперь представим мы весы - (руки в стороны).
Мы взвесить вещество должны – (покачали руками вверх-вниз)
На левую чашку вещество положили - (наклон влево),
На правую разновесы поместили - (наклон вправо).
Покачались, покачались, к равновесию пришли - (встали ровно).
Всё, немножечко размялись – вновь учиться мы должны! – (сели за парты).
А теперь давайте рассмотрим составление уравнений окислительно-восстановительных реакций методом электронного баланса. В основе метода электронного баланса лежит правило: общее число электронов, которые отдаёт восстановитель, всегда равно общему числу электронов, которые присоединяет окислитель.
Среди изученных нами реакций к окислительно-восстановительным реакциям относятся:
1. Взаимодействие металлов с неметаллами
2 Mg + O2 =2 Mg O

Восстановитель Mg 0 - 2e Mg +2 2 окисление

Окислитель O2 + 4e 2O -2 1 восстановление
2. Взаимодействие металлов с кислотой

Восстановитель Mg - 2e Mg 2 окисление

Окислитель 2 H 1 + 2e 2 H 0 1 восстановление
3. Взаимодействие металлов с солью

Восстановитель Mg 0 -2e Mg +2 2 окисление

Окислитель Cu +2 +2e Cu 0 1 восстановление
А теперь давайте все вместе разберем пример. Диктуется реакция, один учащийся самостоятельно составляет схему реакции у доски (слайд № 17):

Из этого примера видно, что число электронов, принятых окислителем, может отличаться от числа электронов, отданных восстановителем. Но этого быть не должно(!), так как при этом нарушается закон сохранения материи. Значит, число отданных электронов должно равняться числу принятых электронов. А для этого следует изменить число атомов окислителя и восстановителя, поставив соответствующие коэффициенты. Например, в данном случае:

Эти коэффициенты (3 и 2) означают, что три атома меди отдают шесть электронов, а два атома азота принимают шесть электронов:

Или в краткой форме:

Теперь осуществлён баланс (равенство) электронов, поэтому именно эти коэффициенты из электронного баланса (3 и 2) должны быть в уравнении реакции

Но теперь не осуществляется баланс по азоту! Где же допущена ошибка? Дело в том, что в электронном балансе учитываются только электронные процессы окисления и восстановления, т. е. учитываются только те атомы, которые меняют степени окисления, а часть атомов не изменила ее:

Отсюда правило: коэффициенты электронного баланса ставят только к тем атомам, которые с данной степенью окисления встречаются в химическом уравнении один раз.
Исправим ошибку и уравняем атомы остальных элементов:
Проверим по кислороду:
до реакции: 8 · 3 = 24 атома;
после реакции: 3 · 3 · 2 + 2 + 4 = 24 атома.
Правила расстановки коэффициентов методом электронного баланса
1. Расставить степени окисления.
2. Выписать элементы, изменившие степени окисления, указав число отданных и принятых электронов. Определить окислитель и восстановитель.
3. Поставить дополнительные коэффициенты, уравняв число отданных и принятых электронов.
4. Проверить эти коэффициенты: они должны соответствовать числу атомов данного элемента в молекуле. Например, если дополнительный коэффициент нечётный, а в молекуле чётное число атомов, то оба дополнительных коэффициента удваиваются.
5. Проверенные коэффициенты переносят в уравнение, считая атомы, к тем элементам, которые с данной степенью окисления встречаются в уравнении ОДИН раз.
6. Затем уравнивают атомы:
Закрепление полученных знаний.
Выполним еще одно задание на закрепление (работа в парах).
Составьте уравнение электронного баланса, расставьте коэффициенты в уравнении реакции:
Проверьте друг друга, сравнив результаты с ответами в презентации.
Составим электронные уравнения:
N +5 +3e — = N +2 | 8 окислитель
S -2 — 8e — = S +6 | 3 восстановитель
Сложим два уравнения
8N +5 +3S -2 — = 8N +2 + 3S +6
Подставим коэффициенты в молекулярное уравнение:
Итак, подведем итоги и сделаем выводы:
окислительно-восстановительные реакции – это единство двух противоположных процессов окисления и восстановления;
сутью окислительно-восстановительных реакций является переход электронов от одних атомов, молекул и ионов к другим;
окислительно-восстановительные реакции играют огромную роль во всех жизненных процессах, поэтому очень важно научиться грамотно их составлять.
Рефлексия учебной деятельности.
В конце нашего урока я хочу попросить вас выразить свое мнение, настроение об уроке, выбрав и подняв вверх соответствующий смайлик, (каждому ученику раздаются наборы карточек со смайликами)
Домашнее задание.
Ребята, запишите домашнее задание (запись на доске).
- запишите основные определения урока;
- приведите примеры важнейших восстановителей и окислителей;
- расставьте коэффициенты в уравнениях реакций, укажите восстановитель и окислитель:
N +5 +2e — = N +3 | 2 окислитель
2N +5 + 2O -2 = 2N +3 + O2 0 ;
N2 +6e — = 2N -3 | 2 | 1 окислитель
Mg 0 -2e — = Mg +2 | 6 | 3 восстановитель
N2 + 3Mg 0 = 2N -3 + 3Mg +2 .
Используемая литература:
Габриелян О.С. Химия. 8 класс: учеб. для ОУ. – 16-е изд., стереотип. – М.: Дрофа, 2010. – 270 с.
Денисова Л.В., Черногорова Г.М. Химия: Таблица Д.И. Менделеева и справочные материалы: Пособие для уч-ся. – М.: Гуманитар. изд. центр ВЛАДОС, 2004. – 16 с.
Аликберова Л.Ю. Полезная химия: задачи и истории. – М.: Дрофа, 2005. – 187 с.
Хомченко Г.П. Химия для поступающих в ВУЗы: Учеб.пособие. – 2-е изд., испр. – М.: Высш.шк., 1994. – 447 с.

ими на практике алгоритма по составлению ОВР методом электронного баланса.
Задачи: 1) Систематизировать знания учащихся о классификации хим. реакций согласно
2) Закрепить умения применять понятия: степень окисления, восстановитель,
окислитель, электронные уравнения- при составлении уравнений ОВР.
3) Развивать логическое и творческое мышление, самостоятельность учащихся
через преодоление проблемной ситуации.
Оборудование: компьютер, проектор, раздаточный материал на каждую парту с текстом задачи и
трех уравнений хим. реакций (см. в конспект).
Ход урока:
Актуализация опорных знаний учащихся.
Фронтальный опрос учащихся:
Вопрос №1 Что такое степень окисления? (показ слайда №2)
Проверка правильности ответа. (показ слайда №3)
Вопрос №3 Что такое ОВР ? (показ слайда №4)
Проверка правильности ответа. (показ слайда №5)
Вопрос №5 Что такое окисление и восстановление? (показ слайда №6)
Проверка правильности ответа (показ слайда №7),
выставление оценок за устные ответы.
Создание проблемной ситуации и ее решение.
Учитель: Зачем нам нужно знать о классификации хим. реакций в свете электронной теории? Что бы ответить на этот вопрос, давайте решим расчетную задачу.
Текст задачи: Какой объем газа - оксида азота (II) - выделится при взаимодействии 32г меди с раствором азотной кислоты? (Запомните, что азотная кислота,при взаимодействии с металлами, ведет себя по сравнению с другими кислотами иначе, окислителем будет азот со степенью окисления +5, которому все равно, где находится металл в ряду напряжений – до или после водорода).
Ученик у доски начинает решать задачу с составления уравнения хим. реакции:
Cu + HNO3 - Cu(NO3)2 + NO + H2O, при этом он и ученики видят, что расставить коэффициенты в уравнении методом подбора, как это делали ранее,- дело не только трудное, даже невозможное … Как же тогда быть?
Учитель задает наводящие вопросы учащимся:
Какой это тип реакции? Что здесь будет окислителем и восстановителем? Как с помощью электронных уравнений показать переход электронов? Есть ли равновесие (баланс) в составленных схемах? Как поступить, если число принятых и отданных электронов не совпадает ( а ведь есть правило сохранения числа электронов в ОВР)? (Это ОВР. Окислителем будет азотная кислота за счет азота со С.О.=+5,которую он понижает до С.О.=+2; а восстановителем будет медь, С.О. свою она повышает от 0 до +2. Электронные уравнения для данного процесса: Cu0 - 2e = Cu+2 (окисление) и N+5 + 3e = N+ 2 (восстановление). Баланса в полученных электронных уравнениях нет. Найдем между принятыми и отданными электронами наименьшее общее кратное, а затем коэффициенты перед формулами веществ в исходном уравнении).
Ученик, составляя электронные уравнения, находит коэффициенты для данного уравнения реакции : 3 Cu + 8 HNO3 - 3 Cu(NO3)2 + 2 NO + H2O
Учитель: Итак, мы поставили в данном уравнении коэффициенты, опираясь на знания электронной теории, т.е. методом электронного баланса. Теперь можно было бы решить задачу, это будет ваше домашнее задание. Так, зачем же нам нужны сведения об ОВР? Давайте попробуем предложить алгоритм действий при составлении ОВР методом электронного баланса.
Ученики рассуждают …. (показ слайда № 8)
Закрепление знаний учащихся.
Учитель предлагает ученикам расставить коэффициенты в следующих уравнениях хим. реакций методом электронного баланса, опираясь на предложенный алгоритм :
При составлении химических уравнений окислительно-восстановительных реакций удобно использовать метод электронного баланса. Алгоритм расставления коэффициентов состоит всего из шести простых пунктов. В его основе лежит закон сохранения массы веществ. При этом для сложных соединений существует возможность выполнить уравнивание на онлайн-калькуляторе.
- Общие понятия
- Суть метода
- Степени окисления
- Простой расчёт
- Пример сложного соединения
- Использование онлайн-калькулятора
Общие понятия
Взаимодействие исходных веществ с образованием новых, при котором ядра атомов остаются неизменными, называют химическими реакциями. Для них характерно перераспределение электронов. Исходные вещества называют реагентами, а прореагирующие — продуктами реакции. Превращение может происходить как сложных, так и простых элементов. Описываются они химическими уравнениями, состоящими из двух частей. Стрелка, разделяющая их, указывает направление протекания реакции.
Числа, стоящие перед веществами, участвующими в превращении, называют коэффициентами. Они указывают на количественную часть веществ. Любая реакция может происходить как с поглощением энергии, так и её выделением. В первом случае химическое уравнение называют эндотермическим, а во втором — экзотермическим.
Окислительно-восстановительными реакциями (ОВР) называют встречно-параллельные превращения с изменением степени окисления. Протекают они методом перераспределения электронов между акцептором — атомом окислителем и донором — восстановителем. Для составления уравнений, описывающих такого типа процесс, используют метод электронного баланса.
Примеры заданий предполагают, что в любой реакции, которую можно описать способом баланса, участвуют две сопряжённые окислительно-восстановительные пары. В итоге фактически возникают две полуреакции. Одна характеризуется увеличением электронов, а другая их отдачей. Таким образом, процессы окисления и восстановления не могут протекать друг без друга и не изменять степень окисления элементов.
Ионы или атомы, забирающие электроны называют окислителями, а отдающие — их восстановителями. Сложность записи таких уравнений заключается в правильном подборе количества молей возникающих соединений. Уравнивающие коэффициенты могут принимать только целые значения. Конкурентом метода баланса в химии является способ полуреакций. Первый отличается простотой и используется в том случае, когда реакция происходит в газообразной среде. Второй же более подходит для реакций, проходящих в жидкости.
Суть метода
Способ электронного баланса предназначен для облегчения решения заданий по уравниванию двух частей уравнения. В его сути лежит возможность расстановки коэффициентов для окислительно-восстановительной реакции с использованием степени окисления. Впервые с объяснением способа знакомят в восьмом классе на уроке неорганической химии.
В школьных учебниках часто приводится следующая последовательность действий для установления балансировки в ОВР:

- В уравнении определяют сложные и простые степени окисления.
- Реакцию переписывают с расстановкой степени окисления. При этом вещества, в которых изменяется степень во всех связях, выделяют любым способом, например, подчёркиванием.
- Находят окислитель, восстановитель, и в случае присутствия, нейтральный элемент.
- Составляют уравнение баланса с выделением внутренних коэффициентов.
- Определяют наименьшее общее кратное.
- Подставляют вычисленные коэффициенты в уравнение.
Классический способ, с помощью которого можно уравнять химические выражения, основан на законе сохранения массы, когда методом подбора находятся коэффициенты до начала реакции и после её окончания. Но для ОВР их подобрать очень сложно или невозможно. Поэтому и используют способ электронного баланса, который подходит как для простых, так и сложных реакций.
Степени окисления
Определение коэффициентов методом баланса непосредственно связано с расстановкой валентности. Не зная, как правильно выполнить эту операцию, уравнять ОВР будет невозможно. Под окислением элемента понимается значение заряда его атома. Этот ион может быть условным или реальным.
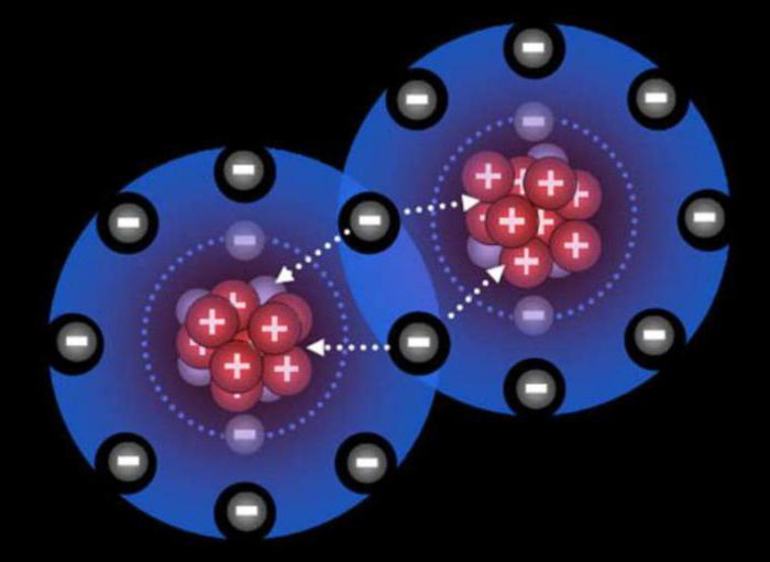
Существует несколько видов химических связей. Одними из них могут быть ковалентная и ионная. И в том, и другом случае между атомами образовывается пара. В первом случае пара смещается в сторону отрицательно заряженного атома, а во втором полностью переходит к более электроотрицательной частице. Поэтому под реальным зарядом понимается процесс, характеризующийся ионной связью, а условным — возникновение заряда при ковалентной.
Например, ионное соединение NaCl = Na 1+ + Cl 1- . Атом натрия имеет один электрон, который в ионном соединении полностью переходит к более отрицательному атому. То есть, электрон натрия отдаётся полностью атому хлора. При этом атом, утратив один ион, приобретает заряд равный один плюс. Хлор же, получая дополнительный электрон, меняет заряд на один минус.
В химии принято заряды обозначать сначала цифрой, а после ставить знак, а степень окисления наоборот. Поэтому правильной записью с указанием валентности для рассматриваемого примера будет выражение вида: Na +1 Cl -1 .
Для ковалентной полярной связи, например, молекулы HCl, общая электронная пара лишь смещается в сторону хлора. На атомах возникают частичные дельта-плюс и минус заряды. Но при расстановке значений на это внимания не обращают. Атом водорода полностью отдаёт свой электрон атому хлора. Соответственно, степень будет выглядеть как H +1 Cl -1 .
Следует помнить, что существуют элементы, которые всегда имеют постоянную валентность:

- Первую — щелочные металлы и фтор.
- Вторую — металлы II группы, главной подгруппы и кислород.
- Третью — алюминий.
Остальные же вещества характеризуются переменной валентностью. При описании реакции характерно выделение и гидроксильной группы. Для соединения ОН значение ионов указывается единым. Например, Na +1 (OH) -1 . Проверку правильности расстановки зарядов можно выполнить по правилу электронейтральности, согласно которому сумма положительных электронов должна быть равна сумме отрицательных.
Простой расчёт
Разобраться в сути способа поможет простой пример. Пусть необходимо расставить коэффициенты в реакции соединения оксида меди с азотной кислотой. Первым делом необходимо записать схему сложения: CuO + NH3 = Cu + N2 +H2O. Теперь нужно расставить валентность для каждого элемента. Делать это следует внимательно, ведь от того, насколько верно будет указана валентность, зависит правильность дальнейших действий.
Опираясь на таблицу Менделеева можно утверждать, что правильная степень окисления будет выглядеть для рассматриваемого выражения следующим образом: Cu +2 O -2 + N -3 H +1 3 = Cu 0 + N 0 2 +H +1 2O -2 . Теперь нужно отметить те элементы, которые поменяли свою валентность. Это медь, была +2, а стала 0, и азот, изменивший своё значение с -3 до 0.
На третьем шаге выписывают схемы уравнений полуреакций, изменивших окисление:
- Cu +2 — Cu 0 . Эта запись говорит, что два электрона были приняты медью и она стала нулевой. Обозначают этот процесс записью вида +2 e.
- 2N -3 — N 0 2. Тут следует обратить внимание на то, что при составлении полуреакций для молекул простых веществ обязательно следует указывать индексы. В рассматриваемом случае это двойка. Соответственно, такие выражения следует тоже уравнять. Поэтому в левой части ставится коэффициент два. Анализируя полуреакцию, можно прийти к выводу, что было -6 атомов, а стало ноль. То есть азот отдал шесть электронов. Записывается это как -6 e.
Закон сохранения заряда говорит о том, что электроны не могут взяться ниоткуда и пропасть никуда. Иными словами, какое их количество отдал восстановитель, то же их число должно быть принято окислителем.
В рассматриваемом примере получается, что два электрона были приняты, а шесть отданы. Так не бывает, поэтому нужно найти, где же потерялась разница. Для полученных чисел ищется наименьший общий знаменатель. Без остатка на них делится шесть. Выполнив действие, получают два опорных коэффициента: три и один. Таким образом, перед медью нужно поставить тройку, а азотом единицу: 3Cu +2 O -2 + 2N -3 H +1 3 = 3Cu 0 + N 0 2 +H +1 2O -2 .
Опираясь на полученные значения, проводят стандартную процедуру уравнивания: 3Cu +2 O -2 +2N -3 H +1 3 = 3Cu 0 + N 0 2 + 3H +1 2O -2 . Задача считается выполненной. Пожалуй, ещё можно указать, что медь в уравнении является окислителем, а азот — восстановителем.
Пример сложного соединения
Научившись решать простые задания можно переходить к формулам и сложнее. Например, соединению бромида и перманганата калия с серной кислотой. Схема реакции будет выглядеть следующим образом: KBr + KMnO4 + H2SO4 → MnSO4 + Br2 + K2SO4 + H2O.

Составляя уравнения полуреакций, проводят анализ. Марганец до реакции был + 7, то есть до нулевого значения ему не хватало семь единиц. После реакции же он стал +2, а значит, до нуля стало не хватать два электрона. Исходя из этого, можно утверждать, что марганец принял пять электронов: +5e.
Вторая полуреакция состоит из брома. Был он в степени -1, а стал в нулевой. При этом индекс у него стал два. Значит, первоначально в реакцию должны были вступить два атома брома. Следовательно, в исходном состоянии было 2*(-1) = -2 электрона, а после стало ноль. То есть бром отдал два электрона: — 2e.
Интересной особенностью метода является закономерность, что при составлении полуреакций в обязательном порядке в одной из них будут отдаваться электроны, а в другой забираться. Полученные уравнения будут иметь следующий вид:
2Br -1 — Br 0 2 |-2e |2.
Для продолжения решения полученные цифры нужно привести к общему знаменателю. В качестве уравнителя здесь будет число десять. Разделив на него количество электронов, находят два опорных коэффициента. Для марганца это будет двойка, а брома — пятёрка.
Полученные числа подставляют в уравнение:
2KBr + 10KMnO4 + H2SO4 → 5 Br2 + 2MnSO4+ K2SO4 + H2O.
Перед бромом должна стоять пятёрка, а вот перед бромом два следует поставить уже десятку. Проверяем, в левой части десять ионов брома вступило в реакцию и десять получилось в прореагирующей части. Возле марганца ставим двойку, соответственно, изменяется и количество калия. В левой части получается 12 атомов, а в правой только два. Поэтому справа возле калия нужно поставить шесть. Аналогично уравнивают серу, водород и кислород.
Использование онлайн-калькулятора

В интернете существуют сервисы, использование которых позволяет не только быстро выполнить уравнивание химических уравнений, но и получить нужные знания для самостоятельных вычислений. Называются они химическими онлайн-калькуляторами. Метод электронного баланса сам по себе несложен, но порой составление полуреакций может занять длительное время. Поэтому даже опытные пользователи прибегают к их помощи.
Эти порталы привлекательны тем, что решить поставленную задачу на них сможет даже тот, кто совершенно не разбирается в химии. Доступны онлайн-калькуляторы любому, кто имеет доступ к интернету.
Читайте также:

