Получение и применение алканов 10 класс конспект
Обновлено: 03.07.2024
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Цель: 1 . Рассмотреть основные способы лабораторного и промышленного получения алканов. Познакомить учащихся с природными источниками углеводородов.
2. Развивать умения строить формулы веществ по названиям и называть вещества по формулам, составлять формулы изомеров и гомологов.
3.Воспитывать творческий интерес к предмету.
План занятия:
Организационный момент: приветствие, перекличка
Опрос опорных знаний.
Мотивация: вступительное слово учителя о природных источниках УВ
Изучение нового материала:
Способы получения алканов
Применение предельных УВ
Ход занятия:
2. Опрос опорных знаний:
Фронтально- общая формула алканов, правила номенклатуры, названия гомологов метана, названия радикалов
Письменно по карточкам
4.Изучение нового материала:
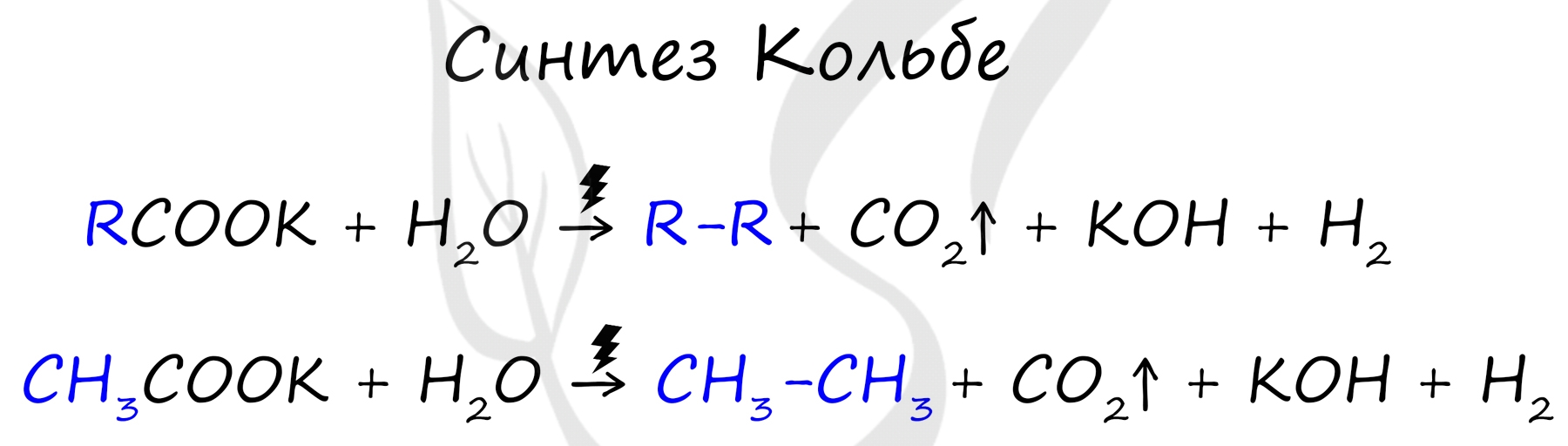
Способы получения алканов: способы получения алканов, как и любых других практически значимых веществ, можно разделить на промышленные и лабораторные (схема):
Используя данные §11 запишите в тетрадь уравнения химических реакций, которые соответствуют данной схеме.
В лаборатории
1. Гидролиз карбида алюминия (получение метана):
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4↑
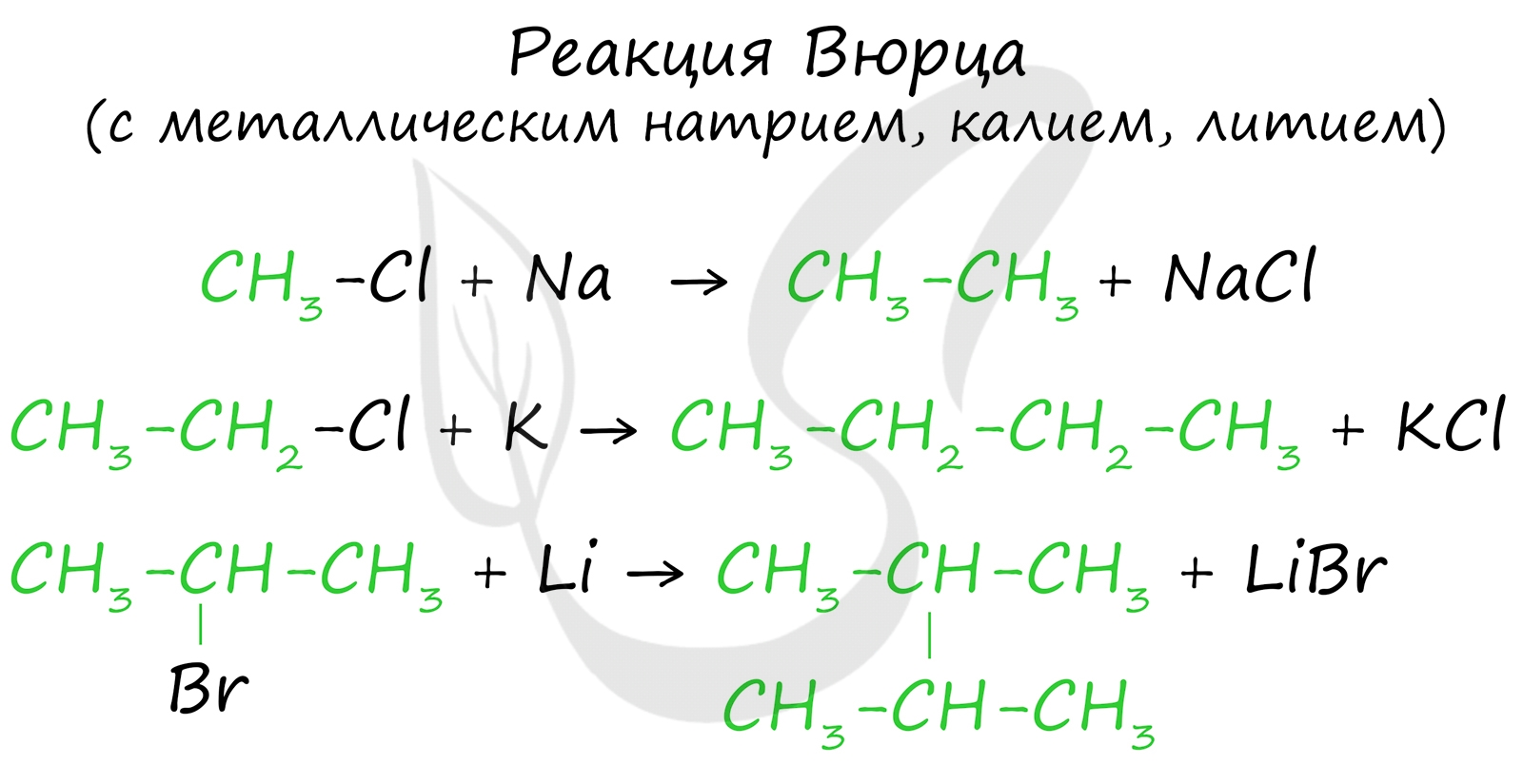
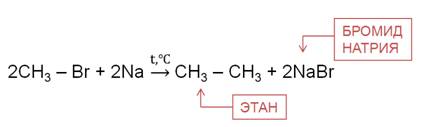
2. Реакция Вюрца (взаимодействие натрия с галогенпроизводными алканов):
R-Г + 2Na + Г-R1 → R-R1 + 2NaГ
(R- это радикал; Г- это галоген)
a) CH3-Cl + 2Na + Cl-CH3 → CH3-CH3 + 2NaCl
2CH3Cl + 2Na → C2H6 + 2NaCl
б ) CH3-I + 2Na + I-C2H5 → CH3-C2H5 + 2NaI
CH3I + 2Na + C2H5I → C3H8 + 2NaI
3. Термическое декарбоксилирование солей карбоновых кислот в присутствии щелочей:
R-COONa + NaOH -t ˚ С → R-H + Na2CO3
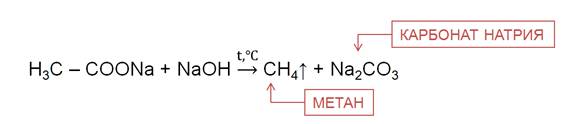
a) CH3-COONa + NaOH -t ˚ С → CH4 + Na2CO3
(ацетат натрия+ едкий натр=(метан+карбонат натрия)
б ) C2H5-COONa + NaOH -t ˚ С → C2H6 + Na2CO3
этилат натрия этан
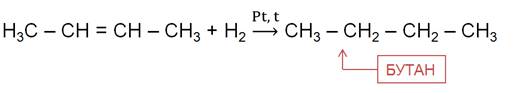
4. Каталитическое гидрирование алкенов и алкинов:
a) CnH2n + H2 -t,kat,p → CnH2n+2
C2H4 + H2 -300°C,Ni → C2H6
b) CnH2n-2 + 2H2 - t,kat→ CnH2n+2
C 2 H 2 + 2 H 2 - t , kat → C 2 H 6
В промышленности
1. Из природного и попутного нефтяного газа
Важнейшим источником алканов в природе является природный газ, минеральное углеводородное сырье - нефть и сопутствующие ей нефтяные газы. Природный газ на 95 процентов состоит из метана. Такой же состав имеет болотный газ, образующийся в результате переработки бактериями (гниения) углеводов.
Метан называют ещё и болотным; рудничным газом.
Попутные нефтяные газы состоят в основном из этана, пропана, бутана и частично пентана. Их отделяют от нефти на специальных установках по подготовке нефти. При отсутствии газоконденсатных станций попутные нефтяные газы сжигают в факелах, что является крайне неразумной и разорительной практикой в нефтедобыче. Одновременно с газами нефть очищается от воды, грязи и песка, после чего поступает в трубу для транспортировки. Из нефти при ее разгонке (перегонке, дистилляции) отбирая последовательно все более и более высококипящие фракции получают:
бензины - т. кип. от 40 до 180 С, (содержит углеводороды С5-С10), состоит более, чем из 100 индивидуальных соединений, нормальных и разветвленных алканов, циклоалканов, алкенов и ароматических углеводородов;
керосин 180-230 C, (С11-С12);
легкий газойль (дизельное топливо) 230-305 С (С13-С17);
смазочные масла 405-515 С (С26-С38).
Остаток после перегонки нефти называется асфальтом или битумом.
2. Синтезом из водяного газа:
n CO + (2 n + 1) H 2 - t , kat → CnH 2 n +2 + n H 2 O
CO + 3H2 - t,kat→ CH4 + H2O
3. Синтезом из простых веществ:
n C + ( n + 1) H 2 - t , kat , p → CnH 2 n +2
Подобно тому как строение вещества определяет его реакциолнную способность, так и свойства во многом обуславливают области применения соединения. Газообразные алканы – это не только бытовое и промышленное топливо, но и сырье для химической промышленности. Из них получают галогенпроизводные, в том числе полностью фторированные УВ (фреоны), являющиеся хладоагентеми бытовых и промышленных холодильников и кондиционеров. Метан идет на производство ацетилена. Из этана и пропана получают непредельные УВ и далее полимерные материалы. Жидкие УВ –это, прежде всего, топливо для двигателей различного типа, растворители, сырье для получения алкенов.
1. Предельные углеводороды находят широкое применение в самых разнообразных сферах жизни и деятельности человека.
2. Использование в качестве топлива – в котельных установках, бензин, дизельное топливо, авиационное топливо, баллоны с пропан-бутановой смесью для бытовых плит
3. Вазелин используется в медицине, парфюмерии, косметике, высшие алканы входят в состав смазочных масел, соединения алканов применяются в качестве хладагентов в домашних холодильниках
4. Смесь изомерных пентанов и гексанов называется петролейным эфиром и применяется в качестве растворителя. Циклогексан также широко применяется в качестве растворителя и для синтеза полимеров.
5. Метан используется для производства шин и краски
6. Значение алканов в современном мире огромно. В нефтехимической промышленности предельные улеводороды являются базой для получения разнообразных органических соединений, важным сырьем в процессах получения полупродуктов для производства пластмасс, каучуков, синтетических волокон, моющих средств и многих других веществ. Велико значение в медицине, парфюмерии и косметике.
Трудно себе представить наш быт без голубых язычков огня кухонной плиты или газовой зажигалки. В этих устройствах сгорают углеводороды одного и того же класса — алканы. Различие лишь в том, что бытовой газ представляет собой главным образом метан СН4, а в резервуаре зажигалки находятся под давлением сжиженные газы пропан С3Н8 и бутан С4Н10.
Углеводороды, молекулы которых не содержат кратных связей, называют предельными или насыщенными.
Своё название предельные углеводороды получили потому, что все валентности углеродных атомов в их молекулах насыщены атомами водорода до предела.
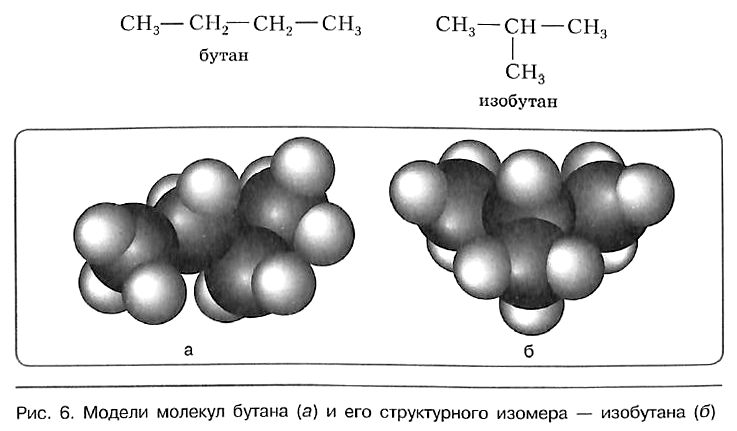
Сокращённая структурная формула пропана СН3—СН2—СН3. Для бутана возможно написание двух структурных формул: в одной углеродная цепь имеет линейное, а в другой — разветвлённое строение:
Свойства бутана и изобутана различны: бутан имеет более низкие температуры кипения и плавления. По отношению друг к другу бутан и изобутан являются изомерами, различающимися строением углеродной цепи. Изомерия углеродной цепи — вариант структурной изомерии.

В молекулах алканов углеродные цепи открытые, т. е. незамкнутые. Но предельными могут быть и углеводороды, имеющие замкнутую углеродную цепь. Этот класс соединений называют циклоалканами. Некоторые циклоалканы, например циклогексан С6Н12, входят в состав нефти.
Простейший представитель алканов — метан СН4. Именно это соединение является родоначальником гомологического ряда алканов.
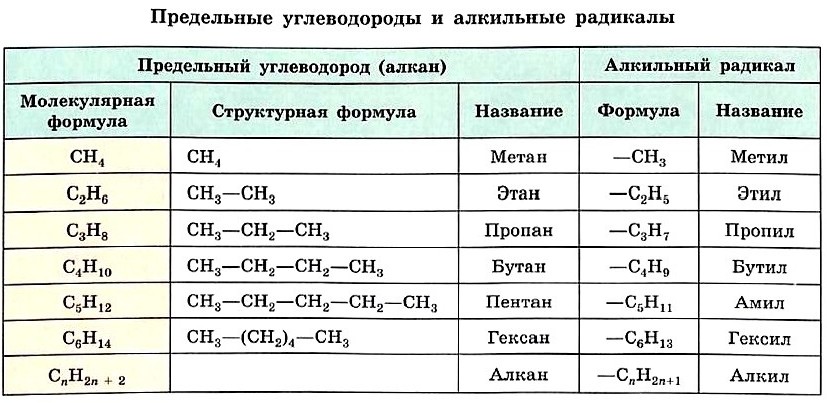
Формулу каждого последующего члена гомологического ряда легко получить из формулы предыдущего, заменив один атом водорода в молекуле на группу СН3. Так, второй гомолог ряда алканов — этан — имеет формулу СН3—СН3. Формулы и названия первых шести представителей алканов с неразветвлённой цепью атомов углерода приведены в таблице.
Если от молекулы алкана мысленно отщепить один атом водорода, мы получим частицу со свободной валентностью у атома углерода — радикал.
Название радикала, соответствующего предельному углеводороду, т. е. алкильного радикала, строится так: суффикс -ан заменяют на -ил, а состав будет подчиняться общей формуле С n Н2 n +1. Формулы и названия алкильных радикалов, приведённые в таблице, нужно запомнить, чтобы уметь называть органические вещества с разветвлённой углеродной цепью.

Номенклатура алканов
Для построения названий органических веществ, в частности предельных углеводородов, используют свод правил — номенклатуру. В соответствии с так называемой международной, или систематической, номенклатурой при составлении названий алканов руководствуются следующими правилами:
- 1) выбирают в молекуле самую длинную цепь атомов углерода;
- 2) нумеруют атомы углерода в цепи с того конца, к которому ближе разветвление;
- 3) записывают основу названия вещества — название углеводорода с тем же числом углеродных атомов, что и в пронумерованной цепи;
- 4) перед основой названия перечисляют все заместители основной цепи с указанием номеров атомов углерода, при которых они стоят. Если одинаковых заместителей несколько, перед их названиями ставят приставки ди-, три-, тетра-,
- 5) все цифры друг от друга отделяют запятыми, буквы от цифр — дефисом. Если при одном углеродном атоме имеется не один, а два заместителя, его цифра повторяется в названии дважды;
- 6) перед названием предельного углеводорода нормального (неразветвлённого) строения ставят букву н-.

Проиллюстрируем эти правила примерами названий алканов.
Физические и химические свойства алканов
Метан и его газообразные гомологи (до бутана включительно) содержатся в природном и попутном нефтяном газах. Жидкие алканы — основная часть нефти. Твёрдые предельные углеводороды (парафин) растворены в нефти, которая и служит источником их получения.
При обычных условиях алканы не реагируют с концентрированными кислотами и щелочами, не окисляются сильными окислителями, такими как перманганат калия.

Однако при нагревании химическое поведение алканов резко меняется. Все алканы горят бледно-голубым пламенем с образованием углекислого газа и воды:
Горение алканов сопровождается выделением большого количества теплоты, что определяет их использование в качестве топлива.
Следует помнить, что углеводороды относятся к пожаро- и взрывоопасным веществам. Утечка бытового газа грозит страшными последствиями. Для того чтобы вовремя обнаружить наличие в воздухе бытового газа, к нему добавляют вещества с резким неприятным запахом — одоранты. Если вы почувствовали на кухне, в подъезде или на улице запах газа, следует немедленно обратиться в экстренную службу по телефону 104, проветрить помещение и ни в коем случае не пользоваться открытым огнём или электроприборами. В случае пожара службу спасения вызывают по телефону 101 или 112 (с сотового телефона бесплатно).
Предельные углеводороды используют не только как топливо, но и в качестве сырья для химической промышленности, поскольку их свойства отнюдь не ограничиваются реакцией горения.

В предельных углеводородах атомы водорода могут замещаться другими атомами или группами, в частности атомами галогенов (хлора и брома). Эти реакции замещения протекают ступенчато при освещении смеси газов:

Галогенпроизводные алканов — прекрасные растворители, хладагенты (рабочие жидкости, которыми заправляют бытовые холодильники и промышленные холодильные установки), реагенты для органического синтеза.

Если предельные углеводороды нагревать без доступа воздуха при более высокой температуре, то они не выдерживают такого воздействия и разлагаются. Например, из метана при нагревании свыше 1000 °С образуется два ценных продукта — сажа (углерод) и водород:
Сажу, полученную таким образом, используют для изготовления автомобильных шин и резины, она входит в состав красок и туши.

Алканы с неразветвлённой цепью углеродных атомов при нагревании превращаются в более устойчивые соединения с разветвлённой цепью. Например, из н-бутана можно получить изобутан:
Поскольку состав исходного вещества и продукта реакции одинаков, эти соединения являются изомерами. Именно поэтому такой процесс получил название реакция изомеризации.
При нагревании в присутствии катализатора алканы способны вступать в реакцию отщепления. Что же могут отщеплять молекулы предельных углеводородов? Если предположить, что углеродная цепь остаётся без изменения, то отщепляться могут только молекулы водорода.
Этилен С2Н4 — представитель непредельных углеводородов, о которых пойдёт речь в следующем параграфе.

Мы приступаем к новому разделу - органической химии. Совершенно необязательно (и даже преступно по отношению к собственному времени!) знать наизусть, зубрить свойства органических веществ.
По мере изучения вы поймете, что свойства вещества определяются его строением, и научитесь легко предсказывать ход реакций ;)
- Атомы в молекуле соединены в определенной последовательности, в соответствии с их валентностью. Порядок связи атомов отражает химическое строение.
- Зная свойства веществ, можно установить их химическое строение, и наоборот, зная строение вещества можно сделать вывод о его свойствах.
- Атомы или группы атомов оказывают взаимное влияние друг на друга непосредственно или через другие атомы
- Свойства вещества зависят от количественного и качественного состава, а также от химического строения молекулы

Алканы (парафины) - насыщенные углеводороды, имеющие линейное или разветвленное строение, содержащие только простые связи. Относятся к алифатическим углеводородам, так как не содержат ароматических связей.
Алканы являются насыщенными соединениями - содержат максимально возможное число атомов водорода. Общая формула их гомологического ряда - CnH2n+2.
Номенклатура алканов
Номенклатура (от лат. nomen - имя + calare - созывать) - совокупность названий индивидуальных химических веществ, а также правила составления этих названий. Названия у алканов формируются путем добавления суффикса "ан": метан, этан, пропан, бутан и т.д.
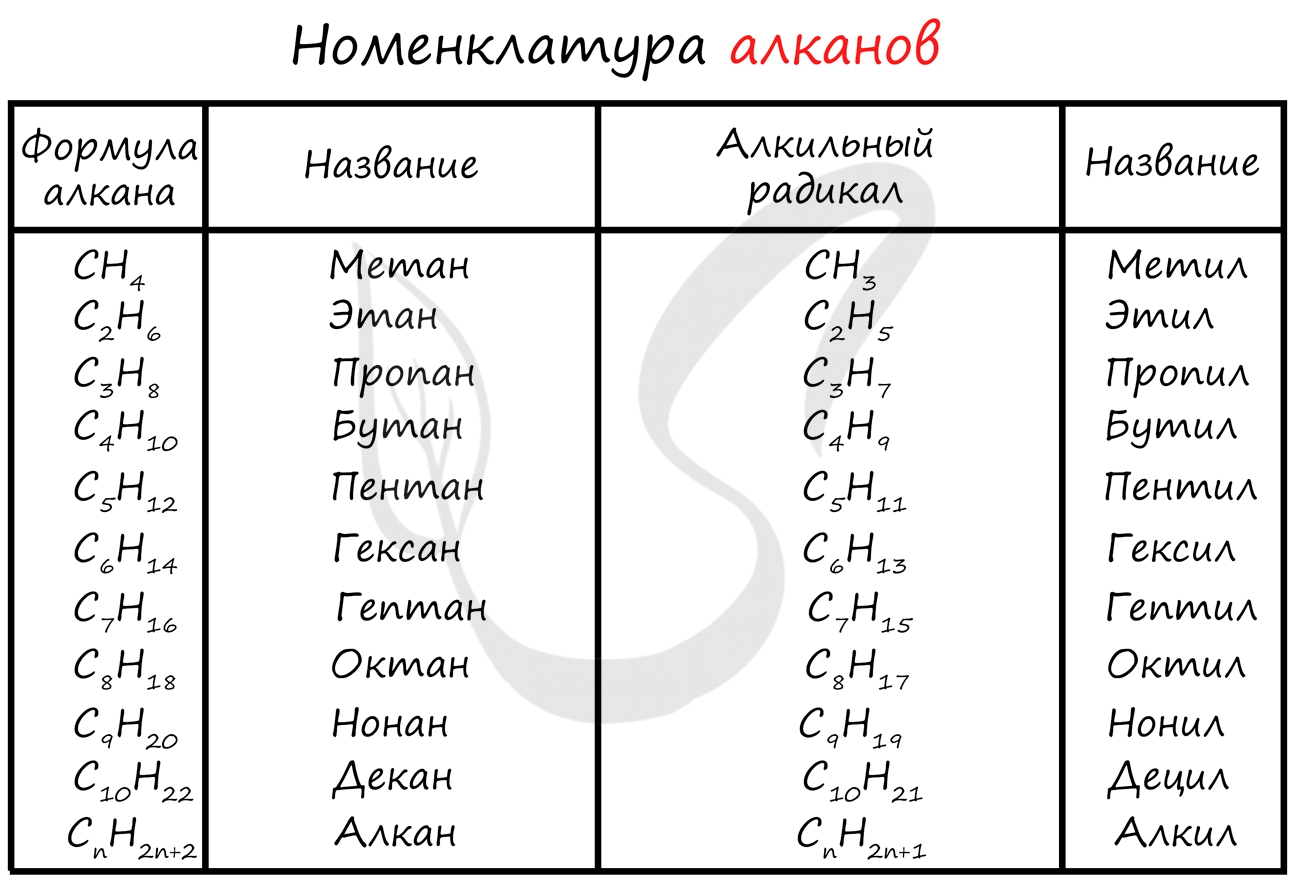
Гомологами называют вещества, сходные по строению и свойствам, отличающиеся на одну или более групп CH2
Перечисленные выше алканы, являются по отношению друг к другу гомологами, то есть составляют один гомологический ряд (греч. homólogos - соответственный).
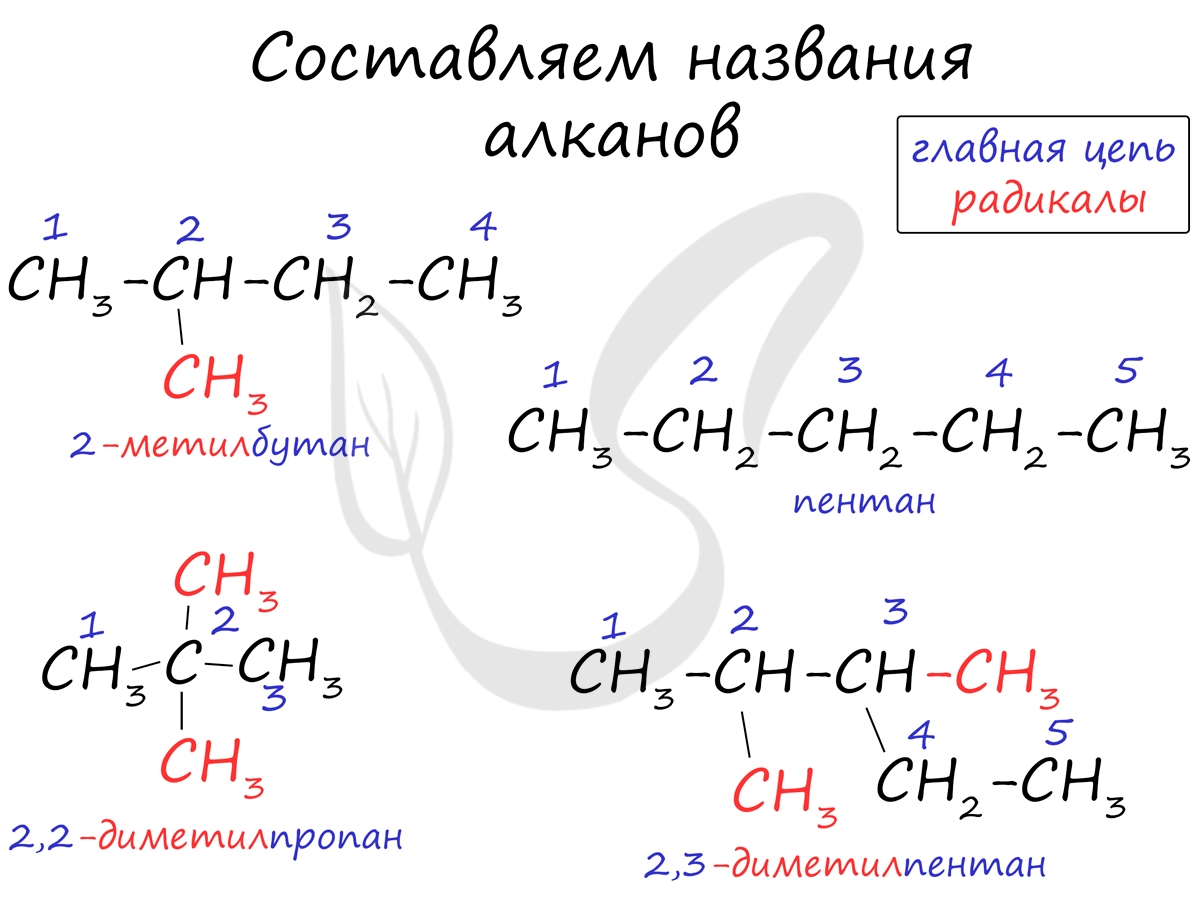
Названия алканов формируются по нескольким правилам. Если вы знаете их, можете пропустить этот пункт, однако я должен познакомить читателя с ними. Итак, алгоритм составления названий следующий:
- В структурной формуле вещества необходимо выбрать самую длинную (пусть и изогнутую на рисунке!) цепь атомов углерода
- Атомы выбранной цепи нумеруют, начиная с того конца, к которому ближе разветвление (радикал)
- В начале название перечисляют радикалы и другие заместители с указанием номеров атомов углерода, с которыми они связаны. Если в молекуле имеется несколько одинаковых радикалов, то цифрой указывают нахождение каждого из них в главной цепи и перед их названием соответственно ставят частицы ди-, три-, тетра- и т.д.
- Основой названия служит наименование предельного углеводорода с тем же количеством атомов углерода, что и в главной цепи
Внимательно изучите составленные для различных веществ названия ниже.
В углеводородной цепочке различают несколько типов атомов углерода, в зависимости от того, с каким числом других атомов углерода соединен данный атом. Различают первичные, вторичные, третичные и четвертичные атомы углерода.

Изомерами (греч. isomeros - составленный из равных частей) называют вещества, имеющие одну молекулярную формулу, но отличающиеся по строению (структурная изомерия) или расположению атомов в пространстве (пространственная изомерия).
Изомерия бывает структурной (межклассовая, углеродного скелета, положения функциональной группы или связи) и пространственной (геометрической, оптической). По мере изучения классов органических веществ вы узнаете о всех этих видах.
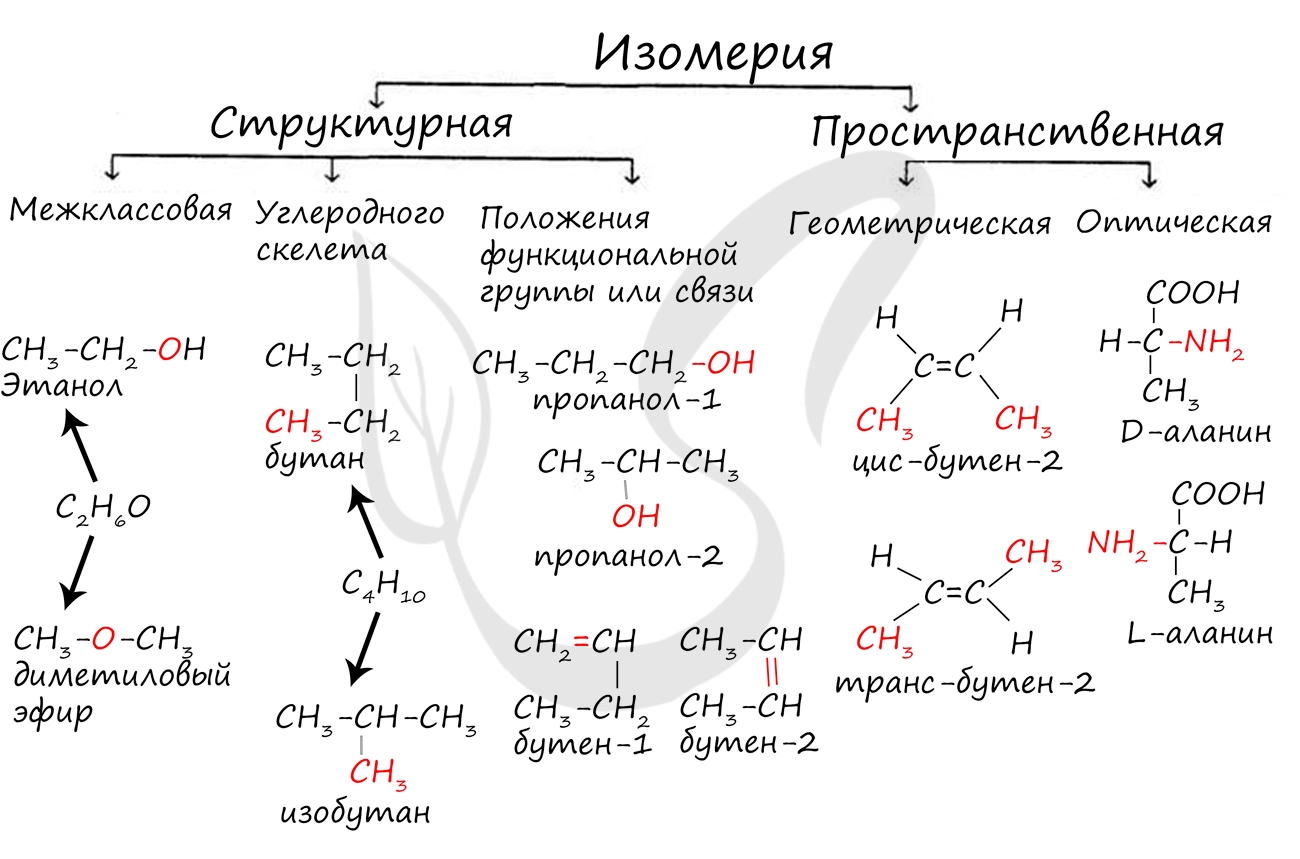
В молекулах алканов отсутствуют функциональные группы, кратные связи. Для алканов возможна изомерия только углеродного скелета. Так у пентана C5H12 существует 3 структурных изомера.

- В молекулах алканов присутствуют одиночные сигма-связи (σ-связи), длина которых составляет 0,154 нм
- Тип гибридизации атомов углерода - sp 3
- Валентный угол (между химическими связями) составляет 109°28'

Природный газ и нефть
Алканы входят в состав природного газа: метан 80-97%, этан 0.5-4%, пропан 0.2-1.5% , бутан 0.1-1%, пентан 0-1%. Состав нефти нельзя выразить одной формулой, он непостоянен и зависит от месторождения.
В состав нефти входят алканы с длинными углеродными цепочками, например: C8H18, C12H26. Путем крекинга из нефти получают алканы.

Получение алканов
В ходе крекинга нефти получается один алкан и один алкен.
Данный синтез заключается в сплавлении соли карбоновой кислоты с щелочью, в результате образуется алкан.

Эта реакция заключается во взаимодействии галогеналкана с металлическим натрием, калием или литием. В результате происходит удвоение углеводородного радикала, рост цепи осуществляется зеркально: в том месте, где находился атом галогена.
В ходе синтеза Гриньяра с помощью реактива Гриньяра (алкилмагнийгалогенида) получают различные органические соединения, в том числе несимметричные (в отличие от реакции Вюрца).
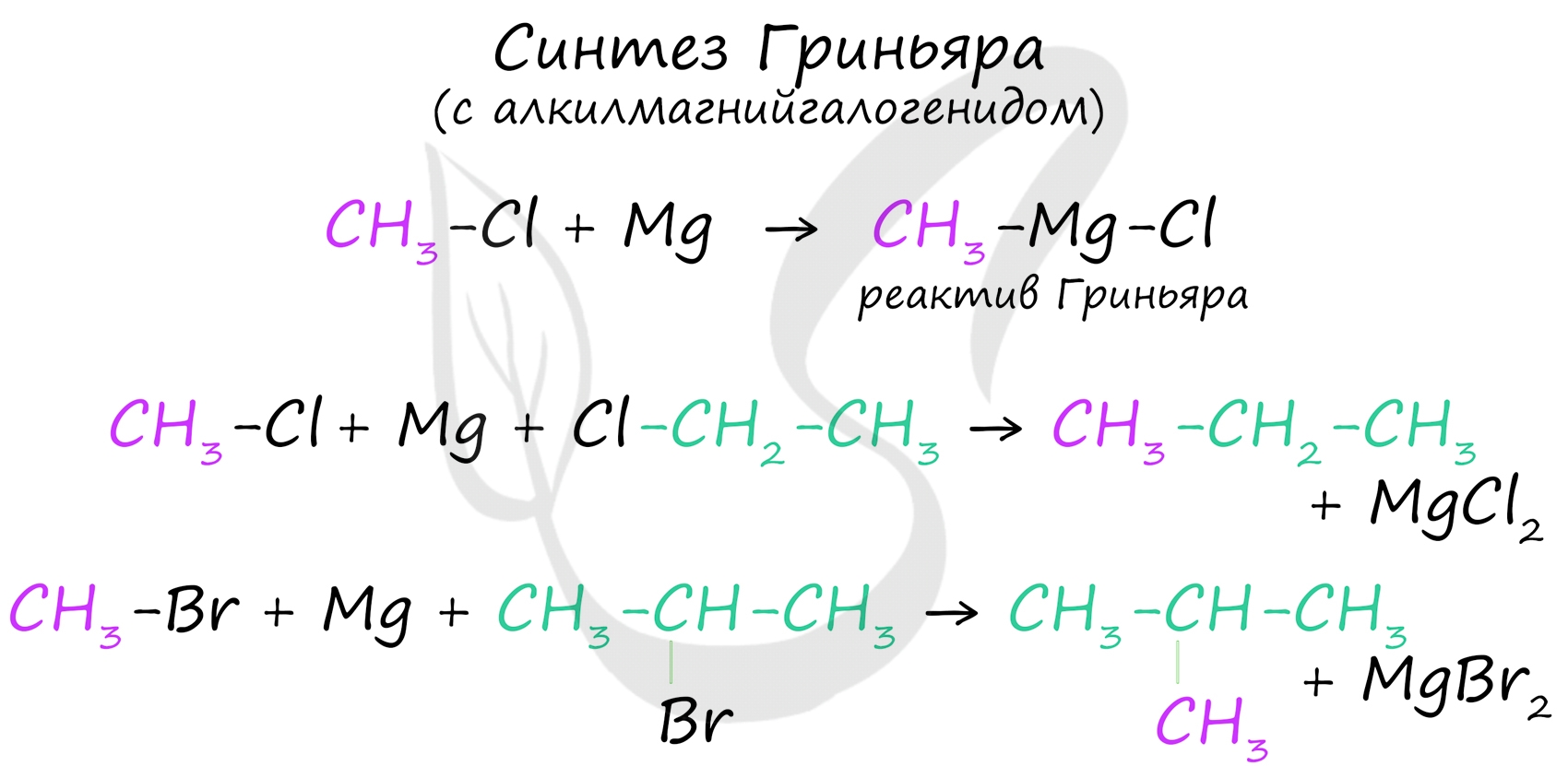
На схеме выше мы сначала получили реактив Гриньяра, а потом использовали его для синтеза. Однако можно записать получение реактива Гриньяра и сам синтез в одну реакцию, как показано на примерах ниже.

В результате электролиза солей карбоновых кислот может происходить образование алканов.
В результате разложения карбида алюминия образуется метан и гидроксид алюминия.
Химические свойства алканов
Атом галогена замещает атом водорода в молекуле алкана. Запомните, что легче всего идет замещение у третичного атома углерода, чуть труднее - у вторичного и значительно труднее - у первичного.

Реакции с хлором на свету происходят по свободнорадикальному механизму. На свету молекула хлора распадается на свободные радикалы, которые и осуществляют атаку на молекулу углеводорода.

Реакция Коновалова заключается в нитровании алифатических (а также ароматических) соединений разбавленной азотной кислотой. Реакция идет при повышенном давлении, по свободнорадикальному механизму.
Для удобства и более глубокого понимания, азотную кислоту - HNO3 - можно представить как HO-NO2.

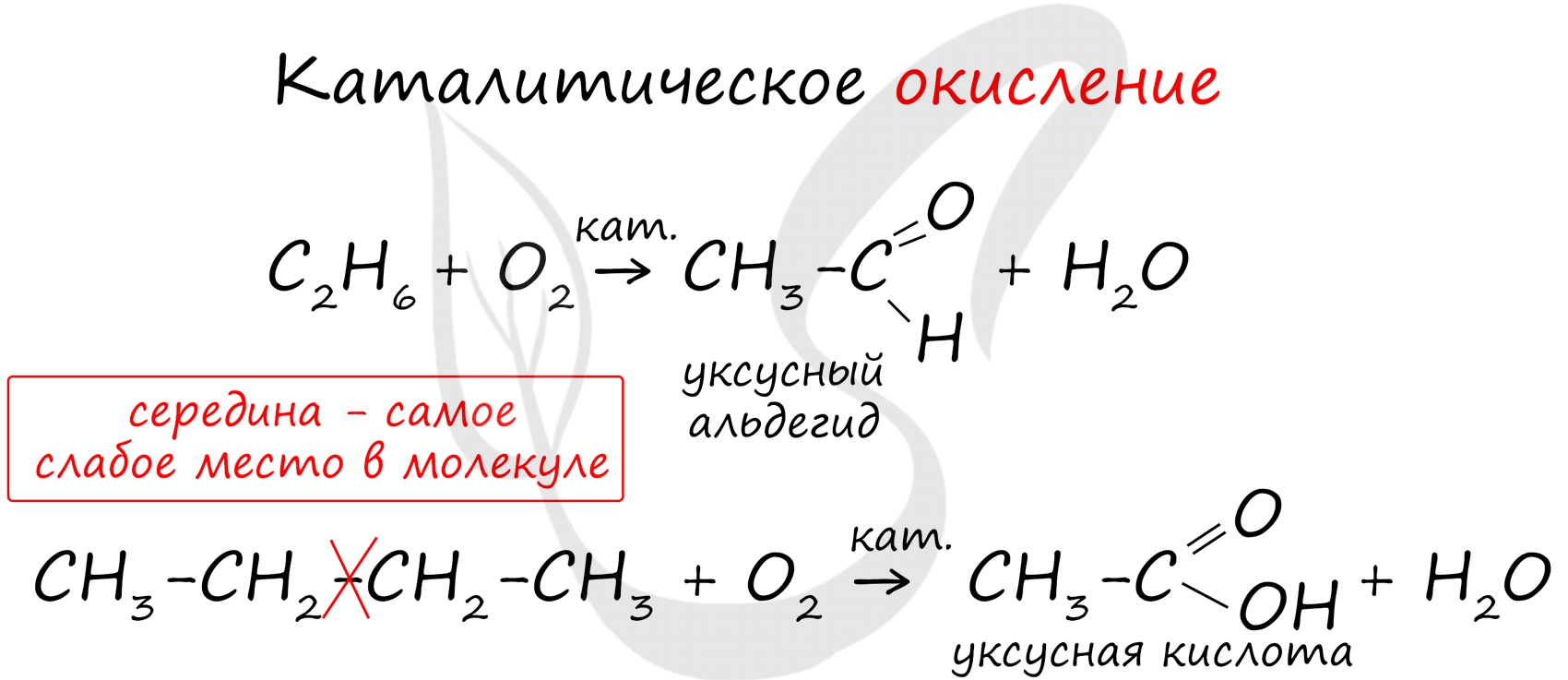
Все органические вещества, в их числе алканы, сгорают с образованием углекислого газа и воды.
В ходе каталитического, управляемого окисления, возможна остановка на стадии спирта, альдегида, кислоты.
Пиролиз (греч. πῦρ - огонь + λύσις - разложение) - термическое разложение неорганических и органических соединений. Принципиальное отличие пиролиза от горения - в отсутствии кислорода.
В реакциях, по итогам которых образуются изомеры, используется характерный катализатор AlCl3.

Вам уже известно, что в результате крекинга образуется один алкан и один алкен. Это не только способ получения алканов, но и их химическое свойство.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.

Этот видеоурок посвящён рассмотрению физических и химических свойств алканов. Приведены примеры уравнений реакций, отражающих химические свойства, получение алканов.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Алканы: свойства, получение и применение"
Предельные углеводороды – алканы, при обычных условиях достаточно инертны. Для них свойственны реакции замещения атомов водорода и реакции расщепления. Эти реакции требуют жёстких условий: нагревания, действия света, наличия катализаторов. Поэтому алканы ещё называют парафинами, что означает мало сродства.
Для алканов характерны реакции окисления. При полном окислении, например, метана образуется углекислый газ, вода и выделяется большое количество теплоты.
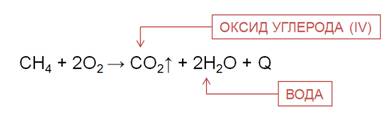
По этой причине метан в составе природного газа используют в качестве топлива в домах, на электростанциях, горючего для машин.
Смеси метана с кислородом (1 : 2 по объёму или воздухом 1 : 10) опасны и приводят к взрывам.
При частичном окислении, например, при недостатке кислорода, образуется оксид углерода (II) и вода.
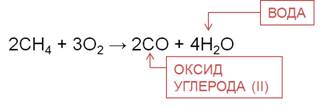
При частичном окислении бутана в присутствии катализаторов образуется уксусная кислота.
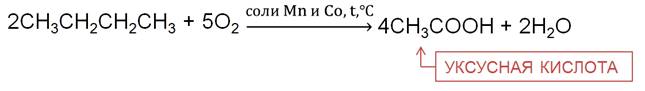
Для алканов свойственны реакции замещения (галогенирования). Большой вклад в разработку цепных реакций внёс физик, академик, лауреат Нобелевской премии Н. Н. Семёнов.
С фтором реакция идёт со взрывом, с йодом алканы не взаимодействуют, а с хлором и бромом в присутствии инициаторов.
В реакции метана с хлором на свету на первой стадии образуется хлорметан. Хлорметан представляет собой газ, легко сжижается, он применяется в холодильных установках.
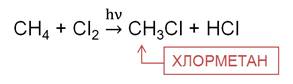
На второй стадии образуется дихлорметан. Это растворитель, его используют для склеивания пластика.
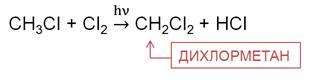
На третьей стадии хлорирования метана образуется трихлорметан. Трихлорметан – бесцветная летучая жидкость с эфирным запахом, используется при производстве фреонового хладагента, в качестве растворителя в фармакологии, для производства красителей и пестицидов.
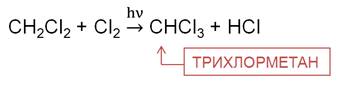
На четвёртой стадии образуется тетрахлорметан, который применяют как растворитель, а также для получения фреонов, как экстрагент в медицине, тетрахлорметан применялся как наполнитель для переносных огнетушителей в советской бронетехнике.
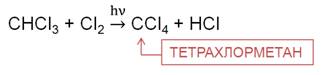
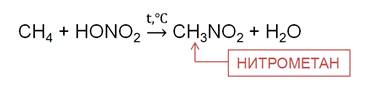
При нагревании алканов до 140 0 C с разбавленной (10 %) HNO3 под давлением идёт реакция нитрирования, то есть замещения атома водорода нитрогруппой. Эту реакцию называют ещё реакцией М. Н. Коновалова. В результате реакции метана с азотной кислотой образуется нитрометан.
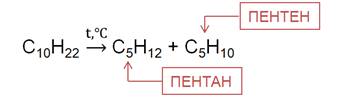
При температуре более 500 0 C в присутствии катализаторов алканы подвергаются расщеплению, то есть крекингу. Это приводит к образованию смеси алкенов и алканов.

При температуре 1000 осуществляется пиролиз, при этом разрываются все связи.
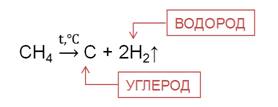
Таким образом, получают технический углерод – пигмент для изготовления типографической краски и наполнителя резины для автомобильных шин.
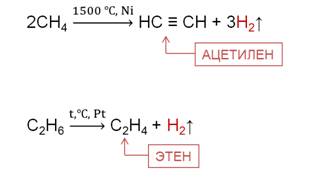
При повышенных температурах алканы образуют, главным образом, непредельные углеводороды. Например, в реакции дегидрирования метана при температуре 1500 0 C образуется ацетилен и водород, в реакции дегидрирования этана образуется этен и водород.
Под влиянием катализаторов и при температуре углеводороды нормального строения подвергаются изомеризации с образование углеводородов разветвлённого строения. Так, в присутствии катализатора хлорида алюминия происходит изомеризация бутана с образованием изобутана.
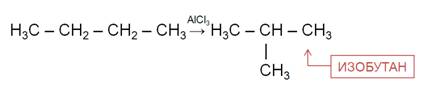
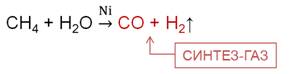
При конверсии метана образуется синтез-газ, который представляет собой смесь угарного газа с водородом.
Рассмотрим получение алканов.
В промышленности насыщенные углеводороды – алканы получают при переработке нефти.
В лаборатории алканы можно получить различными способами. Например, из солей карбоновых кислот при нагревании с твёрдыми щелочами.
Реакция Вюрца используется для увеличения углеводородной цепи.
Алканы также можно получить гидрированием ненасыщенных углеводородов.
Алканы имеют широкое применение. Бутан используется для получения бутадиена-1,3, необходимого в производстве синтетического каучука. Метан используется для получения синтез-газа, метанола, ацетилена, как топливо, горючее для двигателей внутреннего сгорания, для получения растворителей.
Таким образом, при облучении светом или при высоких температурах алканы вступают в реакции окисления и замещения. Алканы в промышленности получают из нефти, а в лаборатории реакциями гидрирования ненасыщенных углеводородов, нагреванием солей карбоновых кислот со щелочами, реакцией Вюрца.

Алканы получают из нефтепродуктов, природного газа, каменного угля. Главное применение алканов – использование в качестве топлива. Из веществ также изготавливают растворители, косметические средства, асфальт.
Описание
Алканы – класс насыщенных или предельных углеводородов. Это значит, что молекулы алканов содержат максимальное количество атомов водорода. Общая формула соединений гомологического ряда алканов – CnH2n+2. Названия веществ составляются из греческого обозначения числительных и суффикса -ан.
Физические и химические свойства алканов зависят от их строения. С возрастанием количества атомов углерода в молекуле происходит переход от газообразных веществ к твёрдым соединениям.
Агрегатное состояние алканов в зависимости от количества атомов углерода:

Рис. 1. Парафиновые свечи.
С увеличением молекулярной массы в гомологическом ряду повышаются температуры плавления и кипения.
Применение
Алканы выделяют из полезных ископаемых – нефти, газа, каменного угля. На разных этапах переработки получают бензин, керосин, мазут. Алканы используются в медицине, косметологии, строительстве.

Рис. 2. Нефть содержит жидкие алканы.
В таблице описаны основные области применения предельных углеводородов.
Область
Что используют
Как используют
Бензин, керосин, мазут
В качестве ракетного, моторного топлива
В качестве бытового газа для приготовления пищи
Петролейный эфир (смесь изопентанов и изогексанов),
Изготовление растворителей, смазочных масел, пропитки
Изготовление вазелинового масла (смесь жидких алканов), вазелина (смесь жидких и твёрдых алканов), свечей, моющих средств, лаков, эмалей, мыла. В качестве пропитки спичек. Использование при производстве органических кислот
Изготовление спиртов, альдегидов, кислот
Вазелин, вазелиновое масло
В качестве пропеллентов для изготовления аэрозолей
Изготовление увлажняющих косметических средств
Гудрон (дёготь) – конечный продукт переработки нефти, содержащий смесь алканов, циклоалканов, аренов, металлов, неметаллов
Для изготовления асфальтовых дорог
В качестве пропитки упаковочной бумаги
Производство жевательных резинок

Рис. 3. Гудрон.
Алканы используются при изготовлении каучука, синтетических тканей, пластмасс, поверхностно-активных веществ. В качестве заправки баллонов для тушения пожаров используются пропан и бутан в сжиженном виде.
Что мы узнали?
Узнали кратко об области применения алканов. Насыщенные углеводороды в газообразном, жидком, твёрдом состоянии используются в химической, пищевой, бумажной, энергетической отраслях, в косметологии и строительстве. Из алканов производят растворители, краски, лаки, мыло, свечи, мази, асфальт. Бензин, керосин, мазут, состоящие из жидких алканов, используют в качестве топлива. Газообразные алканы применяются в быту и для производства аэрозолей. Основные источники алканов – нефть, природный газ, каменный уголь.
Читайте также:

