Относительная молекулярная масса план конспект
Обновлено: 04.07.2024
Цель урока:
- Развитие ответственного отношения к учению, способности обучающихся к саморазвитию и самообразованию на основе мотивации к обучению и познанию.
- Формирование целостного мировоззрения.
- Развитие умений определять способы действий в рамках предложенных условий и требований.
- Развитие умение осуществлять контроль своей деятельности в процессе достижения результата.
- Развитие компетентности в области использования информационно-коммуникационных технологий.
- Формирование первоначальных представлений о веществах: понятия “химическая формула”, “индекс”, “коэффициент”, “относительные атомная и молекулярная массы”.
- Овладение основами химической грамотности: умение писать и читать формулы веществ.
- Формирование навыков расчёта относительной молекулярной массы вещества.
Тип урока: урок введения нового материала с использованием электронно-образовательных ресурсов и самостоятельной исследовательской деятельности учащихся.
Формы работы учащихся: фронтальная, индивидуальная, мини-группы (в парах).
Оборудование: Таблица Д.И.Менделеева, ПК, экран, опорные схемы (приложение 1), карточка для организации игры “Химическое лото”, комплект шаростержневых моделей, лоток для моделей молекул, комплект цветных магнитов, магнитная доска.
ЭТАПЫ УРОКА
1. Актуализация знаний. Повторение символов химических элементов и их названий.
Учитель:
Начнём урок со строк Степана Щипачёва:
“В природе ничего другого нет,
Ни здесь, ни там, в космических глубинах.
Все от песчинок малых до планет
Из элементов состоит единых”
Все вещества окружающих нас тел живой и неживой природы состоят из химических элементов. Чтобы изучить свойства веществ и превращения одних веществ в другие, необходимо знать химический язык. Знаки химических элементов - это “буквы” химического языка. Проверим знания химических элементов.
За работу на уроке вы получаете “аурики” – показатель вашей активности. Название “Аурики” образовано от латинского названия химического элемента – драгоценного металла – Аурум (Золото). После урока вы вернёте их, в обмен на оценку.
Игра. “Химическое лото”. Работа по индивидуальным карточкам (приложение 2).
Зачеркните знак химического элемента, о котором идёт речь в строках стихотворения. (При чтении стихотворных строк ученик, выполнивший задание, держит руку на локте вместе с ручкой – сигнал выполнения работы).
Взаимопроверка (по слайду презентации), оценивание, подведение итогов игры.
Карточки трёх учащихся (по желанию) - индивидуальная проверка учителем после урока.
| Унылая пора! Очей очарованье! Приятна мне твоя прощальная краса — Люблю я пышное природы увяданье, В багрец и в золото одетые леса. | А. С. Пушкин |
| В их стройно зыблемом строю Лоскутья сих знамен победных, Сиянье шапок этих медных, Насквозь простреленных в бою. | А. С. Пушкин |
| И квакуши, как шарики ртути, Голосами сцепляются в шар. | О. Мандельштам |
| И вспышками магния, кроя с балконов Смертельною известью лица, В агонии красных огней и вагонов В лице изменялась столица. | В. Катаев |
| О, если бы вы знали, Какой за ним уход! Он принимает калий, Ему дают азот. | Вера Инбер |
| Воды минеральные бьют из-под земли, Кальцием и натрием насыщены они. | Г. Колпакова |
| О, мощный властелин судьбы! Не так ли ты над самой бездной На высоте, уздой железной Россию поднял на дыбы? | А. С. Пушкин |
| Тогда услышал я (о диво!) запах скверный; Как будто тухлое разбилось яйцо. Иль карантинный страж курил жаровней серной. | А.С. Пушкин |
Учитель: Назовите не закрашенные элементы (за правильный ответ - дополнительный балл).
Физ.минутка. Предлагаю немного отдохнуть и устроить “Стрельбу глазами” [ 1 ]
- В периодической системе найдите самый сильный элемент – неметалл – окислитель -7 группа, главная подгруппа, 2 период. (F)
- Переведите свой взгляд влево, на элемент, стоящий в том же периоде в 3 группе.(B)
- Переведите взгляд вниз, на самый сильный металл – 7 период. (Fr)
- Переведите взгляд вверх и вправо, на элемент 6 группы, главной подгруппы, 2 период, образующий вещество, которое поддерживает горение. (O)
- Переведите взгляд вниз и влево, на элемент, атомы которого образуют металл, содержащийся в градусниках. (Hg)
- Переведите взгляд вверх и вправо, на элемент с относительной атомной массой 35,5. (Cl)
- Переведите взгляд вниз и влево, на элемент, 2 группы, главной подгруппы, с порядковым номером 56. (Вa)
- Переведите взгляд на элемент, который возглавляет группу инертных газов в периодической системе Менделеева. (Не)
- Переведите свой взгляд вниз и влево, на элемент, атомы которого образуют драгоценный металл желтого цвета. (Au)
2. Введение новых знаний. Создание и решение проблемной ситуации. Исследовательское моделирование.
Учитель: Что означают знаки (символы) химических элементов?
Учащиеся: Символы химических элементов используют для обозначения атомов определённого вида; удобное международное сокращение греческих или латинских названий элементов.
Учитель: Знаки химических элементов - это знаковые модели. Давайте попробуем создать предметные модели частиц, из которых состоят вещества. Начнем с атомов. Чем отличаются друг от друга атомы разных видов, т.е. разных химических элементов?
Учащиеся: Атомы разных видов отличаются массой, размерами, строением.
Учитель: Вам выданы шаростержневые модели. Для того, чтобы показать отличие атомов друг от друга, шарики разного цвета. Это – цвет моделей, шариков, но не атомов. Атомы не окрашены. Рассмотрите их. Модели атомов кислорода красного (оранжевого) цвета. Модели атомов азота – синего цвета. Шарики чёрного цвета – обозначают атомы углерода.
Характеристика моделей атомов (инструкция на комплекте шаростержневых моделей).
водород белый углерод чёрный кислород красный (оранжевый) азот синий сера жёлтый галогены зелёный алюминий тёмно-серый
(На доске - магнитные модели, записи. Учащиеся, одновременно с учителем, делают рисунки и записи в опорном конспекте – выделенное поле для работы).
Учитель: Положите на лоток три шарика, обозначающие атомы элемента водорода. Какой символ можно использовать для обозначения?
Учащиеся: Н (аш)
Учитель: Как учесть их количество?
Учащиеся: Записать цифру три перед знаком элемента водорода.
Учитель: Вы за партой работаете в парах. Сколько атомов водорода в ваших моделях приходится на двоих? Как это обозначим в записи?
Учащиеся: Записать цифру шесть перед знаком элемента водорода.
Учитель: Выложите в лотке модели двух атомов кислорода.
Делаем рисунок и соответствующую запись (2О). Сколько атомов кислорода в ваших моделях приходится на двоих? Как это обозначим в записи?
Учащиеся: Записать цифру четыре перед химическим знаком элемента кислорода.
Учитель: Но во многих веществах атомы объединяются друг с другом.
Например, самый лёгкий газ водород, состоит из молекул. Каждая состоит из двух атомов элемента водорода. Создайте модель молекулы газа водорода, используя металлический стержень для соединения атомов.
1 молекула газа водорода, состоит из двух атомов (Н2).
Выложите на лоток две молекулы газа водорода.
Две молекулы газа водорода, каждая состоит из двух атомов.
Учитель: Давайте сосчитаем все молекулы газа водорода, созданные сегодня с помощью моделей? (Запись 12 Н2 )
Цифры в данной записи называются: индекс, коэффициент. Попробуйте объяснить, что означает индекс? Коэффициент? Где записывается индекс? Коэффициент?
Работа по заполнению таблицы в опорной схеме.
Учащиеся: Индекс указывает на число атомов в молекуле, коэффициент – на число отдельных частиц.
Учитель: Молекула воды состоит из одного атома кислорода и двух атомов водорода, расположенных под углом. Соберите модель на столах (на доске – магнитная модель, рисунок в тетради, запись) (Н2О)
Сколько молекул воды в ваших моделях приходится на двоих? Как это обозначим в записи?
Учащиеся: Поставим коэффициент два перед записью.
Учитель: Как вы думаете, чем модели молекул похожи? Чем модели отличаются друг от друга?
Учащиеся: В одной группе – молекула состоят из одинаковых атомов, в другой – из разных.
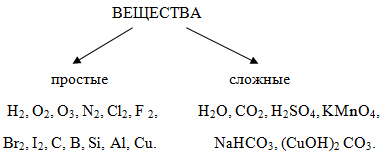
Учитель: Вещества, которые состоят из одинаковых атомов одного химического элемента, называют простыми. Работа по заполнению таблицы.
Учитель: Дайте определение сложным веществам.
Учащиеся: Сложные вещества состоят из атомов разного вида.
Учитель: Итак, состав веществ записывается знаковыми моделями, т.е. химическими формулами.
О чем говорит нам химическая формула?
Учащиеся: О том, из каких атомов состоит вещество, в каком количестве атомы входят в состав вещества.
Учитель: Качественный состав вещества показывает, из атомов каких химических элементов оно состоит.
Количественный состав показывает число атомов каждого химического элемента в составе вещества.
Следовательно, химическая формула описывает КАЧЕСТВЕННЫЙ И КОЛИЧЕСТВЕННЫЙ СОСТАВ вещества.
3. Первичное закрепление знаний, умений, навыков (с использованием слайдов №3 - №13 презентации, при необходимости осуществляется проверка в виде голосового сопровождения к презентации при нажатии на значок).
- Прочитать химическую формулу.
- Дать характеристику состава сложного вещества (качественный и количественный состав).
Чтение химических формул, определение качественного и количественного состава сложных веществ. ДЛЯ СЛОЖНЫХ ВЕЩЕСТВ (За правильный ответ - “аурик”).
4. Игра. Будь внимателен!
Учитель: На какие группы можно разделить предложенные формулы веществ? (Слайд №14 презентации).
Учащиеся: Можно разделить на простые и сложные вещества.
Учитель: Определим, где простые, а где сложные вещества в этом перечне. Если показываемое вещество простое, 1 хлопок в ладоши (поднять одну руку), если сложное – 2 хлопка (поднять две руки, работает весь класс). Слайд №15 презентации к уроку.
Встречаемся ли мы с предложенными веществами в повседневной жизни?
Рассказ учащегося о применении предложенных веществ (учебный проект). Слайд №16 презентации к уроку.
Физ.минутка. Гимнастика для глаз с использованием кружков, расположенных на окне.
Посмотреть на круг, приклеенный на стекло, на счет 1–4, потом перевести взгляд вдаль на счет 1–6. Повторить 4–5 раз.
Крепко зажмурить глаза (считать до 3), открыть глаза и посмотреть вдаль (считать до 5). Повторить 4–5 раз.
Закрыть глаза и посидеть спокойно, медленно считая до 5.
Открыть глаза, потянуться, на счёт 1-4 медленно поднимаем руки вверх, на счёт 1-4 опускаем руки, кладём на парту. Повторить 3-4 раза.
5. Введение новых знаний. Вычисление относительной молекулярной массы.

Учитель: Молекулы также как и атомы, имеют массу, которая также очень мала, поэтому в расчётах используют относительную молекулярную массу.
Как вы считаете, как можно найти массу молекулы, зная массу атомов? Конечно, сложить атомные массы между собой, но при этом не надо забывать, что атомов в молекуле может быть не один и это тоже нужно учитывать.
Относительная молекулярная масса вещества (Mr) – это число, показывающее во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода. Это безразмерная величина
Мы умеем определять относительную атомную массу ХЭ. Где можно найти и проверить цифровое значение относительной атомной массы?
Учащиеся: Можно найти в периодической системе химических элементов Д.И.Менделеева.
Учитель: А как можно определить относительную массу молекулы?
Учащиеся: Относительная молекулярная масса вещества равна сумме относительных атомных масс атомов, входящих в состав молекулы с учетом их индексов.
AxByCz где A, B, C - знаки Эl x, y, z – количество атомов этих Эl
Mr = Ar(A)*X + Ar(B)*Y + Ar(C)*Z
6. Первичное закрепление изученного материала (работа с опорной схемой).
Последовательность действий при определении относительной молекулярной массы.
Алгоритм. Вычисление относительной молекулярной массы по химической формуле.
1. Найти значения относительных атомных масс элементов в периодической системе.
2. Умножить число атомов на значение относительной атомной массы для каждого элемента.
3. Сложить полученные значения.
Слайд №18 презентации к уроку (или работа с ЭОР в сети интернет).

Определение относительной молекулярной массы веществ по предложенным формулам (работа с опорной схемой).
| молекула | значение Мr |
| Н2О | Мr(Н2О)= 2Ar (Н) +1Ar(О)= 2·1 +1·16 = 18 |
| H2SO4 | Мr(H2SO4) = Ar( ) + Ar ( ) + Ar ( ) = |
| HNO3 | Мr(HNO3) = Ar( ) + Ar( ) + Ar( ) = |
| Fe2O3 | Мr(Fe2O3) = Ar + Ar = |
| SO3 | Мr( ) = |
| NaOH | Мr( ) = |
| H3PO4 | Мr ( ) = |
| N2 | Мr ( ) = |
| H2O2 | Мr ( ) = |
7. Закрепление знаний, умений, навыков. Cамостоятельная работа.
Сравнение относительных молекулярных масс. Вставьте знак, больше, меньше, равно, выполнив вычисления. Слайд №19 презентации к уроку.
| Mr (Н2SO4) | Mr (Н3РO4) |
| Mr (SO3) | Mr (MgO) |
| 5 Mr (CH4) | 2 Mr (NaOH) |
| Mr (NH3) | Mr (PH3) |
8. Итог. Рефлексия.
Учитель: С какими понятиями мы познакомились сегодня на уроке.
| Я узнал много нового. | |
| 2. | На уроке было над чем подумать. |
| 3. | Мне это пригодиться в жизни. |
| 4. | На все возникшие вопросы я получил(а) ответы. |
| 5. | На уроке я поработал добросовестно. |
9. Домашнее задание. П.12
Индивидуальное задание (по вариантам, приложение 3).
Сайт “Мир ХИМИИ” Раздел “Учащимся. 8 класс” Урок №14.
ДОПОЛНИТЕЛЬНЫЕ ЗАДАНИЯ (если на уроке остаётся несколько свободных минут):
1. Найдите и запишите значения относительных молекулярных масс:
1) хлорида меди (II), состоящей из одного атома меди и двух атомов хлора;
2) оксида фосфора(V), состоящего из двух атомов фосфора и пяти атомов кислорода;
Планируемые результаты:
- фиксировать индивидуальное затруднение в проблемном действии;
- самостоятельно решать задачи, используя имеющиеся знания;
- контролировать свою деятельность по ходу выполнения задания;
- работать с разными видами информации и ориентироваться в ней;
- выполнять действия по образцу;
- использовать знаково-символичные средства при сворачивании и разворачивании информации;
- задавать проблемные вопросы в ходе исследовательской деятельности и отвечать на них;
- развивать умение анализировать, сравнивать, сопоставлять и обобщать;
- развивать умение сотрудничества со сверстниками при работе в группе;
- развивать умение принимать коллективное решение.
- осознание необходимости учения;
- осознавать необходимость в соблюдении правил техники безопасности;
- работать над самооценкой и адекватным пониманием причин успеха/неуспеха в учебной деятельности;
- учиться проявлять самостоятельность в разных видах деятельности;
- работать над осознанием ответственности за общее дело;
- учиться выражать свое мнение.
Оборудование: коллекция металлов, неметаллов, кислоты (их растворы), соли, основания, оксиды.
Ход занятия
1. Оргмомент
Здравствуйте! Здравствуйте, гости дорогие!
Чем так опечалены на уроке химии?
Расскажите мне скорей: на каком уроке,
Кто обидеть вас посмел в прошлом недалеком?
Значит буду вам сегодня настроенье поднимать,
Знаю самый лучший способ:
Будем тему изучать!
2. Проверка домашнего задания
Проверочный тест
Задание 1: подбери соответствие.
1. Аргентум
2. Аурум
3. Гидраргирум
4. Силициум
5. Станнум
6. Плюмбум
7. Арсеникум
8. Стибиум
9. Купрум
а) Ag; б) Cu; в) Fe; г) Sb; д) Sn; е) Hg; ж) Pb; з) As; и) Si; к) Au.
Явления. Тела и вещества
Образование ржавчины на железных предметах.
Выветривание горных пород.
Испарение воды из водоема.
Кипячение воды в чайнике.
Сжигание бензина в двигателе автомобиля.
Потемнение изделий из серебра.
Что может формула сказать
О разных веществах?
Ты сможешь многое узнать,
Ведь все в твоих руках.
Правило про формулы
Будем составлять,
Чтобы потом правильно
Его применять.
Химическая формула –
Запись ведь условная,
Отразит состав веществ
Всех беспрекословно.
Чтобы было формулы
Нам легко писать,
Знаки элементов
Отлично нужно знать!
Учитель записывает на доске несколько химических формул (например, серной кислоты, перманганата калия и т.д.), на примере которых будет объяснять тему.
Какую же информацию несет в себе химическая формула?
Молекул сколько вещества
Определишь в момент,
Когда внимательно взглянёшь
На коэффициент.
А где же нам его искать?
Логично спросишь ты.
А я хочу тебе сказать:
Ты в формулу смотри,
Пред формулою цифра здесь,
Это коэффициент и есть.
Учитель демонстрирует для закрепления несколько формул с разными коэффициентами:
- H2O – одна молекула воды;
- 2H2O – две молекулы воды;
- 6H2O – шесть молекул воды.
Число молекул разобрали.
А как же с атомами быть?
Как нам узнать, что мы не знали:
Всю разновидность изучить?
Здесь учитель говорит о том, что формула содержит информацию о качественном составе вещества: так молекула воды включает две разновидности атомов – атомы водорода и кислорода; перманганата калия – атомы калия, марганца, кислорода.
Учитель поясняет детям на схемах, что такое индексы и как их отличить от коэффициента:
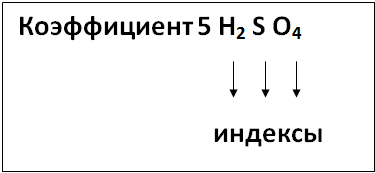
Индекс и коэффициент
Спутать не так просто,
Цифра индекса совсем
Маленького роста.
А коль молекул много,
Усвой приём другой,
Чтоб число атомов найти,
Коэффициент и индекс
Умножь между собой.
Давайте подведем итог
Разобранной тематике,
Чтоб каждый без ошибок смог
Все формулы внимательно
Так как получили её при прокаливании некоторых сульфатов (купоросов).
Теперь молекулы считай,
Ответ мне правильный давай.
– Коэффициент проставлен два.
– Соображает голова.
Какие атомы и сколько?
Теперь нам надо просчитать .
Здесь сера, водород, не только:
Про кислород не забывать!
Атомов серы здесь лишь два,
А кислорода – восемь.
А водорода сколько?
Мы у Сергея спросим.
Водорода здесь четыре.
Вот анализ завершили.
Я очень рада, дети,
За этот результат:
Теперь читать все формулы
Вы сможете подряд.
Все в природе вещества
Мы сейчас поделим.
Но для этого сперва
Сущность определим.
Если наши атомы
Разновидности одной,
Все тогда понятно,
Класс веществ – простой.
Куча разных атомов
В формуле. Возможно.
Отнесем мы вещество
К группировке сложных.
Ребята в тетради составляют схему (с помощью учителя):
Масса молекулярная
Понятие относительное.
Смысл её физический
Совсем не удивительный.
Массу чтоб молекулы быстренько сравнить,
Нужно на двенадцатую часть углерода разделить.
Учащиеся из учебника переписывают формулу:
m (в-ва)
------------------
1/12 m (C)
Mr (в-ва) =
Ты молекулярную
Массу рассчитай:
Атомные массы
Вместе все слагай
И на число атомов
При этом умножай.
Учитель показывает учащимся как правильно вычисляется относительная молекулярная масса вещества:
Mr(A B C D E ) = n(A) Ar(A) + n(B) Ar(B) + n(C) Ar(C) + n(D) Ar(D) + n(E) Ar(E).
Задание 1. Ниже перечисленные вещества разделите на простые и сложные: SO2, K, Cu, N2, O2, Cl2, Al2O3, H2, Br2, NaCl, MgSO4, KOH, Fe, Au, Ag, ZnO, LiI, KF, Cr, SO3
Результат оформите в форме таблицы:
Вычислите молекулярные массы четырёх любых веществ.
7. Заключительная часть
Ну вот, ребята дорогие,
Заканчивается урок.
Вы поработали на славу,
Трудился каждый, кто как мог.
Теперь вы сможете уверенно
Любые формулы читать,
Простые, сложные , наверное,
Соединенья разбирать.
А так же массу находить
Ещё молекулярную.
Ведь эта тема в химии
Всегда важна и главная.
Домашнюю с доски спишите,
Все книжки можете собрать
И на здоровье отдыхать.
Ну что ж я с вами не прощаюсь,
До скорого свидания!
Благодарю всех за урок:
Терпенье и внимание.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
8 класс _________________Дата
Тема урока: Относительная молекулярная масса. Химические формулы
Тип урока: комбинированный урок
Цель урока: формирование представлений учащихся о химической формуле, качественном и количественном составе вещества, индексе, коэффициенте, относительной молекулярной массе.
Задачи урока:
Образовательные:
- сформировать понятия о формуле вещества и её структурных компонентах: коэффициентах, индексах;
- научиться правильно произносить формулы веществ, определять их состав (качественный и количественный);
- отработать навык расчёта относительной молекулярной массы вещества;
Развивающие:
- развивать познавательный интерес, умение сравнивать, анализировать, обобщать, делать выводы;
- продолжить формирование умений формулировать определения.
Воспитательные:
воспитывать личностные качества, обеспечивающие успешность исполнительной деятельности (дисциплинированность, ответственность), творческой деятельности (активность, увлечённость, наблюдательность, сообразительность, способность к самооценке).
Планируемые результаты обучения:
Метапредметные - Развивать умения делать обобщения, устанавливать аналогии, причинно-следственные связи, строить логические рассуждения и делать выводы, планировать и регулировать свою деятельность, владеть устной и письменной речью.
Личностные - Формировать ответственное отношение к учению.
Оборудование и материалы: ПСХЭ, карточки с заданиями
Какую информацию о химическом элементе мы можем получить при помощи ПСХЭ?
Сформулируйте закон постоянства состава веществ.
Предлагает ученикам выполнить задания в карточках (Приложение 1) .
Отвечают на вопросы учителя.
Чем атом отличается от молекулы? Как определить относительную атомную массу? А что же тогда такое относительная молекулярная масса? Приведите пример расчета относительной молекулярной массы.
Как вы считаете, о чем мы сегодня с вами будем говорить? Запишем тему сегодняшнего урока. Попробуйте сформулировать цель урока.
Отвечают на вопросы учителя
Записывают тему урока в тетрадь. Формулируют цель урока.
Изложение нового материала
Химическая формула - это условная запись качественного и количественного состава вещества при помощи химических знаков и индексов.

Индекс - это цифра в химической формуле, которая ставится внизу после химического знака и обозначает число атомов данного вида.
Качественный состав молекулы показывает какие виды атомов входят в состав вещества.
Количественный состав показывает сколько атомов определённого вида входит в состав молекулы вещества.
Числа стоящие перед химическими формулами или химическими знаками называются коэффициентами . Коэффициенты показывают число атомов или молекул определённого вида.
Что обозначают записи?
H 2 - это одна молекула водорода (аш-два), в её состав входят два атома водорода.
5O 2 - это пять молекул кислорода (пять-о-два), в состав одной молекулы входят два атома кислорода.
6Fe - это шесть атомов железа (шесть-феррум).
3H 2 SO 4 - это три молекулы серной кислоты (три-аш-два-эс-о-четыре), в состав одной молекулы серной кислоты входят два атома водорода, один атом серы, четыре атома кислорода.
Относительная молекулярная масса вещества равна сумме относительных атомных масс всех элементов с учетом индексов.
Примеры :
Mr(B 2 O 3 ) = 2 · Ar(B) + 3 · Ar(O) = 2 · 11 + 3 · 16 = 70
Mr(KAl(SO 4 ) 2 ) = 1 · Ar(K) + 1 · Ar(Al) + 1· 2 · Ar(S) + 2· 4 · Ar(O) =
= 1 · 39 + 1 · 27 + 1 · 2 · 32 + 2 · 4 ·16 = 258

Цели: сформировать знания об относительной атомной массе, атомной единицы массы, химической формуле, индексе и коэффициенте, относительной молекулярной массе; научить записывать химические формулы и вычислять относительную молекулярную массу, характеризовать вещество по химической формуле (название вещества, качественный и количественный состав, простое или сложное, относительная молекулярная масса).
Задачи:
Образовательные: сформировать понятия о химических формулах, коэффициентах и индексах. Дать понятия об относительной атомной и молекулярной массы
Развивающие: развивать у учащихся умение делать несложные, логические построения на основе химических знаний; развивать умение анализировать, сравнивать, обобщать
Воспитательные: активизировать познавательный интерес, творческую активность каждого ученика
План – конспект урока №1
Дата: 21.09.2017 г. Класс: 8 Е Номер урока: 2
Тема: Химические формулы. Относительная атомная и молекулярная массы
Цели: сформировать знания об относительной атомной массе, атомной единицы массы, химической формуле, индексе и коэффициенте, относительной молекулярной массе; научить записывать химические формулы и вычислять относительную молекулярную массу, характеризовать вещество по химической формуле (название вещества, качественный и количественный состав, простое или сложное, относительная молекулярная масса).
Образовательные: сформировать понятия о химических формулах, коэффициентах и индексах. Дать понятия об относительной атомной и молекулярной массы
Развивающие: развивать у учащихся умение делать несложные, логические построения на основе химических знаний; развивать умение анализировать, сравнивать, обобщать
Воспитательные: активизировать познавательный интерес, творческую активность каждого ученика
Читайте также:

