Классификация химических веществ конспект
Обновлено: 02.07.2024
Опорный конспект составлен по теме: "Классификация химических реаций" может быть использованкак на теоретическом занятии так и для самомтоятельной работы студентов при отработке пропущенных занятий.
| Вложение | Размер |
|---|---|
| опорный конспект | 21.89 КБ |
Предварительный просмотр:
Классификации химических реакций
- Химическая система.
- Классификация химических реакций по:
а) изменению состава реагентов и продуктов;
б) изменению степеней окисления атомов элементов, входящих в состав реагентов;
в) тепловому эффекту;
г) участию катализатора;
д) направлению протекания;
е) агрегатному состоянию участвующих в реакции веществ.
Химическая система - это совокупность частиц и существующих между ними взаимодействий. Система является изолированной (замкнутой), если между ней и прилегающими системами отсутствует обмен как веществами, так и энергией.
Химические реакции можно классифицировать по различным признакам.
• По изменению состава реагентов и продуктов различают:
реакции соединения - из нескольких веществ более простого строения образуется одно - более сложного строения, например:
SO 3 + Н 2 О = H 2 SO 4
реакции разложения - одно сложное вещество разлагается на несколько веществ более простого строения, например:
СаСО 3 = СаО + СО 2 ↑
реакции замещения - реагируют простое и сложное вещества, в ходе реакции атомы простого вещества замещают часть атомов в сложном веществе, например:
Zn + 2НС1 = ZnCl 2 + Н 2 ↑
реакции обмена - два сложных вещества обмениваются своими составными частями, например:
NaOH + НС1 = NaCI + Н 2 О
• По изменению степеней окисления атомов элементов, входящих в состав реагентов, различают:
окислительно-восстановительные реакции - (ОВР), протекающие с изменением степеней окисления атомов элементов, входящих в состав окислителя и восстановителя, например:
2NaNO 3 = 2NaNO 2 +O 2 ↑
реакции, протекающие без изменения степеней окисления, например:
H 2 SO 4 + Са(ОН) 2 = CaSO 4 + 2Н 2 О
• По тепловому эффекту реакции различаю:
экзотермические реакции — идут с выделением теплоты, например:
С + О 2 = СО 2 + Q
эндотермические реакции — идут с поглощением теплоты, например:
N 2 + О 2 = 2NO – Q
• По участию катализатора различаю:
каталитические реакции - протекают с участием катализатора, например:
N 2 + 3H 2 ==== 2N Н 3
некаталитические реакции — протекают без участия катализатора, например:
2H 2 + О 2 = 2 H 2 O
•По направлению протекания реакций различают:
обратимые реакции - в зависимости от условий могут протекать как в прямом, так и в обратном направлении, например:
СО 2 + Н 2 О→←Н 2 СО 3 ;
необратимые реакции - протекают только в прямом направлении, завершаются полным превраще-нием реагентов в продукты, например:
Na 2 CO 3 + 2НСl = 2NaCl + Н 2 О + СО 2 ↑
• По агрегатному состоянию участвующих в реакции веществ раз -личают:
гомогенные реакции, в которых реагирующие частицы не отделены друг от друга какими-либо граничными поверхностями, а составляют единое целое, например:
2СО + О 2 = 2СО 2
гетерогенные реакции, в которых реагирующие вещества разделены граничными поверхностями, например:
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
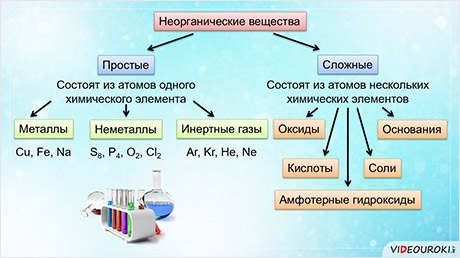
Все вещества по составу классифицируют на простые и сложны. Простые- вещества, образованные атомами одного химического элемента. Сложные- вещества, в составе которых присутствуют атомы разных химических элементов.
Простые вещества делят на металлы и неметаллы.
Бинарные соединения- сложные вещества, состоящие из атомов двух химических элементов.
Гидриды- бинарные соединения активных металлов и водорода ( NaH , CaH 2 )
Нитриды- бинарные соединения активных металлов и азота ( Na 3 N Ca 3 N 2 )
Соединения металлов и галогенов: хлориды, фториды, йодиды…
Суффикс –ИД- указывает на бинарность соединения.
Если необходимо составить формулу бинарного соединения, то нужно помнить: из двух элементов первым записывают металл. Если бинарное соединение состоит из неметаллов, то первым записывают менее электроотрицательный.
Оксиды- бинарные соединения, содержащие кислород в степени окисления (-2). Оксиды разделяют на несолеобразующие ( все оксиды неметаллов с валентностью 1, 2: N 2 O , NO , CO , SiO ) и солеобразующие. Солеобразующие оксиды бывают: оснОвными ( это оксиды металлов с валентностью 1, 2. Кроме BeO , ZnO ), амфотерными ( оксиды металлов с валентностью 3,4 и BeO , ZnO ), кислотными ( это оксиды металлов с валентностью выше 4 и оксиды неметаллов с валентностью 3 и выше).
Основные оксиды- оксиды, которым соответствуют основания.
Основания- сложные вещества, состоящие из катионов металла и анионов гидроксогрупп. Все основания делят на две группы: щёлочи- растворимые основания ( NaOH , Ba ( OH ) 2 ) и нерастворимые основания.
Кислотные оксиды- оксиды, которым соответствуют кислоты. Степень окисления элемента в оксиде и кислоте должна быть одинакова.
Амфотерные оксиды- оксиды, которым соответствуют амфотерные гидроксиды.
Амфотерные гидроксиды – сложные вещества, способные в водных растворах вести себя как кислоты и как основания.
Соли- сложные вещества, состоящие из катиона металла и аниона кислотного остатка. Соли могут быть: средние ( продукт полного замещения катионов водорода и гидроксогрупп Na 2 SO 4 ), кислые ( продукт неполного замещения атомов водорода в кислоте NaHSO 4 ), основные (продукт неполного замещения гидроксогрупп в основаниях CaOHCl ).
Кристаллогидраты – продукты взаимодействия соли с молекулами воды. Наиболее важные: CuSO 4 *5 H 2 O –медный купорос;

Видеоурок позволяет обобщить знания об основных классах неорганических соединений. Урок содержит примеры веществ различных классов, где указана тривиальная и международная номенклатура.
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Классификация неорганических веществ"
Каждый класс веществ образован веществами со сходными свойствами. Эти вещества имеют схожее строение и состав.
Все неорганические вещества делят на простые и сложные. Простые вещества состоят из атомов одного химического элемента. К простым веществам относятся металлы: медь, железо, натрий и другие; неметаллы: сера, фосфор, кислород, хлор; инэртные, или благородные газы: аргон, криптон, гелий, неон.
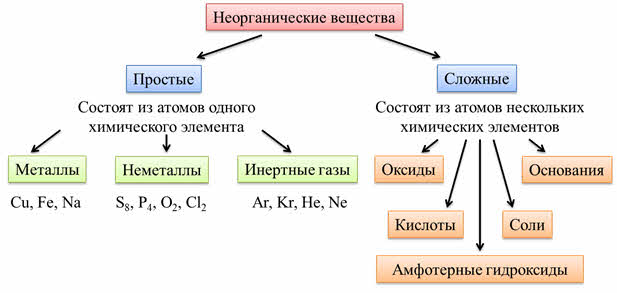
Сложные вещества состоят из атомов нескольких химических элементов. К сложным веществам относятся оксиды, основания, амфотэрные гидроксиды, кислоты и соли.
Оксиды – это сложные вещества, которые состоят из двух химических элементов, один из которых кислород. Общая формула оксидов: э-эм-о-эн, где эм и эн – индэксы. Степень окисления кислорода в оксидах равна минус двум.

Оксиды делят на две группы: солеобразующие и несолеобразующие (индифферентные).
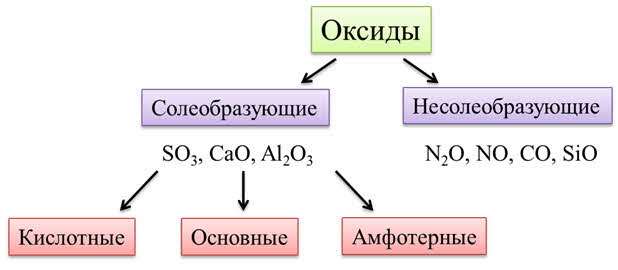
Солеобразующие оксиды образуют гидроксиды и соответствующие соли. Например, к солеобразующим оксидам относятся оксид серы шесть, оксид кальция, оксид алюминия.
Несолеобразующие оксиды не образуют гидроксидов и солей. К таким оксидам относятся: оксид азота один, оксид азота два, оксид углерода два, оксид кремния два.
Оксиды бывают кислотные, амфотэрные и основные. Кислотным оксидам соответствуют кислотные гидроксиды, основным оксидам соответствуют основные гидроксиды.
Например: оксиду натрия соответствует основный гидроксид – гидроксид натрия, в реакции этого гидроксида с соляной кислотой образуется соль – хлорид натрия.
Оксиду алюминия соответствует амфотэрный гидроксид – гидроксид алюминия, этот гидроксид с азотной кислотой образует соль – нитрат алюминия.
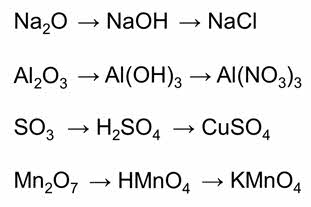
Оксиду серы шесть соответствует кислотный гидроксид – серная кислота, эта кислота с гидроксидом меди два образует соль – сульфат меди два.
Оксиду марганца семь соответствует кислотный гидроксид – марганцовая кислота, которая в реакции с гидроксидом калия образует соль – перманганат калия.
Кислотные оксиды образованы элементами металлами и неметаллами со степенью окисления больше, чем плюс четыре.
Кислотным оксидам соответствуют кислоты: оксиду углерода четыре соответствует угольная кислота, оксиду серы шесть соответствует серная кислота, оксиду фосфора пять соответствует фосфорная кислота.

Для этих оксидов характерен ковалентный характер связи между элементами. В основном у кислотных оксидов молекулярная кристаллическая решётка. Они могут быть газообразными, жидкими и твёрдыми. Например: оксид серы четыре, оксид углерода четыре – газы, оксид хлора семь, оксид марганца семь – жидкости, оксид фосфора пять, оксид кремния четыре, оксид хрома шесть – твёрдые.
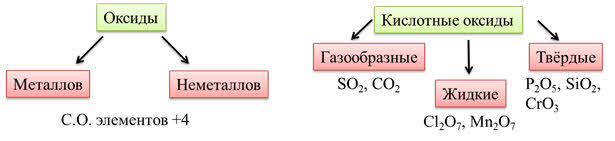
Основные оксиды – это оксиды, гидраты которых являются основаниями. Все основные оксиды являются оксидами металлов. Например: оксиду натрия соответствует гидроксид натрия, оксиду кальция соответствует гидроксид кальция, оксиду железа два соответствует гидроксид железа два.

Амфотэрные оксиды – это оксиды, которым соответствуют амфотэрные гидроксиды. Все амфотэрные оксиды являются оксидами металлов. Например: оксид алюминия, оксид хрома три, оксид железа три, оксид свинца четыре, оксид олова четыре. Так оксиду цинка соответствует амфотэрный гидроксид – гидроксид цинка, оксиду алюминия соответствует амфотэрный гидроксид – гидроксид алюминия.

Оксиды широко распространены в природе. Так, большая часть Земли покрыта Мировым океаном, который образован оксидом водорода, в атмосфере содержится оксид углерода четыре; оксид кремния четыре является основой многих минералов и горных пород, таких как кварц, аметист, яшма; оксид алюминия – корунд, известные и его разновидности – рубин и сапфир.

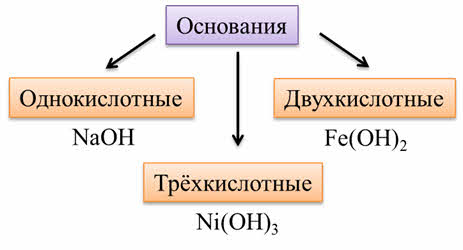
Основания – это сложные вещества, состоящие из катионов металлов и гидроксогруппы. Общая формула оснований – металл –о-аш.

К основаниям относятся: гидроксид натрия, гидроксид кальция, гидроксид железа три, гидроксид калия и другие. Для оснований характерен ионный тип связи, а значит, и ионная кристаллическая решётка, поэтому основания – это твёрдые вещества.
По числу гидроксогрупп различают однокислотные основания (как гидроксид натрия), двухкислотные (как гидроксид железа два), трёхкислотные (как гидроксид никеля три).
По растворимости в воде различают растворимые в воде основания – щёлочи, которые являются сильными основаниями. К ним относятся: гидроксид натрия, гидроксид бария и другие. Нерастворимые в воде основания – это слабые основания. К ним относятся: гидроксид меди два, гидроксид железа два.
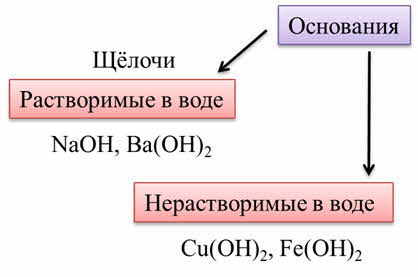
Щёлочи являются твёрдыми веществами.
В реакции сульфата меди два с гидроксидом натрия образуется нерастворимое основание – гидроксид меди два и соль – сульфат натрия.
При добавлении гидроксида натрия к сульфату железа два образуется также нерастворимое основание – гидроксид железа два и соль – хлорид натрия.

Есть основания, где в составе не ионы металла, а катион аммония. Раствор аммиака используют как нашатырный спирт, основания используют для штукатурки стен.

Кислоты – это сложные вещества, которые состоят из атомов металла и кислотных остатков.

Кислоты могут быть образованы не только атомами неметаллов, как соляная кислота, сернистая, азотная кислоты, но и атомами металлов в высшей степени окисления: как например марганцовая кислота.
По количеству атомов водорода (основности) различают одноосновные кислоты (такие как соляная кислота, азотная), двухосновные (такие как сероводородная, дихромовая кислоты), трёхосновные (как фосфорная кислота).
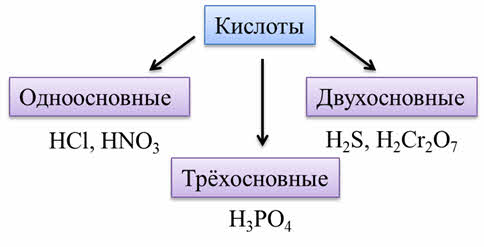
По содержанию атомов кислорода различают кислородсодержащие кислоты (или оксокислоты), как азотная кислота, хромовая кислота, так и бескислородные, как сероводородная, соляная.
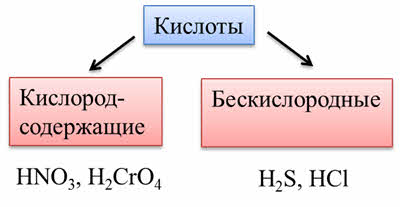
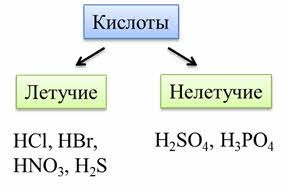
По летучести кислоты бывают летучие, которые легко испаряются или выветриваются из раствора: это такие кислоты, как соляная, бромоводородная, азотная, сероводородная; к нелетучим кислотам относятся серная, фосфорная кислота и другие.
Кислоты бывают сильные и слабые. Сильные кислоты практически полностью диссоциируют на ионы. К таким кислотам относятся: азотная, серная, соляная, хлорная. Слабые кислоты диссоциируют незначительно, к таким кислотам относятся: сернистая, сероводородная, фосфорная кислоты.

К кислотам-окислителям относятся: азотная кислота, серная, то есть в этих кислотах есть элемент-окислитель. К кислотам-неокислителям относится большинство кислот, в которых окислителем является ион водорода.

Для кислот характерен ковалентный тип связи и молекулярная кристаллическая решётка.
При обычных условиях кислоты могут быть в газообразном состоянии: как соляная и сероводородная, в жидком состоянии, как азотная, серная кислоты. Кислоты могут быть и в твёрдом состоянии, как кремниевая кислота.

Амфотэрные гидроксиды – это сложные вещества, имеющие свойства кислот и оснований, поэтому формулы амфотэрных гидроксидов можно записать в форме оснований и в форме кислот.

Их образуют элементы, проявляющие переходные свойства металлов и неметаллов. Эти соединения образуют большинство дэ-элементов со степенью окисления плюс три, плюс четыре, иногда плюс два; эти соединения могут образовывать и пэ-элементы: бериллий, алюминий, олово, свинец.
К амфотэрным гидроксидам относятся гидроксид цинка, гидроксид алюминия, гидроксид железа три, гидроксид бериллия.

Амфотэрные гидроксиды практически нерастворимы в воде. Например, при растворении хлорида железа три с гидроксидом натрия образуется бурый осадок – гидроксид железа три.

При растворении сульфата алюминия с гидроксидом натрия образуется белый осадок – гидроксид алюминия. Полученные гидроксиды являются амфотэрными гидроксидами.

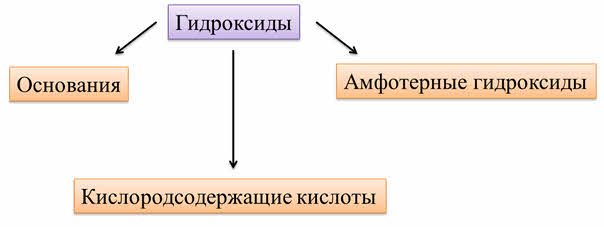
Таким образом, к гидроксидам относятся основания, амфотэрные гидроксиды и кислородсодержащие кислоты.
Соли – это сложные вещества, которые состоят из катионов металла или аммония и кислотных остатков.

Соли бывают средними, кислыми, основными.
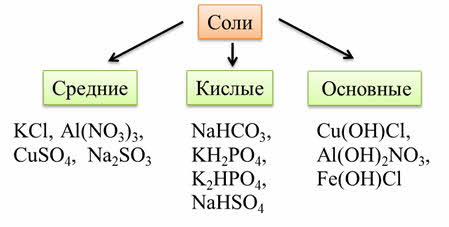
Средние соли – это продукты полного замещения атомов водорода в кислоте атомами металлов: например, хлорид калия, нитрат алюминия, сульфат меди два, сульфит натрия.
Кислые соли – это продукты неполного замещения атомов водорода в молекулах многоосновных кислот атомами металла. Например: гидрокарбонат натрия, дигидрофосфат калия, гидрофосфат калия, гидросульфат натрия.
Основные соли – это продукты неполного замещения гидроксидных групп в молекулах многокислотных оснований кислотными остатками. Например: гидроксохлорид меди два, дигидроксонитрат алюминия, гидроксохлорид железа два.
Для солей характерен ионный характер связи и ионная кристаллическая решётка, поэтому это твёрдые вещества.
Соли применяются в быту: например, перманганат калия используют как дезинфицирующее средство, широко используют алебастр и побелку, при приготовлении пищи используют поваренную соль.

Таким образом, вещества делят на простые и сложные. К простым веществам относятся металлы, неметаллы, инэртные газы. К сложным веществам относятся оксиды, основания, амфотэрные гидроксиды, кислоты и соли.
Вспомните, чем отличаются химические явления или химические реакции от физических (Конспект).

Химические реакции, протекающие
без изменения состава веществ.
Одно из положений теории химического строения утверждает, что свойства веществ зависят не только от их качественного и количественного состава, но и от строения. Следовательно, можно сделать вывод, что некоторые химические реакции могут сопровождаться изменением только качественного или только количественного состава исходных и образующихся веществ или же изменением их строения.
На примере кислорода и озона можно проиллюстрировать философский закон о переходе количественных отношений в качественные. Вспомните и сравните физические, химические и физиологические свойства кислорода и озона.
Влияние строения простых веществ, образованных одним химическим элементом на их свойства, иллюстрируют аллотропные модификации углерода.
Процесс получения искусственных алмазов моделирует природные экстремальные явления: проводится при очень высоких давлениях и температурах.
Первые сведения об аллотропии и аллотропных модификациях связаны с фосфором. В 1669 г. алхимик Хеннинг Брант, прокаливая сухой остаток мочи в попытке получить философский камень, получил белый фосфор (от греч. phos — свет и phoros — несущий), который затем превратился в красный.
Химические реакции, протекающие
с изменением состава веществ
(по признаку числа и состава реагентов и продуктов реакции).
Из курса химии основной школы вы знаете четыре типа реакций по этому признаку: соединения, разложения, замещения и обмена.
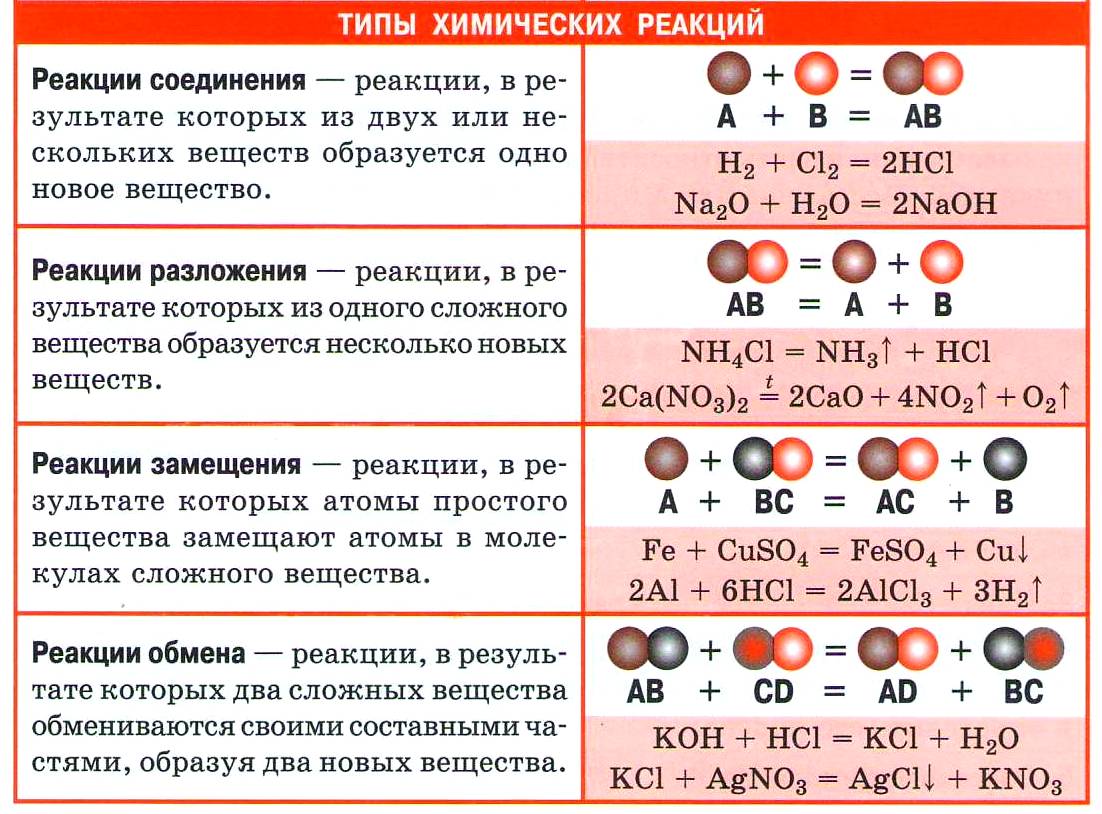
1. Реакции соединения (присоединения)
В неорганической химии весь спектр разнообразных реакций можно проиллюстрировать примерами промышленных процессов:
- Реакция горения фосфора — первая стадия получения чистой фосфорной кислоты: 4Р + 5O2 = 2Р2O5
В этом процессе участвуют два простых вещества и получается одно сложное.
- Заключительная стадия получения фосфорной кислоты описывается уравнением Р2O5 + 3Н2O = 2Н3РO4(сложное вещество образуется в результате взаимодействия двух сложных веществ).
- На заключительной стадии получения азотной кислоты в реакцию вступают три вещества (одно простое и два сложных): 4NO2 +O2 + 2Н2O = 4HNO3
В органической химии реакции соединения называются реакциями присоединения, так как к основному веществу (субстрату) присоединяется дополнительное вещество (реагент). Такие реакции характерны для непредельных углеводородов и в зависимости от реагента носят видовые названия:
- гидрирование — присоединение водорода;
- галогенирование — присоединение галогенов;
- гидрогалогенирование — присоединение галогеноводородов;
- гидратация — присоединение воды.
Частным случаем реакции присоединения является реакция полимеризации — соединение множества одинаковых молекул мономера в макромолекулу полимера.
2. Реакции разложения (отщепления)
Рассмотрим реакции разложения на примере реакций получения кислорода лабораторными способами.
Последняя реакция используется не для получения кислорода, а в медицинских целях. Полученное при разложении серебро прижигает ранки или удаляет бородавки, если используется особый ляписный (от лат. lapis infernalis — адский камень) карандаш.
В органической химии реакции разложения называют реакциями отщепления. Так, для получения этилена используются реакции дегидратации этанола, деполимеризации полиэтилена, дегидрирования этана (запишите уравнения реакций).
3. Реакции замещения
Как видно из определения, эти реакции характеризуют свойства классов простых веществ. Например, такое важное свойство галогенов, как их способность вытеснять менее активные галогены из растворов галогеноводородных кислот или их солей: Сl2 > Вг2 > I2.
Аналогично, этот тип реакций характеризует химические свойства металлов:
- Щелочные и щёлочноземельные металлы активно взаимодействуют с водой: 2Na + 2Н2O = 2NaOH + Н2↑
- С растворами кислот взаимодействуют металлы, стоящие в ряду напряжений до водорода: Zn + 2НСl = ZnCl2 + H2↑
- Металлы, стоящие в ряду напряжений до металла соли, вытесняют его из раствора соли: Fe +CuSO4 = Сu +FeSO4
- Более активные металлы вытесняют менее активные из их оксидов с выделением большого количества теплоты — металлотермия: 2Аl +Fe2O3 = Аl2O3 + 2Fe
Реакции замещения характерны для предельных соединений, например галогенирование метана, согласно цепочке переходов: СН4 –> СН3Сl –> СН2Сl2 –> СНСl3 –> ССl4.
Нитрование бензола относится к реакциям замещения, но протекает между двумя сложными веществами: С6Н6 + HNO3 —> C6H5NO2 + Н2O
В органической химии продуктами реакций этого типа являются не простое и сложное вещества, а два сложных. Кроме этого, в реакцию замещения могут вступать и сложные вещества.
4. Реакции обмена
Для растворов электролитов такие реакции протекают в соответствии с правилом Бертолле (названным по имени предложившего его французского химика Клода Бертолле) и возможны в том случае, если образуется осадок, газ или малодиссоциирующее вещество (например, вода).
- Золотисто–жёлтый осадок иодида свинца выпадает при взаимодействии растворов иодида натрия и нитрата свинца:
2NH4Cl + Са(ОН)2 = СаСl2 + 2NH3↑ + 2Н2O
NH4 + + ОН – = NH3↑ + Н2O
- Частным случаем реакции обмена является реакция нейтрализации — она протекает между растворами кислот и щелочей:
NaOH + НСl = NaCl + Н2O
OH – + H + = H2O
Химические реакции, протекающие
с тепловым эффектом.
Важный классификационный признак реакций — выделение или поглощение теплоты. Как правило, реакции соединения сопровождаются выделением теплоты. Такие реакции называются экзотермическими.
Если экзотермическая реакция сопровождается выделением света, то она называется реакцией горения: 2Mg + О2 = 2MgO + Q
Важным источником теплоты и энергии является горение углеводородов: СН4 + 2О2 –> СО2↑ + 2Н2О + Q
Но нет правил без исключения: реакция взаимодействия азота с кислородом сопровождается поглощением теплоты: N2 + О2 2NO – Q
Схематично экзо- и эндотермические реакции отражает рисунок.
Если в уравнении реакции указывается тепловой эффект, то уравнение называется термохимическим.
Например:
СН4 + 2О2 —> СO2 + 2Н2O + 800 кДж — реакция экзотермическая;
СаСO3 = СаО + СO2 – 187 кДж — реакция эндотермическая.
Классификация реакций по другим критериям
Классификация реакций — многоплановый процесс. Их можно классифицировать также:
- по направлению (обратимые и необратимые реакции);
- по использованию катализатора (каталитические и некаталитические реакции);
- по агрегатному состоянию реагентов и продуктов реакции (гомогенные и гетерогенные реакции);
- по изменению степеней окисления элементов, образующих реагенты и продукты реакции (окислительно–восстановительные и реакции, протекающие без изменения степеней окисления).

Читайте также:

