Характеристика химического элемента по кислотно основным свойствам образуемых им соединений конспект
Обновлено: 30.06.2024
Цель урока: дать характеристику химических элементов по кислотно – основным свойствам, образуемых ими соединений, дать понятие амфотерности.
Задачи:
-изучить характеристику химического элемента, опираясь на кислотно-основные свойства соединений, которые он образует;
— вспомнить химические свойства оснований, кислот, солей;
— познакомиться с основными амфотерными оксидами и гидроксидами, изучить их свойства.
— развивать у учащихся умение самостоятельно работать с текстом учебника, извлекая из них нужную информацию;
— формировать у учащихся умение осуществлять основные мыслительные операции и излагать их в устной и письменной форме;
— развивать воображение, память и внимание;
— развивать у учащихся ориентирование в ПСХЭ Д.И. Менделеева.
— воспитывать у учащихся бережное отношение к своему здоровью и здоровью окружающих;
— продолжить формирование интереса учащихся к научным знаниям;
— формирование мировоззрения у учащихся и расширение их кругозора.
Оборудование: ПСХЭ Д.И. Менделеева, раствор хлорида цинка, гидроксида натрия, соляной кислоты, пробирки.
Понятия урока: амфотерные оксиды, гидроксиды, переходные элементы(переходные металлы), зависимость химических свойств оксидов и гидроксидов элементов побочных подгрупп ПСХЭ Д.И. Менделеева.
Тип урока: комбинированный.
Вид урока: традиционный.
Ход урока.
Но для начала, проверим, как вы усвоили материал предыдущего урока:
- Дать характеристику фосфора, калия по плану.
- Работа по карточкам.
Ответы: 1 вар. 1,4,3,2,2,4,1,4,2
2 вар. 1,3,2,4,3,4,2,1,1,3
Существенным отличительным признаком элементов является кислотный или основный характер соответствующих им оксидов или гидроксидов. Какие степени окисления имеют типичные металлы?(+1 +2). В данных степенях окисления металлы образуют типичные основные оксиды(приведите примеры.) и гидроксиды – основания(примеры). Металлы с большими степенями окисления и неметаллы образуют кислотные оксиды, которым соответствуют кислородсодержащие кислоты(пример).Но в существуют и такие химические элементы, которые образуют и кислотные и основные оксиды. С ними я вас сегодня и буду знакомить.
Получим гидроксид цинка и исследуем его химические свойства. Дя этого в две пробирки с 1-2 мл раствора соли цинка(например ZnCl2) начнем по каплям добавлять раствор щелочи до появления белого осадка гидроксида цинка(запишем уравнение на доске):
Затем прильем в одну из пробирок соляную кислоту, а в другую – избыток раствора щелочи. Мы увидим, что осадок гидроксида цинка в обеих пробирках растворяется.
В чем причина такого необычного поведения Zn(OH)2 как нерастворимого основания? Опыт показывает, что гидроксид цинка проявляет свойства оснований, взаимодействуя с кислотой, но он также ведет себя и как нерастворимая кислота, взаимодействуя со щелочью.
Вещества, которые в зависимости от условий реакций проявляют кислотные или основные свойства, называют амфотерными.
Таким образом, гидроксиду цинка присущи амфотерные свойства: он может реагировать с кислотами как основание и со щелочами как кислота. Соответственно формулу этого соединения можно представить двояко:
Тогда уравнения реакций гидроксида цинка с кислотой можно записать так:
В обоих случаях образуется растворимая соль.
Аналогично гидроксиду цинка и соответствующий ему оксид цинка проявляет амфотерные свойства – образует соли при взаимодействии как с кислотой, так и с основаниями, например:
В первой реакции оксид цинка ведет себя как основный оксид, а во второй реакции выступает в роли кислотного оксида – образуется соль, в которой цинк входит в состав кислотного остатка.
Амфотерными являются оксиды и гидроксиды многих элементов: бериллия, алюминия, хрома.
Если элемент-металл проявляет несколько степеней окисления, то его оксид и гидроксид с низшей степенью окисления будут проявлять, как правило, основные свойства, с высшей – кислотные, а с промежуточной — амфотерные. Например:
Основный Амфотерный Кислотный оксид
оксид хрома(II) оксид хрома(III) хрома(VI)
Амфотерные оксиды и гидроксиды образуют чаще всего те элементы, которые составляют побочные подгруппы ПСХЭ Д.И. Менделеева. Данные элементы называют переходные элементы или переходные металлы.
- Закрепление изученного материала.
Итак, сегодня на уроке мы с вами познакомились с понятием амфотерностью. 1. Объясните своими словами, что оно значит.
- Что доказывает проведенный мною опыт?
- Оксиды и гидроксиды элементов с какими степенями окисления проявляют кислотные, основные и амфотерные свойства?
- вспомните, какие металлы называются переходными?
Домашнее задание.
Характеристика химического элемента.
Вариант 1 ☺
Инструкция к выполнению. При выполнении заданий уровня А (часть 1 ЕГЭ) выберите номер правильного ответа.
А1. Заряд ядра атома равен числу:
- протонов
- электронов во внешнем электронном слое
- нейтронов
- энергетических уровней
А2. Для элементов главных подгрупп число электронов во внешнем слое равно:
- числу нейтронов 3) заряду ядра атома
- номеру периода 4) номеру группы
А3.Какое число электронов содержится в атоме азота?:
А4.В атоме углерода распределение электронов по электронным слоям соответствует ряду чисел:
А5. В каком ряду химические элементы расположены в порядке возрастания их атомных радиусов:
- N, B, C
- N, P, As
- Na, Mg, K
- B, Si, N
А6. В каком ряду химические элементы расположены в порядке увеличения зарядов ядер атомов:
А7.Наибольшей восстаниовительной активностью обладает:
А8. В каком ряду химические элементы расположены в порядке ослабления их неметаллических свойств:
А9. В ряду химических элементов B→C→N :
- усиливаются металлические свойства
- ослабевают восстановительные свойства
- уменьшается электроотрицательность атомов
- уменьшается высшая степень окисления в оксидах
А10. Иону S -2 соответствует схема заполнения электронных слоев :
Характеристика химического элемента.
Вариант 2 ☺
Инструкция к выполнению. При выполнении заданий уровня А (часть 1 ЕГЭ) выберите номер правильного ответа.
А1. Заряд ядра атома равен:
1)числу протонов в ядре
2)числу нейтронов в ядре
4)относительной атомной массе
А2. Число электронов во внешнем слое элементов главных подгрупп равно:
1)высшей валентности по водороду 3) порядковому номеру элемента
2)номеру периода 4) номеру группы
А3.Какое число нейтронов содержит ядро атома 17 37 Cl:
А4.В атоме натрия распределение электронов по электронным слоям соответствует ряду чисел:
А5. В каком ряду химические элементы расположены в порядке уменьшения их атомных радиусов:
А6. В каком ряду химические элементы расположены в порядке увеличения зарядов ядер атомов:
А7.Наибольшей восстаниовительной активностью обладает:
А8. В каком ряду химические элементы расположены в порядке усиления их неметаллических свойств:
А9. В ряду химических элементов S→P→Si :
- усиливаются металлические свойства
- ослабевают восстановительные свойства
- увеличивается число энергетических уровней
- уменьшается высшая степень окисления в оксидах
А10. Какую электронную конфигурацию имеет атом наиболее активного металла :
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Конспект урока будет удобен на уроке химии для 9 класса, здесь есть цель и задачи, все этапы урока соблюдены, организационный момент, приветствие, мотивация к учебной деятельности, приветствие, актуализация опорных знаний, открытие нового. Познакомить учащихся с амфотерными оксидами и гидроксидами. Развивать внимание, память, речь, аналитическое мышление, способность делать выводы. Воспитывать любовь к предмету. Повторить и развивать знания о классификации и свойствах гидроксидов; дать понятие об амфотерности и амфотерных соединениях; рассмотреть химические свойства амфотерных соединений, развивать умения анализировать, сравнивать, делать выводы, выделять главное, уметь находить в таблице ПСХЭ переходные металлы, прогнозировать свойства металлов исходя из степени окисления; развивать умения записывать уравнения реакций, способствовать развитию познавательного интереса учащихся к изучению химии.
Конспект урока по химии для 9 класса на тему: Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды
Цель – Познакомить учащихся с амфотерными оксидами и гидроксидами. Задачи урока: Познакомить учащихся с амфотерными оксидами и гидроксидами. Развивать внимание, память, речь, аналитическое мышление, способность делать выводы. Воспитывать любовь к предмету. Повторить и развивать знания о классификации и свойствах гидроксидов; дать понятие об амфотерности и амфотерных соединениях; рассмотреть химические свойства амфотерных соединений, развивать умения анализировать, сравнивать, делать выводы, выделять главное, уметь находить в таблице ПСХЭ переходные металлы, прогнозировать свойства металлов исходя из степени окисления; развивать умения записывать уравнения реакций, способствовать развитию познавательного интереса учащихся к изучению химии.
I.Организационный этап. Мотивация к учебной деятельности .
Учитель: - Учебник на столе у вас?
А ручки и тетрадки?
Тогда урок начнём сейчас,
Раз всё у вас в порядке.
Чтобы литературные тайны познавать,
Нужно всё серьёзно изучать.
- проверка готовности класса к уроку:
Я рада новой встрече с вами,
Приятно ваше общество, друзья!
Ответы ваши вы готовьте сами,
Их с интересом буду слушать я.
Мы сегодня снова будем читать,
Выводы делать и рассуждать.
А чтобы урок пошёл каждому впрок
Активно включайся в работу, дружок!
Вот книжки на столе,
Не хочется играть
Сегодня в прятки
Сегодня в классе у ребят
Урок очень важный
А почему он важный –
Добрый день, мои друзья,
Встрече с вами рада я.
Сели ровно, все достали,
Вспоминаем все, что знали,
Оставляем все заботы
И включаемся в работу.
II. Актуализация знаний учащихся.
Что такое химия как наука?
Химия – это наука о веществах, их свойствах, превращениях в-в и явлениях, сопровождающих эти превращения.
В прошлом учебном году вы изучали общую химию, познакомились с основными хим законами, классами неорг соединений, типами хим связей… В этом уч году, используя знания, полученные в прошлом, вы будите изучать неорганическую химию - это наука о хим эл-тах и их соединениях (кроме соединений углерода), изучающая св-ва и превращения неорг в-в.
Неорг в-ва – это хим соединения, образуемые всеми хим эл-тами ( кроме соединений углерода, относящихся к органическим в-вам), СО, СО2, Н2СО3 и ее соли.
Неорг в-ва образуются на Земле и в Космосе под воздействием природных физико-химических факторов. Известно ≈ 300 000 неоргв-в. Они образуют практически всю литосферу, атмосферу и гидросферу Земли. В их состав могут входить атомы всех хим эл-тов, известных в настоящее время в различных сочетаниях и количественных отношениях. Кроме того, огромное кол-во неорг в-в получают в научных лабораториях и на хим предприятиях искусственно.
Задачи неорг химии:
· Установление строения хим эл-тов, состава и св-вобразуемых ими соединений,
· Установление строения молекул сложных в-в;
· Разработка и научное обоснование способов создания новых материалов с нужнымисв-вами.
Основными методами неорг химии являются синтез и анализ.
Основным теоретическим фундаментом неорг химии служат:
· Теория строения атомов;
" Поэтому, вспомним строение ПС. Строение атома".
· Периоды, группы, п/гр; изменение св-в эл-товв периодах и группах; табл на стр 4-5
· Строение атомов: Li+3 3p + , 4n 0 , 3е - ; О+8; Р+15;
· Электронно-графические формулы атомов хим эл-тов(ЭГФ):О+8; Р+15;
· Определить степень окисления элементов в соединениях:
· Дать названия веществам или составить формулы по названию:
Хлорид бария, йодид марганца (II), нитрат серебра, фосфат никеля (II), силикат цинка, карбонат кальция, нитрат магния, сульфид натрия, сульфат меди (II), гидроксид калия, оксид алюминия.
Св-вахим эл-та зависят от его положения в ПСХЭ. Поэтому важно научиться характеризовать св-ва ХЭ на основании его положения в ПСХЭ. Для этого можно использовать план, приведенный на стр 3.
1. Положение в ПСХЭ и строение его атома;
2. Характер простого в-ва: Ме, неМе, переходный эл-т;
3. Сравнение св-в простого в-васо св-вами простых в-в, образованных соседними по п/гр эл-тами;
4. Сравнение св-в простого в-ва со св-вами простых в-в, образованных соседними по периоду эл-тами;
5. Состав высшего оксида, его хар-р: кислотный, основный, амфотерный;
6. Состав высшего гидроксида, его хар-р: кислотный, основный, амфотерный;
7. Состав летучего водородного соединения (для неМе).
Например, НАТРИЙ.
1. Na+11IIIпериодI А группа, 11 p+, 12 n 0 , 11 е - .
Na+111s 2 2s 2 2p 6 3s 1 ;на наружном энергетическом уровне находится 1 неспаренный электрон, зн. валентность равна I, степень окисления +1.
2. Простое вещ-во натрий – металл. Зн. металлическая кристаллическая решетка и металлическая хим связь. Na 0 -1e - ↔ Na + . Зн натрий проявляет все характерные св-ва металлов:ковкость, пластичность…
3. Металлическиесв-ва простого в-ваNa выражены сильнее, чем у Li, но слабее, чем у К.
4. Металлическиесв-ва простого в-ваNa выражены сильнее, чем уMg.
5. Натрий образует оксид формулой Na2О, который обладает основнымисв-вами. Какие это св-ва?
6. В качестве гидроксида натрию соответствует основание NaOН (щелочь), которое проявляет все характерные св-ва оснований. Какие это св-ва?
7. Натрий не образует летучих водородных соединений. С водородом он образует гидрид NaH – твердое белое кристаллическое в-во.
По такому же принципу хар-ют и неМе. Например,АЗОТ.
На основе данных характеристик можно составить генетические ряды МЕ и неМе:
Na → Na2O → NaOH → NaCl
1. № 1, 2, 3, 5, стр 8 письм
2. Задача № 7-8 стр 9
3. № 10 стр 9 – электронный баланс
Общая характеристика калия. Калий (лат. Kalium) является мягким щелочным металлом, элементом главной подгруппы I группы, IV периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 19 и обозначение– К. Нахождение в природе. Калий в свободном состоянии в природе не встречается, он входит в состав всех клеток. Достаточно распространённый металл, занимает 7-е место по содержанию в земной коре (calorizator).
III. Работа по новой теме.
Амфотерные соединения (оксиды и гидроксиды) – вещества, которые в зависимости от условий проявляют кислотные или основные свойства. Элементы, которые образуют амфотерные соединения, называют переходными.
Переходные элементы: цинк, бериллий, алюминий.
Свойства амфотерных соединений.
Переходными элементами являются: цинк, алюминий, бериллий (имеют постоянные степени окисления) и металлы, побочных подгрупп, имеющие степени окисления +3,+4.
Показать зависимость характера соединений переходного металла от степени окисления элемента на примере хрома.(в периодической системе переходные элементы зеленым цветом)
Физкультминутка
Встали дружно, потянулись
Богу солнца улыбнулись!
Богу ГЕБУ наш поклон
Многократным будет он.
Руки вверх к богине НУТ
Пусть немножко отдохнут.
Тело наше сделай круг
Повтори АМОНА путь
Готовы из знаний
Плести сотни сот
Поможет нам в этом
Бог мудрости ТОТ.
IV. Закреплени е
5. Первичное закрепление знаний.
1.Укажите, к какому классу неорганических веществ относится соединение:H2SO4, LiOH, Al(OH)3, H2SiO3, Ca(OH)2, Zn(OH)2, H2CO3 .Какой оксид соответствует каждому соединению?
2.Напишите уравнения возможных реакций оксида цинка со следующими веществами:Ba(OH)2, H2O, Na2O,BaCl2, H2SO4.
3. Напишите уравнения возможных реакций гидроксида цинка со следующими веществами: KOH, Li2O, NaCl, HCl, K2SO4.

В этом видеофрагменте профессор Колбочкин рассказывает о способности некоторых оксидов и гидроксидов проявлять амфотерные свойства. А разобраться с этим поможет рассказ о двуличном Алюминии. Кроме этого, профессор разъяснит, как определить, какими свойствами будет обладать тот или иной оксид или гидроксид: кислотными, основными или амфотерными. Он покажет опыт, иллюстрирующий свойства гидроксида цинка, составит соответствующие уравнения реакций и покажет элементы в Периодической системе, соединения которых проявляют амфотерные свойства.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Характеристика ХЭ по кислотно-основным свойствам. Амфотерные оксиды и гидроксиды"
Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды
Как же определить: кислотными или основными свойствами будет обладать то или иное соединение? Это совсем несложно, достаточно просто посмотреть Периодическую систему химических элементов Д.И. Менделеева.



А что же такое амфотерные оксиды и гидроксиды. Это слово, наверняка, вы слышали, но этому понятию ранее не придавалось никакого значения. Попробуйте сами догадаться, а для этого мы проведем опыт по получению гидроксида цинка (Zn(OH)2) и исследованию его свойств. Для этого, в две пробирки нальем раствора соли хлорида цинка (ZnCl2) и добавим в каждую несколько капель раствора гидроксида натрия (NaOH). При этом можно наблюдать выпадение осадка белого цвета. Таким образом, мы получили гидроксид цинка реакцией обмена между хлоридом цинка и гидроксидом натрия.

Исследуем свойства гидроксида цинка. Для этого, в одну пробирку мы прильем соляной кислоты (HCl), и что же мы наблюдаем, осадок начинает растворяться. Во вторую пробирку прильем раствора гидроксида натрия (NaOH), и в этом случае осадок тоже растворяется.
Какой же все-таки двуличный этот гидроксид цинка: он вступает в реакции и с кислотами, и с основаниями. Значит, все гидроксиды, которые реагируют и с основаниями, и с кислотами называются амфотерными. Они могут вести себя как кислоты в реакциях со щелочами и как основания в реакциях с кислотами. Т.е. в зависимости от условий они могут проявлять как кислотные свойства, так и основные. Значит, и записать химическую формулу гидроксида цинка можно по-разному: в виде кислоты H2ZnO2 и в виде основания Zn(OH)2.
Давайте запишем уравнения этих реакций:

В первой реакции образуется соль хлорид цинка (ZnCl2), а во второй комплексная соль тетрагидроксоцинкат натрия (Na2[Zn(OH)4]).
И цинк, и его оксид будут тоже амфотерными соединениями.
Например, цинк реагирует с кислотами: если в пробирку с цинком прилить серной кислоты (H2SO4), то будет выделяться газ. В результате этой реакции образуется соль – сульфат цинка (ZnSO4) и выделяется газ – водород (H2).

Zn 0 + 2H + = Zn 2+ + H2↑
Цинк будет реагировать и со щелочами. Запомните, если реакция протекает в растворе, то образуется комплексная соль тетрагидроксоцинкат натрия (Na2[Zn(OH)4]), при сплавлении образуется соль – цинкат натрия (Na2ZnO2), но водород выделяется в обоих случаях.
Аналогично ведет себя и оксид цинка, т.е. он реагирует с кислотами и с основаниями.
Например, в реакции оксида цинка (ZnO) с соляной кислотой образуется соль – хлорид цинка, в реакции оксида цинка с раствором гидроксида натрия образуется опять комплексная соль – тетрагидроксоцинкат натрия, а при сплавлении с гидроксидом натрия – цинкат натрия.
ZnO + 2H + = Zn 2+ + H2O
А сейчас послушайте историю про двуличного Алюминия.
Жил да был на свете хитрец-наглец по имени Алюминий. Его владения находились между двумя могущественными королевствами. Одним королевством правил молодой жизнерадостный король Натрий. Все в его королевстве было голубым: чистое голубое небо, глубокие прозрачные голубые озера и реки, голубые цветы благоухали на голубых полях. И жили в королевстве голубоглазые веселые и добрые люди. Работалось и жилось в королевстве легко, свободно, радостно. А это вызывало сильную зависть у правительницы другого королевства – Серы. Она вся пожелтела от зависти и злобы, порой даже начинала плавиться от внутреннего жара или гореть лиловым пламенем. Наконец ее терпение лопнуло после одного пышного празднества, устроенного Натрием в честь рождения сына, и Сера объявила войну Натрию.
Войска Натрия и Серы сражались, не жалея сил, выделяя огромное количество теплоты. А Алюминий со своим войском все выгадывал удобную позицию: если побеждало войско Натрия, он стремился быть в его гуще, если одерживало верх войско Серы, он перекидывался на его сторону. Наконец и Натрий, и Сера поняли хитрость и двойственность замыслов Алюминия. Оба послали самых сильных воинов с приказом уничтожить негодяя и предателя.
Алюминий увидел, что с двух сторон к нему стремительно приближаются два всадника. Вскоре два копья с силой вонзились в его безвольное тело.
Как видите, алюминий тоже проявляет двойственность свойств, т.е. он тоже является амфотерным, значит, его оксид и гидроксид тоже будут амфотерными.
Алюминий, как и цинк, реагирует с кислотами. Например, в реакции с серной кислотой (H2SO4) он также образует соль – сульфат алюминия (Al2(SO4)3) и при этом выделяется газ – водород (H2).
Алюминий реагирует и со щелочами: если реакция алюминия с гидроксидом натрия (NaOH) протекает в растворе, то в этом случае, как и в случае с цинком, образуется комплексная соль тетрагидроксоалюминат натрия (2Na[Al(OH)4])

Оксид алюминия и его гидроксид ведет себя тоже двойственно. При реакции оксида алюминия (Al2O3) с соляной кислотой (HCl), он ведет себя, как основный оксид, при этом образуется соль – хлорид алюминия (AlCl3). А при взаимодействии с раствором щелочи, этот же оксид ведет себя как кислота, при этом образуется комплексная соль – тетрагидроксоалюминат натрия (Na[Al(OH)4]), или гексагидроксоалюминат натрия (Na3[Al(OH)6]), что будет верно в любом случае. А вот при сплавлении со щелочью, образуется соль – метаалюминат натрия (NaAlO2).
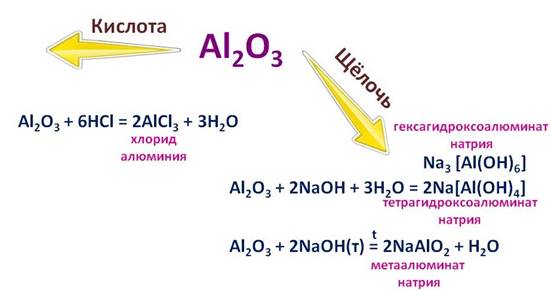
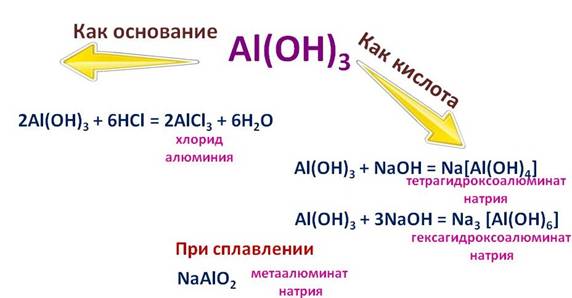
Гидроксид алюминия (Al(OH)3)тоже является амфотерным, поэтому он реагирует с кислотами и с основаниями.
Например, в реакции соляной кислотой (HCl), он себя ведет, как основание, при этом образуется соль – хлорид алюминия (AlCl3) и вода (H2O) , а вот в реакции с гидроксидом натрия (NaOH), он ведет себя, как кислота. Если реакция протекает в растворе, то образуется комплексная соль – тетрагидроксоалюминат натрия (Na[Al(OH)4]), или гексагидроксоалюминат натрия (Na3[Al(OH)6]), а при сплавлении другая соль – метаалюминат натрия (NaAlO2).
Будьте внимательны, посмотрите амфотерные элементы в периодической таблице. Интересно, что элементы побочных подгрупп, в промежуточной степени окисления также могут проявлять амфотерные свойства, эти элементы еще называют переходными элементами или переходными металлами.

К амфотерным элементам относятся: Be, Al, Ga, Ge, Sn, Pb, Sb, Bi, Po, Cr, Mn, Fe, Zn, Cd, Au и др.
Проведём небольшой лабораторный опыт. Получим гидроксид цинка и исследуем его химические свойства.
Лабораторный опыт № 1
Получение гидроксида цинка и исследование его свойств
| В две пробирки налейте по 1 мл раствора соли цинка (хлорида, сульфата или нитрата), а затем добавьте в каждую с помощью пипетки по 5 капель раствора щёлочи (гидроксида натрия или калия). Что наблюдаете? Прилейте к содержимому одной пробирки раствор кислоты (соляной, серной или азотной), а к другой — раствор щёлочи. Что наблюдаете? О каком свойстве гидроксида цинка свидетельствует вторая часть опыта? Запишите уравнение проделанных реакций в молекулярной и ионной формах. |
В чём причина такого необычного поведения Zn(OH)2 как нерастворимого основания? Опыт показывает, что гидроксид цинка проявляет свойства оснований, взаимодействуя с кислотой, но он также ведёт себя и как нерастворимая кислота, взаимодействуя с щёлочью.
| Вещества, которые в зависимости от условий реакций проявляют кислотные или основные свойства, называют амфотерными (от греч. амфотеро — и тот, и другой). |
Таким образом, гидроксиду цинка присущи амфотерные свойства: он может реагировать с кислотами как основание и с щелочами как кислота. Соответственно формулу этого соединения можно представить двояко:

Тогда уравнения реакций гидроксида цинка с кислотой и с щёлочью можно записать так:

В обоих случаях образуется растворимая соль.
Аналогично гидроксиду цинка и соответствующий ему оксид цинка проявляет амфотерные свойства — образует соли при взаимодействии как с кислотами, так и с основаниями, например:

В первой реакции оксид цинка ведёт себя как основный оксид, а во второй реакции выступает в роли кислотного оксида — образует соль, в которой цинк входит в состав кислотного остатка.
Амфотерными являются оксиды и гидроксиды многих элементов, например бериллия, алюминия, хрома (III).
Если элемент-металл проявляет несколько степеней окисления, то его оксид и гидроксид с низшей степенью окисления будут проявлять, как правило, основные свойства, с высшей — кислотные, а с промежуточной — амфотерные. Например, для хрома:

Амфотерные оксиды и гидроксиды образуют чаще всего те элементы, которые составляют побочные подгруппы Периодической системы Д. И. Менделеева. Эти элементы называют переходными элементами или переходными металлами.
Читайте также:

