Этиленовые углеводороды конспект 10 класс
Обновлено: 03.07.2024
Урок посвящён непредельным углеводородам, их номенклатуре, физическим и химическим свойствам, а также роли в жизни человека. В ходе урока учащиеся познакомятся с представителями данного класса органических веществ.
Алкены – непредельные углеводороды ряда этилена, имеющие одну двойную углерод-углеродную связь
Гибридизация – процесс взаимодействия разных, но близких по энергии электронных орбиталей, приводящий к их выравниванию по форме и энергии.
Гомология – явление сходства по составу, строению, химическим свойствам и принадлежности к тому же классу одного вещества с другим веществом, но различающиеся дуг от друга на одну или несколько групп СН2. Группу СН2 называют гомологической разностью.
Горение – быстро протекающий процесс окисления вещества, сопровождающийся большим выделением тепла и ярким свечением.
Полимеризация – реакция, при которой одинаковые молекулы соединяются между собой в более крупную молекулу
Изомерия – явление существования веществ, одинаковых по составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и вследствие этого по физическим и химическим свойствам. Такие вещества называются изомерами.
Формула структурная – изображение молекулы, в котором показан порядок связывания атомов между собой. Химические связи в таких формулах обозначаются черточками.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Алкены – непредельные углеводороды, в молекулах которых между атомами углерода имеется одна двойная углерод-углеродная связь. Общая формула алкенов СnH2n, где n≥2.
Простейшим представителем алкенов является этен, или этилен С2Н4.
Структурная формула этилена:

Особенности пространственного и электронного строения алкенов на примере молекулы этилена
Рассмотрим особенности электронного и пространственного строения алкенов на примере молекулы этилена. Все атомы углерода в молекуле этилена находятся в состоянии sp 2 -гибридизации. Три гибридных орбитали участвуют в образовании трех достаточно прочных сигма связей (по две связи у каждого атома углерода с атомами водорода и одна общая между собой). Оставшаяся негибридная р-орбиталь образует менее прочную пи-связь между атомами углерода. Таким образом, в молекуле этилена присутствуют 5 сигма-связей и одна пи-связь, причем двойная связь между атомами углерода образована одной сигма и и одно пи-связями. Наличие пи-связей в молекулах алкенов делает невозможным вращение атомов углерода друг относительно друга (имеются ввиду те атомы, при которых находится двойная связь)
Каждый атом углерода в молекуле этилена имеет треугольное строение.
Номенклатура алкенов
Особенности номенклатуры алкенов заключаются в следующем:
1. Нумерация углеродной цепи начинается с того конца, где ближе расположена двойная связь
2. В конце названия изменяется суффикс -ан соответствующего предельного углеводорода на -ен или -илен, и, если это необходимо, указывается атом углерода, при котором находится двойная связь

1. Нумерация главной цепи начинается слева направо, так как двойная связь ближе к левой части молекулы.
2. Называем радикал, расположенный у второго атома углерода: 2-метил
3. В главной цепи находится четыре атома углерода, следовательно, она соответствует предельному углеводороду – бутану.
4. Так как присутствует двойная связь, то суффикс – ан меняется на суффикс -ен и указывается положение двойной связи: бутен-1.
5. Соединяем суффикc с корнем и получаем название 2-матилбутен-1.
Гомология алкенов и изомерия алкенов.
Ближайшие гомологи этилена:
Для алкенов характерны следующие виды изомерии:
1. Изомерия углеродного скелета
2. Изомерия положения кратной связи
3. Пространственная геометрическая изомерия
4. Межклассовая (с циклоалканами)
Рассмотрим каждый вид изомерии на примере вещества состава С4Н8:
При построении структурной формулы данного вещества возможно расположение двойной связи как между первым и вторым атомами углерода, так и между вторым и третьим, тогда возможно получить две структурные формулы

Данный вид изомерии называется изомерией положения кратных связей.
Для данного вещества возможно построить единственный разветвлённый изомер – изомер углеродного скелета – 2-метилпропен:

Межклассовый изомер бутена – циклобутан:

Также для бутена-2 возможно существование геометрических изомеров, это связано с тем, что метильная группа СН3 - может располагаться относительно плоскости двойной связи в двух разных положениях, что приводит к образованию цис- (если эти группы расположены по одну линию связи) и транс-изомеров (если метильные группы расположены по разные линии связи):

Физические свойства алкенов
Этилен – бесцветный газ, почти без запаха, легче воздуха, плохо растворим в воде. Пропен и бутен – также газы. От пентена до октадецена – жидкости. Остальные – твердые вещества. Все агрегатные состояния указаны при нормальных условиях.
Способы получения алкенов
1. Внутримолекулярная дегидратация спиртов:
Данный способ является основным способом получения этилена в лабораторных условиях. Реакция протекает при температуре выше 140 градусов и в присутствии концентрированной серной кислоты, выполняющей роль катализатора. При дегидратации этанола получают этилен, а при дегидратации пропанола – пропилен:

2. Дегидрирование предельных углеводородов.
Данная реакция протекает при нагревании в присутствии катализаторов: никеля, платины, оксида хрома (III). При этом получают соответствующие алкены:

Химические свойства алкенов
Химические свойства алкенов обусловлены наличием в их молекулах двойных углерод-углеродных связей. Дело в том, что пи-связь, как было сказано ранее, является менее устойчивой, чем сигма связь. Поэтому при атаке её каким-либо реагентом она легко разрывается. Это объясняет основные химические свойства алкенов: они способны вступать в реакции присоединения и окисления.
Реакции присоединения
Гидрирование – присоединение водорода
Протекает при нагревании в присутствии катализаторов: платина, никель, оксид хрома (III). Продуктом реакции всегда является алкан.
Галогенирование – присоединение галогенов
Реакция протекает при обычных условиях. Продукт реакции – дигалогеналкан (1,2 - дибромэтан)
Признак реакции – обесцвечивание раствора брома, поэтому данную реакцию используют как качественную на двойную связь.
Гидрогалогенирование – присоединение галогенводородов
Продукт реакции – галогеналкан (хлорэтан)
Гидратация – присоединение воды
Продукт реакции - спирт
Реакция полимеризации
Полимеризация – реакция, при которой одинаковые молекулы соединяются в более крупные молекулы.
Условия реакции – высокая температура и давление
Продукт реакции – полимер (полиэтилен)
Продукты реакции полимеризации используются для производства пластмасс и синтетических волокон
Продукт реакции – многоатомный спирт (этиленгликоль)
Признак реакции – обесцвечивание раствора перманганата калия , поэтому данную реакцию используют как качественную на двойную связь.
Каталитическое – окисление кислородом в присутствии катализаторов
Продукт реакции – оксид алкена (оксид этилена)
Продуктами полного горения алкенов являются углекислый газ и вода
Особенности реакций гидрогалогенирования и гидратации у пропилена и других гомологов этилена
Реакции присоединения галогеналканов и воды у гомологов этилена протекают по правилу Марковникова: водород присоединяется по месту разрыва двойной связи к более гидрированному атому углерода. Например, при присоединении хлороводорода к молекуле пропилена, образуется не 1-хлорпропан, а 2-хлорпропан:
Аналогично протекает реакция гидратации:

Применение этилена и его соединений
Производство пластмасс, взрывчатых веществ, антифриза, растворителей, синтетического каучука, ацетальдегида, для ускорения созревания плодов.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЯ ЗАДАНИЙ ТРЕНИРОВОЧНОГО МОДУЛЯ
- Решение задачи на нахождение массы раствора.
Масса 2%-го раствора бромной воды, которая вступает в реакцию с 2,24 л пропилена равна
Шаг первый: Составляем уравнение химической реакции С2Н4 + Br2 = C2H4Br2
Шаг второй: Находим количество вещества пропилена по формуле n=V\Vm= 2,24 л / 22,4 л/моль = 0,1 моль
Шаг третий: По уравнению реакции количество вещества пропилена равно количеству вещества брома: n(С2Н4)=n(Br2)=0,1 моль
Шаг четвёртый: Находим массу брома по формуле: m=Mn=160 г/моль*0,1 моль= 16 г
Шаг пятый: Находим массу раствора бромной воды по формуле: m (раствора)=m/ω = 16г / 0,02 = 800г
- Решение упражнения на химические свойства алкенов
Вставьте в таблицу пропущенные продукты реакции
Первый шаг: При гидрировании алкенов водородом образуются предельные углеводороды – алканы с соответствующим числом атомов углерода. Поэтому первая колонка заполняется продуктами реакции – этан и пропан:
Второй шаг: При галогенировании алкенов галогены, в данном случае бром, присоединяются по месту разрыва двойной связи, образуя дигалогенпроизводные, например:

Поэтому второй столбец заполняется следующими веществами: 1,2-дибромэтан, 1,2-дибромпропан.
Третий шаг: При гидратации (присоединении воды) образуются спирты. При реакции пропилена с водой важно помнить о правиле Марковникова, поэтому продуктами реакции будут этанол и пропанол-2:
4. При гидрогалогенировании алкенов продуктом реакции будут галогеналканы. И опять нужно помнить о правиле Марковникова для гидрогалогенирования пропилена:
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Тема урока: Алкены. Свойства и применение.
Цель урока: изучить химические свойства алкенов, узнать основные области применения этиленовых углеводородов.
Тип урока: комбинированный.
Средства обучения: проектор, экран, компьютер.
Программное обеспечение: компьютерная презентация к уроку.
Организационный момент:
Актуализация знаний.
Беседа по вопросам:
А) Дать понятие какие вещества называют – Алкенами?
Б) Какова молекулярная формула первого представителя гомологического ряда алкенов? Назовите его.
В) Какие вещества называют изомерами?
Г) Перечислить виды изомерии алкенов
Д) Какие способы получения алкенов вы знаете?
Е) Назвать вещества. (Задание на слайде).
3. Изучение нового материала.
Химические свойства алкенов определяются двойной углерод - углеродной связью.
Для алкенов характерны реакции присоединения, полимеризации, окисления. Реакции присоединения.
1. Присоединение водорода (гидрирование): Н 2 С=СН 2 + H 2 → Н 3 С—СН 3
2. Присоединение галогенов (галогенирование:) Н 2 С=СН– СН 3 + Cl 2 → CH 2 Cl —CH Cl – СН 3
3. Присоединение галогеноводородов:
4. Присоединение воды (реакция гидратации):
C Н 2 = СН – СН 3 + Н – ОН → СН 3 – СН ОН – СН 3
Присоединение молекул галогеноводородов и воды к молекулам алкенов происходит в соответствии с правилом В.В. Марковникова.
Правило В.В. Марковникова:
Атом водорода присоединяется к наиболее гидрированному атому углерода при двойной связи, а атом галогена или гидроксогруппа – к наименее гидрированному.
Процесс соединения многих одинаковых молекул в более крупные называется реакцией полимеризации.
Алкены широко используются в качестве мономеров для получения многих высокомолекулярных соединений (полимеров).
Реакции окисления. Алкены окисляются легче, чем алканы. Продукты, образованные при окислении алкенов, и их строение зависят от строения алкенов и от условий проведения реакции.
Качественные реакции на двойную углерод - углеродную связь
Обесцвечивание бромной воды :
3. При действии на этилен водного раствора КМnO 4 (при нормальных условиях) происходит образование двухатомного спирта — этиленгликоля:
Эта реакция является качественной : фиолетовая окраска раствора перманганата калия изменяется при добавлении к нему непредельного соединения.
Этиленгликоль используется в качестве антифриза, из него получают волокно лавсан, взрывчатые вещества.
Применение этиленовых углеводородов :
Из этилена и его соединений получают: горючее, пластмассы, взрывчатые вещества, антифризы, растворители, синтетический каучук.
Закрепление изученного материала:
На слайде приведены уравнения реакций. По правилу Марковникова закончить уравнения химических реакций.
(Преподаватель делает вместе с обучающимися). Выставляются оценки за работу на уроке.
Домашнее задание.
a втор О. С. Габриелян
параграф 9.2, стр. 162 №2, №4.
- подготовка к ЕГЭ/ОГЭ и ВПР
- по всем предметам 1-11 классов
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 933 человека из 80 регионов

Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 24 человека из 17 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- ЗП до 91 000 руб.
- Гибкий график
- Удаленная работа
Дистанционные курсы для педагогов
Свидетельство и скидка на обучение каждому участнику
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 610 812 материалов в базе
Материал подходит для УМК
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
Свидетельство и скидка на обучение каждому участнику
Другие материалы
Вам будут интересны эти курсы:
Оставьте свой комментарий
- 25.12.2017 1943
- DOCX 23.5 кбайт
- 34 скачивания
- Оцените материал:
Настоящий материал опубликован пользователем Усачева Юлия Игоревна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
40%
- Подготовка к ЕГЭ/ОГЭ и ВПР
- Для учеников 1-11 классов
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Время чтения: 2 минуты
В Белгородской области отменяют занятия в школах и детсадах на границе с Украиной
Время чтения: 0 минут
Отчисленные за рубежом студенты смогут бесплатно учиться в России
Время чтения: 1 минута
Рособрнадзор предложил дать возможность детям из ДНР и ЛНР поступать в вузы без сдачи ЕГЭ
Время чтения: 1 минута
Новые курсы: функциональная грамотность, ФГОС НОО, инклюзивное обучение и другие
Время чтения: 15 минут
В приграничных пунктах Брянской области на день приостановили занятия в школах
Время чтения: 0 минут
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.

В гибридизации участвуют орбитали одного s - и двух p -электронов:

Общая формула С n Н 2n
Возможны два типа изомерии:
структурная изомерия :
- углеродного скелета
- положения двойной связи
- межклассовая
пространственная изомерия:
Примеры изомеров углеродного скелета (С 5 Н 10 )
1 2 3 4 1 2 3 4 СН 2 = С – СН 2 – СН 3 СН 2 = СН – СН – СН 3
2-метилбутен-1 3-метилбутен-1
1 2 3 4
СН 3 – С = СН – СН 3
СН 3 2-метилбутен-2
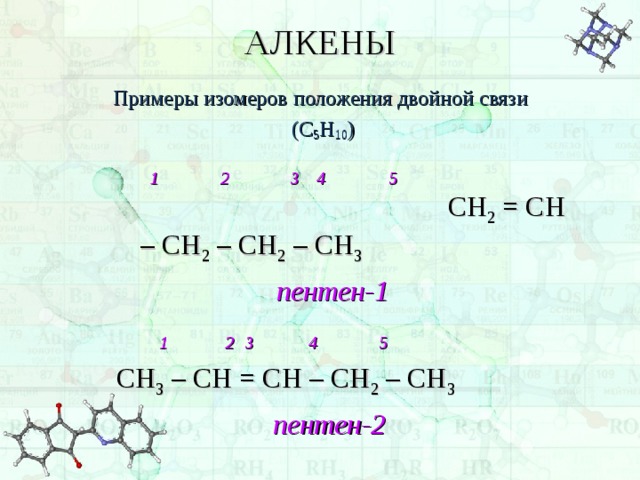
Примеры изомеров положения двойной связи
1 2 3 4 5 СН 2 = СН – СН 2 – СН 2 – СН 3
1 2 3 4 5
СН 3 – СН = СН – СН 2 – СН 3
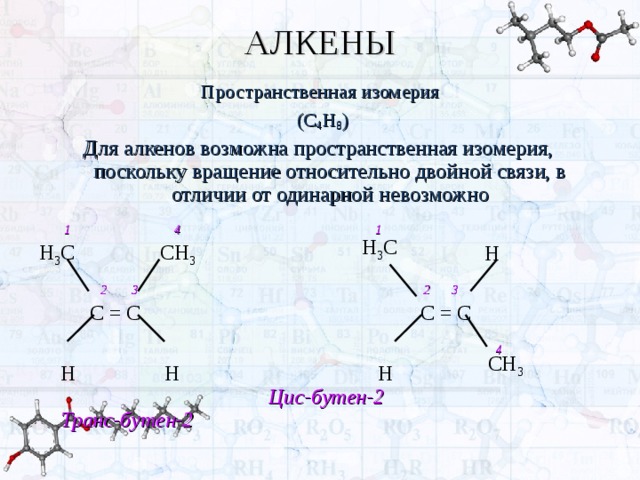
Для алкенов возможна пространственная изомерия, поскольку вращение относительно двойной связи, в отличии от одинарной невозможно
1 4 1
2 3 2 3
Н Н Н Цис-бутен-2 Транс-бутен-2
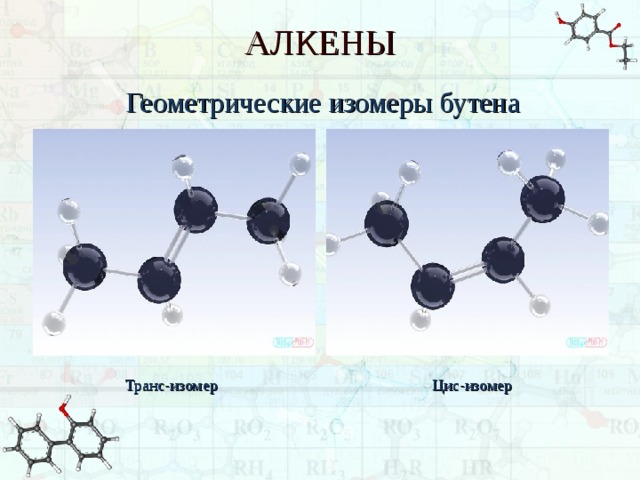
Геометрические изомеры бутена
Физические свойства алкенов
Химические свойства алкенов
По химическим свойствам алкены резко отличаются от алканов. Алкены более химически активные вещества, что обусловлено наличием двойной связи, состоящей из σ - и π -связей. Алкены способны присоединять два одновалентных атома или радикала за счёт разрыва π -связи, как менее прочной

Типы химических реакций, характерные для алкенов
1. Гидрирование
C Н 2 = СН 2 + Н 2 СН 3 – СН 3
этен этан
Условия реакции : катализатор – Ni, Pt, Pd
2. Галогенирование
C Н 2 = СН – СН 3 + С l – С l СН 2 – СН – СН 3
1,2-дихлорпропан
Реакция идёт при обычных условиях
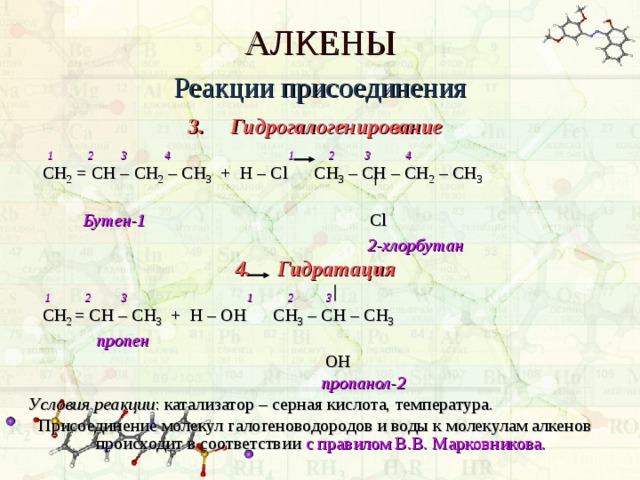
3. Гидрогалогенирование
1 2 3 4 1 2 3 4
СН 2 = СН – СН 2 – СН 3 + Н – С l C Н 3 – СН – СН 2 – СН 3
4. Гидратация
1 2 3 1 2 3
C Н 2 = СН – СН 3 + Н – ОН СН 3 – СН – СН 3
Условия реакции : катализатор – серная кислота, температура.
Присоединение молекул галогеноводородов и воды к молекулам алкенов происходит в соответствии с правилом В.В. Марковникова.
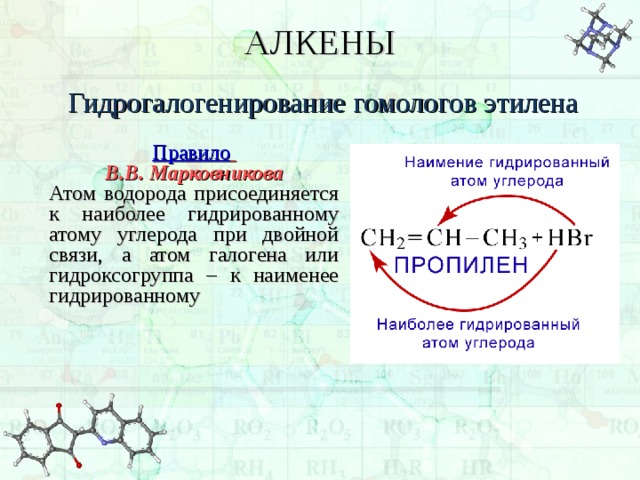
Гидрогалогенирование гомологов этилена
В.В. Марковникова
Атом водорода присоединяется к наиболее гидрированному атому углерода при двойной связи, а атом галогена или гидроксогруппа – к наименее гидрированному
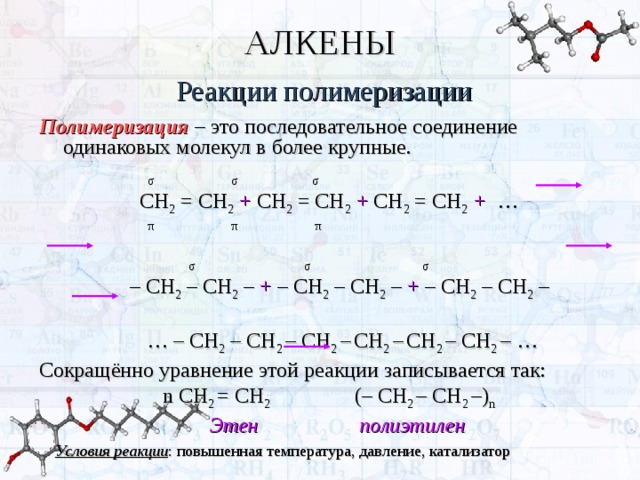
Полимеризация – это последовательное соединение одинаковых молекул в более крупные.
СН 2 = СН 2 + СН 2 = СН 2 + СН 2 = СН 2 + …
– СН 2 – СН 2 – + – СН 2 – СН 2 – + – СН 2 – СН 2 –
… – СН 2 – СН 2 – СН 2 – СН 2 – СН 2 – СН 2 – …
Сокращённо уравнение этой реакции записывается так:
n СН 2 = СН 2 (– СН 2 – СН 2 –) n
Этен полиэтилен
Условия реакции : повышенная температура, давление, катализатор

Реакция Вагнера (Мягкое окисление раствором перманганата калия)
3СН 2 = СН 2 + 2КМ n О 4 + 4Н 2 О
3СН 2 - СН 2 + 2М n О 2 + 2КОН
С 2 Н 4 + (О) + Н 2 О С 2 Н 4 (ОН) 2
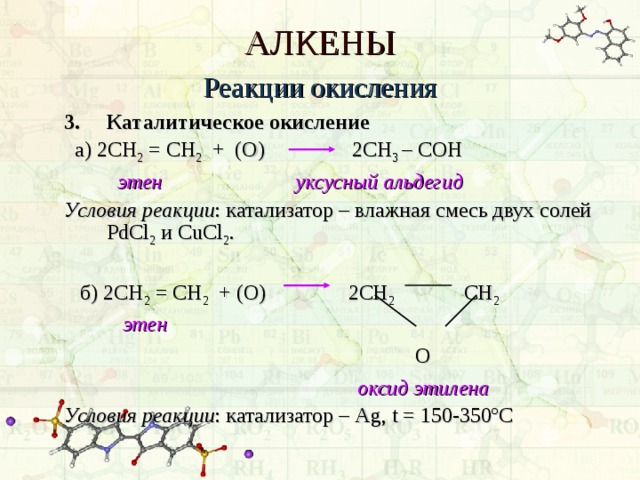
3. Каталитическое окисление
а) 2СН 2 = СН 2 + (О) 2СН 3 – C ОН
этен уксусный альдегид
Условия реакции : катализатор – влажная смесь двух солей PdCl 2 и CuCl 2 .
б) 2СН 2 = СН 2 + (О) 2СН 2 СН 2
оксид этилена
Условия реакции : катализатор – Ag , t = 150-350 º С

Алкены горят красноватым светящимся пламенем, в то время как пламя предельных углеводородов голубое. Массовая доля углерода в алкенах несколько выше, чем в алканах с тем же числом атомов углерода.
С 4 Н 8 + 8О 2 4СО 2 + 4Н 2 О
При недостатке кислорода
С 4 Н 8 + 6О 2 4СО + 4Н 2 О

Алкены широко используются в промышленности в качестве исходных веществ для получения растворителей (спирты, дихлорэтан, эфиры гликолей и пр.), полимеров (полиэтилен, поливинилхлорид, полиизобутилен и др.), а также многих других важнейших продуктов

-75%

Непредельные углеводороды
Ключевые слова конспекта: Непредельные углеводороды. Алкены. Пространственная (геометрическая) изомерия. Реакции дегидратации. Реакции присоединения (гидратация, гидрогалогенирование, галогенирование). Правило Марковникова. Реакции полимеризации. Мономер. Полимер. Структурное звено. Степень полимеризации. Качественные реакции на непредельные углеводороды.
Гомологический ряд алкенов
Полиэтилен получают из углеводорода этилена С2Н4. В молекуле этилена два атома углерода связаны не одинарной, а двойной связью, что отражает структурная формула СН2=СН2. Этилен — первый представитель гомологического ряда этиленовых углеводородов, или алкенов.

Наличие в молекуле одной двойной связи С=С показывает, что валентности углеродных атомов не полностью насыщены атомами водорода, поэтому такие углеводороды называют непредельными углеводородами.
Этиленовые углеводороды образуют свой гомологический ряд. Как и в случае алканов, состав двух гомологов отличается на одну или несколько групп СН2. Приведём молекулярные и структурные формулы ближайших гомологов этилена.

Номенклатура и изомерия алкенов

Два последних углеводорода в таблице 2 имеют одинаковый состав, но различное химическое строение, т. е. это изомеры. Однако у бутена изомерия проявляется не только в строении углеродной цепи (линейная или разветвлённая), но и в положении двойной связи в молекуле. В конце названия алкена арабской цифрой указывают атом углерода, за которым следует двойная связь:
Изомерия положения двойной связи — тоже один из видов структурной изомерии.
Особенности пространственного строения этиленовых углеводородов приводят к появлению в гомологическом ряду алкенов ещё одного вида изомерии — пространственной изомерии.

Для бутена-2 возможно написание двух различных структурных формул. В первом случае углеродная цепь алкена расположена по одну сторону от линии двойной связи, а во втором — по разные стороны:
Эти два углеводорода имеют разные физические свойства (температуры кипения, плавления и др.). Каждое вещество имеет состав С4Н8, неразветвлённую цепь углеродных атомов, одинаковое положение кратной связи в цепи, но различаются они взаимным расположением атомов в пространстве. Следовательно, эти углеводороды являются изомерами. Первый называют цис-бутен-2, второй — транс-бутен-2. Такой вид пространственной изомерии носит название геометрической или цис-транс-изомерии (от лат. cis — на одной стороне и trans — напротив).

Способы получения алкенов
В отличие от предельных углеводородов, алкены встречаются в природе нечасто. Промышленные способы их получения основаны на превращении алканов в алкены. В качестве природных источников алкенов используют главным образом нефть и природный газ.
Один из способов получения алкенов — уже знакомая вам реакция дегидрирования соответствующих предельных углеводородов.
К лабораторным способам получения алкенов относят реакции отщепления. Для образования в молекуле двойной связи от соседних атомов углерода нужно отнять по одному связанному с ними атому или группе. Тогда освободившиеся валентности превращаются во вторую углерод-углеродную связь.

или
Химические свойства алкенов
Химические свойства этилена и его гомологов обусловлены особенностями их строения, а именно наличием в их молекулах двойной углерод-углерод ной связи.
Для непредельных соединений характерны реакции присоединения.

Одна из наиболее важных реакций присоединения для этилена — его взаимодействие с водой в присутствии катализатора (кислоты):

Обычно эту реакцию записывают так:
В результате реакции гидратации этилена получают технический этиловый спирт. Его используют только в качестве растворителя, горючего, сырья для химических производств — словом, везде, кроме пищевой промышленности.
Присоединение воды к гомологу этилена — пропилену происходит по правилу, сформулированному выдающимся русским химиком, учеником Бутлерова В. В. Марковниковым.


Этиленовые углеводороды вступают в реакции присоединения галогеноводородов — реакции гидрогалогенирования:

И в этих реакциях, как и в реакциях гидратации, соблюдается правило Марковникова:

К реакциям присоединения относят также взаимодействие этиленовых углеводородов с галогенами — реакции галогенирования. В отличие от алканов, которые с галогенами вступают в реакцию замещения, алкены присоединяют молекулу галогена за счёт разрыва связи С=С:

или
В качестве реагента для реакции бромирования этилена можно использовать раствор брома в воде — так называемую бромную воду. При этом жёлтая окраска бромной воды исчезает. Поскольку реакция сопровождается характерными видимыми изменениями, обесцвечивание бромной воды можно использовать как качественную реакцию на этилен и другие непредельные соединения.

Вещества, содержащие двойную углерод-углеродную связь, можно обнаружить с помощью ещё одной качественной реакции. При пропускании этилена через водный раствор перманганата калия происходит обесцвечивание этого раствора. В упрощённом виде, обозначив окислитель ( КМ nO 4 ) как [О], уравнение реакции записывают так:
Разновидностью реакции присоединения можно считать процесс полимеризации.
Под действием высокой температуры и давления двойные углерод-углеродные связи в этилене разрываются, и за счёт освободившихся валентностей атомы углерода соединяются друг с другом:

Исходное вещество (в данном случае — этилен) называют мономером, а продукт реакции (в нашем примере — полиэтилен) — полимером. В результате реакции полимеризации образуются длинные цепи, состоящие из фрагментов этилена —СН2—СН2—. Многократно повторяющуюся в полимерной цепи группу атомов называют структурным звеном полимера. Число структурных звеньев в макромолекуле обозначают буквой п и называют степенью полимеризации. Относительная молекулярная масса таких гигантских молекул может составлять от нескольких тысяч до нескольких миллионов. Поскольку эта величина не является постоянной, говорят о средней молекулярной массе полимера. Уравнение реакции полимеризации этилена записывают так:
Этилен — важное химическое сырьё для производства полиэтилена, галогенпроизводных (используются, например, в качестве растворителей), этилового спирта, этиленгликоля и других продуктов химической промышленности.
Алкены — не единственные представители углеводородов, содержащих в молекуле двойную связь. О других углеводородах с двойными связями вы узнаете из материала следующего конспекта.


Aлкенами (олефиновыми, этиленовыми) называют непредельные углеводороды с открытыми углеродными цепями, молекулы которых содержат одну двойную углерод-углеродную связь. Простейшим представителем алкенов является этилен СН2=СН2.
Электронное и пространственное строение молекулы этилена.
В молекуле этилена атомы углерода имеют иной тип гибридизации по сравнению с метаном. Гибридизации подвержены одна s – и две р – орбитали; третья р – орбиталь остается без изменения. Такое состояние атома углерода называют sр 2 – гибридизацией (рис. 3.1).

В результате у атома углерода имеются четыре орбитали: три гибридные sр 2 – орбитали и одна негибридизованная р – орбиталь. На каждой из них находится по одному неспаренному электрону, за счет которых углерод образует четыре ковалентные связи. В результате взаимного отталкивания электронов орбитали стремятся расположиться в пространстве на максимальном удалении. Такое удаление орбиталей друг от друга достигается в том случае, если оси sр 2 -орбиталейлежат в одной плоскости под углом 120 0 , а ось р-орбитали будет перпендикулярна этой плоскости (рис.3.2).

Каждый атом углерода в молекуле этилена за счет перекрывания Sp 2- оpбиталей образует три -связи: с двумя атомами водорода и соседним атомом углерода. При параллельном расположении осей р-орбиталей двух атомов происходит их боковое перекрывание с образованием второй углерод-углеродной связи π-типа (рис. 3.3).

π –Связь является менее прочной и более доступной для атаки реагентов по сравнению с -связью. Однако суммарная энергия двойной связи больше, чем одинарной.
Электронное строение молекулы этилена определяет и ее пространственное строение (рис. 3.4). Центры ядер всех шести атомов расположены в одной плоскости, перпендикулярной плоскости π-связи. Все валентные углы 0 . Длина двойной связи значительно меньше длины одинарной и составляет 0,134нм. Свободное вращение атомов углерода относительно связи С=С невозможно.

Гомологический ряд и изомерия алкенов. Этилен является первым представителем гомологического ряда этиленовых (олефиновых) углеводородов, или алкенов. Как и в случае алканов, два ближайших гомолога отличаются по составу на гомологическую разность – СН2 –.
Общая формула углеводородов гомологического ряда алкенов СnН2n. В табл. 3.1 приведены структурные формулы и названия первых четырех гомологов ряда алкенов.
Названия и структурные формулы первых четырех гомологов ряда алкенов
Для алкенов характерны три типа изомерии: изомерия углеродного скелета, изомерия положения двойной связи и геометрическая изомерия.
Изомерия начинается с углеводорода состава С4Н8 – бутена. При расположении двойной связи между первым и вторым углеродными атомами возможны два структурных изомера: бутен-l и 2-метилпропен. Для углеводородов, в молекулах которых двойная связь расположена в середине цепи, существуют два геометрических изомера: цис-бутен-2 и транс-бутен-2. Они отличаются взаимным расположением атомов водорода относительно линии двойной связи:

Поскольку поворот молекулы относительно двойной связи в алкенах невозможен, цuс-бутен-2 и транс-бутен-2 являются разными веществами.
Не любой алкен имеет геометрические изомеры. для этого необходимо, чтобы каждый из двух атомов углерода в состоянии sр-гибридизации имел по два разных заместителя. Например, 3-этилгексен-3 пространственных изомеров не имеет (третий углеродный атом связан с двумя одинаковыми группами), а 3-метилгексен-3 имеет. Изображение начинают с атомов углерода, связанных двойной связью, затем указывают четыре заместителя:

Следует иметь в виду, что в алкенах все атомы углерода, не связанные двойной связью, находятся в состоянии sр З -гибридизации.
Приведенные правила иллюстрируют следующие примеры:


Простейшие алкены наряду с названиями согласно международной номенклатуре: этен, пропен и бутен - называют исторически сложившимися (тривиальными) названиями: этилен, пропилен, бутилен соответственно.
При отщеплении одного атома водорода от молекул алкенов образуются непредельные радикалы общей формулы СnH2n-1, простейшие из которых: винил СН2=СН – и аллил СН2 = СН – СН2
Физические свойства. При обычных условиях алкены состава С2Н4, С3Н6, С4Н8 являются газообразными веществами без цвета и запаха; углеводороды СnH2n, где n = 5 – 15 – бесцветные жидкости; при n 16 – твердые вещества. Алкены не растворимы в воде, однако могут растворяться в органических растворителях. Газообразные алкены образуют с воздухом взрывоопасные смеси.
3.2. Получение и химические свойства алкенов
В отличие от предельных углеводородов алкены встречаются в природе нечасто. Промышленные способы получения этиленовых углеводородов основаны на превращении алканов (природных источников углеводородов, главным образом нефти и природного газа) в алкены. Все лабораторные способы получения основаны на реакциях отщепления, или элиминирования. При этом от двух соседних атомов углерода отщепляются два атома или группы, и между атомами углерода возникает π-связь.
Промышленные способы получения алкенов. Основными промышленными способами получения алкенов являются крекинг и дегидрирование алканов.
1. Крекинг алканов. Главным промышленным способом получения алкенов является крекинг алканов, входящих в состав нефти и попутного нефтяного газа:

В зависимости от условий про ведения процесса различают термический и каталитический крекинг. С целью получения алкенов используют, как правило, крекинг термический, протекающий при температуре 400 – 700 0 С.
2. Дегидрирование алканов. Этот процесс рассматривался в подразд.2.2 как химическое свойство предельных углеводородов:

Лабораторные способы получения алкенов. В лаборатории для получения алкенов используют реакции дегидратации спиртов и дегидрогалогенирования производных предельных углеводородов.
1. Дегидратация спиртов. При нагревании спиртов в присутствии концентрированной серной кислоты до температуры выше 180 0 С происходит внутримолекулярное отщепление воды с образованием этиленового углеводорода:

Реакция дегидратации - это реакция, в результате которой от молекулы органического вещества отщепляется молекула воды
2. Дегидрогалогенирование галогеналканов. Отщепление галогеноводородов проводят при действии спиртовых растворов щелочей на бром- и хлорпроизводные алканов, например:

Реакция дегидрогалогенирования - это реакция, в результате которой от молекулы органического вещества отщепляется молекула галогеноводорода.
Обратите внимание на тот факт, что во всех реакциях элиминирования углеродный скелет молекулы н е и з м е н я е т с я, происходит лишь образование кратной связи между двумя атомами углерода.
Химические свойства алкенов. По химическим свойствам алкены коренным образом отличаются от алканов. Наличие в молекуле двойной углерод-углеродной связи обусловливает характерные свойства олефинов: реакции присоединения, окисления, полимеризации.
Реакции присоединения. π-Связь в молекулах алкенов значительно менее прочная, чем
-связь. Она относительно легко разрывается, за счет освободившихся валентностей атомы углерода способны присоединять различные реагенты: водород, галогены, галогеноводороды, воду.
1. Г и д р и ро в а н и е а л к е н о в. Происходит при повышенных значениях температуры и давления в присутствии металлических катализаторов. Наиболее распространенным катализатором процессов гидрирования (равно как и обратного процесса - дегидрирования) является никель

Присоединение водорода по кратным углерод-углеродным связям называют реакцией гидрирования
2. Г а л о г е н и р о в а н и е а л к е н о в. Алкены легко присоединяют молекулы хлора и брома с разрывом двойной связи и образованием дигалогенопроизводных:

Присоединение галогенов по кратным углерод-углеродным связям называют реакцией галогенирования.
Если газообразный этилен пропускать через раствор брома в воде то желтая окраска бромной воды постепенно исчезает. Обесцвечивание бромной воды является качественной реакцией на непредельные соединения, в том числе на алкены.
3. Г и д р о г а л о г е н и р о в а н и е а л к е н о в. При взаимодействии алкенов с хлороводородом или бромоводородом образуются галогеналканы:

Присоединение галогеноводородов по кратным углерод-углеродным связям называют реакцией гидрогалогенирования.
При присоединении галогеноводородов к гомологам этилена строение образующегося продукта в ряде случаев определяется правилом Марковникова:
При присоединении молекул типа их НХ (Х= ОН, галогены и т.п.) к алкенам водород преимущественно присоединяется к наиболее гидрогенизированиому атому углерода двойной связи
Наиболее гидрогенизированный – это тот атом углерода двойной связи, который содержит большее число атомов водорода. Например, при взаимодействии пропена с бромоводородом образуется 2-бромпропан:

Правило Марковникова отражает распределение электронной плотности в молекулах алкенов. π-Связь в молекулах этиленовых углеводородов очень чувствительна к влиянию заместителей sр 2 -гибридных атомов углерода. Если заместитель при двойной связи обладает электронодонорным эффектом (например, алкильный радикал), т. е. подает на связанный с ним атом электронную пару, то электронная плотность двойной связи в ответ смещается к наиболее гидрогенизированному атому углерода.
Так, алкены с несимметричным расположением двойной связи имеют следующее распределение электронной плотности:

Молекула бромоводорода также полярная, причем атом водорода как менее электроотрицательного, чем бром, элемента обладает частичным положительным зарядом:

По законам электростатического взаимодействия атом водорода присоединяется к более гидрогенизированному атому углерода двойной связи.
4. Г и д р а т а ц и я а л к е н о в. При взаимодействии алкенов с водой в присутствии серной или фосфорной кислот образуются спирты. Кислота в данном случае выполняет роль катализатора. Строение образующегося спирта также определяется правилом Марковникова:

Присоединение воды по кратным углерод-углеродным связям называют реакцией гидратации.
Реакции окисления.
1. Г о р е н и е. Как и любые другие углеводороды, алкены горят с образованием углекислого газа и воды:
За счет большей массовой доли углерода в алкенах по сравнению с алканами пламя этиленовых углеводородов имеет красноватый оттенок, оно более светящееся.
2. О к и с л е н и е п е р м а н г а н а т о м к а л и я. Пропускание газообразного алкена через водный раствор перманганата калия при комнатной температуре приводит к обесцвечиванию раствора:

В результате реакции двойная связь разрывается, и оба атома углерода присоединяют по гидроксильной группе. Соединения такого класса называют гликолями. Эта реакция также является качественной на двойную углерод-углеродную связь.
Реакция полимеризации. При повышенных значениях температуры и давления в присутствии катализаторов двойные связи молекул алкенов разрываются и атомы углерода соединяются друг с другом с образованием длинных цепочек:
Какие углеводороды называют непредельными? Охарактеризуйте класс органических соединений алкены. Относятся ли этиленовые углеводороды к непредельным соединениям?
Какие типы изомерии характерны для алкенов? Приведите примеры изомеров различного типа и назовите эти вещества.
Напишите структурные формулы следующих углеводородов: а) 2-метилбутен-2; б) 2-метилпропен; в) 2,3-диметилгексен-3; г) 2,5,5 -триметилгексен-2; д) цис-4-метилпентен-2.
Какие из них имеют геометрические изомеры? Напишите их структурные формулы и назовите.
10л паров этиленового углеводорода при нормальных условиях имеют массу 18,75г. Определите его формулу и плотность по воздуху.
Напишите реакции получения следующих алкенов: а) бутена-2; б) 3-метилпентена-1; в) 2-метилбутена-2 – дегидратацией и дегидрогалогенированием соответствующих исходных соединений.
Сформулируйте правило Марковникова. Приведите примеры реакций гидрогалогенирования и реакций гидратации, иллюстрирующие это правило.
С помощью каких реакций можно отличить алкены от алканов? Напишите уравнения этих реакций для пропена.
Какова структурная формула этиленового углеводорода, если 11,2г его при взаимодействии с избытком HBr превращаются в 27,4г бромалкана с положением галогена у третичного атома углерода?
Сколько граммов 1,2-дихлорэтана можно получить взаимодействием этилена с хлором, полученным при действии 200г хлороводородной кислоты с массовой долей НСl 36,5% на избыток оксида марганца(IV)?
Габриелян О,С. Химия: учеб для студ. Сред. Проф. Учеб. Заведений/ О.С. Габриелян, И.Г. Остроумов. – 6-е изд., стер. – М.: Издательский центр «Академия, 2009. – 336с.
Габриелян О,С. Химия для профессий и специальностей технического профиля: учебник/ О.С. Габриелян, И.Г. Остроумов. – М.: Издательский центр «Академия, 2009. – 256с
Читайте также:

