Какое правило должно соблюдаться при разбавлении серной кислоты кратко
Обновлено: 04.07.2024
Данная реакция является экзотермической ,значит выделяется тепло💥
Но какая же разница :лить воду в кислоту или кислоту в воду,если в обоих случаях раствор нагреется?
❄Дело в том,что плотность серной кислоты 1,84 г/см³, а плотность воды 1г/см³.Значит серная кислота тяжелее,чем вода.
Произойдет быстрое вскипание на поверхности раствора, брызги могут попасть на человека и причинить вред его здоровью 💔
❄При приливании кислоты в воду,она опускается на дно,так как тяжелее, и распределяется по всему объёму раствора ,брызгов не возникает
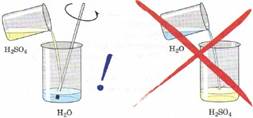
Правило разбавления серной кислоты : следует влипать при перемешивании кислоту в воду, а не наоборот. Сервал кислота очень гигроскопична и поэтому пригодна для осушки многих газов ( но не аммиака. [17]
Теплота разбавления серной кислоты Qp выражается в кДж / кг 100 % - ной H2SO4 и может быть вычислена несколькими способами. [18]
При разбавлении серной кислоты необходимо приливать кислоту к воде, а не наоборот. Смешивание кислоты с водой сопровождается сильным разогреванием, поэтому при добавлении воды в кислоту происходит разбрызгивание кислоты, что очень опасно. Если кислота попала на кожу или одежду, необходимо смыть ее большим количеством воды, а затем нейтрализовать раствором щелочи. [19]
При разбавлении серной кислоты водой выделяется большое количество тепла. Вода, не успевая смешаться с кислотой, закипает. Образующиеся при этом брызги могут причинить ожоги. Поэтому при разбавлении необходимо постепенно приливать кислоту в воду при непрерывном размешивании. Взаимодействие серной кислоты со многими химическими веществами сопровождается Выделением большого количества тепла и газов, что может привести к разбрызгиванию и даже выбросу реакционной массы. [20]
При разбавлении серной кислоты ее следует медленно приливать в воду. Приливание воды в кислоту категорически запрещается. Эту операцию следует проводить в фарфоровых стаканах, так как она сопровождается сильным разогреванием. [21]
При разбавлении серной кислоты необходимо медленно приливать кислоту в воду. [22]
При разбавлении серной кислоты водой выделяется большое количество тепла. Вода, не успевая смешаться с кислотой, закипает. Образующиеся при этом брызги могут причинять ожоги. Поэтому при разбавлении необходимо постепенно приливать кислоту в воду при непрерывном размешивании. Взаимодействие серной кислоты со многими химическими веществами сопровождается выделением большого количества тепла и газов, что может привести к разбрызгиванию и даже выбросу реакционной массы. [23]
При разбавлении серной кислоты водой следует во избежание вскипания раствора и выброса брызг подливать серную кислоту в воду тонкой струей ( при помешивании), а не добавлять воду в кислоту. [24]
При разбавлении серной кислоты водой концентрация иона NC2 уменьшается, и вместе с этим резко падает скорость нитрования. Однако очень реакциоиноспособные арены нитруются даже в таких условиях, когда обнаружить ион NC2 в растворе какими-либо физическими методами уже невозможно. Имеются доказательства, что даже в отсутствие серной кислоты нитрование осуществляется ионом нитрония. Например, изотопный обмен HNOs с ЩО имеет точно такую же скорость, как и нитрование реакциоиноспособных аренов. [25]
При разбавлении серной кислоты водой необходимо соблюдать большую осторожность и вливать при тщательном перемешивании кислоту тонкой струей в воду, а не наоборот. [26]
При разбавлении серной кислоты необходимо приливать кислоту тонкой струйкой в холодную воду и при этом хорошо размешивать. [27]
При разбавлении серной кислоты водой - - кислоту вливают в воду тонкой струей, непрерывно перемешивая. [28]
При разбавлении серной кислоты всегда следует приливать кислоту к воде тонкой струей, перемешивая при этом жидкость. При обратном порядке сливания происходит сильное местное разогревание жидкости и разбрызгивание кислоты, которая может ожечь лицо и руки, а также испортить одежду. [29]
При разбавлении серной кислоты ее следует медленно приливать в воду. Приливание воды в кислоту категорически запрещается. Эту операцию следует проводить в фарфоровых стаканах, так как она сопровождается сильным разогреванием. [30]
ни в коем случае при разбавлении нельзя добавлять воду в кислоту. Существует строгое правило: лить кислоту в воду! Нарушение этого правила может привести к несчастному случаю. Дело в том, что при приготовлении растворов часто происходит их разогрев. При приготовлении растворов серной кислоты происходит сильный разогрев. В нашем опыте при добавлении небольшого количества концентрированной серной кислоты температура поднимается до 90 градусов! Представьте, что будет, если добавить воду в кислоту. Вода, попав в массу концентрированной кислоты, моментально разогреется до кипения - произойдет выброс кислоты. Особенно опасна кислота для глаз и слизистых оболочек. Поэтому правила техники безопасности при приготовлении растворов – правила сохранения жизни и здоровья. На производстве при составлении растворов мастера надевают резиновые сапоги и перчатки, резиновые фартуки и защитные очки. И всегда кислоту льют в воду, а не наоборот.
Кислоты – это сложные вещества, состоящие из атомов водорода и кислотного остатка.
| HF | Фтороводородная кислота (плавиковая) |
| HCl | Хлороводородная кислота (соляная) |
| HBr | Бромоводородная кислота |
| HI | Йодоводородная кислота |
| H2S | Сероводородная кислота |
| H2SO3 | Сернистая кислота |
| H2SO4 | Серная кислота |
| HNO3 | Азотная кислота |
| HNO2 | Азотистая кислота |
| H3PO4 | Фосфорная (ортофосфорная) кислота |
| H2CO3 | Угольная кислота |
| H2SiO3 | Кремниевая кислота |
Все кислоты обязательно содержат водород, который записывается в формуле на первом месте. Вся остальная часть формулы называется кислотным остатком.
Например, у НСl кислотным остатком является Сl - , а у Н3РО4 кислоьный остаток РО4 3- .
Классификация кислот.
1) По содержанию кислорода:
Кислоты
По количеству водорода
Кислоты
По растворимости в воде
Кислоты
По стабильности
Кислоты
Физические свойства кислот.
1. Агрегатное состояние: жидкие или твердые (H3PO4, H2SiO3).
2. Кислые на вкус.
H 2 SO 4 - серная кислота - бесцветная жидкость, вязкая, как масло, не имеющая запаха, почти вдвое тяжелее воды. Серная кислота поглощает влагу из вождуха и других газов. Это свойство серной кислоты используют для осушения некоторых газов.
При смешивании серной кислоты с водой выделяется большое количество количество теплоты. Если воду вливать в серную кислоту, то вода, не успев смешаться с кислотой, может закипеть и выбросить брызги серной кислоты на лицо и руки работающего.
Правило разбавления серной кислоты:
При растворении серной кислоты нужно вливать ее тонкой струей в воду и перемешивать.
Серная кислота обугливает древесину, кожу, ткани. Если в пробирку с H2SO4 опустить лучинку, то происходит химическая реакция - лучинка обугливается.
Угольная и сернистая кислоты - H 2 CO 3 и H 2 SO 3 - в свободном виде не существуют, т.к. они легко разлагаются на воду и соответствующий оксид:
Действие их на индикаторы.
Индикаторы - вещества, изменяющие окраску в зависимости от среды – кислотной или щелочной (лакмус, метилоранж, фенолфталеин).
| Лакмус | Метилоранж | Фенолфталеин |
| красный | красно-розовый | бесцветный |
Кремниевую кислоту распознать с помощью индикаторов распознать нельзя, т.к. она нерастворима в воде.
Диссоциация кислот.
Химические свойства.
Химические свойства кислот.
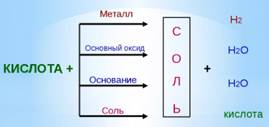
Кислоты взаимодействуют с металлами, оксидами металлов, основаниями и солями. Во всех случаях основным продуктом реакции будет соль.
Кислоты и их свойства.
Кислоты – это сложные вещества, состоящие из атомов водорода и кислотного остатка.
| HF | Фтороводородная кислота (плавиковая) |
| HCl | Хлороводородная кислота (соляная) |
| HBr | Бромоводородная кислота |
| HI | Йодоводородная кислота |
| H2S | Сероводородная кислота |
| H2SO3 | Сернистая кислота |
| H2SO4 | Серная кислота |
| HNO3 | Азотная кислота |
| HNO2 | Азотистая кислота |
| H3PO4 | Фосфорная (ортофосфорная) кислота |
| H2CO3 | Угольная кислота |
| H2SiO3 | Кремниевая кислота |
Все кислоты обязательно содержат водород, который записывается в формуле на первом месте. Вся остальная часть формулы называется кислотным остатком.
Например, у НСl кислотным остатком является Сl - , а у Н3РО4 кислоьный остаток РО4 3- .
Классификация кислот.
1) По содержанию кислорода:
Кислоты
По количеству водорода
Кислоты
По растворимости в воде
Кислоты
По стабильности
Кислоты
Физические свойства кислот.
1. Агрегатное состояние: жидкие или твердые (H3PO4, H2SiO3).
2. Кислые на вкус.
H 2 SO 4 - серная кислота - бесцветная жидкость, вязкая, как масло, не имеющая запаха, почти вдвое тяжелее воды. Серная кислота поглощает влагу из вождуха и других газов. Это свойство серной кислоты используют для осушения некоторых газов.
При смешивании серной кислоты с водой выделяется большое количество количество теплоты. Если воду вливать в серную кислоту, то вода, не успев смешаться с кислотой, может закипеть и выбросить брызги серной кислоты на лицо и руки работающего.
Правило разбавления серной кислоты:
При растворении серной кислоты нужно вливать ее тонкой струей в воду и перемешивать.

Серная кислота обугливает древесину, кожу, ткани. Если в пробирку с H2SO4 опустить лучинку, то происходит химическая реакция - лучинка обугливается.
Угольная и сернистая кислоты - H 2 CO 3 и H 2 SO 3 - в свободном виде не существуют, т.к. они легко разлагаются на воду и соответствующий оксид:
Действие их на индикаторы.
Индикаторы - вещества, изменяющие окраску в зависимости от среды – кислотной или щелочной (лакмус, метилоранж, фенолфталеин).
| Лакмус | Метилоранж | Фенолфталеин |
| красный | красно-розовый | бесцветный |
Кислоты и их свойства.
Кислоты – это сложные вещества, состоящие из атомов водорода и кислотного остатка.
| HF | Фтороводородная кислота (плавиковая) |
| HCl | Хлороводородная кислота (соляная) |
| HBr | Бромоводородная кислота |
| HI | Йодоводородная кислота |
| H2S | Сероводородная кислота |
| H2SO3 | Сернистая кислота |
| H2SO4 | Серная кислота |
| HNO3 | Азотная кислота |
| HNO2 | Азотистая кислота |
| H3PO4 | Фосфорная (ортофосфорная) кислота |
| H2CO3 | Угольная кислота |
| H2SiO3 | Кремниевая кислота |
Все кислоты обязательно содержат водород, который записывается в формуле на первом месте. Вся остальная часть формулы называется кислотным остатком.
Например, у НСl кислотным остатком является Сl - , а у Н3РО4 кислоьный остаток РО4 3- .
Классификация кислот.
1) По содержанию кислорода:
Кислоты
По количеству водорода
Кислоты
По растворимости в воде
Кислоты
По стабильности
Кислоты
Физические свойства кислот.
1. Агрегатное состояние: жидкие или твердые (H3PO4, H2SiO3).
2. Кислые на вкус.
H 2 SO 4 - серная кислота - бесцветная жидкость, вязкая, как масло, не имеющая запаха, почти вдвое тяжелее воды. Серная кислота поглощает влагу из вождуха и других газов. Это свойство серной кислоты используют для осушения некоторых газов.
При смешивании серной кислоты с водой выделяется большое количество количество теплоты. Если воду вливать в серную кислоту, то вода, не успев смешаться с кислотой, может закипеть и выбросить брызги серной кислоты на лицо и руки работающего.
Правило разбавления серной кислоты:
При растворении серной кислоты нужно вливать ее тонкой струей в воду и перемешивать.

Серная кислота обугливает древесину, кожу, ткани. Если в пробирку с H2SO4 опустить лучинку, то происходит химическая реакция - лучинка обугливается.
Угольная и сернистая кислоты - H 2 CO 3 и H 2 SO 3 - в свободном виде не существуют, т.к. они легко разлагаются на воду и соответствующий оксид:
Действие их на индикаторы.
Индикаторы - вещества, изменяющие окраску в зависимости от среды – кислотной или щелочной (лакмус, метилоранж, фенолфталеин).
| Лакмус | Метилоранж | Фенолфталеин |
| красный | красно-розовый | бесцветный |
Кремниевую кислоту распознать с помощью индикаторов распознать нельзя, т.к. она нерастворима в воде.
Диссоциация кислот.
Химические свойства.
Химические свойства кислот.
Кислоты взаимодействуют с металлами, оксидами металлов, основаниями и солями. Во всех случаях основным продуктом реакции будет соль.

Кислоты и их свойства.
Кислоты – это сложные вещества, состоящие из атомов водорода и кислотного остатка.
| HF | Фтороводородная кислота (плавиковая) |
| HCl | Хлороводородная кислота (соляная) |
| HBr | Бромоводородная кислота |
| HI | Йодоводородная кислота |
| H2S | Сероводородная кислота |
| H2SO3 | Сернистая кислота |
| H2SO4 | Серная кислота |
| HNO3 | Азотная кислота |
| HNO2 | Азотистая кислота |
| H3PO4 | Фосфорная (ортофосфорная) кислота |
| H2CO3 | Угольная кислота |
| H2SiO3 | Кремниевая кислота |
Все кислоты обязательно содержат водород, который записывается в формуле на первом месте. Вся остальная часть формулы называется кислотным остатком.
Например, у НСl кислотным остатком является Сl - , а у Н3РО4 кислоьный остаток РО4 3- .
Классификация кислот.
1) По содержанию кислорода:
Кислоты
По количеству водорода
Кислоты
По растворимости в воде
Кислоты
По стабильности
Кислоты
Физические свойства кислот.
1. Агрегатное состояние: жидкие или твердые (H3PO4, H2SiO3).
2. Кислые на вкус.
H 2 SO 4 - серная кислота - бесцветная жидкость, вязкая, как масло, не имеющая запаха, почти вдвое тяжелее воды. Серная кислота поглощает влагу из вождуха и других газов. Это свойство серной кислоты используют для осушения некоторых газов.
При смешивании серной кислоты с водой выделяется большое количество количество теплоты. Если воду вливать в серную кислоту, то вода, не успев смешаться с кислотой, может закипеть и выбросить брызги серной кислоты на лицо и руки работающего.
Правило разбавления серной кислоты:
При растворении серной кислоты нужно вливать ее тонкой струей в воду и перемешивать.

Серная кислота обугливает древесину, кожу, ткани. Если в пробирку с H2SO4 опустить лучинку, то происходит химическая реакция - лучинка обугливается.
Угольная и сернистая кислоты - H 2 CO 3 и H 2 SO 3 - в свободном виде не существуют, т.к. они легко разлагаются на воду и соответствующий оксид:
Действие их на индикаторы.
Индикаторы - вещества, изменяющие окраску в зависимости от среды – кислотной или щелочной (лакмус, метилоранж, фенолфталеин).
| Лакмус | Метилоранж | Фенолфталеин |
| красный | красно-розовый | бесцветный |
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.


Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
Читайте также:
- Какие вопросы общественного развития стали главными в годы великой российской революции кратко
- Понятие педагогических технологий их обусловленность характером педагогических задач кратко
- В чем лермонтов находит сходство своей судьбы своего изгнания с судьбой тучек ответ кратко
- Роль учителя в организации проектной деятельности обучающихся старшей школы
- Приоритетное направление деятельности в инициативе наша новая школа

