Сообщение про опыт резерфорда
Обновлено: 02.07.2024
Первая попытка создания модели атома была предпринята Дж. Томпсоном. Он полагал, что атом – это электронейтральная система формы шара с радиусом 10 - 10 м . На рисунке 6 . 1 . 1 . показано, как одинаково распределяется положительный заряд атома, причем отрицательные электроны располагаются внутри него. Чтобы получить объяснение линейчатых спектров атомов, Томпсон тщетно пытался определить расположение электронов в атоме, для расчета частоты их колебаний в положении равновесия. Спустя время Э. Резерфорд доказал, что заданная Томсоном модель была неверна.
Рисунок 6 . 1 . 1 . Модель Дж. Томпсона.
Электроны в атоме. Опыты Резерфорда и Томпсона
Внутренняя структура атомов была исследована Э. Резарфордом, Э. Марсденом, Х. Гейгером еще в 1909 - 1911 годах. Было применено зондирование атома α -частицами, возникающими во время радиоактивного распада радия и других элементов. Их масса в 7300 раз больше массы электрона, а положительный заряд равняется удвоенному элементарному заряду.
В опытах Резерфорда были использованы α -частицы, имеющие кинетическую энергию 5 М э в .
Альфа-частицы – это ионизированные атомы гелия.
Рисунок 6 . 1 . 2 . Схема опыта Резерфорда по рассеянию α -частиц. K – свинцовый контейнер с радиоактивным веществом, Э – экран, покрытый сернистым цинком, Ф – золотая фольга, M – микроскоп.
Радиоактивный источник, заключенный в свинцовый контейнер, располагается таким образом, что
α -частицы направляются от него к тонкой металлической фольге. Рассеянные частицы попадают на экран со слоем кристаллов сульфида цинка, светящиеся от их ударов. Сцинтилляции (вспышки) можно наблюдать при помощи микроскопа. Угол φ к первоначальному направлению пучка не имеет ограничений для данного опыта.
После испытаний было выявлено, что α -частицы, проходящие через тонкий слой металла, не испытывали отклонений. Наблюдались их отклонения и на углы, превышающие 30 градусов и близкие к 180 .
Модели атомов Томпсона и Резерфорда
Результат Резерфорда противоречил модели Томпсона, так как положительный заряд не был распределен по всему объему атома. Согласно модели Томпсона, заряд не имеет возможности создавать сильное электрическое поле, которое впоследствии отбросит α -частицы. Такое поле однородно заряженного шара максимально на его поверхности и убывает до нуля к центру.
При уменьшении радиуса шара с положительным зарядом атома максимальная сила отталкивания, действующая на α -частицы, по закону Кулона увеличилась бы в n 2 раз.
Если размеры α -частиц достаточно большие, тогда рассеивание может достичь угла в 180 градусов.
Резерфорд пришел к выводу, что пустота атома связана с наличием положительного заряда, сосредоточенного в малом объеме. Данная часть была названа атомным ядром.
Далее возникла ядерная модель атома, показанная на рисунке 6 . 1 . 3 .
Рисунок 6 . 1 . 3 . Рассеяние α -частицы в атоме Томсона ( a ) и в атоме Резерфорда ( b ) .
Резерфорд выяснил, что центр атома имеет положительно заряженное ядро с диаметром 10 - 14 - 10 - 15 м . Оно занимает 10 - 12 полного объема атома, но содержит весь положительный заряд и около 99 , 95 % его массы. Вещество, входящее в состав атома, предполагало наличие плотности p ≈ 10 15 г / с м 3 , а заряд ядра равнялся суммарному заряду электронов. Было установлено, что при взятии за 1 значение заряда электрона, заряд ядра равнялся числу из таблицы Менделеева.
Планетарная модель
Опыты Резерфорда приводили к радикальным выводам и сомнениям ученых. Используя классическое представление о движении микрочастиц, он предлагает планетарную модель атома. Ее смысл заключался в том, что центр атома состоит из положительно заряженного ядра, которое является основной частью массы элементарной частицы. Атом считается нейтральным. При наличии кулоновских сил вокруг ядра по орбиталям вращаются электроны, как показано на рисунке 6 . 1 . 4 . Электроны всегда находятся в состоянии движения.
Рисунок 6 . 1 . 4 . Планетарная модель атома Резерфорда. Показаны круговые орбиты четырех электронов.
Предложенная Резерфордом планетарная модель была толчком в развитии знаний о строении атома. Благодаря ей, опыты по рассеиванию α -частиц смогли объяснить. Но вопрос об его устойчивости остался открытым. Исходя из закона классической электродинамики, заряд, движущийся с ускорением, излучает электромагнитные волны, забирающие и распределяющие энергию. За время 10 - 8 с все электроны потратить всю энергию, вследствие чего упасть на ядро. Так как это не происходит, есть объяснение – внутренние процессы не выполняются согласно классическим законам.

Важнейшим опытом, демонстрирующим сложное строение атома, стал опыт физика Э. Резерфорда. Рассмотрим суть этого опыта.
Опыт Резерфорда
Модель атома Томсона хорошо описывала явление испускания катодных лучей. Однако, она ничего не говорила о распределении заряда по атому. Для его изучения Э. Резерфорд предложил поставить специальный опыт.
Кратко об опыте Резерфорда можно сказать следующее.
Многие радиоактивные вещества испускают α-частицы, масса которых гораздо больше, чем масса электронов, а заряд равен удвоенному заряду электрона. Теперь, если облучать вещество α-частицами, то легкие электроны, входящие в состав атома, не смогут изменить направление их движения. Рассеяние α-частиц возможно лишь на положительно заряженной части атома.
Экспериментальная установка состояла из контейнера с радием, испускающим α-частицы, на пути частиц ставилась тонкая металлическая фольга, а за фольгой устанавливался экран, покрытый сульфидом цинка, на котором при попадании α-частиц возникало свечение (сцинтилляция). Схема опыта представлена на следующем рисунке:

Рис. 1. Схема опыта Резерфорда по рассеянию альфа частиц.
Без фольги, в точке облучения возникало сцинтилляционное пятно. Если на пути полета α-частиц поместить фольгу – размер пятна увеличится за счет рассеяния частиц из-за взаимодействия с положительными зарядами. По характеру изменения пятна можно судить о распределении положительного заряда в атомах вещества.
Результаты опыта
Если положительный заряд равномерно распределен по веществу, рассеяния α-частиц не будет. В соответствии с моделью атома Томсона, положительные заряды имеют некоторую пространственную неоднородность, а значит, рассеяние появится.
Рассеяние, действительно, появилось, но при этом имело довольно интересное распределение – некоторая часть частиц отклонялась на довольно заметные углы, иногда на большие, чем была рассчитана установка.
Это уже говорило о большой неравномерности распределения положительного заряда. Установка была модифицирована, экраны стали устанавливаться вокруг нее.

Рис. 2. Изменение траекторий альфа частиц при отскоке от ядер.
В левой части этой формулы – потенциальная энергия взаимодействия, а в правой – кинетическая энергия частицы.
Если предположить, что положительный заряд имеет радиус порядка $10^$м, то заряд $q$ должен почти в сто тысяч раз превышать заряд электрона. Поскольку атом нейтрален, то можно предположить, что число электронов в сто тысяч раз больше, чем число атомов. Однако, такое число электронов имеют значительную массу, которая не регистрируется в опыте.
Следовательно, положительный заряд сосредоточен в очень небольшой части атома, которая была названа ядром. Расчеты показали, что размер ядра атома имеет величину порядка $10^-10^$м. Электроны же движутся вокруг ядра на большом расстоянии. Была построена планетарная модель атома:
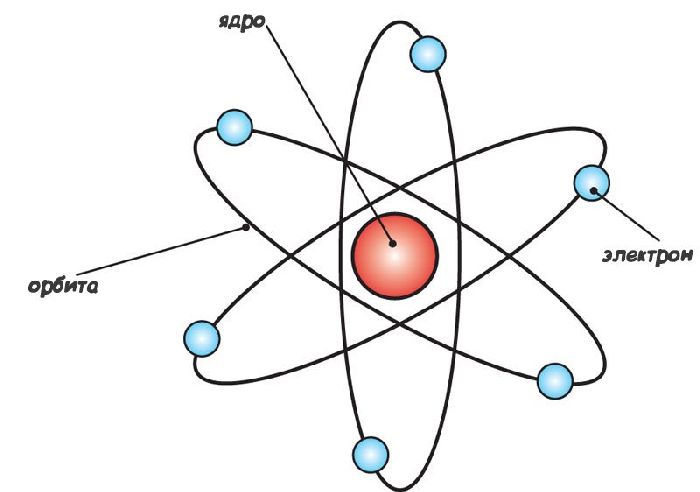
Рис. 3. Планетарная модель атома.
Опыт Резерфорда также позволяет оценить и заряд ядра. Он оказался разным для разных материалов, и если принять за единицу заряд электрона, то заряд ядра оказался равным порядковому номеру элемента в таблице Менделеева.
Если атом увеличить до размеров орбиты Земли, размер ядра окажется в сто раз меньше, чем размер Солнца.
Что мы узнали?
В опыте Э.Резерфорда по рассеянию альфа частиц поток частиц направлялся на тонкую фольгу, после которой на экране можно было видеть картину рассеяния. Оказалось, что некоторые частицы отклоняются на очень большие углы. Это говорило о том, что положительно заряженный заряд внутри атома сосредоточен в очень малой части атома, которая была названа ядром.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Ученица 11 класса
Ядерная модель атома. 9
В нашем веке физику все стали рассматривать каждый по – своему. Ведь, если подумать, то отличие современного общества от того что было ранее, напрямую зависит от физических открытий. Например, исследования электромагнетизма. Подобные прорывы в науке привели к возникновению телефона. Так, если завести речь об автомобиле, то он возник благодаря термодинамике. Компьютер возник вследствие развития электроники.
Подобные процессы не стоят на месте, а лишь усовершенствуются. Новые открытия способствуют улучшению промышленности и техники. Следует задуматься о новых загадках природы, которые требуют объяснения. В этом поможет – физика.
Конечно, не смотря на то, что наука зашла слишком далеко, невозможно объяснить с первого раза все явления природы. Основы физических исследований и методов разрабатываются тщательно, исходя из накопленных знаний.
Аристотель Существует: экспериментальная и теоретическая физика. Если рассмотреть экспериментальную, то теории и законы опираются только на данные после исследований.
Области физики многогранны и тем самым интересны. При классической механике верным будет решение, если атомы меньше чем размеры исследуемых объектов. Важно, чтобы гравитационные силы были малы и чтобы скорость объектов была меньше скорости света.

Эрнест Резерфорд родился 30 августа 1871 г. в деревне Спринг Гроув близ г. Нельсона, Новая Зеландия, в семье фермера Джеймса Резерфорда и его жены Марты Томсон .
В детстве Эрнест ходит в школу г. Хэвлок, по окончании которой продолжает учёбу в колледже в г. Нельсоне. Он усердно трудится, чтобы поступить в Кентерберийский колледж, бывший подразделением Университета Новой Зеландии.
Там он получает высшее образование, защищая звания бакалавра и магистра в области гуманитарных наук, а также бакалавра естественных наук, после чего, на протяжении двух лет, увлечённо занимается исследованиями в области электротехники. В 1895 г. он отправляется в Англию для повышения уровня образования, где с 1895 г. по 1898 г. трудится в Кавендишской лаборатории при Кембриджском университете.
В 1898 г. Резерфорд переходит на должности профессора физики в Университете МакГилла и в 1908 г. Получает Нобелевскую премию в области химии.
В 1899 г., он вводит понятия альфа- и бета-частиц.
В 1900 г. в Университете Новой Зеландии он получает степень доктора наук..
Резерфорд открывает и точно описывает, что радиация является следствием спонтанного разложения атомов.
В 1907 г. Резерфорд, вместе с Томасом Ройдсом, проводит химический опыт, заключающийся в прохождении альфа-лучей через узкое окно в вакуумную трубку.

В 1909 г. объединяет усилия с Гансом Гейгером и Эрнестом Марсденом и проводит опыт Гейгера-Марсдена, нацеленный на обнаружение и наглядную демонстрацию истинной ядерной природы атомов. Истолкование и результаты этого эксперимента в 1911 г. выливаются в представление модели атома Резерфорда. Согласно его теории, даже маленькое положительно заряженное ядро имеет вращающиеся вокруг него электроны. В 1919 г. Резерфорд отправляется в Кавендишскую лабораторию, где проводит (первым в истории) опыт по трансмутации одного вещества в другое, превратив с помощью ядерной реакции азот в кислород.
В 1932 г. эту теорию существования нейтронов доказывает Джеймс Чедвик, получивший в 1935 г. Нобелевскую премию в области физики за это открытие.
В 1900 г. Резерфорд женится на Марии Георгине Ньютон. У них рождается дочь, Эйлин Мария.

ЯДЕРНАЯ МОДЕЛЬ АТОМА
Как же всё-таки устроен атом? На этот вопрос Резерфорд дал ответ после своего эксперимента, проведенного в 1909 г. совместно с немецким физиком Гансом Гейгером и новозеландским физиком Эрнстом Марсденом.
Целью опыта было исследование атома с помощью альфа-частиц, сфокусированный пучок которых, летящий с огромной скоростью, направлялся на тончайшую золотую фольгу. За фольгой располагался люминесцентный экран. При столкновении с ним частиц возникали вспышки, которые можно было наблюдать в микроскоп.
Если Томсон прав, и атом состоит из облака с электронами, то частицы должны были легко пролетать через фольгу, не отклоняясь. Так как масса альфа-частицы превышала массу электрона примерно в 8000 раз, то электрон не мог воздействовать на неё и отклонять её траекторию на большой угол, подобно тому, как камешек весом в 10 г не смог бы изменить траекторию движущегося автомобиля.
Но на практике всё оказалось по-другому. Большинство частиц действительно пролетало через фольгу, практически не отклоняясь или отклоняясь на небольшой угол. Но часть частиц отклонялась довольно значительно или даже отскакивала назад, словно на их пути возникало какое-то препятствие. Как сказал сам Резерфорд, это было так же невероятно, как если бы 15-дюймовый снаряд отскочил от куска папиросной бумаги.
Что же заставило некоторые альфа-частицы так сильно изменить направление движения? Учёный предположил, что причиной этому стала часть атома, сосредоточенная в очень малом объёме и имеющая положительный заряд. Её он назвал ядром атома.
Из-за своей схожести с Солнечной системой модель Резерфорда была названа планетарной.

Хотя описанная Резерфордом модель не смогла объяснить устойчивость атома, она позволила значительно продвинуться вперёд в изучении его строения.

РАДИОАКТИВНЫЙ РАСПАД

Радиоактивный препарат, например радий, помещался внутри свинцового цилиндра 1, вдоль которого был высверлен узкий канал. Пучок -частиц из канала падал на тонкую фольгу 2 из исследуемого материала (золото, медь и пр.). После рассеяния α-частицы попадали на полупрозрачный экран 3, покрытый сульфидом цинка. Столкновение каждой частицы с экраном сопровождалось вспышкой света (сцинтилляцией), которую можно было наблюдать в микроскоп 4. Весь прибор размещался в сосуде, из которого был откачан воздух. При хорошем вакууме внутри прибора в отсутствие фольги на экране возникал светлый кружок, состоящий из сцинтилляций, вызванных тонким пучком α-частиц. Но когда на пути пучка помещали фольгу, α-частицы из-за рассеяния распределялись на экране по кружку большей площади. Модифицируя экспериментальную установку, Резерфорд попытался обнаружить отклонение α-частиц на большие углы. Для этого он окружил фольгу сцинтилляциоными экранами и определил число вспышек на каждом экране. Совершенно неожиданно оказалось, что небольшое число α-частиц (примерно одна из двух тысяч) отклонилось на углы, большие 90°. Позднее Резерфорд признался, что, предложив своим ученикам провести эксперимент по наблюдению за рассеянием α-частиц на большие углы, он сам не верил в положительный результат. В самом деле, предвидеть этот результат на основе модели Томсона было нельзя. При распределении по всему атому положительный заряд не может создать достаточно сильное электрическое поле, способное отбросить α-частицу назад. Максимальная сила отталкивания может быть определена по закону Кулона: где qα — заряд α-частицы; q - положительный заряд атома; R — его радиус; k — коэффициент пропорциональности. Напряженность электрического поля равномерно заряженного шара максимальна на поверхности шара и убывает до нуля по мере приближения к центру. Поэтому чем меньше радиус R, тем больше сила, отталкивающая α-частицы. Определение размеров атомного ядра Резерфорд понял, что α-частица могла быть отброшена назад лишь в том случае, если положительный заряд атома и его масса сконцентрированы в очень малой области пространства. Так Резерфорд пришел к мысли о существовании атомного ядра — тела малых размеров, в котором сконцентрированы почти вся масса и весь положительный заряд атома. На рисунке показаны траектории α-частиц, пролетающих на различных расстояниях от ядра. Подсчитывая число α-частиц, рассеянных на различные углы, Резерфорд смог оценить размеры ядра. Оказалось, что ядро имеет диаметр порядка 10—10 см (у разных ядер диаметры различны). Размер же самого атома 10 см, т. е. в 10—100 тысяч раз превышает размеры ядра. Впоследствии удалось определить и заряд ядра. При условии, что заряд электрона принят за единицу, заряд ядра в точности равен номеру данного химического элемента в периодической системе Д. И. Менделеева.
Открытие электрона, рентгеновского излучения и явления радиоактивности свидетельствовало о том, что представление об атоме как неделимой частице являлось неверным. К концу \(XIX\) века стало понятно, что атом должен иметь сложное строение. Большой вклад в изучение строения атома внёс физик-экспериментатор Эрнест Резерфорд .

В \(1904\) году Резерфорд начал свои эксперименты по бомбардировке альфа-частицами тонких металлических пластин (золотых и платиновых) для изучения структуры атомов, из которых состоят пластины.
Альфа-частица — это массивная (масса альфа-частицы в несколько тысяч раз больше, чем масса электрона) положительно заряженная частица. Заряд альфа-частицы в два раза больше элементарного заряда.
В толстостенном свинцовом футляре (\(1\)) находится радиоактивное вещество (\(2\)), излучающее поток альфа-частиц. Через небольшое отверстие (\(3\)) поток альфа-частиц направляется на тонкую золотую фольгу (\(4\)) (толщиной порядка \(0,1\) мк). За фольгой располагается экран, покрытый сернистым цинком (\(5\)). При столкновении альфа-частицы на экране наблюдается вспышка.
Согласно модели строения атома по Томсону, альфа-частицы должны столкнуться с большими плотными атомами и разлететься под разными углами. Однако опыт показал, что большинство альфа-частиц пролетают беспрепятственно через пластинку металла (\(6\)). И только небольшая часть всех альфа-частиц изменяет направление движения, отклоняясь на небольшие углы (\(7\)). А некоторые частицы и вовсе отлетают от фольги в обратном направлении (\(8\)).
Результаты опыта были удивительными. Только в \(1911\) году Резерфорд смог объяснить результаты опытов, предложив новую модель строения атома.

Согласно модели Резерфорда, атом состоит из очень маленького положительно заряженного ядра, размер которого в тысячи раз меньше самого атома, и электронов, которые вращаются вокруг ядра по круговым орбитам.
Читайте также:

