Реферат на тему ингаляционные анестетики
Обновлено: 06.07.2024
Эфир, являвшийся более 100 лет одним из основных общих анестетиков, в последнее время был вытеснен из практики и в настоящее время применяется ограниченно. Это вызвано появлением новых средств и разработкой более совершенных методов анестезии.
Наиболее существенными недостатками эфира являются взрывоопасность его паров в смеси с О2, раздражающее действие на слизистую дыхательных путей, медленное развитие анестетического эффекта и сравнительно медленный выход из наркотического состояния.
У эфира есть и положительные качества, заслуживающие внимания. Он имеет большую терапевтическую широту, в применяемых концентрациях стимулирует сердечно-сосудистую систему, не угнетает дыхание, к анестезии эфиром нет противопоказаний. К тому же эфир - один из самых дешевых общих анестетиков, и методика анестезии проста, поэтому эфир до сих пор применим для общей анестезии, особенно в военно-полевых условиях.
Методика. Перед началом анестезии наркозный аппарат несколько раз продувают кислородом, заполняют эфирницу из проверенного, только что открытого флакона. На лицо больного накладывают маску, закрепляют ее специальными лямками и дают возможность подышать кислородом и привыкнуть к дыханию через маску. Скорость подачи кислорода должна быть не менее 1 л/мин. Концентрацию эфира во вдыхаемой смеси изменяют постепенно, начиная с 1 об.% и увеличивая до 10-12 об.%, до начала хирургической стадии. Наркотический сон наступает в течение 12-20 мин. Для поддержания анестезии необходимой глубины дозу эфира постепенно снижают до 2-4 об.% в зависимости от клинических и ЭЭГ-признаков. По окончании операции эфир постепенно отключают и переводят больного на дыхание воздухом, обогащенным кислородом.
Клиническая картина эфирной анестезии полностью соответствует классификации Гведела.
II стадия (возбуждения) начинается сразу же после потери сознания и длится 1-7 мин. Концентрация эфира в крови составляет 0,30—0,80 г/л. Для этой стадии характерны двигательное и речевое возбуждение, учащение пульса, дыхания, гиперемия кожных покровов, гиперсаливация, повышение АД, кашлевого, рвотного, глоточного и патологических рефлексов, тонуса мускулатуры (особенно жевательных мышц), расширение зрачков с сохраненной реакцией на свет. В этой стадии необходимо усилить подачу эфира.
III стадия (хирургического сна) наступает через 12-20 мин после начала анестезии при концентрации эфира во вдыхаемой смеси 4-10 об.%, в крови - 0,9-1,2 г/л. На фоне глубокого сна отмечаются потеря всех видов чувствительности, расслабление мышц, угнетение рефлексов, урежение пульса, углубление дыхания, некоторое снижение АД.
III1 - характеризуется тем, что глазные яблоки совершают медленные кругообразные движения при сохранении роговичного рефлекса и сужении зрачков счеткой реакцией их на свет.
III2 - глазные яблоки фиксированы, роговичный рефлекс исчезает, зрачки сужены или нормальной величины, с умеренной реакцией на свет.
III3 - вследствие токсического влияния эфира возникает паралич гладкой мускулатуры радужной оболочки и зрачок расширяется с ослаблением реакции на свет, появляется сухость роговицы. Наблюдаются резкая бледность кожных покровов, признаки угнетениядыхания и ослабления сердечной деятельности (следует снизить подачу эфира,так как имеет место передозировка!).
III4 - отмечается резкое расширение зрачков, отсутствует их реакция на свет, роговица тусклая. Наблюдается полный паралич дыхательных межреберных и других мышц. Движения диафрагмы сохранены, дыхание аритмичное, поверхностное, кожные покровы бледные, цианотичные, АД падает, пульс учащен, слабого наполнения, иногда возникает паралич сфинктеров. Если не приняты срочные меры (отключение эфира, кислород, ВВЛ или ИВЛ, сердечные, сосудотонизирующие средства, центральные аналептики и др.), то наступает смерть от передозировки (паралич дыхательного и сосудодвигательного центров).
IV стадия (пробуждения) характеризуется постепенным восстановлением рефлексов, тонуса мышц, сознания, чувствительности (в обратном порядке). Она продолжается несколько часов, аналгетический эффект сохраняется до полного пробуждения больного.
Анестезия эфиром на фоне миорелаксации обычно поддерживается на первом уровне хирургической стадии, до второго уровня анестезию приходится углублять только при проведении ее в условиях самостоятельного дыхания больного.
Чтобы не допустить передозировки эфира, нужно к началу перехода анестезии к первому уровню хирургической стадии снизить его концентрацию до 5—6 об.% и затем корригировать дозировку, руководствуясь указанными симптомами глубины анестезии.
При использовании эфира в качестве основного анестетика для введения в анестезию обычно применяют неингаляционные средства, чаще барбитураты или натрия оксибутират. В процессе самой анестезии эфир нередко сочетают с N2O, фторотаном.
Эфир, как и другие общие анестетики, оказывает некоторое влияние на функциональные системы организма и метаболизм.
Действие на кровообращение. Влияние эфира на сердечно-сосудистую систему двояко. С одной стороны, действие эфира угнетает сократимость миокарда, с другой — стимулирует повышение тонуса симпатического отдела нервной системы. Это действие при неглубокой анестезии не только нивелирует первое, но нередко даже превалирует, что характерно для первого уровня хирургической стадии. Но и при втором уровне показатели центральной гемодинамики остаются обычно близкими к нормальным. Эфир, в отличие от фторотана, не сенсибилизирует сердце к катехоламинам.
Действие на дыхание. Влияние эфира на дыхательную систему выражается его раздражающим действием на слизистые дыхательных путей, некоторым расширением бронхов, усилением секреции бронхиальных желез. Объемные показатели дыхания и альвеолярная вентиляция легких при первом и втором уровнях анестезии остаются удовлетворительными.
Действие на другие органы. Функция печени и почек существенно не изменяется. Действие анестетика на желудочно-кишечный тракт проявляется угнетением моторики и секреции, что обусловлено превалированием влияний со стороны симпатикуса. Этим же объясняют некоторую гипергликемию и небольшую склонность к развитию метаболического ацидоза.
Возможным осложнением в период введения в анестезию и выхода из нее является рвота, которая может приводить к аспирации желудочного содержимого. Если допускается значительная передозировка эфира, больному угрожает опасность нарушения сердечной деятельности и дыхания.
Абсолютных противопоказаний для анестезии эфиром нет. Относительными противопоказаниями являются гипертиреоз, диабет и патологическое состояние, характеризующееся гиперфункцией симпатико-адреналовой системы.
Под сбалансированной анестезией понимают все формы комбинированного применения ингаляционных и внутривенных анестетиков. Этот метод анестезии позволяет оптимизировать использование преимуществ различных путей введения анестетиков:
— легкая управляемость ингаляционной анестезии;
— отсутствие фазы возбуждения при внутривенной анестезии;
— длительная аналгезия, сохраняющаяся и в послеоперационном периоде, при применении опиоидов.
Поэтому сбалансированная анестезия все еще остается наиболее часто применяемым методом анестезии, даже несмотря на то, что в последние годы все большее распространение получают новые методы внутривенной анестезии.
При всех описанных методах общего обезболивания (кроме анальгоседации), применяемых в настоящее время, в связи с вызываемым анестетиками угнетением дыхания и нарушением защитных дыхательных рефлексов необходима та или иная степень защиты дыхания и дыхательных путей. Она осуществляется с помощью таких средств, как:
— обычная лицевая маска;
— гортанная маска;
— эндотрахеальная трубка.
В соответствии с типом упомянутых искусственных дыхательных путей различают наркоз масочный, гортанно-масочный и интубационный.
Фармакокинетика ингаляционных анестетиков
Ингаляционные анестетики представляют собой либо летучие жидкости с температурой кипения, едва превышающей комнатную температуру (парообразующие, или летучие анестетики), или газы, такие как закись азота (веселящий газ, N20). В группу летучих анестетиков входят эфироподобные вещества, подвергшиеся дальнейшей химической обработке (например, Изофлуран, Севофлуран), или галогенированные углеводороды (например, Галотан).
Ингаляционные анестетики поступают в организм через легкие, где они диффундируют в кровь и, растворяясь в ней, доставляются с током крови в ЦНС. Выводятся ингаляционные анестетики также преимущественно через легкие. Поэтому действие этих веществ зависит от их физико-химических свойств и функционального состояния легких и органов кровообращения. На поступление, распределение и выведение ингаляционных анестетиков влияют следующие показатели:
— альвеолярная концентрация;
— растворимость в воде и в крови;
— растворимость в тканях, в том числе нервной;
— альвеолярная вентиляция;
— минутный объем сердца (МОС);
— мозговой кровоток.
Переход ингаляционного анестетика из альвеол в легочные капилляры, т.е. альвеолярно-капиллярная диффузия, происходит в основном благодаря парциальному давлению (давление анестетика в общем давлении газовой смеси) паров применяемого анестетика во вдыхаемом или альвеолярном воздухе. Высокий градиент парциального давления между альвеолами и капиллярами способствует быстрому переходу анестетика в кровь. Анестетик диффундирует в кровь до тех пор, пока парциальное давление в альвеолах и в крови не сравняется. Предполагаемая при этом концентрация анестетика в крови, помимо парциального давления зависит и от физической его растворимости в крови. Соотношение концентраций анестетика в крови и газонаркотической фазы после достижения равновесного pacтворения описывается коэффициентом распределения. Чем меньше растворимость инфуционного анестетика в крови, тем более должно быть его парциальное давление достижения эффективной концентрации. При этом сокращается время достижения равновесия, так как для этого должно быть введено меньше анестетика. Растворимости анестетика в крови обратно пропорциональна скорости достижения анестезии.
Другим важным показателем, характеризующим поступление ингаляционного анестетика через легкие, является легочный кровоток, который при физиологичусловиях равен МОС. Чем больше легочный кровоток, тем больше анестетика может поступить в кровь в единицу времени. Альвеолярная концентрация анестетика (при условии, что легочная вентиляция не изменяется) при этом снизится, что приведет к уменьшению градиента между альвеолами и кровью и, следовательно, к уменьшению поступления анестетика в кровь, и концентрация его в крови будет расти медленнее. В клинических условиях это означает, что введение в наркоз при высоком МОС замедляется, а при низком (например, при шоке), наоборот, ускоряется.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Рис. 2. Отношение средних геометрических значений продолжительности госпитализации на фоне применения различных ингаляционных анестетиков в сравнении друг с другом (95% ДИ)
Профессор Ян Фердинанд ХЕНДРИКС (Госпиталь Св. Богоматери, г. Аалст, Бельгия, доцент-консультант кафедры анестезиологии медицинского факультета Стенфордского университета, Калифорния) сравнил физико-химические свойства и клинические характеристики галогенсодержащих ингаляционных анестетиков. Десфлуран и севофлуран относятся к последнему поколению галогенсодержащих анестетиков. Несмотря на некоторую схожесть по химической структуре и физико-химическим свойствам, они имеют различия в фармакотерапевтическом действии.
Длительность индукции анестезии, или вводного наркоза, определяется скоростью подъема альвеолярной концентрации. Поскольку процесс поглощения ингаляционного анестетика начинается в альвеолах, возникает разница между вдыхаемым и альвеолярным парциальным давлением. Другими словами, длительность индукции зависит от скорости наступления равновесия между альвеолярной концентрацией анестетика в конце выдоха (F А ) и вдыхаемой концентрацией (F i ). Чем быстрее анестетик поглощается кровью, тем медленнее возрастает фракционная альвеолярная концентрация и ниже отношение F А /F i (рис. 1). Период наиболее интенсивного поглощения анестетика зависит от его физико-химических свойств. У десфлурана одна минимальная альвеолярная концентрация равна 6%, у севофлурана – 2%. Иначе говоря, градиент/напор подаваемого десфлурана выше, чем у всех других ингаляционных анестетиков. Следовательно, десфлуран обладает самой высокой степенью поглощения 1 . Однако сравнение севофлурана и десфлурана не должно ограничиваться кривыми F А /F i . Прежде всего важна фактическая концентрация, а она зависит от F i .
Концентрация газа прямо пропорциональна его парциальному давлению, поэтому альвеолярное парциальное давление анестетика будет возрастать медленно. Следовательно, чем выше скорость поступления анестетика из альвеол в кровь, тем существеннее разница между F i и F А и медленнее индукция анестезии.
Время восстановления сознания пациента – еще одна важная характеристика анестетика. Сравнительный анализ профиля восстановления сознания по окончании анестезии разными анестетиками в амбулаторных условиях показал, что время пробуждения при использовании десфлурана незначительно отличается от такового при применении севофлурана (на две-три минуты). Однако надо понимать, что важнее: промежуточные или значимые конечные результаты? Во многих исследованиях изучалось влияние летучего анестетика на продолжительность пребывания пациента в больнице и интенсивность послеоперационной боли. Как показал ретроспективный анализ результатов анестезии за 2005–2009 гг., среди 42 352 пациентов, получавших изофлуран, десфлуран и севофлуран, продолжительность пребывания в стационаре при использовании изофлурана составила 2,85 дня (2,78–2,93), десфлурана – 2,64 дня (2,57–2,72), севофлурана – 2,55 дня (2,48–2,62) 2 . Таким образом, несмотря на более быстрое восстановление сознания после применения десфлурана, достоверно быстрее (р = 0,009) выписываются пациенты, получавшие анестезию севофлураном (рис. 2).
При назначении анестетиков следует учитывать их фармакодинамический профиль. Существует мнение, что у пациентов с ожирением, у которых нарушены функции многих органов, по сравнению с пациентами без ожирения пробуждение после прекращения подачи севофлурана (в отличие от десфлурана) происходит медленнее. Однако в клинической практике время насыщения тканей и время элиминации препарата после прекращения его подачи у больных с ожирением и пациентов с нормальной массой тела практически идентичны. Следовательно, препарат может с успехом применяться и у больных с ожирением. В клиническом исследовании было подтверждено, что в рутинной клинической практике морбидное ожирение не оказывает клинически значимого влияния на поглощение ингаляционных анестетиков (изофлуран, севофлуран, десфлуран) 3 .
Профессор Я. Хендрикс отметил, что технологии подачи ингаляционных анестетиков в настоящее время активно и успешно развиваются. Сегодня внимание специалистов приковано к системам автоматизированной низкопоточной анестезии, предназначенным для достижения и поддержания итоговой концентрации препарата. Новейшее программное обеспечение оборудования позволяет автоматизировать подачу ингаляционного анестетика и обеспечить работу на низком потоке. Недавно специалистам-анестезиологам были представлены новые системы автоматизированной низкопоточной анестезии, которые независимо от степени растворимости ингаляционного анестетика позволяют поддерживать необходимый уровень концентрации препарата.
Еще один вопрос, волнующий мировую общественность, – влияние ингаляционных анестетиков на окружающую среду. Докладчик отметил, что в отличие от N 2 O десфлуран и севофлуран не содержат опасных для озонового слоя веществ. Однако ингаляционные анестетики, содержащие галогенизированные органические соединения – сильные парниковые газы, задерживают инфракрасное излучение в атмосфере и тем самым представляют угрозу в плане глобального потепления. В исследовании, посвященном воздействию анестетиков на окружающую среду и изменение климата, показано, что галогенизированные органические соединения ответственны за парниковый эффект приблизительно на 10–15% от общего антропогенного радиационного воздействия на климат, измеренного относительно начала индустриальной эпохи 4 . Вклад же самих ингаляционных анестетиков в парниковый эффект, по мнению профессора Хендрикса, равен примерно действию одной угольной электростанции или одного миллиона легковых автомобилей.
В заключение профессор Хендрикс отметил, что научные исследования принципов действия и свойств ингаляционных анестетиков продолжаются.
Ингаляционные анестетики третьего поколения: аспекты практического применения
Заведующий отделением реаниматологии МОНИКИ им. М.Ф. Владимирского, д.м.н., профессор Валерий Владимирович ЛИХВАНЦЕВ рассмотрел механизм действия галогенсодержащих анестетиков, который реализуется через взаимодействие с эндогенными рецепторами.
Как известно, минимальная альвеолярная концентрация, при которой у 50% пациентов отсутствует двигательная реакция на болевой раздражитель, является показателем силы действия ингаляционного анестетика. Показатели минимальной альвеолярной концентрации у галогенсодержащих анестетиков существенно различаются, причем у десфлурана уровень минимальной альвеолярной концентрации выше (6,00%), чем у севофлурана (1,58–2,05%) и изофлурана (1,15%), а значит, анестетический потенциал ниже. Уровень минимальной альвеолярной концентрации летучих анестетиков зависит от состояния пациента и уменьшается с возрастом, а также при использовании ряда лекарственных средств, в частности опиатов, N 2 O.
Степень раздражающего действия ингаляционных галогенсодержащих анестетиков также различна. Десфлуран не рекомендуется использовать для индукции анестезии, хотя отдельные работы демонстрируют возможность индукции анестезии десфлураном на фоне премедикации опиоидами. Однако в отличие от севофлурана десфлуран оказывает раздражающее воздействие на верхние дыхательные пути и бронхи, обладает резким запахом, вызывающим саливацию, задержку дыхания, кашель и ларингоспазм. В связи с этим десфлуран противопоказан больным бронхиальной астмой и курильщикам. Севофлуран в свою очередь может без оговорок использоваться для ингаляционной индукции у детей и взрослых.
Скорость поглощения анестетика тканями определяется величиной альвеолярно-венозного градиента парциальных давлений. Если анестетик перестает поглощаться тканями, венозное и альвеолярное парциальное давление выравнивается. Равновесное состояние у десфлурана и севофлурана достигается быстро. В связи с этим оба препарата можно использовать через ларингеальную маску. Ингаляционная индукция анестезии в нашей стране пока не распространена. Между тем, по мнению докладчика, поддержание анестезии с помощью ингаляционных препаратов возможно благодаря их свойствам. Так, период насыщения при анестезии десфлураном занимает три-четыре минуты, севофлураном – пять – семь минут. Препараты позволяют легко управлять глубиной анестезии.
Периоды поддержания анестезии с применением десфлурана и севофлурана существенно различаются. Если моноанестезия севофлураном при ряде амбулаторных малотравматичных вмешательств все-таки возможна, то для десфлурана по ряду причин вряд ли оправданна. При поддержании анестезии следует использовать фентанил при анестезии десфлураном в дозе не менее 3 мкг/кг/ч, что позволит избежать побочных эффектов, при анестезии севофлураном – не более 3 мкг/кг/ч. Севофлуран способен потенцировать эффекты миорелаксантов, что не свойственно десфлурану.
С появлением галогенсодержащих анестетиков возросла тенденция к применению низкопоточной анестезии на наркозных аппаратах. Ингаляционная анестезия считается низкопоточной, если общий поток свежего газа по ротаметрам наркозного аппарата составляет 0,5–1 л/мин. Для анестезии с потоком свежих газов менее 0,5 л/мин лучше использовать анестезию десфлураном и севофлураном. Пропускная способность испарителей исключает использование галотана и энфлурана уже при потоке свежих газов менее 0,5 л/мин, следовательно, для закрытой системы циркуляции подходят только десфлуран и севофлуран.
Высокий уровень доставки при малом газотоке (разрешенные высокие установки на испарителе) в сочетании с низкой индивидуальной поглощаемостью приводит к низкой постоянной времени при использовании севофлурана и десфлурана. Это важная характеристика ингаляционных анестетиков, поскольку чем ниже постоянная времени, тем быстрее можно достичь необходимой концентрации препарата, то есть углубить анестезию или, наоборот, сделать ее более поверхностной.
Профессор В.В. Лихванцев отметил, что существуют разные мнения по поводу отрицательного влияния ингаляционных анестетиков на функцию печени. Проблема гепатотоксичности связана с использованием первого галогенсодержащего анестетика – галотана, который вызывает два вида поражения печени – острый некроз (галотановый гепатит) и легкую субклиническую гепатотоксичность. Острый некроз печени – это аутоиммунный процесс, который инициируется перекисным окислением галогенсодержащего анестетика с образованием трифторацетата. Метаболизм севофлурана исключает образование трифторацетата, а десфлуран, хотя образует его в процессе биодеградации, подвергается биотрансформации в малой степени. Уровень трифторацетата у десфлурана в 1000 раз меньше, чем у галотана, поэтому десфлуран отличается низкой гепатотоксичностью, что подтверждено клинически. Однако при анализе данных специальной литературы разных стран за 1999–2010 гг. было установлено пять случаев, когда токсический гепатит, ставший следствием анестезии десфлураном, привел к летальному исходу.
Прямое нефротоксическое действие галогенсодержащих анестетиков доказано только для метоксифлурана, который может вызывать полиурию, гипернатриемию, дегидратацию и другие нарушения. Нефротоксичность метоксифлурана прямо пропорциональна метаболизму анестетика. Действующим агентом считается фторид-ион, образующийся в процессе биотрансформации. Именно поэтому ингаляционные анестетики проходят тестирование на количество фторид-иона, образующегося в процессе их биодеградации.
Как показали результаты исследований, благодаря незначительной биодеградации десфлуран не оказывает негативного влияния на работу почек. Севофлуран имеет ограниченную доступность для биотрансформации в почках, поэтому при использовании в клинических концентрациях не вызывает острого некроза почек.
Важным аспектом при рассмотрении проблем ингаляционной анестезии является кардиопротективный эффект галогенсодержащих анестетиков. Метаанализ 38 рандомизированных исследований с участием 3996 пациентов был посвящен сравнению кардиопротективного эффекта ингаляционных анестетиков – десфлурана, севофлурана, изофлурана 6 . Результаты метаанализа продемонстрировали кардиопротективный эффект всех исследуемых галогенсодержащих анестетиков. Применение анестезии севофлураном и десфлураном ассоциируется со снижением общей летальности, частоты случаев инфаркта миокарда.
Профессор В.В. Лихванцев назвал вопрос о скорости пробуждения после анестезии десфлураном и севофлураном спорным. Низкая растворимость в крови и тканях делает пробуждение после прекращения подачи десфлурана более быстрым по сравнению с севофлураном, но результаты исследований подтверждают, что в ряде случаев показатели темпа пробуждения после анестезии этими препаратами примерно равны.
Докладчик рассказал о результатах собственного рандомизированного исследования темпов пробуждения пациентов после анестезии севофлураном и десфлураном в реальных условиях. Всего в исследование был включен 131 пациент: у 44 пациентов анестезию проводили пропофолом, у 43 – десфлураном, у 44 – севофлураном.
Завершая выступление, профессор В.В. Лихванцев отметил, что ингаляционные анестетики третьего поколения севофлуран и десфлуран на сегодняшний день являются препаратами выбора в анестезиологии. Они характеризуются уникальными свойствами, подтвержденными многочисленными исследованиями, и предназначены для широкого клинического применения.
Ингаляционные анестетики третьего поколения: шаг к детям
Применению ингаляционной анестезии в педиатрии был посвящен доклад заведующего отделением анестезиологии и реанимации Российской детской клинической больницы, к.м.н. Владимира Станиславовича КОЧКИНА.
В нашей стране ингаляционные анестетики третьего поколения в педиатрической практике используются уже несколько лет. Применение севофлурана без ограничений в педиатрии разрешено в России с 2005 г., десфлурана с ограничениями – с 2013 г. Третья фаза клинических исследований отечественного препарата ксенон завершена в 2011 г., но он разрешен к применению только у лиц старше 18 лет.
Севофлуран показан для вводной и поддерживающей анестезии у взрослых и детей при хирургических операциях в стационарных и амбулаторных условиях. Противопоказаниями к применению препарата являются повышенная чувствительность, подтвержденная или предполагаемая генетическая восприимчивость к развитию злокачественной гипертермии, грудное вскармливание.
Показания к применению десфлурана: для вводной и поддерживающей анестезии у взрослых, а также для поддерживающей анестезии у детей при проведении хирургических вмешательств как в стационаре, так и в амбулаторных условиях. Среди противопоказаний, в частности, проведение вводной анестезии у детей в возрасте до
12 лет, поддерживающей анестезии у детей в возрасте до шести лет, если не применяется интубация.
Севофлуран обладает относительно приятным запахом и не раздражает слизистые оболочки дыхательных путей, что отличает его от десфлурана. Данное свойство позволяет достаточно комфортно проводить аппаратно-масочную индукцию у пациентов детского возраста.
Десфлуран и севофлуран обладают схожими клиническими характеристиками. Они одинаково действуют на мозговой кровоток и внутричерепное давление, не провоцируют судорожную активность, не влияют на почечный кровоток, уменьшают кровоток в печени. Различия наблюдаются в уровне СО2 в покое и при нагрузке. Но если сравнивать анестетическую силу десфлурана и севофлурана, у последнего она выше.
Индукция с предварительным заполнением контура наркозного аппарата смесью, содержащей 6–8% севофлурана, может быть инициирована быстрым насыщением жизненной емкости легких смесью или проводится при спокойном дыхании пациента. При использовании десфлурана индукция может быть только последовательной, с начальной концентрацией 3% и последующим повышением на 0,5–1% через каждые два-три вдоха до 11%. Однако, по словам докладчика, в педиатрии она неприемлема, поскольку вызывает осложнения (таблица).
Сравнительный анализ осложнений индукции показал, что более чем у 1% пациентов в возрасте от двух до 16 лет во время индукции анестезии десфлураном с использованием лицевой или ларингеальной маски возникают проблемы респираторного характера. Распространенное осложнение при использовании галогенсодержащих анестетиков, в том числе севофлурана, у детей – злокачественная гипертермия. Она проявляется повышенным потреблением кислорода, накоплением лактата и продукцией большого количества углекислого газа и тепла. Специфическим антидотом злокачественной гипертермии служит дантролен. При применении десфлурана также может развиться гиперкалиемия – резкое повышение в сыворотке крови уровня калия и креатинина, а также миоглобинурия у пациентов с нейромышечными дистрофиями. При этом у пациентов не наблюдаются симптомы ригидности или гиперметаболизма. Для лечения такого состояния используют экстракорпоральные методы.
Как показали результаты исследований, одновременное применение фентанила 2,5 мкг/кг у детей, получавших анестезию на основе десфлурана или севофлурана, значительно уменьшало частоту развития ажитации. При использовании десфлурана у детей быстрее восстанавливалось сознание 7 .
В рандомизированном исследовании изучали особенности экстубации у детей, находившихся под наркозом с использованием десфлурана или севофлурана. Серьезных осложнений не выявлено. Проблемы респираторного характера (кашель) были зафиксированы в группе десфлурана. В ходе исследования было выявлено, что применение мидазолама в премедикацию на длительность пробуждения влияло значительнее, чем выбор ингаляционного анестетика. Частота возникновения ажитации пробуждения также не зависела от анестетика 8 .
Возникновение кашля в ответ на стимуляцию трахеи при интубации, раздувании манжеты и глубоком вдохе – надежная и клинически значимая оценка реактивности дыхательных путей. Исследования показали, что при 1,0 минимальной альвеолярной концентрации севофлуран значительно превосходит десфлуран в подавлении умеренного и тяжелого ответа на эту стимуляцию 9 .
Докладчик подчеркнул, что поддержание анестезии через ларингеальную маску неприемлемо для детей до шести лет. Для поддержания анестезии через ларингеальную маску при небольших концентрациях не отмечалось значимой разницы на раздражение дыхательных путей между десфлураном и севофлураном 10 .
В нейрохирургии севофлуран и десфлуран могут быть в равной степени использованы у детей, поскольку не влияют на мозговой кровоток. Применение этих препаратов способствует раннему выведению из наркоза нейрохирургических больных.
В.С. Кочкин отметил, что результаты собственного клинического опыта по использованию галогенсодержащих анестетиков показали преимущество севофлурана перед десфлураном.
Севофлуран считается препаратом выбора у пациентов с поливалентной аллергией, при прогнозируемой трудной интубации, критическом состоянии. Десфлуран в педиатрической практике используют только после интубации для поддержания анестезии, поскольку имеются серьезные ограничения по его использованию.
Подводя итог, В.С. Кочкин подчеркнул, что для дальнейшего расширения возможности использования ингаляционных анестетиков в детской клинической практике необходимы многосторонние исследования их эффективности и безопасности. Совершенствование хирургических и анестезиологических технологий позволит улучшить качество оказываемой помощи детям в стационаре.

Анестетики разделяют на:
- Местные
- Общие:
а) ингаляционные - летучие жидкости и газы
б) неингаляционные (внутривенные)

Таблица 1
1. Местные анестетики
Местные анестетики обратимо снижают возбудимость чувствительных нервных окончаний и блокируют проведение афферентных импульсов в нервных стволах в зоне непосредственного применения, используются для устранения боли.
Местные анестетики классифицируют на сложные эфиры (анестезин, дикаин, новокаин) и замещенные амиды (лидокаин, тримекаин, бупивакаин). Местные анестетики — сложные эфиры подвергаются гидролизу псевдохолинэстеразой крови и действуют в течение 30 — 60 мин. Их эффект пролонгируют антихолинэстеразные средства (прозерин). Продукт гидролиза — n-амино-бензойная кислота ослабляет бактериостатическое влияние сульфаниламидов. Замещенные амиды кислот инактивируются монооксигеназной системой печени в течение 2 — 3 ч. Бупивакин вызывает местную анестезию продолжительностью 3 — 6 ч, после ее прекращения длительно сохраняется анальгетический эффект.
С точки зрения практического применения анестетики подразделяют на следующие группы:
- Средства, применяемые для поверхностной (терминальной) анестезии: Кокаин, Дикаин, Анестезин, Пиромекаин
- Средства, применяемые преимущественно для инфильтрационной и проводниковой анестезии: Новокаин, Бупивакаин
- Средства, применяемые для всех видов анестезии: Лидокаин, Тримекаин
Механизм действия
Местные анестетики представляют собой третичные азотистые основания. Они состоят из гидрофильной и липофильной частей, соединенных эфирной или амидной связями. Механизм действия определяет липофильная часть, имеющая ароматическую структуру. Для нанесения на слизистые оболочки и кожу и парентерального введения применяют водные растворы хлористоводородных солей местных анестетиков. В слабощелочной среде тканей (рН=7,4) соли гидролизуются с освобождением оснований. Основания местных анестетиков растворяются в липидах мембран нервных окончаний и стволов, проникают к внутренней поверхности мембраны, где превращаются в ионизированную катионную форму.
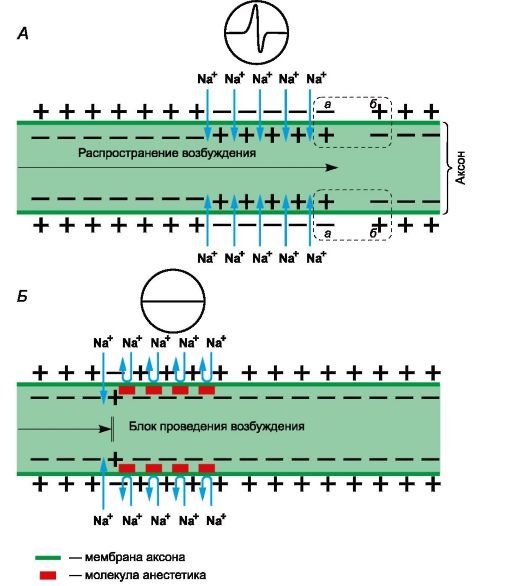
Рисунок 1 | Механизм действия местных анестетиков
Рецепторы для местных анестетиков локализованы в S6-сегменте IV домена внутриклеточной части натриевых каналов. Связываясь с рецепторами, катионы местных анестетиков пролонгируют инактивированное состояние натриевых каналов, что задерживает развитие следующего потенциала действия. Местные анестетики не взаимодействуют с закрытыми каналами в период потенциала покоя. Таким образом, в зоне нанесения местных анестетиков не развиваются потенциалы действия, что сопровождается блоком проведения нервных импульсов. Избирательное влияние местных анестетиков на чувствительные афферентные нервы обусловлено генерацией в них длительных (более 5 мс) потенциалов действия с высокой частотой.
В первую очередь местные анестетики блокируют безмиелиновые С и миелиновые Аδ и Аβ волокна (афферентные пути, проводящие болевые и температурные раздражения; вегетативные нервы). На волокна, окруженные миелиновой оболочкой, местные анестетики действуют в области перехватов Ранвье. Толстые миелиновые волокна (афферентные пути, проводящие тактильные раздражения; двигательные нервы) слабее реагируют на местные анестетики. Кроме того, устойчивость двигательных нервов к анестезии обусловлена низкочастотными короткими (менее 5 мс) потенциалами действия. В очаге воспаления в условиях ацидоза нарушаются диссоциация хлористоводородных солей местных анестетиков и образование их свободных липидорастворимых оснований, поэтому обезболивающее влияние утрачивается. Например, местная анестезия может оказаться неэффективной при удалении зуба в случае тяжелого периодонтита.
2. Общие анестетики
2.1. Ингаляционные анестетики
2.1.1 Летучие жидкости
Теории механизма действия общих анестетиков
Эффекты ингаляционных анестетиков не могут быть объяснены одним молекулярным механизмом. Скорее всего многокомпонентное действие каждого анестетика реализуется через множество мишеней. Тем не менее, эти эффекты сходятся на ограниченном числе изменений, лежащих в основе физиологических эффектов. На данный момент существуют липидная и белковая теории анестезии, но ни одна из них пока не описывает последовательность событий, происходящих от взаимодействия молекулы анестетика и ее мишеней до физиологических эффектов.

Рисунок 2 | Ингаляционные анестетики
Активность ингаляционных анестетиков оценивают по минимальной альвеолярной концентрации (МАК). Доза, создающая 1 МАК, предотвращает у половины пациентов движения в ответ на хирургическое вмешательство. Сила общих анестетиков коррелирует с их растворимостью в жирах, что говорит о важности взаимодействия с гидрофильными мишенями. В частности, обнаружение связи между силой анестетика и его липофильностью (правило Мейер-Овертона) дало начало липидной теории механизма действия анестетиков. Липидная теория анестезии утверждает, что анестетики растворяются в двойном липидном слое биологических мембран и вызывают анестезию, достигая критической концентрации в мембране. Наиболее усложненные версии липидной теории требуют, чтобы молекулы анестетиков вызывали пертурбацию (изменение свойств) мембраны.

Рисунок 3 | Правило Мейер-Овертона

Рисунок 4 | В 20 веке было показано, что сила общих анестетиков коррелируют с их способностью ингибировать активность растворимого фермента люциферазы, который физиологически не является мишенью анестетиков, но служит в качестве безлипидной модели белковой молекулы для связывания анестетика.
Механизм действия
Таким образом, общие анестетики изменяют физико-химические свойства липидов мембран нейронов и нарушают взаимодействие липидов с белками ионных каналов. При этом уменьшается транспорт в нейроны ионов натрия, сохраняется выход менее гидратированных ионов калия, в 1,5 раза возрастает проницаемость хлорных каналов, управляемых ГАМК-А рецепторами. Итогом этих эффектов становится гиперполяризация с усилением процессов торможения. Общие анестетики подавляют вход в нейроны ионов кальция, блокируя Н-холинорецепторы и NMDA-рецепторы глутаминовой кислоты; снижают подвижность Са 2+ в мембране, поэтому препятствуют кальций-зависимому выделению возбуждающих нейромедиаторов. Наиболее чувствительны к действию общих анестетиков полисинаптические системы ЦНС — кора больших полушарий (10 13 – 10 14 синапсов), таламус, ретикулярная формация, спинной мозг. К наркозу устойчивы дыхательный и сосудодвигательный центры продолговатого мозга.
Летучие ингаляционные анестетики:
- постсинаптически усиливают тормозящую передачу путем потенциирования лиганд-управляемых ионных каналов, активируемых ГАМК и глицином;
- экстрасинаптиески путем усиления ГАМК-рецепторов и ионных токов утечки;
- пресинаптически за счет повышения базального высвобождения ГАМК.
Ингаляционные анестетики подавляют возбуждающую синаптическую передачу путем снижения высвобождения глутамата и постсинаптически путем ингибирования ионотропных глутаматных рецепторов. Парализующий эффект местных анестетиков включает действие на спинной мозг, в то время как седация/наркоз и амнезия включают супраспинальные механизмы памяти, сна и сознания.
2.1.2. Газовый наркоз
В анестезиологии широко применяют ингаляционный газовый анестетик азота закись (N2O). В конце 1980-х гг. в зарубежную анестезиологическую практику вошел инертный газ ксенон.
Азота закись представляет собой бесцветный газ характерного запаха, хранится в металлических баллонах под давлением 50 атм в жидком состоянии, не горит, но поддерживает горение. Ее смеси с анестетиками группы летучих жидкостей в определенных концентрациях взрывоопасны. В субнаркотических концентрациях (20 — 30 %) азота закись вызывает эйфорию (веселящий газ) и сильную анальгезию. В концентрации 20 % обеспечивает обезболивание в такой же степени, как 15 мг морфина. Закись азота на ГАМК-А рецепторы не влияет. Используется только в комбинациях, так как МАК составляет 104 %.
Инертный газ ксенон считают лучшей альтернативой азота закиси, так как он обладает более выраженным наркозным действием, индифферентностью и экологической безопасностью. Способность ксенона вызвать наркоз была открыта в связи с практикой глубоководных погружений и развитием гипербарической физиологии. Ксенон бесцветен, не горит и не обладает запахом, при соприкосновении со слизистой оболочкой рта создает на языке ощущение горьковатого металлического вкуса. Отличается низкой вязкостью и высокой растворимостью в липидах, выводится легкими в неизмененном виде. Разработана технология ксенонсберегающей анестезии с включением минимального потока и системы рециклинга для повторного многократного использования газа. Такая технология успешно решает важную в практическом отношении проблему дефицита и дороговизны ксенона. В механизме наркозного эффекта ксенона имеют значение блокада циторецепторов возбуждающих нейромедиаторов — Н-холинорецепторов, NMDA-рецепторов глутаминовой кислоты, а также активация рецепторов тормозящего нейромедиатора глицина. При взаимодействии с циторецепторами ксенон выступает как протонсвязывающий кластер и образует комплексы с катионами НСО + , NH2 + , HNCH + . Ксенон проявляет свойства антиоксиданта и иммуностимулятора, снижает выделение гидрокортизона и адреналина из надпочечников.
2.2. Неингаляционные (внутривенные) наркозные средства подразделяют на три группы:
Препараты короткого действия (3 — 5 мин)
- пропанидин (эпонтол, сомбревин)
- пропофол (диприван, рекофол)
Препараты средней продолжительности действия (20 — 30 мин)
- кетамин (калипсол, кеталар, кетанест)
- мидазолам (дормикум, флормидал)
- гексенал (гексобарбитал-натрий)
- тиопентал-натрий (пентотал)
Препараты длительного действия (0,5 — 2 ч)

Рисунок 5 | Общие анестетики для внутривенного введения
Механизм действия
Наиболее широко используемым внутривенный анестетиком является пропофол. Его механизм действия связан с увеличение хлорной проводимости ГАМК рецепторов.
Метогекситал по скорости наступления и выхода из наркоза близок к пропофолу.
Барбитураты использовались для анестезии до введения в практику пропофола. Тиопентал вызывает быстрое наступление и быстрый выход из наркоза при разовом введении, но он быстро накапливается при повторном или пролонгированном введении и таким образом замедляет выход из анестезии. Барбитураты являются лигандами барбитуратных рецепторов. В малых дозах они аллостерически усиливают действие ГАМК на ГАМК А-рецепторы . При этом удлиняется открытое состояние хлорных каналов, возрастает вход в нейроны анионов хлора, развиваются гиперполяризация и торможение. В больших дозах барбитураты прямо повышают хлорную проницаемость мембран нейронов. Кроме того, они тормозят высвобождение возбуждающих медиаторов ЦНС — ацетилхолина и глутаминовой кислоты, блокируют АМРА-рецепторы (квисквалатные рецепторы ) глутаминовой кислоты. Барбитураты обладают церебропротективными свойствами и могут быть использованы с такой целью.
Бензодиазепины используются в основном как анксиолитики и для седации с сохранением сознания.Все бензодиазепиновые рецепторы аллостерически усиливают кооперацию ГАМК с ГАМК А-рецепторами, что сопровождается повышением хлорной проводимости нейронов, развитием гиперполяризации и торможения. Реакция с бензодиазепиновыми рецепторами происходит только в присутствии ГАМК. Ремимазолам - самый молодой бензодиазепин, имеет очень короткое время действия из-за быстрой нейтрализации эстеразами плазмы.
Кетамин химически является производным фенциклидина. Синаптические механизмы действия кетамина многообразны. Он является неконкурентным антагонистом возбуждающих медиаторов головного мозга глутаминовой и аспарагиновой кислот в отношении NMDA-рецепторов. Эти рецепторы активируют натриевые, калиевые и кальциевые каналы мембран нейронов. При блокаде рецепторов нарушается деполяризация. Кроме того, кетамин стимулирует освобождение энкефалинов и β-эндорфина; тормозит нейрональный захват серотонина и норадреналина. Последний эффект проявляется тахикардией, ростом АД и внутричерепного давления. Кетамин расширяет бронхи. При выходе из кетаминового наркоза возможны бред, галлюцинации, двигательное возбуждение (эти нежелательные явления предупреждают введением дроперидола или транквилизаторов).Важным терапевтическим эффектом кетамина является нейропротективный. Как известно, в первые минуты гипоксии мозга происходит выброс возбуждающих медиаторов — глутаминовой и аспарагиновой кислот. Последующая активация NMDA-рецепторов, увеличивая во внутриклеточной среде концентрацию ионов натрия и кальция и осмотическое давление, вызывает набухание и гибель нейронов. Кетамин как антагонист NMDA-рецепторов устраняет перегрузку нейронов ионами и связанный с этим неврологический дефицит.
Самым новым внутривенным анестетиком является дексмедетомидин. Это высокоселективный агонист а2-адренорецепторов с седативными, симпатолитическими, снотворными и анальгетическими эффектами. Его основное действие - в качестве агониста на а2 рецепторы в голубом пятне.
Читайте также:

