Парентеральные препараты железа реферат
Обновлено: 30.06.2024
Обсуждается новый препарат для внутривенного введения — карбоксимальтозат железа, который быстро восстанавливает дефицит железа, не вызывает реакции гиперчувствительности, характерные для препаратов, содержащих декстран, и обеспечивает медленное высвобождение железа, что снижает риск токсических эффектов.
Ключевые слова. Железодефицитная анемия, лечение, карбоксимальтозат железа, внутривенно.
АНЕМИЯ относится к числу глобальных проблем современного здравоохранения. По данным экспертов ВОЗ [1], в мире анемией страдают около 1,6 млрд человек, или 24,8% от общего населения. Частота анемии оказалась высокой во всех группах и составила 25,4-47,4% у детей дошкольного и школьного возраста, 41,8% у беременных женщин, 30,2% у небеременных женщин репродуктивного возраста, 23,9% у пожилых людей и 12,7% у мужчин. Хотя среди взрослого населения анемия чаще всего развивалась во время беременности, тем не менее, в популяции основную долю пациентов с анемией составляли небеременные женщины репродуктивного возраста (468 млн человек). По крайней мере в половине случаев причиной анемии служит дефицит железа [2], который может быть следствием хронической кровопотери (менструации и другие причины), недостаточного поступления железа с пищей (например, при хроническом алкоголизме), повышенной потребности (детский и подростковый возраст, беременность, послеродовый период), нарушения всасывания. Дефицит железа бывает не только абсолютным, но и функциональным. Последний возникает в том случае, когда адекватное или даже повышенное общее содержание железа в организме оказывается недостаточным при увеличении потребности в нем костного мозга на фоне стимуляции эритропоэза. Важную роль в регуляции обмена железа играет гепсидин — гормон, который образуется в печени, взаимодействует с ферропортином (белком, осуществляющим транспорт железа) и подавляет всасывание железа в кишечнике, а также его высвобождение из депо и макрофагов [3]. Повышение уровня гепсидина, отмечающееся при воспалении, считают основной причиной анемии хронических заболеваний. Кроме того, уровень гепсидина увеличивается при хронической болезни почек и вносит вклад в развитие нефрогенной анемии и резистентности к стимуляторам эритропоэза. При усилении эритропоэза под действием эритроэпоэтина скорость мобилизации железа из депо становится недостаточной для обеспечения возросших потребностей костного мозга. Пролиферирующим эритробластам необходимо все большее количество железа, что приводит к истощению лабильного пула железа и снижению сывороточного уровня ферритина. Для мобилизации и растворения железа из гемосидерина требуется определенное время. В результате уменьшается количество поступающего в костный мозг железа, что приводит к развитию его функционального дефицита [4].
Независимо от причины железодефицитной анемии основной метод ее лечения — устранение абсолютного или функционального дефицита железа. С этой целью применяют препараты железа, которые можно назначать перорально или внутривенно. Хотя пероральные препараты удобнее парентеральных, они оказывают медленное действие, неэффективны при синдроме нарушенного всасывания и часто вызывают нежелательные реакции со стороны желудочно-кишечного тракта (10-40% пациентов), которые снижают приверженность к лечению. Соответственно, внутривенное введение препаратов железа обосновано в тех случаях, когда необходимо быстро добиться эффекта (например, при более тяжелой анемии, особенно у пациентов, страдающих сердечно-сосудистыми заболеваниями или находящихся на химиотерапии), плохой переносимости препаратов для приема внутрь или их неэффективности (синдром мальабсорбции, хроническая потеря железа, превышающая скорость его восполнения, и др.) [5,6]. Кроме того, внутривенное введение железа считают методом выбора при лечении препаратами, стимулирующими эритропоэз, у больных с хронической болезнью почек (ХБП), воспалительными заболеваниями кишечника, злокачественными опухолями [7].
Некоторые препараты железа можно вводить внутримышечно, однако внутримышечные инъекции болезненные, вызывают изменение цвета кожи и ассоциировались с развитием саркомы ягодичной мышцы [8,9]. По мнению некоторых авторов [10], от внутримышечного введения препаратов железа следует отказаться.
Железа карбоксимальтозат (Феринжект®) — это новый внутривенный препарат железа (рис. 1). Он позволяет быстро восполнить дефицит железа, крайне редко вызывает реакции гиперчувствительности, характерные для препаратов, которые содержат декстран, и обеспечивает медленное высвобождение железа, что снижает риск токсических эффектов.

Рис.1. Строение карбоксимальтозата железа
Препараты железа для внутривенного введения
Для внутривенного введения в России применяют карбоксимальтозат железа (Феринжект®), сахарат железа (Венофер), глюконат железа (Феррлецит) и декстран железа (КосмоФер), которые представляют собой сферические железоуглеводные коллоиды. Углеводная оболочка придает комплексу стабильность, замедляет высвобождение железа и поддерживает образующиеся формы в коллоидной суспензии. Эффективность и безопасность внутривенных препаратов железа зависят от их молекулярной массы, стабильности и состава. Комплексы с низкой молекулярной массой, такие как глюконат железа, менее стабильны и быстрее высвобождают в плазму железо, которое в свободном виде может катализировать образование реактивных форм кислорода, вызывающих перекисное окисление липидов и повреждение тканей. Значительная часть дозы подобных препаратов выводится через почки в первые 4 часа после приема препарата и не используется для эритропоэза. Хотя препараты декстрана железа обладают высокими молекулярной массой и стабильностью, их недостатком является повышенный риск аллергических реакций. Карбоксимальтозат железа сочетает в себе положительные свойства высокомолекулярных комплексов железа, но не вызывает реакции гиперчувствительности, наблюдающиеся при применении препаратов, содержащих декстран (рис. 2), и, в отличие от сахарата и глюконата железа, может вводиться в более высокой дозе [11].

Рис. 2. Риск токсических эффектов и анафилактических реакций при применении внутривенных препаратов железа
Применение карбоксимальтозата железа позволяет вводить за одну инфузию до 1000 мг железа (внутривенно капельно в течение 15 минут), в то время как максимальная доза железа в виде сахарата составляет 500 мг и вводится в течение 3,5 ч, а длительность инфузии декстрана железа достигает 6 ч. Причем в двух последних случаях перед началом инфузии необходимо ввести тестовую дозу препарата. Введение большой дозы железа позволяет сократить необходимое число инфузий и затраты на лечение. Помимо удобства применения важными свойствами карбоксимальтозата железа являются низкая токсичность и отсутствие оксидативного стресса, которые определяются медленным и физиологичным высвобождением железа из стабильного комплекса с углеводом, по структуре сходного с ферритином.
Нарушения кроветворения занимают одно из ведущих мест в клинике внутренних болезней, педиатрии, акушерства и гинекологии. Анемия (малокровие) — уменьшение в крови общего количества гемоглобина (менее 130 г/л у мужчин и 120 г/л у женщин) и гематокрита (менее 39% у мужчин и 36% у женщин). Различают постгеморрагическую, апластическую, железодефицитную, мегало- и сидеробластную, гемолитическую анемии. Наиболее часто встречаются анемии, связанные с дефицитом железа (около 90% всех анемий), реже — анемии при хронических заболеваниях, еще реже — анемии, связанные с дефицитом витамина В12 или фолиевой кислоты (мегалобластные), гемолитические и апластические.
Железодефицитная анемия (ЖДА) характеризующаяся снижением количества железа в сыворотке крови, костном мозге и депо, что сопровождается нарушением синтеза гемоглобина, других железосодержащих белков (миоглобина, некоторых тканевых ферментов — цитохромов, каталазы, пероксидазы) и эритроцитов, развитием трофических нарушений в органах и тканях. По данным ВОЗ, 700 млн людей в мире (до 20 % населения земного шара) страдают дефицитом железа. Наиболее часто ЖДА встречается у детей, подростков, женщин детородного возраста. Явный или скрытый дефицит железа регистрируется у 30 % всех женщин и у половины детей раннего возраста. Частота ЖДА у беременных колеблется от 21 % до 80 %.
Основными этиологическими факторами ЖДА являются следующие:
- хронические кровопотери различной локализации;
- недостаточное потребление железа в продуктах питания;
- повышенная потребность в железе (беременность, лактация, интенсивный рост в пубертатный период);
- нарушения процессов пищеварения и всасывания железа;
- нарушение транспорта железа в связи с дефицитом трансферрина в случае первичной патологии печени;
- изменения процесса депонирования железа при тяжелых заболеваниях печени;
- нарушения процесса реутилизации железа при кровопотере или интенсивной аккумуляции железа зоной воспаления.
Существует два понятия — железодефицит и анемия. Железодефицит — это постепенное истощение запасов железа в организме, а анемия — это крайнее проявление железодефицита, выражающееся снижением количества гемоглобина. Пока концентрация железа в сыворотке крови остается нормальной, хотя запас железа в организме снижен или полностью отсутствует — клинические симптомы ЖДА отсутствуют. Это так называемый скрытый железодефицит.
Клиническими признаками ЖДА являются: вялость, повышенная утомляемость, запор, головная боль, извращение вкуса (больные едят мел, глину и т. п.), ломкость ногтей, выпадение волос, недержание мочи. Также отмечаются специфические для всех анемий признаки, связанные со степенью малокровия: бледность кожи и слизистых оболочек, сердцебиение, одышка, снижение иммунитета.
Железа фумарат (Хеферол)
Железа глюконат (Мегаферин, Ферронал)
Железа хлорид (Гемофер)
Железа сульфат (Ферроградумет)
Оксида железа сахарат (Глобиген, Железа сахарат-железное вино)
Комплекс железа с кармеллозой (Феростат)
Комплекс гидро-ксида железа с полимальтозой (Фенюльс беби, Феррум Лек, Мальтофер)
Оксида железа сахарат (Венофер)
Комплекс гидрокси-да железа с полимальтозой (Феррум Лек, Мальтофер В. М.)
Оксида железа декстрановый комплекс (Ферролек-Здоровье)
Актиферрин
Гино-тардиферон
Ранферон-12
Глогем ТР
Сорбифер Дурулес
Тардиферон
Тотема
Феррамин-Вита
Ферроплекс
Ферроплект
Феррофол
Биофер*
Мальтофер*
Орофер*
Гемоферон**
Гемсинерал-ТД**
Ранферон-12**
Глобирон-Н***
Феррамин-Вита***
Фенюльс•
Биовиталь классик•
Фенотек•
Глобирен••
Феррон форте••
Хемси••
Примечание: жирным шрифтом выделены международные названия (INN).
Лечение ЖДА состоит из дието-и фармакотерапии. Невозможно вылечить железодефицит без препаратов железа лишь диетой, состоящей из богатых железом продуктов. Максимальное количество железа, которое может усвоиться из пищи — 2,5 мг / сутки, из лекарственных препаратов железа может поступить в 15–20 раз больше. Особенно полезны мясные продукты. Из растительной пищи усваивается лишь до 4 % железа, тогда как из продуктов животного происхождения — от 10 до 20 %. Лучше всего железо усваивается из нежирного мяса (около 23 %), т. к. это гемовое железо. В печени содержится в пять раз больше железа, но всасывается 5–10 %, т. к. оно содержится в трудноусваиваемой трехвалентной форме. Из растительных продуктов в качестве источников железа можно выделить овсянку, грибы, персики и гранаты, укроп, петрушку. В яблоках, молоке, зерновых продуктах содержится мало железа.
Препараты железа являются донаторами иона железа, стимулируют синтез гемоглобина и применяются для профилактики и лечения ЖДА.
Сегодня на фармацевтическом рынке страны имеется большой выбор препаратов железа, представленных монокомпонентными и комбинированными соединениями солей железа, и препаратов на основе многомолекулярных комплексов гидроокиси железа (табл. 1).
В клинической практике препараты железа применяются внутрь и парентерально. Большинство препаратов, применяемых внутрь, содержат ионизированное железо в виде солей двухвалентного железа: сульфат железа (тардиферон, гино-тардиферон, актиферрин, фенюльс, ферроградумет, ферроплекс, конферон, фенотек), хлорид железа (гемофер), лактат железа (гемостимулин), фумарат железа (хеферол, ранферон, ферронат), глюконат железа (мегаферин, ферронал). Различаются они по дозе солей железа, наличию дополнительных компонентов (аскорбиновой и янтарной кислот, витаминов, фруктозы и др.), лекарственным формам (таблетки, драже, сиропы, растворы). До недавнего времени для приема внутрь применялись исключительно соли двухвалентного железа, сейчас появились препараты нового поколения, содержащие неионизированное железо и представляющие собой многомолекулярные комплексы гидроокиси трехвалентного железа (мальтофер, феррум-лек).
В инъекционных препаратах железо всегда находится в трехвалентной форме. Эти препараты железа можно вводить как внутривенно — ферковен, венофер (комплекс с сахарозой), так и внутримышечно — феррум-лек, мальтофер (комплекс с мальтозой), фербитол (железосорбитоловый комплекс).
Препараты железа могут быть как монокомпонентными, так и поликомпонентными (тотема, ферроплекс, актиферрин, гино-тардиферон, сорбифер-дурулес, фенотек и др.). В последнее время все большую популярность приобретают препараты железа пролонгированного действия (сорбифер дурулес, тардиферон, гино-тардиферон, хеферол, ферроградумет).
Рациональные принципы применения препаратов железа
1. Невозможно устранить ЖДА без применения препаратов железа лишь диетой, состоящей из богатых железом продуктов (из-за ограничения возможности всасывания железа из пищи).
2. Лечение ЖДА следует проводить препаратами железа для приема внутрь. Препараты для инъекций применяются лишь по специальным показаниям.
3. До недавнего времени предпочтение отдавалось препаратам, содержащим железо в двухвалентной форме (ионизированное). В последние годы были разработаны препараты, содержащие трехвалентное (неионизированное) железо (гидроксид полимальтозный комплекс железа и т. д.). Они обладают лучшей переносимостью и более безопасны.
4. Для обеспечения оптимального суточного прироста гемоглобина минимальная суточная доза должна составлять не менее 100 мг двухвалентного железа. Оптимальной суточной дозой является 150–200 мг, максимальной — 300–400 мг элементарного железа. Суточную дозу делят обычно на 3–4 приема с интервалом между ними не менее 4 ч. При назначении высоких доз (более 200 мг) их целесообразно делить на 6–8 приемов.
5. Усиливают всасывание негемового железа органические кислоты (аскорбиновая, лимонная, фумаровая, яблочная, янтарная и др.), алкоголь, ионы меди и цинка, белки животного происхождения, аминокислоты.
Окрашивание мочи, кала и зубов в темный цвет
Металлический вкус во рту
Боли в эпигастрии, обострение язвенной болезни; кишечные колики
Запор (соединение с сероводородом, снижение перистальтики
Тошнота, рвота, диарея (раздражающее действие на слизистую), снижение аппетита
Лихорадка, гиперемия кожи
Боли в поясничной области
Боли в суставах, за грудиной
Головная боль, головокружение
Острая сосудистая недостаточность
Кожный зуд, аллергический дерматит
Абсцесс в месте введения
6. Продукты, уменьшающие всасывание железа (кофе, чай, молоко, хлеб из цельных зерен или хлопьев, яйца, молочные продукты) не следует есть в течение двух часов после приема препаратов железа. Ухудшают всасывание железа оксалаты, фосфаты, соли кальция, танин.
7. После нормализации уровня гемоглобина в крови необходимо продолжить лечение препаратами железа еще в течение 3 месяцев (нередко до 4–6 месяцев) в поддерживающей дозе (в 2–3 раза меньше той, которой проводилось лечение — обычно 60–80 мг) для восстановления запасов железа в организме.
8. Парентеральное введение железосодержащих препаратов показано при массивных кровопотерях, непереносимости перорального приема, при нарушении всасывания железа. Максимальная доза железа, вводимого парентерально, составляет 100 мг. Обычно эту дозу вводят 1 раз в три дня.
9. Гемотрансфузии при ЖДА проводят только по жизненным показаниям.
10. Препараты железа лучше принимать натощак, за час до еды или через два часа после еды. При плохой переносимости — во время еды.
11. Препараты железа в таблетках и драже не следует разжевывать, а жидкие лекарственные формы (сиропы, растворы для приема внутрь) лучше применять через трубочку во избежание окрашивания зубов в черный цвет. После приема препаратов железа рекомендуется прополоскать полость рта, почистить зубы.
Высокий риск возникновения побочных эффектов и передозировки при терапии солями железа обусловлен механизмом всасывания двухвалентного железа. Из солей двухвалентное железо всасывается как при помощи активного транспорта, так и при помощи пассивной диффузии. Причем этот механизм работает даже после насыщения транспортных систем. Для связывания с трансферрином и апоферритином ион двухвалентного железа окисляется до трехвалентного, что способствует образованию свободных радикалов и активации свободно-радикальных (прооксидантных) реакций, вызывающих повреждение клеточных мембран (СРО), нарушение функций клеток и их гибель.
Соли железа диссоциируют с выделением свободных ионов железа. Именно свободные ионы железа вызывают неприятный металлический привкус и могут служить причиной окрашивания эмали зубов. Кроме того, ионы железа, выделяющиеся в желудочно-кишечном тракте, даже после приема терапевтических доз приводят к локальному раздражению и повреждению слизистой оболочки желудка. Поэтому препараты солей железа часто вызывают тошноту, боли в животе, чувство переполнения и давления в эпигастрии. Так как свободные ионы железа имеют низкий молекулярный вес, то при приеме терапевтических доз препаратов свободные ионы железа выделяются в ЖКТ и проникают в кровь в прямой зависимости от вводимой дозы путем пассивной диффузии даже после того, как исчерпаны возможности физиологического транспортного механизма. Таким образом, препараты солей железа несут риск перенасыщения железом. Случайная их передозировка может закончиться смертельным исходом, особенно у детей.
При отравлении препаратами железа наблюдаются боли в животе, понос, кровавая рвота, слабость, цианоз, головокружение, нарушение сознания. Специфическим антидотом является дефероксамин, образующий комплексы с железом. При незначительной передозировке препаратов железа необходимо назначить молочную диету (железо и кальций образуют труднорастворимый комплекс).
 |
Развитие побочных эффектов при парентеральном введении препаратов железа связано с большим количеством быстро ионизируемого железа, вводимого непосредственно в сосуды, без наличия необходимого количества трансферрина, способного его связывать. В норме во всей плазме содержится 3 мг железа, а при внутривенной инъекции сразу вводится 100 мг. При передозировке железо откладывается во внутренних органах в виде гемосидерина, что может привести к гемосидерозу.
Парентеральные препараты железа назначаются при нарушении всасывания железа в ЖКТ или плохой переносимости пероральных лекарственных форм. Обычно в этих случаях препараты железа назначают внутримышечно. Практический опыт последних десятилетий показал эффективность применения также и внутривенных препаратов железа различными специалистами: нефрологами, гинекологами, хирургами, гастроэнтерологами, кардиологами и онкологами. В кардиологии применение препаратов внутривенного железа сопровождается улучшением качества жизни больных сердечной недостаточностью. В гинекологии препараты внутривенного железа обеспечивают быстрое восполнение запасов железа в организме беременной и способствуют нормальному развитию плода и физиологическим родам.
Доказано, что использование препаратов железа для внутривенного применения позволяет до 70 % уменьшить терапевтическую дозу дорогостоящего рекомбинантного человеческого эритропоэтина, а также значительно снизить риск, связанный с переливанием крови. Это позволяет рассматривать препараты внутривенного железа как альтернативу донорской крови при отсутствии жизненно важных показаний к ее переливанию.
В заключение следует отметить, что современная тактика лечения ЖДА предусматривает выбор оптимального железосодержащего препарата, оценку его эффективности и переносимости, выбор пути введения с учетом клинической ситуации, длительность фармакотерапии и поддерживающей терапии, и позволяет успешно устранять анемический синдром.
1. Анемии у детей: диагностика и лечение / Практическое пособие для врачей под редакцией Румянцева А. Г., Токарева Ю. Н. М.: МАКС Пресс, 2000. — 917 с.
2. Гайдукова С. М., Видиборець С. В., Колесник І. В. Залізодефіцитна анемія. — К.: Наук. світ, 2001. — 131 с.
3. Гусева С. А. Железодефицитная анемия / / Лікування та діагностика. — 2000. — № 2. — С. 25–30.
4. Идельсон Л. И. Гипохромные анемии. М.: Медицина, 1981. — 192 с.
5. Казюкова Т. В., Самсыгина Г. А., Калашникова Г. В., Румянцев А. Г., Фаллух А., Мотина А. Г., Левина А. А. Новые возможности ферротерапии железодефицитной анемии / / Клиническая фармакология и терапия. — 2000. — Т. 9, № 2. — С. 88–91.
8. Мосолов С. Н. Основы психофармакотерапии. М., 1996. — 282 с.
9. Соболева М. К. Железодефицитная анемия у детей раннего возраста и кормящих матерей и ее лечение и профилактика Мальтофером и МальтоферомФол / / Педиатрия. — 2000. — № 6. — С. 27–32.
Для цитирования: Бабанов С.А., Агаркова И.А. Клиническая фармакология современных препаратов железа и их место в терапии железодефицитных анемий. РМЖ. 2012;20:990.
В годовом отчете Всемирной организации здравоохранения (ВОЗ) за 1998 г. указывается, что во всем мире дефицит железа выявлен у 3,6 млрд человек, в 50% случаев развивается синдром железодефицитной анемии (ЖДА) (1,8 млрд человек). В настоящее время не отмечается тенденции к уменьшению этих показателей, что определяет данную патологию как одну из ведущих медико–социальных проблем [1].
Литература
1. ВОЗ. Официальный ежегодный отчет. Женева, 2002.
2. Захарова Н.О., Никитин О.Л. Железодефицитные анемии у пациентов пожилого и старческого возраста: научно–практическое пособие для врачей. Самара, 2008. 60 с.
3. Городецкий В.В., Годулян О.В. Железодефицитные состояния и железодефицитная анемия: лечение и диагностика. М.: Медпрактика–М, 2004. С. 1–28.
4. Дворецкий Л.И. Лечение железодефицитной анемии // Русский медицинский журнал. 2006. Т. 6. № 20. С. 1312–1316.
5. Крюков Н.Н., Качковский М.А., Вербовой А.Ф., Бабанов С.А. Настольная книга терапевта. Диагностический справочник. М.: Астрель, 2012. 672 с.
6. Хиллман Р. Железодефицитная и другие гипорегенераторные анемии. Внутренние болезни по Тинсли Р. Харриссону // Трудный пациент. 2005. № 2. С. 770.
7. Шехтман М.М. Железодефицитная анемия и беременность // Гинекол. 2000. Т. 2. № 6. С. 164–171.
8. Серов В.Н., Шаповаленко С.А., Флакс Г.А. Диагностика и лечение железодефицитных состояний у женщин в различные периоды жизни // Атмосфера. Кардиология. 2008. № 2. С. 17–20.
9. Косарев В.В., Бабанов С.А., Вербовой А.Ф. Справочник клинического фармаколога. Ростов–на–Дону: Феникс, 2011. 476 с.
10.Подзолкова Н.М., Нестерова А.А., Назарова С.В., Шевелева Т.В. Железодефицитная анемия беременных // Русский медицинский журнал. 2003. № 11 (5). С. 326–32.
11. Смирнова О.В., Чеснокова Н.П., Михайлов А.В. Железодефицитная анемия у беременных. Этиология и патогенез метаболических и функциональных расстройств. Саратов, 1994.
12. Косарев В.В., Бабанов С.А. Клиническая фармакология и рациональная фармакотерапия. М.: Инфра–М, 2012. 236 с.
13. Дворецкий Л.И., Заспа Е.А., Литвицкий П.Ф., Болевич С.Б., Меньшова Н.И. Свободнорадикальные процессы у больных железодефицитной анемией на фоне лечения препаратами железа // Терапевтический архив. 2006. № 78 (1). С. 52–57.
14. Верткин А.Л., Годулян О.В., Городецкий В.В., Скотников А.С. Железодефицитная анемия и выбор препарата для ее коррекции // Русский медицинский журнал. 2010. № 5.
15. Шилов А.М., Мельник М.В., Ретивых О.Н., Ким И.Р. Коррекция железодефицитной анемии при хронической сердечной недостаточности // Русский медицинский журнал. 2005. № 19. С. 1254–1257.
16. Бурлев, В.А., Коноводова Е.Н., Орджоникидзе Н.В., Серов В.Н., Елохина Т.Б., Ильясова Н.А. Лечение латентного дефицита железа и железодефицитной анемии у беременных // Российский вестник акушера–гинеколога. 2006. № 1. C. 64–68.
17. Коноводова Е.Н., Бурлев В.А. Ферро–Фольгамма + Эритропоэтин – новые возможности лечения анемии у больных с миомой матки // Фарматека. 2004. № 15 (92). C. 70–73.
18. Коноводова Е.Н., Бурлев В.А., Кравченко Н.Ф., Карибджанов О.К., Мурашко Л.Е., Сопоева Ж.А. Коэффициент насыщения трансферрина железом у беременных // Проблемы репродукции. 2002. № 6. С. 45–47.
19. Мурашко Л.Е., Коноводова Е.Н., Бурлев В.А., Сопоева Ж.А. Объемный транспорт кислорода у беременных с анемией и гестозом при лечении Ферро–Фольгаммой // Русский медицинский журнал. 2002. Т. 10. № 7. С. 364–367.
20. Петрухин В.А., Гришин В.Л. Лечение анемии беременных с использованием препарата ферро–фольгамма // Проблемы репродукции. 2002. № 6.
Показания к внутривенному введению препаратов железа для лечения железодефицитной анемии (ЖДА) включают в себя неэффективность или плохую переносимость пероральных препаратов железа, тяжелую степень анемии, ЖДА в предоперационном периоде, ЖДА при воспалительных заболеваниях кишечника, сопровождающихся нарушением всасывания, также существуют рекомендации комплексной терапии со стимуляторами эритропоэза. В ряде клинических исследований проанализированы результаты внутривенного введения препаратов железа в разных режимах для лечения ЖДА.
По данным экспертов Всемирной организации здравоохранения, в мире анемией страдают около 1,6 млрд человек, или 24,8% от общего населения [1]. Значительная доля случаев анемии связана с дефицитом железа [2], который может быть следствием недостаточного поступления его с пищей, в частности при хроническом алкоголизме, повышенной потребности (детский и подростковый возраст, беременность, послеродовый период), хронической кровопотере, нарушениях всасывания (например, при воспалительных заболеваниях кишечника) [3]. При функциональном дефиците железа, например при лечении стимуляторами эритропоэза, нормальное или даже повышенное общее содержание его в организме оказывается недостаточным на фоне увеличения потребности в железе костного мозга [4]. В регуляции обмена железа принимает участие гепсидин, который синтезируется в печени и подавляет всасывание железа в кишечнике и его высвобождение из депо и макрофагов [5]. Повышение концентрации гепсидина способствует развитию анемии при хронических заболеваниях, нефрогенной анемии с возможной резистентностью к стимуляторам эритропоэза [6].
Анемия встречается у трети женщин репродуктивного возраста, а во время беременности ее частота достигает 23–52% [2]. У женщин железодефицитная анемия (ЖДА) чаще всего развивается при обильных и длительных менструациях (более 5 дней), дисфункциональных маточных кровотечениях, миоме матки [7]. При низком потреблении железа анемия может развиваться даже при относительной небольшой кровопотере [8]. Высокая встречаемость анемии во время беременности отражает значительное увеличение потребности в железе в связи с усилением эритропоэза у женщины и ростом плода [9].
При ЖДА увеличение потребления железа с пищей не позволяет компенсировать его дефицит, т.к. предельное всасывание железа составляет всего 2,5–3 мг/сут [9]. В связи с этим основной метод лечения ЖДА – пероральное или внутривенное введение препаратов железа.
Внутривенные препараты железа и показания к их применению
Для внутривенного введения используют железоуглеводные соединения (карбоксимальтозат, сахарат, глюконат и декстран железа). Углеводная оболочка стабилизирует комплекс и замедляет высвобождение железа в крови. Комплексы с низкой молекулярной массой, такие как глюконат железа, менее стабильны и быстрее высвобождают в плазму железо, которое в свободном виде может катализировать образование реактивных форм кислорода, вызывающих перекисное окисление липидов и повреждение тканей [26]. Значительная часть дозы подобных препаратов выводится через почки в первые 4 часа после приема препарата и не используется для эритропоэза. Недостатком декстрана железа, который обладает высокими молекулярной массой и стабильностью, является повышенный риск аллергических реакций [26]. Карбоксимальтозат железа (Феринжект) представляет собой стабильный высокомолекулярной комплекс, который обеспечивает медленное и физиологичное высвобождение железа. Он обладает меньшим иммуногенным потенциалом и в отличие от сахарата и глюконата железа может вводиться в высокой дозе [10].
При применении карбоксимальтозата железа 1000 мг железа можно ввести внутривенно капельно в течение 15 минут, в то время как максимальная доза железа в виде сахарата составляет 500 мг и вводится в течение 3,5 часа, а длительность инфузии декстрана железа достигает 6 часов, согласно инструкциям по медицинскому применению. Причем в двух последних случаях перед началом инфузии необходимо ввести пробную дозу. Максимальные рекомендуемые однократные дозы большинства препаратов железа для внутривенного введения ниже таковой карбоксимальтозата железа, поэтому для восполнения запасов железа необходимо многократное их введение, в то время как при применении карбоксимальтоза железа кратность инфузий, соответственно, меньше.
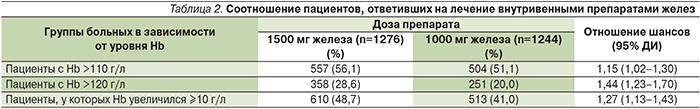
При легкой анемии препараты железа чаще всего назначают внутрь. Основное преимущество пероральных препаратов железа перед внутривенными – удобство применения, хотя оно нивелируется высокой частотой (10–40%) побочных эффектов со стороны желудочно-кишечного тракта (ЖКТ [10]) и необходимостью в длительном лечении. Внутривенное введение препаратов железа позволяет быстро восполнять его запасы в организме для восстановления концентрации гемоглобина (Hb). Данный эффект имеет особое значение при более тяжелой анемии, особенно для пациентов с сердечно-сосудистыми заболеваниями, а также при предоперационной анемии, когда оперативное вмешательство не может быть отложено [12]. Следует учитывать, что предоперационная анемия (в т.ч. легкая) не только часто встречается в клинической практике, но и ассоциируется с достоверным увеличением риска смерти и других осложнений в течение 30 дней после оперативного вмешательства [13]. По данным систематизированного обзора 24 рандомизированных и 15 нерандомизированных исследований [14], внутривенное введение препаратов железа при предоперационной анемии давало более быстрый и надежный эффект, чем их пероральный прием. Внутривенное введение железа используют пациенты, получающие лечение препаратами, стимулирующими эритропоэз, больные хронической болезнью почек, воспалительными заболеваниями кишечника, злокачественными опухолями [15]. Причиной дефицита железа у онкологических больных могут быть не только кровотечение или нарушение поступления железа при анорексии или после резекции опухолей ЖКТ, но и другие факторы, в частности увеличение секреции гепсидина, который подавляет всасывание железа в кишечнике и его высвобождение из депо и макрофагов [5, 15]. В нескольких рандомизированных клинических исследованиях внутривенное введение препаратов железа позволило увеличить частоту ответа на лечение эпоэтинами у онкологических больных с 25–70 до 68–93% [16], в то время как пероральные препараты для таких больных были малоэффективными или неэффективными. Переход на внутривенное введение препаратов железа показан также больным, для которых лечение пероральными препаратами оказывается малоэффективным или плохо переносится [17].
Сегодня мировым врачебным сообществом обсуждается также возможность применения препаратов железа и при его латентном дефиците, который не сопровождается анемией, но может быть причиной утомляемости. В многоцентровое рандомизированное плацебо-контролируемое исследование PREFER были включены 290 женщин с утомляемостью (индекс по шкале Piper Fatigue Scale [PFS] score ≥5), дефицитом железа (ферритин 20% и концентрацией ферритина >50 нг/мл при расчете дефицита железа не учитывали 500 мг, необходимых для восполнения запасов железа [19]. Средние кумулятивные дозы потребления железа в 5 клинических исследованиях потребление карбоксимальтозата железа представлено в табл. 1.
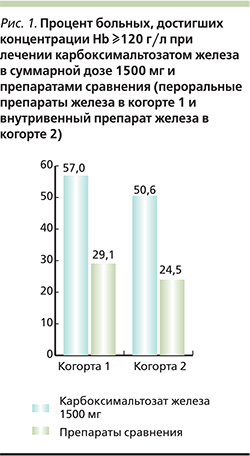
J. Onken и соавт. изучали эффективность и безопасность двух инфузий карбоксимальтозата железа по 750 мг с интервалом в неделю по сравнению с пероральным приемом препарата железа 1011 пациентами с ЖДА различного происхождения, которых разделили на две когорты [24]. Первую когорту составили 507 больных, для которых лечение пероральными препаратами железа в течение 14 дней не привело к существенному росту концентрации Hb (на величину до 10 г/л). В этой когорте сравнивали карбоксмальтозат железа в режиме двукратной инфузии (группа А) и пероральный препарат железа в дозе 325 мг/сут в течение 14 дней (группа В). Через 35 дней концентрация Hb в двух группах увеличилась в среднем на 15,7 и 8,0 г/л соответственно (p=0,001), а доля пациентов, у которых она достигла по крайней мере 120 г/л, составила 57,0 и 29,1% соответственно (р=0,001) (рис. 1). Во вторую когорту были включены 504 пациента, которые не переносили пероральные препараты железа. В этой когорте применяли карбоксимальтозат железа (группа С) или другие внутривенные препараты железа (группа D). Суммарная доза железа в двух группах составила в среднем 1432 и 813 мг соответственно. Средняя концентрация Hb через 35 дней после введения карбоксимальтозата железа в более высокой дозе увеличилась на 29,0 г/л, а при введении других препаратов железа – на 21,6 г/л (р=0,001). Преимущества более высокой дозы железа были показаны и при анализе числа пациентов, достигших концентрации Hb по крайней 120 г/л, их численность составила 50,6 и 24,5% в двух группах соответственно (р=0,001). Таким образом, в этом исследовании было показано, что две инфузии карбоксимальтозата железа по 750 мг с интервалом в одну неделю, – эффективные и безопасные методы лечения ЖДА при недостаточной эффективности или плохой переносимости пероральных препаратов железа.
В исследовании REPAIR-IDA сравнивали эффективность и безопасность внутривенного введения карбоксимальтозата железа (две инфузии по 750 мг с интервалом в неделю) и сахарата железа (до 5 инфузий по 200 мг в течение 14 дней) 2584 больным ЖДА и додиализными стадиями хронической болезни почек (ХБП) [25]. Первичным показателем эффективности было среднее изменение концентрации Hb через 56 дней по сравнению с исходным, а композитной первичной конечной точкой безопасности – частота смертей от любых причин, нефатальных инфаркта миокарда и инсульта, нестабильной стенокардии, хронической сердечной недостаточности, аритмий, эпизодов повышения давления и гипотонии. Суммарная доза железа составила 1464 мг в группе карбоксимальтозата железа и 963 мг в группе сравнения. Исходная концентрация Hb была сопоставимой в двух группах (103,1 и 103,2 г/л соответственно).
Содержание Hb увеличилось в среднем на 11,3 г/л при введении карбоксимальтозата железа в дозе 750 мг двукратно с интервалом в неделю и на 9,2 г/л при введении сахарата железа в суммарной дозе для 5 инъекций – 1000 мг. Доля пациентов, у которых через 56 дней концентрация Hb после введения карбоксимальтозата железа увеличилась более чем на 10 г/л, была выше, чем после введения сахарата железа (48,6 и 41,0%). При этом доля пациентов, которым потребовалось повторное внутривенное введение препарата железа через 56–90 дней, в основной группе была значительно ниже, чем в группе сравнения (5,6 и 11,1% соответственно; p
В статье описаны четыре типа комплексов парентеральных препаратов железа, в том числе внутривенных. Рассмотрены показания к применению внутривенных препаратов железа, особенности строения железа карбоксимальтозата, эффективность и безопасность его использования при различных заболеваниях, доказанные на основании метаанализа рандомизированных клинических исследований.
- КЛЮЧЕВЫЕ СЛОВА: типы комплексов железа, внутривенные препараты железа, железа карбоксимальтозат, types of iron complexes, intravenous iron preparations, ferric carboxymaltose
В статье описаны четыре типа комплексов парентеральных препаратов железа, в том числе внутривенных. Рассмотрены показания к применению внутривенных препаратов железа, особенности строения железа карбоксимальтозата, эффективность и безопасность его использования при различных заболеваниях, доказанные на основании метаанализа рандомизированных клинических исследований.
Во-первых, анемия часто не распознается и поэтому не лечится.
Во-вторых, анемия сопровождает многие хронические болезни и состояния.
В-третьих, если анемию не лечить, возможны серьезные последствия – более тяжелое течение хронического заболевания, снижение качества и продолжительности жизни пациента.
В-четвертых, анемию можно лечить с помощью современных методов.
В настоящее время для лечения анемии применяются следующие методы:
- переливание эритроцитной массы. Плюсы метода: широкое внедрение в клиническую практику, немедленный эффект, относительно невысокая стоимость. Минусы: возможность трансмиссии инфекционных агентов, супрессия гемопоэза реципиента, посттрансфузионные осложнения, необходимость определения группы крови и резус-фактора, дефицит донорских кадров [2, 3];
- применение гемоглобин-ассоциированного переносчика кислорода (Гемопюр). Плюсы: дешевое сырье (эритроциты быка) для приготовления препарата, отсутствие необходимости определять группу крови и резус-фактор, быстрый эффект, стимуляция образования собственных эритроцитов, большой срок годности (три года). Минусы: введение ксеногенного материала, небольшой опыт клинического применения, отсутствие данных о применении у детей, подростков, беременных и кормящих женщин [4];
- использование эритропоэтина (ЭПО). Плюсы: возможность использования препарата в любой момент (при его наличии) и отсутствие необходимости в переливании эритроцитной массы. Минусы: высокая стоимость препарата и курса лечения, отсроченный эффект (не ранее чем через одну-две недели), необходимость сочетания с препаратами железа, не всегда эффективное применение [5];
- применение пероральных препаратов железа. Плюсы: самый доступный и дешевый метод. Минусы: не всегда эффективен, медленное наступление эффекта [6];
- применение внутривенных препаратов железа. Плюсы: доступность препаратов, относительно низкая стоимость лечения, полное отсутствие риска трансмиссии инфекций и супрессии гемопоэза больного, быстрая доставка железа в костный мозг, возможность применения в сочетании с ЭПО. Минусы: отсроченный эффект [7].
Особенности лечения внутривенными препаратами железа сформулировал I.C. Macdougall [8]:
- такое лечение наиболее гарантированно доставляет железо в костный мозг;
- больные, получающие внутривенные препараты железа, нуждаются в тщательном клиническом наблюдении;
- может индуцироваться кратковременное появление свободного железа;
- в силу высокой токсичности некоторые препараты применяются только в низких дозах (глюконат железа);
- возможны осложнения: перегрузка железом, анафилактоидные реакции (вызываемые декстраном), отдаленная токсичность, повышение риска инфекций и др.
Свойства и особенности парентеральных препаратов железа
Выделяют четыре группы парентеральных препаратов железа с учетом кинетических (лабильные, стабильные) и термодинамических (слабые, сильные) свойств. Препараты этих групп различаются стабильностью комплекса, молекулярной массой, токсичностью, гистотоксичностью, фармакокинетикой и наличием нежелательных явлений.
Комплексы 1-го типа: декстран железа и декстрин железа. Оба комплекса стабильные, с молекулярной массой более 100 кД. Известны также комплексы декстрана железа для внутривенного введения: низкомолекулярные – с молекулярной массой до 200 кД и высокомолекулярные – с молекулярной массой более 200 кД [9]. Эти комплексы отличаются высокой структурной гомогенностью, поэтому содержащееся в них железо выделяется очень медленно. Период полураспада декстрана железа составляет 3–4 дня. Высокая стабильность комплекса и медленное выделение содержащегося в нем железа позволяют относить комплексы декстрана железа к клинически безопасным. Развитие нежелательных явлений вследствие применения таких комплексов маловероятно. Однако из-за высокой молекулярной массы эти комплексы могут в редких случаях вызывать аллергические реакции. Реактогенность комплексов декстрана железа также зависит от способа введения. При внутривенном введении реакции наблюдаются чаще. Следует отметить, что с увеличением молекулярной массы реактогенность комплексов декстрана железа при внутривенном введении возрастает [9]. Декстрины железа лишены этого [10].
Комплексы 2-го типа: комплексы железа средней стабильности, такие как железа(III) гидроксид сахарозный комплекс с молекулярной массой от 30 до 100 кД. Время полураспада этих комплексов около шести часов. Железо преимущественно доставляется в ретикулоэндотелиальную систему (РЭС) и печень трансферрином и апоферритином, а также обнаруживается в почках и костном мозге. Железо быстро метаболизируется и становится доступным для эритропоэза. При медленном введении обычной терапевтической дозы железа с помощью инъекции или инфузии транспортная система не перегружается и свободные ионы железа не поступают в кровоток. Стабильность комплекса и распределение железа делают эту группу комплексов железа относительно безопасной. Кроме того, поскольку комплексы не содержат биологических полимеров, анафилактоидные реакции достаточно редки [9, 11].
Комплексы 3-го типа: лабильные и слабые комплексы железа с молекулярной массой менее 50 кД, например, глюконат железа(III), цитрат железа(III) и сорбитол железа(III). Применение глюконата железа в дозах, в которых используются комплексы 1-го и 2-го типов, вызывает тяжелый и обширный некроз печени. Железо обнаруживается не только в РЭС, но и в паренхиме печени, что ведет к индуцируемому свободными радикалами перекисному окислению липидов. Цитрат железа и сорбитол железа имеют очень низкую молекулярную массу (около 8,7 кД) и быстро выводятся почками. Поэтому очень небольшое количество железа может быть захвачено эндогенными железосвязывающими белками.
Комплексы 4-го типа совмещают как минимум два комплекса разных типов (например, глюконат железа + сахарат железа или цитрат железа + сорбитол железа + декстрин железа); выделяют железо, которое может быть захвачено всеми типами белков; связь с трансферрином или апоферритином возможна только в случае применения очень малых доз. Лишнее железо захватывается белками, такими как альбумин, и метаболизируется.
При соблюдении рекомендуемой дозы препараты 1-го и особенно 2-го типа оптимальны для внутривенного введения в силу биохимических особенностей. Комплексы 3-го типа должны назначаться преимущественно внутримышечно, поскольку при внутривенном введении они быстро выводятся почками из-за низкой молекулярной массы. Однако и при внутримышечном введении абсорбция комплексов этого типа может существенно различаться. Как следствие, риск возникновения местных и системных нежелательных явлений, таких как боль, некроз, изменение цвета кожи в месте инъекции. Для комплексов 3-го и 4-го типов характерно главным образом токсическое повреждение клеток. Эти комплексы чаще других вызывают токсические побочные эффекты. Высокая почечная экскреция исключает возможность рекомендовать их для клинического использования [10, 12].
В связи с ненадежностью комплексов 3-го и 4-го типов и механизмами распределения железа при использовании ни один из комплексов не может быть охарактеризован как клинически безопасный. Даже в случае применения очень малых доз возможны токсические реакции. Внутривенное применение этих комплексов не рекомендуется.
Совершенствование препаратов железа, в том числе парентеральных, привело к тому, что острая токсичность препаратов, определяемая по LD 50 , значительно снизилась и выходит за пределы терапевтических доз (табл. 1) [13].
Анафилактоидные реакции
При использовании высокомолекулярного декстрана железа анафилактоидные реакции наблюдались в 0,6–2,3% случаев [14], низкомолекулярного декстрана железа – менее чем в одном случае на 10 000 [15], сахарозного комплекса железа – в 0,0046% случаев (17 случаев на 367 000 больных, или 0,46 случая на 10 000) [7].
Виды внутривенного введения препаратов железа
Перечислим виды внутривенного введения препаратов железа:
- внутривенная инъекция: 100 мг железа, струйно, медленно, не менее чем за 5 мин;
- внутривенная инфузия: 100–200 мг железа, капельно, в 100–200 мл физиологического раствора, в течение не менее чем от 15 до 60 мин;
- внутривенная однократная инфузия общей дозы железа с введением 500–1000 мг железа.
Показания к назначению парентеральных препаратов железа
Показаниями к назначению парентеральных препаратов железа, в том числе внутривенных, являются:
- тяжелые формы железодефицитной анемии (ЖДА) (менее 3% больных);
- неэффективность или непереносимость пероральных препаратов железа;
- наличие язвенной болезни и операций на желудочно-кишечном тракте, даже в анамнезе;
- необходимость быстрого насыщения организма железом.
Лечение парентеральными препаратами железа должно быть безопасным. Для этого следует:
- использовать парентеральные препараты только при наличии показаний;
- обязательно применять тест-дозу, если это указано в инструкции по применению препарата;
- использовать современные препараты железа;
- не превышать общий дефицит железа в организме, рассчитанный по формуле;
- не превышать коэффициент насыщения трансферрина железом (НТЖ).
Гидроксид сахарозный комплекс железа – это высокомолекулярный комплекс (молекулярная масса 45–50 кД), состоящий из центрально расположенного ядра трехвалентной гидроокиси железа, окруженного молекулами сахарозы. По строению комплекс похож на молекулу сывороточного ферритина (СФ) – естественного белка (металлопротеина), ответственного за хранение железа в организме, но вместо белковой оболочки, окружающей ядро, использована оболочка из полисахарида. Считается, что это снизило иммуногенность молекулы [7].
Современные препараты железа для внутривенного введения представлены в табл. 2.
Новая молекула – железа карбоксимальтозат
После создания гидроксид сахарозного комплекса было показано, что, используя различные полисахариды в качестве оболочки в молекуле препарата железа, можно создавать препараты с различными свойствами. Таким образом были получены гидроксид полимальтозный комплекс для перорального применения и железа карбоксимальтозат для внутривенного введения (см. рисунок).
Комплекс состоит из 1000 атомов железа с высоким содержанием железа – около 27%, молекулярная масса комплекса примерно 150 кД. Таким строением молекулы объясняются определенные свойства. При физиологическом значении pH около 7,0 гидроксид железа обычно не растворим. В комбинации с органическими молекулами, такими как карбоксимальтоза, он может поступать в раствор в виде коллоидных частиц. Большинство оксидов и гидроксидов железа в организме человека находится в ядре СФ. Матрикс препарата гидроксида железа обеспечивает такую же растворимость, как и у СФ. После поглощения макрофагами железа карбоксимальтозат переносится к СФ. Период высвобождения моноядерных гидроксидов железа из карбоксимальтозы составляет от 7 до 21 часа [16].
Особенностями препарата Феринжект ® являются отсутствие необходимости применения тест-дозы, возможность введения в течение 15 минут, применение до 1000 мг препарата один раз в неделю.
Препарат Феринжект ® применяют в лечении ЖДА (любой), анемии при воспалительных заболеваниях кишечника (болезнь Крона, неспецифический язвенный колит), хронической болезни почек, акушерских и гинекологических ситуациях, сердечной недостаточности, анемии, вызванной противоопухолевой терапией.
Изучены эффективность и безопасность внутривенного введения железа карбоксимальтозата (Феринжект ® ). В метаанализ были включены 14 рандомизированных контролируемых исследований [17]. Согласно рандомизации пациенты с анемией, в том числе ЖДА, и различными заболеваниями (хроническая болезнь почек, воспалительные заболевания кишечника, сердечная недостаточность, акушерские и гинекологические ситуации) получали железа карбоксимальтозат (n = 2348), пероральные препараты железа (n = 832), внутривенный препарат сахарата железа (n = 384) или плацебо (n = 762). Феринжект ® вводили в дозе, рассчитанной по формуле, но не более 1000 мг в неделю. В конце исследования в группе пациентов, получавших Феринжект ® , прирост концентрации гемоглобина, концентрации СФ и НТЖ был больше, чем в группе пациентов, получавших пероральные препараты железа – в среднем на 4,8 г/л (95% доверительный интервал (ДИ) 33–63), 163 мкг/л (95% ДИ 153–173) и 5,3% (95% ДИ 3,7–6,8) соответственно. Количество случаев запора, поноса, тошноты и рвоты при использовании препарата Феринжект ® было значительно меньше, чем при пероральном приеме препаратов железа.
Применение внутривенных препаратов железа полностью соответствует развитию современной трансфузионной медицины, которая за свою богатую историю проделала три этапа: этап 1 – переливание цельной крови, этап 2 – компонентная гемотерапия с применением раздельно эритроцитов, тромбоцитов, лейкоцитов, плазмы, кровезаменителей, этап 3 – препаратная гемотерапия с отказом (по возможности) от клеточных субстратов и с использованием ЭПО, колониестимулирующих факторов, внутривенных препаратов железа, модифицированного гемоглобина, перфторанов [2, 3].
Эволюция внутривенных препаратов железа способствовала появлению высокоэффективных и безопасных препаратов, а разработки последних лет позволили сделать возможным одномоментное введение всего недостающего количества железа в организме. Получены убедительные доказательства того, что внутривенное введение железа карбоксимальтозата эффективно в лечении анемии при многих заболеваниях. Частота развития таких нежелательных явлений, как запор, диарея, тошнота, рвота, была значительно меньше при введении железа карбоксимальтозата, чем при пероральном приеме препаратов железа. Преимуществами препарата Феринжект ® являются возможность применения высоких доз, быстрое одномоментное введение, отсутствие необходимости применения тест-дозы. В современной сопроводительной терапии появилась возможность коррекции анемии с помощью препарата железа нового поколения – железа карбоксимальтозата.
Читайте также:

