14 биохимия мышечного сокращения реферат
Обновлено: 04.07.2024
М. Аталай и О.О.П. Хяннинен Университет Куопио, Финляндия
Мышцы состоят из ткани, способной сокращаться. Выделяют три основных типа мышц -скелетная, сердечная и гладкая. В мышечных клетках всех трех типов большинство образуемой энергии используется для мышечного сокращения, которое осуществляется за счет скольжения молекул актина вдоль молекул миозина. Помимо этого, энергия используется для перемещения Са2+ из саркоплазмы в саркоплазматическую сеть после окончания мышечного сокращения. Энергия требуется и для переноса ионов натрия и калия через мембрану миоцита (мышечной клетки) для поддержания градиента концентрации.
Основное топливо в мышцах - это макроэргическое фосфатное соединение аденозинтрифосфат (АТФ). Однако запаса АТФ в мышцах хватило бы только на 1-2 с. Креатинфосфат (КФ), который также содержит макроэргическую связь, является быстрым источником энергии для регенерации АТФ. Запасы КФ также ограничены и предоставляемой энергии хватило бы всего на 5-8 с мышечных сокращений. Основной источник энергии для мышц - это глюкоза и жирные кислоты, потребление которых зависит от веса и физического состояния организма, а также от доступности кислорода. Образование АТФ при цитозольном гликолизе, митохондриальном бета-окислении жирных кислот и в цикле трикарбоновых кислот строго регулируется и коррелирует с потребностями мышц в большем количестве АТФ. Когда потребности в энергии превышают возможность скелетной мышцы предоставить АТФ посредством цикла трикарбоновых кислот в окислительных условиях, стимулируется гликолиз и вырабатывается молочная кислота, что приводит к образованию АТФ в анаэробных условиях - без кислорода.
Сердечная мышца может функционировать за счет разных источников энергии и мало зависит от обмена глюкозы. Гладкая мышца работает более эффективно и требует меньше АТФ, чем сердечная и скелетная мышцы.
Мышечная ткань - эта ткань организма, которая характеризуется способностью к сокращению, возникающему обычно в ответ на сигнал нервной системы. Среди трех типов мышц скелетная и сердечная потребляют наибольшее количество энергии. Сердце - это мышечный насос, за счет которого кровь циркулирует по руслу. Несмотря на то, что сердечная мышца мала по сравнению с другими типами мышечной ткани, она очень хорошо снабжается кровью и характеризуется активным энергетическим обменом.
Гладкие мышцы можно обнаружить в первую очередь в дыхательной, мочеполовой системах, желудочно-кишечном тракте и кровеносных сосудах. Многие жизненно важные функции контролируются за счет сокращения и тонуса гладкой мускулатуры в этих тканях и органах, например, поддержание кровотока и кровяного давления, регуляция воздушного потока в дыхательной системе, продвижение содержимого желудка и выведение мочи. Гладкие мышцы используют сравнительно небольшое количество энергии, несмотря на тяжелую работу, которую они выполняют. Масса опорно-двигательного аппарата, включая скелетные мышцы, составляет около двух третей от общей массы тела. В состоянии покоя на скелетные мышцы приходится одна шестая часть от минутного объема, что сопоставимо с долей мозга. В период наибольшей активности при аэробной работе мышцы потребляют наибольшее количество кислорода, и циркуляция крови в них составляет четыре пятых от минутного сердечного объема.
Энергетический обмен в скелетных мышцах уникален. Помимо аэробной работы они приспособлены к кратковременной анаэробной активности, что позволяет увеличить выносливость при физической активности более низкой интенсивности и дает возможность для кратковременной высокоактивной деятельности. Уровень потребления АТФ в скелетной мышце может сильно меняться, более чем в сто раз. Изменение количества потраченного АТФ приводит к компенсаторным изменениям в циркуляторной, сердечной и дыхательной функциях. В организме человека в состоянии покоя скелетная мышца получает примерно 5 мл крови на 100 г ткани. Во время тяжелых физических упражнений доля минутного сердечного объема мышечной ткани может возрастать у тренированного организма до четырех пятых или даже больше от общего минутного объема (рис. 1). Выделение кислорода также возрастает, в пользу чего свидетельствует повышение артериовенозной разности с 25% в состоянии покоя до 80% или даже больше при максимальной физической нагрузке. Таким образом, потребление кислорода в рабочей мышце может возрастать в сто раз; это на самом деле небольшое повышение в сравнении с некоторыми животными, у которых повышение может быть в тысячи раз.
Обмен в мышцах характеризуется следующими утверждениями о биохимическом энергетическом объеме:
- химическая энергия накапливается в мышцах в виде АТФ и креатинфосфата;
- АТФ предоставляет энергию для всех типов мышечной работы;
- АТФазы - ферменты, которые расщепляют АТФ и высвобождают энергию для мышечной работы и обмена веществ, являются потребителем в данном процессе и определяют энергетическое состояние;
- эта потребность удовлетворяется непрерывным аэробным обменом веществ.
- Рабочая единица всех мышц - это миофибрилла, мелкая нитевидная структура, состоящая из белков. Каждая мышечная клетка (волокно) содержит несколько миофибрилл, которые состоят из строго упорядоченных толстых и тонких мышечных филаментов.

Рис. 1. Распределение минутного объема, выраженное как кровоток в различные ткани, в покое и при максимальной физической нагрузке. Источник: Hanninen, Atalay, 1998, p. 29
Сокращения в скелетных мышцах в норме связаны с деполяризацией плазматической мембраны, которая вызывает высвобождение ионов кальция из внутриклеточных запасов в саркоплазматическом ретикулуме. Ионы кальция связываются с тропонином С - регуляторным белком, связанным с тонкими филаментами, что приводит к изменению конформации белка. Это изменение формы передается другим компонентам филамента (тропонин Т, тропонин I, тропомиозин и актин), что позволяет субъединицам актина взаимодействовать с соседними молекулами миозина. Сокращение останавливается, когда ионы кальция поглощаются саркоплазматическим ретикулумом через АТФ-зависимый насос, известный как Са2+АТФаза.
Скелетные мышцы получают энергию в основном из глюкозы и жирных кислот. Она также хранится в значительном количестве в мышечных волокнах в виде гликогена и триглицеридов. Химическая энергия связей углеводов, жиров и белков высвобождается в виде АТФ -источника быстрой энергии. Аденозинфосфаты участвуют в циклах в качестве акцепторов и доноров энергии: запасы АТФ восполняются во время окисления источников энергии и используются при работе скелетных мышц. АТФ состоит из молекулы аденозина, связанной с тремя фосфатными группами. Связи молекулы с фосфатными группами называются ма-кроэргическими, поскольку при их гидролизе (взаимодействии с водой) высвобождается 7,3 ккал энергии. Эта реакция катализируется ферментом, который называется аденозинтри-фосфатаза (АТФаза), а конечным продуктом реакции является молекула аденозина, содержащая две фосфатные группы 1 аденозиндифосфат (АДФ). Дополнительную энергию можно получить при гидролизе второй фосфатной группы; конечный продукт i это аденозинмо-нофосфат (АМФ).
АТФ + Н20 - АТФаза— АДФ + Р + 7,3 ккал/моль
Запасов АТФ достаточно, чтобы обеспечить мышцы энергией на несколько секунд.
В скелетных мышцах человека всего хранится 80 г АТФ. Однако расход АТФ у наиболее выносливых спортсменов может достигать 75-80% от массы тела за счет постоянного восполнения содержания АТФ в мышцах. По мере расходования АТФ синтезируется посредством трех механизмов: быстрый из макроэргических фосфатов (креатинфосфат), средней продолжительности (анаэробный гликолиз) и длительный (окислительное фосфорилирование глюкозы и жирных кислот до воды и С02). Окисление жиров и углеводов - это основной источник повторного синтеза АТФ; это медленный и непрерывный процесс. Быстрое восполнение запасов АТФ поддерживается без кислорода за счет КФ - макроэргического фосфата. Энергия высвобождается при распаде КФ и идет на немедленный синтез АТФ. АТФ и КФ (фосфагенная система) являются важным и необходимым источником энергии для сокращения мышц, особенно при физических нагрузках, для которых необходимо большое количество энергии за малое время, например, при быстром старте спринтеров и прыгунов в высоту. Для длительного аэробного обмена веществ необходимо поддерживать стационарное равновесие между синтезом и распадом АТФ. Поэтому концентрации АТФ и КФ довольно постоянны (примерно 5 ммоль/л и 30 ммоль/л, соответственно). Во время фазы восстановления после мышечного сокращения КФ синтезируется повторно из продуктов его распада креатина и неорганического фосфата за счет АТФ. Энергия, необходимая для восполнения фосфагена, образуется при аэробном обмене веществ.
БИОХИМИЯ МЫШЦ И МЫШЕЧНОГО СОКРАЩЕНИЯ
Описание: БИОХИМИЯ МЫШЦ И МЫШЕЧНОГО СОКРАЩЕНИЯ. Механизм мышечного сокращения и расслабления. Важнейшей особенностью функционирования мышц является то что в процессе мышечного сокращения происходит непосредственное превращение химической энергии АТФ в механическую энергию сокращения мышц. Биохимически они различаются механизмами энергетического обеспечения мышечного сокращения.
Дата добавления: 2014-06-18
Размер файла: 712.31 KB
Работу скачали: 292 чел.
Поделитесь работой в социальных сетях
Если эта работа Вам не подошла внизу страницы есть список похожих работ. Так же Вы можете воспользоваться кнопкой поиск
1. Общая характеристика мышц. Строение мышечных клеток.
2. Строение миофибрилл.
3. Механизм мышечного сокращения и расслабления.
1. Общая характеристика мышц. Строение мышечных клеток.
Учение о мышцах это важнейший раздел биохимии, имеющий исключительное значение для спортивной биохимии.
Важнейшей особенностью функционирования мышц является то, что в процессе мышечного сокращения происходит непосредственное превращение химической энергии АТФ в механическую энергию сокращения мышц. Это явление не имеет аналогов в технике и присуще только живым организмам.
При изучении скелетных мышц с помощью светового микро скопа в них обнаружили поперечную исчерченность; отсюда их название поперечно-полосатые.
В скелетной мышце выделяют сухожильную головку, которой мышца начинается на кости, мышечное брюшко, состоящее из волокон, и сухожильный хвост, которым мышца заканчивается на другой кости (рис.).
Мышечное волокно структурная единица мышцы. Известны три типа мышечных волокон: белые быстро сокращающиеся ( VT ), промежуточные ( FR ) и медленно сокращающиеся ( ST ). Биохи мически они различаются механизмами энергетического обес печения мышечного сокращения. Их иннервируют разные мотоней роны, чем обусловлены неодновременность включения в работу и различная скорость сокращения волокон. Разные мышцы имеют разное сочетание типов волокон.

Каждая мышца состоит из нескольких тысяч мышечных воло кон, объединяемых соединительными прослойками и такой же оболочкой. Мышца представляет собой многокомпонентный комплекс. Чтобы разобраться в строении мышцы следует изучить все уровни ее организации и структуры, входящие в ее состав.
У животных и человека два основных типа мышц: поперечнополосатые и гладкие , причем поперечнополосатые мышцы делятся на два вида скелетные и сердечные . Гладкие мышцы характерны для внутренних органов, кровеносных сосудов.
Поперечнополосатые мышцы состоят из тысяч мышечных клеток волокон. Волокна объединены соединительно-тканными прослойками и такой же оболочкой фасцией . Мышечные волокна миоциты - представляют собой сильно вытянутые многоядерные клетки гигантских размеров от 0,1 до 10см длиной и толщиной около 0,1 0,2 мм.
Миоцит состоит из всех обязательных компонентов клетки. Особенностью мышечного волокна является то, что внутри эта клетка содержит большое количество сократительных элементов миофибрилл. Как и другие клетки тела миоциты содержат ядро, причем, у клеток поперечнополосатых мышц ядер несколько, рибосомы, митохондрии, лизосомы, цитоплазматическую сеть.
Цитоплазматическая сеть называется в этих клетках саркоплазматической сетью. Она связана с помощью особых трубочек, называемых Т-трубочками, с клеточной мембранной сарколеммой. Особо следует выделить в саркоплазматической сети пузырьки, называемые цистернами. Они содержат большое количество ионов кальция. С помощью специального фермента кальций накачивается в цистерны. Этот механизм называется кальциевым насосом и необходим для сокращения мышцы.
Цитоплазма или саркоплазма миоцитов содержит большое количество белков. Здесь немало активных ферментов, среди которых важнейшими являются ферменты гликолиза , креатинкиназа. Немалое значение имеет белок миоглобин, сохраняющий кислород в мышцах.
Кроме белков в цитоплазме мышечных клеток содержатся фосфогены АТФ, АДФ, АМФ, а также креатинфосфат, необходимые для нормального снабжения мышцы энергией.
Основной углевод мышечной ткани гликоген. Его концентрация достигает 3%. Свободная глюкоза в саркоплазме встречается в малых концентрациях. В тренируемых на выносливость мышцах накапливается запасной жир .
Снаружи сарколемма окружена нитями белка коллагена. Мышечное волокно растягивается и возвращается в исходное состояние за счет упругих сил, возникающих в коллагеновой оболочке.
2. Строение миофибрилл.
Сократительные элементы миофибриллы занимают большую часть объема миоцитов. В нетренированных мышцах миофибриллы расположены, рассеяно, а тренированных они сгруппированы в пучки, называемые полями Конгейма .
Микроскопическое изучение строения миофибрилл показало, что они имеют диаметр около 1 мкм и состоят из чередующихся светлых и темных участков или дисков. В мышечных клетках миофибриллы располагаются таким образом, что светлые и темные участки рядом расположенных миофибрилл совпадают, что создает видимую под микроскопом поперечную исчертанность всего мышечного волокна.
Использование электронного микроскопа с очень большим увеличением позволило расшифровать строение миофибрилл и установить причины наличия у них светлых и темных участков. Было обнаружено, что миофибриллы являются сложными структурами, построенными в свою очередь, из большого числа мышечных нитей дух типов толстых и тонких. Толстые в два раза толще тонких, соответственно 15 и 7 нм.
Состоят миофибриллы из чередующихся пучков параллельно расположенных толстых и тонких нитей, которые концами заходят друг на друга.
Участок миофибриллы, состоящий из толстых нитей и находящимися между ними концов тонких нитей, обладает двойным лучепреломлением. Под микроскопом эти участки кажутся темными и получили название анизотропных или темных дисков (А-диски).
Тонкие участки состоят из тонких нитей и выглядят светлыми, так как не обладают двойным лучепреломлением и легко пропускают свет. Такие участки называются изотропными или светлыми дисками ( I -диски).
Рисунок. Схема строения миофибриллы
В середине пучка тонких нитей (диск I ) поперечно располагается тонкая пластинка из белка, которая фиксирует положение мышечных нитей в пространстве и одновременно упорядочивая расположение А- и I -дисков многих миофибрилл. Эта пластинка хорошо видна под микроскопом и названа Z -пластинкой или Z -линией .
Диски А имеют в середине более светлую полосу зону Н, пересекаемую более темной М зоной.
Участок между соседними Z -линиями называется саркомер. Каждая миофибрилла состоит из нескольких сотен саркомеров (до 1000-1200).

а
I -диск А-диск I -диск
Рисунок. Структура мышцы на разных уровнях организации: а мышечное волокно; б расположение миофибриллы в покоящейся мышце
Каждый саркомер включает: 1) сеть поперечных трубочек, ориентированных под углом 90° к продольной оси волокна и соединяющихся с наружной поверхностью клетки; 2) саркоплаз-матический ретикулум, составляющий 810% объема клетки; 3) несколько митохондрий.
Диски I состоят только из тонких филаментов, а диски А из филамен тов двух типов. Зона Н содержит только толстые филаменты, линия Z скрепляет тонкие филаменты между собой. Между толстыми и тонкими филаментами расположены поперечные мостики (спайки) толщиной около 3 нм; расстояние между этими мости ками 40 нм.
Изучение химического состава миофибрилл показало, что тонкие и толстые нити образованы белками . Палочковидная молекула миозина состоит из двух идентичных основных цепей (по 200 кДа) и четырех легких цепей (по 20 кДа), общая масса миозина около 500 кДа.
Толстые нити состоят из белка миозина. Эти белки образуют двойную спираль с глобулярной головкой на конце, присоединенной к очень длинному стержню. Стержень представляет собой двухцепочечную а-спирализованную супер спираль.
Миозиновые головки обладают АТФазной активностью, то есть способностью расщеплять АТФ. Второй участок миозина обеспечивает связь толстых нитей с тонкими. Общая струк тура миозина показана на рисунке.

хвост
Рисунок. Схематичное изображение молекулы миозина
Тонкие нити состоят из белков актина, тропонина и тропомиозина.
Основной белок в данном случае актин . Он обладает двумя важнейшими свойствами:
- образует фибриллярный актин, способный к быстрой полимеризации;
- актин способен соединяться с миозиновыми головками поперечными мостиками.
Актин водорастворимый глобулярный белок с молекулярной массой 42 кДа; эта форма актина обозначается как G -актин. В мы шечном волокне актин находится в полимеризованной форме, которая обозначается как F -актин. Тонкие филаменты мышцы об разованы двунитчатыми актиновыми структурами, связанными между собой нековалентными связями.
Другие белки тонких нитей помогают актину осуществлять его функции.
Тропонин (Тн), мо лекулярная масса которого около 76 кДа. Он представляет собой сферическую молекулу, состоящую из трех разных субъединиц, получивших название в соответствии с выполняемыми функция ми: тропомиозинсвязывающей (Тн-Т), ингибирующей (Тн-1) и кальцийсвязывающей (Тн-С). Каждый компонент тонких фила ментов соединяется с двумя другими нековалентными связями:
F -актин тропомиозин
Тн-1 Тн-Т

В мышце, где все рассмотренные компоненты собраны вместе в тонком филаменте (рис.), тропомиозин блокирует присоеди нение миозиновой головки к находящемуся рядом молекулами глобулярного актина тонких нитей ( F -актину).

Рисунок. Упаковка миозиновых молекул при образовании толстого филамента
Миозин выполняет три биологически важные функции:
При физиологических значениях ионной силы и рН молеку лы миозина спонтанно образуют волокно.
Миозин обладает каталитической активностью, т. е. является ферментом. В 1939 г. ВА Энгельгардт и М.Н. Любимова обнаружили, что миозин способен катализировать гидролиз АТФ. Эта реакция является непосредственным источником свободной энергии, не обходимой для мышечного сокращения.
Миозин связывает полимеризованную форму актина ос новного белкового компонента тонких миофибрилл. Именно это взаимодействие, как будет показано ниже, играет ключевую роль в мышечном сокращении.
Строение и механизм сокращения скелетных мышц.

3. Механизм мышечного сокращения и расслабления.
Подвижность является характерным свойством всех форм жизни. Направленное движение имеет место при расхождении хромосом в процессе клеточного деления, активном транспорте молекул, пе ремещении рибосом в ходе белкового синтеза, сокращении и рас слаблении мышц. Мышечное сокращение наиболее совершенная форма биологической подвижности. В основе любого движения, в том числе и мышечного, лежат общие молекулярные механизмы.
У человека различают несколько видов мышечной ткани. По перечно-полосатая мышечная ткань составляет мышцы скелета (скелетные мышцы, которые мы можем сокращать произвольно). Гладкая мышечная ткань входит в состав мышц внутренних орга нов: желудочно-кишечного тракта, бронхов, мочевыводящих путей, кровеносных сосудов. Эти мышцы сокращаются непроиз вольно, независимо от нашего сознания.
В данной главе мы рассмотрим строение и процессы сокращения и расслабления скелетных мышц, поскольку именно они пред ставляют наибольший интерес для биохимии спорта.
Механизм мышечного сокращения до настоящего времени раскрыт не полностью.
Достоверно известно следующее.
1. Источником энергии для мышечного сокращения являются молекулы АТФ.
2. Гидролиз АТФ катализируется при мышечном сокращении миозином, обладающим ферментативной активностью.
3. Пусковым механизмом мышечного сокращения является повышение концентрации ионов кальция в саркоплазме миоцитов, вызываемое нервным двигательным импульсом.
4. Во время мышечного сокращения между тонкими и толстыми нитями миофибрилл возникают поперечные мостики или спайки.
5. Во время мышечного сокращения происходит скольжение тонких нитей вдоль толстых, что приводит к укорочению миофибрилл и всего мышечного волокна в целом.
В покоящейся мышце тонкие и толстые нити находятся в разъединенном состоянии.
Под воздействием нервного импульса ионы кальция выходят из цистерн саркоплазматической сети и присоединяются к белку тонких нитей тропонину. Этот белок меняет свою конфигурацию и меняет конфигурацию актина. В результате образуется поперечный мостик между актином тонких нитей и миозином толстых нитей. При этом повышается АТФазная активность миозина. Миозин расщепляет АТФ и за счет выделившейся при этом энергии миозиновая головка подобно шарниру или веслу лодки поворачивается, что приводит к скольжению мышечных нитей навстречу друг другу.
Совершив поворот, мостики между нитями разрываются. АТФазная активность миозина резко снижается , прекращается гидролиз АТФ. Однако при дальнейшем поступлении нервного импульса поперечные мостики вновь образуются, так как процесс, описанный выше, повторяется вновь.
В каждом цикле сокращения расходуется 1 молекула АТФ.
В основе мышечного сокращения лежат два процесса:
спиральное скручивание сократительных белков;
циклически повторяющееся образование и диссоциация ком плекса между цепью миозина и актином.
Мышечное сокращение инициируется приходом потенциала действия на концевую пластинку двигательного нерва, где выделяется нейрогормон ацетилхолин, функцией которого яв ляется передача импульсов. Сначала ацетилхолин взаимодействует с ацетилхолиновыми рецепторами, что приводит к распростране нию потенциала действия вдоль сарколеммы. Все это вызывает увеличение проницаемости сарколеммы для катионов Na + , которые устремляются внутрь мышечного волокна, нейтрализуя отрицатель ный заряд на внутренней поверхности сарколеммы. С сарколеммой связаны поперечные трубочки саркоплазматического ретикулума, по которым распространяется волна возбуждения. От трубочек волна возбуждения передается мембранам пузырьков и цистерн, которые оплетают миофибриллы на участках, где происходит взаи модействие актиновых и миозиновых нитей. При передаче сигнала на цистерны саркоплазматического ретикулума, последние начина ют освобождать находящийся в них Са 2+ . Высвобожденный Са 2+ связывается с Тн-С, что вызывает конформационные сдвиги, передающиеся на тропомиозин и далее на актин. Актин как бы освобождается из комплекса с компонентами тонких филамен-тов, в котором он находился. Далее актин взаимодействует с мио зином, и результатом такого взаимодействия является образова ние спайки, что делает возможным движение тонких нитей вдоль толстых.
Генерация силы (укорочение) обусловлена характером взаи модействия между миозином и актином. На миозиновом стержне имеется подвижный шарнир, в области которого происходит по ворот при связывании глобулярной головки миозина с опреде ленным участком актина. Именно такие повороты, происходящие одновременно в многочисленных участках взаимодействия миозина и актина, являются причиной втягивания актиновых филаментов (тонких нитей) в Н-зону. Здесь они контактируют (при макси мальном укорочении) или даже перекрываются друг с другом, как это показано на рисунке.



б в
Рисунок. Механизм сокращения: а состояние покоя; б умеренное сокращение; в максимальное сокращение
Затрата АТФ необходима и для расслабления мышц. После прекращения действия двигательного импульса Са 2+ переходит в цистерны саркоплазматического ретикулума. Тн-С теряет свя занный с ним кальций, следствием этого являются конформаци-онные сдвиги в комплексе тропонин-тропомиозин, и Тн- I снова закрывает активные центры актина, делая их неспособными взаимодействовать с миозином. Концентрация Са 2+ в области со кратительных белков становится ниже пороговой, и мышечные волокна теряют способность образовывать актомиозин.
В этих условиях эластические силы стромы, деформированной в момент сокращения, берут верх, и мышца расслабляется. При этом тонкие нити извлекаются из пространства между толстыми нитями диска А, зона Н и диск I приобретают первоначальную длину, линии Z отдаляются друг от друга на прежнее расстояние. Мышца становится тоньше и длиннее.
Скорость гидролиза АТФ при мышечной работе огромна: до 10 мк моль на 1 г мышцы за 1 мин. Общие запасы АТФ невелики, поэтому для обеспечения нормальной работы мышц АТФ должна восстанавливаться с той же скоростью, с какой она расходуется.
Расслабление мышцы происходит после прекращения поступления длительного нервного импульса. При этом проницаемость стенки цистерн саркоплазматической сети уменьшается, и ионы кальция под действием кальциевого насоса, используя энергию АТФ, уходят в цистерны. Концентрация ионов кальция в саркоплазме быстро снижается до исходного уровня.Белки вновь приобретают конформацию характерную для состояния покоя.
Таким образом, и процесс мышечного сокращения и процесс мышечного расслабления это активные процессы, идущие с затратами энергии в виде молекул АТФ,
В гладких мышцах нет миофибрилл. Тонкие нити присоединяются к сарколемме, толстые находятся внутри волокон. Ионы кальция также играют роль в сокращении, но поступают в мышцу не из цистерн, а из внеклеточного вещества, поскольку в гладких мышцах отсутствуют цистерны с ионами калькия. Этот процесс медленный и поэтому медленно работают гладкие мышцы.
Рисунок. Схема расположения толстых и тонких нией в гладких мышечных волокнах.
Громова О.А., Егорова Е.Ю., Торшин И.Ю.
Ивановская государственная медицинская академия, Иваново. Российский сотрудничающий центр “Институт микроэлементов” ЮНЕСКО. Ивановский государственный университет, Иваново.
В статье обсуждается проблема дефицита магния в организме, проявляющегося таким симптомом, как судороги. Рассматривается биохимия мышечного сокращения, раскрывается физиологическая роль магния, взаимосвязь дефицита магния и судорог, особенности магнезиальной терапии и синергичный эффект применения магния и одного из его фармакологических носителей – оротовой кислоты.
Судорогами называют непроизвольные мышечные сокращения, существенно различающиеся по продолжительности, интенсивности и локализации, этиологии и патогенезу. В зависимости от механизма развития выделяют эпилептические и неэпилептические судороги. Последние могут быть связаны с патологией центральной и периферической нервной системы. Хорошо известно, что развитию судорог способствуют нарушения минерального баланса: в частности гипомагнезиемия [1–11]. Дефицит магния часто не учитывают при анализе патофизиологии судорог различной этиологии. Между тем участие магния в нервно-мышечной работе убедительно доказано с помощью методов доказательной медицины и результатами эпидемиологических исследований [6, 13–15].
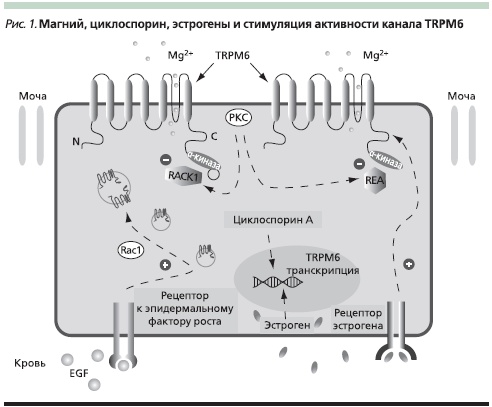
В исследованиях Wijst и соавт. (2009) установлено, что одним из основных регуляторов судорог, зависимых от уровня магния в крови, является магниевый канал TRPM6. На экспрессию этого гена влияют определенные гормоны (например, эстрогены) и определенные лекарства (например, циклоспорин), меняющие кислотно-основной баланс и способные повышать судорожную готовность и даже ее провоцировать (циклоспорин А). Длительный прием препаратов, содержащих эстрогены (средства для заместительной терапии и оральные контрацептивы), также провоцирует активность канала и усиливает потери магния, приводя к магнийдефицитным судорогам (рис. 1). Активность канала TRPM6 зависит от уровня внутриклеточного магния, рН и АТФ. Эпидермальный фактор роста и рецепторы эстрогенов тоже могут непосредственно стимулировать активность канала TRPM, который регулирует абсорбцию магния в дистальных канальцах почек. Активность канала также моделируется рядом белков (RACK1, REA, RAC1) [14].
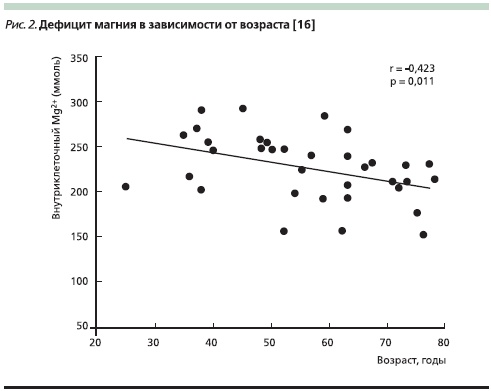
C возрастом в 2–3 раза увеличивается вероятность судорог икроножных мышц, подергиваний отдельных мышц спины и т. д., падает уровень магния (рис. 2). Основные механизмы снижения уровня магния с возрастом включают неадекватное его потребление, уменьшение абсорбции, что, возможно, связано с уменьшением потребления витамина D, увеличение потерь с мочой при приеме диуретиков и вследствие вышеперечисленных болезней пожилого возраста. Поэтому поддержание уровня магния на оптимальном уровне у пожилых является хорошей рабочей темой для изучения в рамках крупномасштабных клинических исследований качества жизни [16].
Одно из первых внутривенных введений магния было произведено французским акушером М. Бертраном в 1906 г. для снятия судорог при эклампсии. Преэклампсия встречается у 5–50 % женщин и приводит к самому тяжелому осложнению беременности – эклампсии. Общепризнанной терапией является внутривенное введение сульфата магния. Проведено сравнительное исследование экспрессии генов в 10 плацентах, полученных после физиологических родов, 10 – от пациенток, перенесших преэклампсию, и 8 плацент пациенток с преэклампсией, получавших сульфат магния, показавшее, что у женщин с преэклампсией повышены (р 0,81 ммоль/л). Этот внеклеточный магний находится в процессе непрерывного обмена с магниевыми запасами костей и мышечной ткани. Во многих случаях компенсировать недостаток магния только диетическими мероприятиями не удается, и тогда возникает необходимость в применении фармакологических препаратов, содержащих магний. К недостаткам магниевых препаратов I поколения относят не только относительно низкую всасываемость и усвояемость, но и его замедленное включение в метаболизм. В последние 20 лет отмечается довольно стойкая тенденция к переходу на применение II и последующих поколений магнийсодержащих препаратов, в которых минерал содержится в виде органической соли или комплекса с аминокислотами (например, оротат магния).
Органические соли магния не только значительно лучше усваиваются организмом, но и реже дают побочные эффекты. В настоящее время продолжают применять препараты магния на основе многочисленных органических солей: оротат, аспарагинат, лактат, цитрат магния и др. Терапия препаратами магния эффективнее, если вводить их одновременно с т. н. магниевыми протекторами – соединениями, усиливающими абсорбцию магния и его транспорт в клетку. К магниевым протекторам относятся оротовая кислота, витамины В6, D, В1, А, С и Е, рибоксин, карнитин, таурин и препараты кальция, т. к. все эти вещества повышают содержание магния в клетке.
При судорогах, обусловленных гипокальциемией, гипомагниемией, алкалозом, требуется внутривенное введение кальция и/или магния с последующим их применением [8]. У больных эпилепсией комплексную терапию дополняют препаратами магния [12].
Препараты оротовой кислоты (оротата) применяют при нарушениях белкового обмена (в постинфарктном периоде, при голодании, заболеваниях печени, в спортивной медицине и т. д.). Оротовая кислота является производным пиримидинового основания урацила, участвует в биосинтезе пиримидиновых нуклеотидов, уридинмонофосфата (УМФ) и цитидинмонофосфата. Повышение концентрации оротата в результате приема солей оротовой кислоты значительно увеличивает концентрацию УМФ, уридиндифосфата (УДФ) и уридинтрифосфата (УTФ) [5].
Механизм действия оротовой кислоты состоит в увеличении синтеза УМФ и других уридинфосфатов, которые являются сигнальными молекулами, взаимодействующими с пуринергическими рецепторами и способствующими расслаблению гладкомышечной и поперечнополосатой мускулатуры. Оротовая кислота, как и тиамин, и пиридоксин, способствует перемещению магния в клетку. Поэтому сочетание магния с оротовой кислотой усиливает эффект устранения судорог.
Рассматривая вопрос о лечении магнийдефицитных судорог, следует обратить внимание на препарат МагнеротR (оротат магния; Worwag Pharma GmbH & Co., Германия). В 1 таблетке препарата содержится 500 мг оротата магния, или 32,8 мг чистого магния. Эта соль мало растворима в воде, не связывает соляную кислоту желудочного сока, не оказывает послабляющего действия в отличие от некоторых других солей магния. Оротат магния – хороший источник элементного магния, что важно при внеклеточном дефиците магния в организме [3].
Соли оротовой кислоты используются в качестве переносчиков минералов, поскольку оротовая кислота повышает клеточную биодоступность катионов. В данном случае оротовая кислота является своеобразным транспортером иона магния в клетку. Таким образом, обеспечивая высокую биодоступность магния, Магнерот® обладает рядом дополнительных синергичных свойств, связанных с биологической ролью аниона оротовой кислоты. Этот препарат магния обладает анаболическими, гепатопротекторными, урикозурическими свойствами и может применяться длительными курсами.
У больных после операций на сердце восстановительный период реже осложняется перебоями в сердце и аритмией, протекает более благоприятно на фоне метаболической терапии, в т. ч. и оротатом магния [10]. Оротат магния может использоваться как средство вспомогательной терапии у лиц с серьезной сердечной недостаточностью, тахиаритмией и экстрасистолией [11]. Однако при столбнячных судорогах сульфат магния считается неэффективным [9].
Магний и оротовая кислота положительно влияют на энергетический метаболизм, структуру мышечной и соединительной тканей и сосудистый тонус, способствуя уменьшению содержания катехоламинов в плазме крови, существенно снижают гиперреактивность мышечной клетки, что обеспечивает их противосудорожное действие. Совместное применение магния и оротата потенцирует их эффект при магнийдефицитных судорогах, возникающих по разным причинам и имеющих разные механизмы развития.
Литература
1. Ребров В.Г., Громова О.А. Витамины, макрои микроэлементы. М., 2008. С. 960.
2. Torshin I, Gromova O. Magnesium: fundamental studies and clinica practice. NovaBiomedicalPublishers. NY, 2009:210.
3. Справочник Видаль. Лекарственные препараты в России: справочник. М., 2010. C. 1488.
4. Торшин И.Ю., Громова О.А. Молекулярные механизмы магния в развитии дисплазии соединительной ткани // РМЖ 2008. № 4. С. 203–09.
5. Торшин И.Ю., Громова О.А. Молекулярные механизмы воздействия оротата магния на кардиоваскулярную физиологию // Кардиология. 2008. № 5. C. 65–7.
6. Школьникова М.А. Метаболизм магния и терапевтическое значение его препаратов. М., 2002. С. 28.
7. Школьникова М.А., Ерастова Е.К., Клейменова Н.И. и др. Применение препарата Магнерот в детской кардиологической практике // Трудный пациент. 2010. C. 1–2.
8. Ito N, Fukumoto S. Symptoms and management of tetany. Clin Calcium 2007;17(8):1234.
9. Pepe S, Leong J, Van der Merwe J, et al. Targeting oxidative stress in surgery: effects of ageing and therapy. Exp Gerontol 2008;43(7):653–57.
10. Stepura O, Martynow A. Magnesium orotate in severe congestive heart failure (MACH). Int. J Cardiol 2009;131(2):293–95.
11. Thiel R. Might calcium disorders cause or contribute to myoclonic seizures in epileptics? Med Hypotheses 2006;66(5):969–74.
12. Громова О.А., Кудрин А.В. Нейрохимия макрои микроэлементов. М., 2001. C. 300.
13. Wijst van der J, Joost G, Bindels RJM, et al. Epithelial Mg2+ channel TRPM6: insight into the molecular regulation. Magnesium Research 2009;22(3):127–32.
14. Li Y. Magnesium status and dietary intake of mid-old people in a rural area of China. Magnesium Research 2009;22(2):66–71.
15. Ariza АС, Bobadilla N, Diaz L, Avila1 E, et al. Placental gene expression of calcitonin generelated peptide and nitric oxide synthases in preeclampsia: effects of magnesium sulfate. Magnesium Research 2009;22(1):44–9.
16. Barbagallo M, Belvedere M, Dominguez LJ. Magnesium homeostasis and aging. Magnesium Res 2009;22(4):235–46.
Читайте также:

