Строение мицеллы гидрозоля кратко
Обновлено: 02.07.2024
Всякий лиофобный (гидрофобный) коллоидный раствор состоит из двух частей: мицелл и интермицеллярной жидкости. Мицеллы — это отдельные коллоидные частицы, которые в совокупности составляют дисперсную фазу золя, а интермицеллярная жидкость — это дисперсионная среда того же золя, включающая помимо растворителя все другие растворенные в нем вещества (электролиты и неэлектролиты), которые не входят в состав мицелл.
Коллоидная мицелла имеет значительно более сложное строение, чем обычные молекулы. В ней различают две основные части: внутреннюю — нейтральную, обычно называемую ядром, и внешнюю— ионогенную, в свою очередь состоящую из двух слоев (двух ионных сфер).
Ядро составляет основную массу коллоидной мицеллы и представляет собой комплекс, состоящий из атомов (в случае гидрозолей металлов или неметаллов) или нейтральных молекул [в золях гидроксида железа (III) или иодида серебра]. Общее число входящих в состав ядра атомов или молекул огромно (от нескольких сот до миллионов) и зависит от степени дисперсности золя и от размеров самих атомов или молекул.
В процессе образования гидрофобного золя рост ядра в той или иной стадии может быть приостановлен созданием так называемого адсорбционного слоя из ионов стабилизатора.
Ионная сфера вокруг ядра коллоидной мицеллы состоит из двух слоев (или двух сфер)— адсорбционного и диффузного. Адсорбционный слой слагается из слоя потенциалопределяющих ионов, адсорбированных на поверхности ядра и сообщающих ему свой заряд, и части противоионов, проникших за плоскость скольжения и наиболее прочно связанных электростатическими силами притяжения. Вместе с ядром эта ионная атмосфера образует как бы отдельный гигантских размеров многозарядный ион — катион или анион, называемый гранулой. Диффузный слой, расположенный за плоскостью скольжения, в отличие от адсорбционного не имеет в дисперсионной фазе резко очерченной границы. Этот слой состоит из противоионов, общее число которых равняется в среднем разности между всем числом потенциалопределяющих ионов и числом противоионов, находящихся в адсорбционном слое.
Гранула вместе с диффузным слоем противоионов составляет коллоидную частицу — мицеллу. Мицелла всегда электронейтральна. Необходимо отметить, что противоионами могут служить любые ноны тех электролитов, которые участвуют в реакциях при образовании данного золя или же присутствуют как посторонние примеси
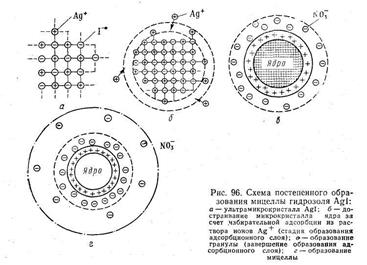
ПРИМЕР. Для примера рассмотрим получение гидрозоля иодида серебра методом конденсации. Оно основано на химической реакции
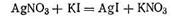
Согласно теории строения коллоидной мицеллы ядро в данном случае будет состоять из нейтральных молекул AgI. В зависимости от относительной концентрации реагирующих веществ может быть три случая.
1. Концентрация нитрата серебра больше концентрации иодида калия. При этом в системе, помимо нерастворимого комплекса Agl, имеются ионы Ag + , K + и NO 3- . В процессе роста ядра коллоидной мицеллы достраивание решетки AgI идет только за счет ионов Ag + , которые прочно входят в его структуру, сообщают ему электрический заряд и потому называются потенциалопределяющими. Полученный в результате адсорбции ионов Ag + электрический заряд определяет термодинамический потенциал.
Положительно заряженное ядро притягивает оставшиеся в растворе противоионы NО 3- . Часть противоионов при этом входит в состав адсорбционного слоя, оставшаяся часть — в состав диффузного слоя. На рис. 6.11 изображена схема постепенного образования мицеллы гидрозоля AgI.
2. Концентрация нитрата серебра меньше концентрации иодида калия. В этом случае поверхность ядра адсорбирует только анион I – , который входит в его структуру и определяет знак заряда.
3. Концентрации нитрата серебра и иодида калия равны. В этом случае золь находится в так называемом изоэлектрическом состоянии, т. е. в состоянии, при котором электрокинетический потенциал (дзета-потенциал) равен нулю. В этом случае противоионы диффузного слоя перешли в адсорбционный слой, а потому гранула лишена заряда.
Строение мицелл в коллоидной химии принято выражать особыми мицеллярными формулами. Так, в обобщенном и упрощенном виде строение любой мицеллы гидрофобного золя можно передать следующими формулами: + хА - — положительно заряженная мицелла; - хК + — отрицательно заряженная мицелла, где К + — катионы; А – —анионы; n — число потенциалопределяющих ионов; х — число ионов, находящихся в диффузном слое; m — число нейтральных атомов или молекул в ядре.
В этих формулах в квадратные скобки заключено ядро, а в фигурные— заряженный комплекс (гранула).
Мицеллярная формула иодида серебра для случая, когда CAgNO3>CK1, имеет вид

Для случая, когда
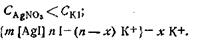
Когда концентрации обоих электролитов равны,
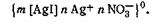
Форма коллоидных частиц может быть самой разнообразной. Изучение строения и процесса образования коллоидных частиц с помощью электронного микроскопа позволило установить, что их форма во многом определяется типом кристаллической решетки ядра, которую образуют входящие в него атомы и молекулы. В зависимости от природы вещества решетка может быть как симметричной, так и асимметричной.
От формы частиц дисперсной фазы зависят некоторые свойства коллоидных растворов. Так, коллоидные системы асимметрического строения способны образовать внутреннюю сетчатую структуру.
Опыты показали, что в случае гидрофобных коллоидов прибавление электролита к коллоидному раствору почти не влияет на термодинамический потенциал, тогда как на электрокинетический потенциал (дзета-потенциал) оказывает сильное влияние.
Вязкость гидрофобных золей.
Измерение вязкости золей имеет большое значение при изучении природы коллоидных растворов. Вязкость гидрофобных золей, как показали многочисленные исследования, зависит только от концентрации и не зависит от способа их приготовления.
Увеличение относительной вязкости гидрофобных золей в связи с возрастанием дзета-потенциала объясняется тем, что при этом возрастает концентрация противоионов, а следовательно, и сольватация (гидратация), что вызывает увеличение объема коллоидных мицелл.
Между относительной вязкостью и радиусом коллоидных частиц существует обратная зависимость: при одинаковых концентрациях гидрофобного золя вязкость растворов, содержащих частицы меньших размеров, как правило, бывает больше, чем вязкость растворов, содержащих частицы больших размеров.
Процесс химического образования частиц дисперсной фазы очень сложен, но упрощенно его можно описать следующим образом. Рассмотрим образование золя и строение его частиц на примере хлорида серебра AgCl. Этот золь образуется при медленном приливании водного раствора хлорида натрия NaCl к водному раствору нитрата серебра AgNO3, взятому в избытке (если ввести сразу большую порцию раствора NaCl, то мгновенно выпадет осадок хлорида серебра и золь не получится). Реакция протекает по уравнению:
При постепенном приливании раствора NaCl в раствор AgNO3 в первый момент из ионов Ag + и Cl – образуется агрегат (AgCl)n, в котором ионы расположены в том же порядке, что и в кристаллической решетке AgCl.
Далее агрегат (AgCl)n адсорбирует на своей поверхности преимущественно те ионы, которые входят в его состав (или изоморфны по типу кристаллической решетки) и находятся в растворе в избытке. Этим условиям в данном случае отвечают ионы серебра. В результате адсорбции ионов Ag + агрегат из хлорида серебра со слоем ионов серебра приобретает положительный заряд.
Ионы, адсорбирующиеся на поверхности агрегата, придают частице заряд и называются потенциалопределяющими. Наличие одноименных зарядов на агрегатах препятствует их объединению и росту кристалла AgCl. Таким образом агрегаты AgCl с адсорбированными на них ионами приобретают состояние агрегативной устойчивости.
Агрегат (AgCl)n вместе с потенциалопределяющими ионами Ag + составляет ядро. К заряженному ядру притягиваются ионы противоположного заряда – противоионы. В данном случае такими ионами будут ионы, содержащиеся в растворе (но не входящие в состав агрегата), – нитрат-ионы NO3 – . Противоионы, непосредственно примыкающие к ядру, образуют адсорбционный слой противоионов.
За адсорбционным слоем противоионов следует диффузный слой тех же противоионов. Количество противоионов диффузного слоя постепенно понижается по мере удаления от ядра. Противоионы диффузного слоя ориентируют вокруг себя полярные молекулы растворителя, создавая дополнительную сольватную (гидратную) оболочку.
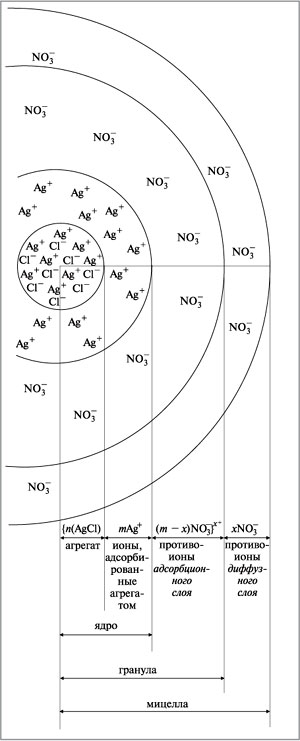
| Рис. 5.10. Строение (разрез) мицеллы хлорида серебра |
Ионы адсорбционного слоя сравнительно прочно связаны с агрегатом, а противоионы диффузного слоя находятся под действием двух факторов: электростатического притяжения ионами противоположного заряда, которое удерживает их вблизи ядра, и броуновского движения, стремящегося распределить их в дисперсионной среде.
Ядро вместе с противоионами адсорбционного слоя составляет коллоидную частицу, или гранулу. Гранула с противоионами диффузного слоя называетсямицеллой. Следует иметь в виду, что знак заряда гранулы соответствует знаку заряда потенциалопределяющих ионов. Мицелла в отличие от гранулы электронейтральна.
Формулу мицеллы гидрозоля хлорида серебра записывают так:
В фигурные скобки заключена гранула. Ионы, указанные за фигурными скобками, составляют внешнюю часть мицеллы. Строение мицеллы хлорида серебра представлено на рис. 5.10. Подобный механизм мицеллобразования относится к лиофобным коллоидам.
Строение мицеллы и заряд гранулы зависят от способа получения коллоидного раствора. Если медленно приливать разбавленный раствор нитрата серебра к раствору хлорида натрия, взятому в избытке, то на поверхности агрегата n(AgCl) будут адсорбироваться хлорид-ионы, имеющиеся в растворе в избытке (образуется слой потенциалопределяющих ионов), а в качестве противоионов адсорбционного и диффузионного слоев будут выступать ионы натрия. Состав мицеллы полученного гидрозоля записывается формулой:
Основу мицеллы составляет нерастворимое в данной среде ядро, микрокристалл или совокупность микрокристаллов.
Рассмотрим другие наиболее важные для обсуждения природных процессов примеры образования дисперсной фазы. Прильем к раствору хлорида железа FеCl3 по каплям раствор гидроксида натрия NaОН до помутнения раствора или образования хлопьев малорастворимого гидроксида железа
Fe(ОН)3:
Образовавшаяся мицелла имеет такое строение:
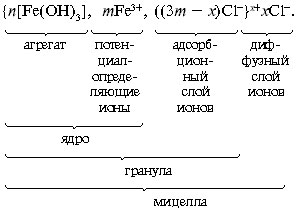
В слой потенциалопределяющих ионов могут входить не только ионы Fe 3+ , но и образующиеся при гидролизе ионы Fe(OH) 2+ , Fe(OH) 2+ и др. Примерно таково же строение мицеллы гидроксида алюминия.

При медленном приливании раствора хлорида железа в раствор гидроксида натрия процесс образования мицеллы протекает намного сложнее, но теоретически можно предположить, что гидроксид-ионы могут быть потенциалопределяющими, а ионы натрия входят в состав адсорбционного и диффузного слоев.
Состав мицеллы кремниевой кислоты, образующейся при приливании к раствору силиката натрия (избыток) сильной кислоты, может быть выражен такой формулой:
<[nH2SiO3], mHSiO3 – , (m – x)Na + > х – xNa + .
Процесс химического образования частиц дисперсной фазы очень сложен, но упрощенно его можно описать следующим образом. Рассмотрим образование золя и строение его частиц на примере хлорида серебра AgCl. Этот золь образуется при медленном приливании водного раствора хлорида натрия NaCl к водному раствору нитрата серебра AgNO3, взятому в избытке (если ввести сразу большую порцию раствора NaCl, то мгновенно выпадет осадок хлорида серебра и золь не получится). Реакция протекает по уравнению:
При постепенном приливании раствора NaCl в раствор AgNO3 в первый момент из ионов Ag + и Cl – образуется агрегат (AgCl)n, в котором ионы расположены в том же порядке, что и в кристаллической решетке AgCl.
Далее агрегат (AgCl)n адсорбирует на своей поверхности преимущественно те ионы, которые входят в его состав (или изоморфны по типу кристаллической решетки) и находятся в растворе в избытке. Этим условиям в данном случае отвечают ионы серебра. В результате адсорбции ионов Ag + агрегат из хлорида серебра со слоем ионов серебра приобретает положительный заряд.
Ионы, адсорбирующиеся на поверхности агрегата, придают частице заряд и называются потенциалопределяющими. Наличие одноименных зарядов на агрегатах препятствует их объединению и росту кристалла AgCl. Таким образом агрегаты AgCl с адсорбированными на них ионами приобретают состояние агрегативной устойчивости.
Агрегат (AgCl)n вместе с потенциалопределяющими ионами Ag + составляет ядро. К заряженному ядру притягиваются ионы противоположного заряда – противоионы. В данном случае такими ионами будут ионы, содержащиеся в растворе (но не входящие в состав агрегата), – нитрат-ионы NO3 – . Противоионы, непосредственно примыкающие к ядру, образуют адсорбционный слой противоионов.
За адсорбционным слоем противоионов следует диффузный слой тех же противоионов. Количество противоионов диффузного слоя постепенно понижается по мере удаления от ядра. Противоионы диффузного слоя ориентируют вокруг себя полярные молекулы растворителя, создавая дополнительную сольватную (гидратную) оболочку.

| Рис. 5.10. Строение (разрез) мицеллы хлорида серебра |
Ионы адсорбционного слоя сравнительно прочно связаны с агрегатом, а противоионы диффузного слоя находятся под действием двух факторов: электростатического притяжения ионами противоположного заряда, которое удерживает их вблизи ядра, и броуновского движения, стремящегося распределить их в дисперсионной среде.
Ядро вместе с противоионами адсорбционного слоя составляет коллоидную частицу, или гранулу. Гранула с противоионами диффузного слоя называетсямицеллой. Следует иметь в виду, что знак заряда гранулы соответствует знаку заряда потенциалопределяющих ионов. Мицелла в отличие от гранулы электронейтральна.
Формулу мицеллы гидрозоля хлорида серебра записывают так:
В фигурные скобки заключена гранула. Ионы, указанные за фигурными скобками, составляют внешнюю часть мицеллы. Строение мицеллы хлорида серебра представлено на рис. 5.10. Подобный механизм мицеллобразования относится к лиофобным коллоидам.
Строение мицеллы и заряд гранулы зависят от способа получения коллоидного раствора. Если медленно приливать разбавленный раствор нитрата серебра к раствору хлорида натрия, взятому в избытке, то на поверхности агрегата n(AgCl) будут адсорбироваться хлорид-ионы, имеющиеся в растворе в избытке (образуется слой потенциалопределяющих ионов), а в качестве противоионов адсорбционного и диффузионного слоев будут выступать ионы натрия. Состав мицеллы полученного гидрозоля записывается формулой:
Основу мицеллы составляет нерастворимое в данной среде ядро, микрокристалл или совокупность микрокристаллов.
Рассмотрим другие наиболее важные для обсуждения природных процессов примеры образования дисперсной фазы. Прильем к раствору хлорида железа FеCl3 по каплям раствор гидроксида натрия NaОН до помутнения раствора или образования хлопьев малорастворимого гидроксида железа
Fe(ОН)3:
Образовавшаяся мицелла имеет такое строение:

В слой потенциалопределяющих ионов могут входить не только ионы Fe 3+ , но и образующиеся при гидролизе ионы Fe(OH) 2+ , Fe(OH) 2+ и др. Примерно таково же строение мицеллы гидроксида алюминия.
При медленном приливании раствора хлорида железа в раствор гидроксида натрия процесс образования мицеллы протекает намного сложнее, но теоретически можно предположить, что гидроксид-ионы могут быть потенциалопределяющими, а ионы натрия входят в состав адсорбционного и диффузного слоев.
Состав мицеллы кремниевой кислоты, образующейся при приливании к раствору силиката натрия (избыток) сильной кислоты, может быть выражен такой формулой:
<[nH2SiO3], mHSiO3 – , (m – x)Na + > х – xNa + .
Основные понятия: коллоидные растворы, виды устойчивости коллоидных растворов, их причину и факторы, вызывающие ее нарушении, мицелла, правило Панета-Фаянса правило Шульце-Гарди.
Мицелла состоит из электронейтрального агрегата, окруженного двойным электрическим слоем. Агрегат и потенциалопределяющие ионы образуют ядро. Агрегат вместе с адсорбционным слоем называют гранулой (частицей). Заряд гранулы равен сумме зарядов потенциалопределяющих ионов и прочно связанных противоионов. Если гранула заряжена положительно, при электрофорезе она движется к катоду; если гранула заряжена отрицательно – к аноду.
В общем виде строение мицеллы можно представить следующим образом:
 |
Пример 30. Строение структурной единицы лиофобных коллоидов – мицеллы – может быть показано лишь схематически, поскольку мицелла не имеет определенного состава. Рассмотрим строение коллоидной мицеллы на примере гидрозоля иодида серебра, получаемого взаимодействием разбавленных растворов нитрата серебра и иодида калия:
Коллоидная мицелла золя иодида серебра образована микрокристаллом иодида серебра, который способен к избирательной адсорбции из окружающей среды катионов Ag + или иодид-ионов. Если реакция проводится в избытке иодида калия, то кристалл будет адсорбировать иодид-ионы; при избытке нитрата серебра микрокристалл адсорбирует ионы Ag + . В результате этого микрокристалл приобретает отрицательный либо положительный заряд; ионы, сообщающие ему этот заряд, называются потенциалопределяющими, а сам заряженный кристалл – ядром мицеллы. Заряженное ядро притягивает из раствора ионы с противоположным зарядом – противоионы; на поверхности раздела фаз образуется двойной электрический слой. Некоторая часть противоионов адсорбируется на поверхности ядра, образуя т.н. адсорбционный слой противоионов; ядро вместе с адсорбированными на нем противоионами называют коллоидной частицей или гранулой. Остальные противоионы, число которых определяется, исходя из правила электронейтральности мицеллы, составляют диффузный слой противоионов; противоионы адсорбционного и диффузного слоев находятся в состоянии динамического равновесия адсорбции – десорбции.
Схематически мицелла золя иодида серебра, полученного в избытке иодида калия (потенциалопределяющие ионы – анионы I – , противоионы – ионы К + ) может быть изображена следующим образом:
При получении золя иодида серебра в избытке нитрата серебра коллоидные частицы будут иметь положительный заряд: < m [AgI] · nAg + · (n-x)NO3 – > x + · x NO3 –
Пример 31. Коллоидный раствор гидроксида железа (III)получен по реакции:
При некотором избытке а) FeCl3, б) NaOH. Составьте схему строения мицеллы золя гидроксида железа (III) для случая а) и б). Определите знак заряда коллоидных частиц.
Решение. а) FeCl3→ Fe 3+ + 3Cl -
Знак заряда гранулы положительный.
Знак заряда коллоидных частиц отрицательный.
Коагуляция – потеря коллоидными системами агрегативной устойчивости. Коагуляция коллоидных растворов может быть вызвана воздействием различных факторов: концентрированием дисперсной фазы, диализом, механическим воздействием, изменением температуры, различными видами излучений, добавлением электролитов.
Наибольшее теоретическое и практическое значение имеет разрушение золя при добавлении электролита. Минимальная концентрация электролита, по достижении которой начинается коагуляция, называется порогом коагуляции.
где V0 – объем золя, л; Vmin – минимальный объем раствора электролита, вызывающий коагуляцию золя, л; С – концентрация электролита в растворе, моль/л. Величина, обратная, порогу коагуляции, называется коагулирующей способностью: КС = 1/Спор
Коагулирующее действие электролитов подчиняется правилу Шульце-Гарди, теоретически обоснованному Дерягиным и Ландау: коагуляцию вызывают ионы с зарядом, противоположным заряду гранулы, и коагулирующая способность тем выше, чем выше заряд коагулирующего иона.
Пример 32. Для коагуляции 100мл золя иодида серебра потребовалось 3мл 0,2М сульфата натрия и 4мл 0,3М хлорида натрия. Коагулирующая способность какого электролита – коагулятора (ЭК) больше? Каков знак заряда частица золя? Катионы или анионы вызывают коагуляцию золя?
Решение.
1. Вычислим порог коагуляции каждого электролита-коагулятора так:
2. Определим коагулирующую способность:
Коагулирующая способность Na2SO4>NaCl. Так как заряд катионов одинаков, а коагулирующая способность различна, значит, коагуляцию золя вызывают анионы: SO4 2- >Cl - . Следовательно, согласно правилу Шульце-Гарди золь иодида серебра заряжен положительно и частица при электрофорезе перемещается к катоду.
Пример 33. Коагуляция 10 мл гидрозоля железа (III) наступила при добавлении к нему 2 мл раствора сульфата натрия с молярной концентрацией 1,25ммоль/л. Вычислите порог коагуляции и коагулирующую способность электролита.
Решение. Для расчета порога коагуляции воспользуемся формулой:
Применительно к данной задаче ;
Где С(SO4 2- ) = C(Na2SO4 2- ) = 1,25ммоль/л = 1,25·10 -3 моль/л
Величину коагулирующей способности вычисляют по формуле:
Ответ: Спор=0,208ммоль/л, КС = 4,8л/моль
Пример 34. Для коагуляции золя хлорида серебра, полученного при недостатке нитрата серебра, использовались растворы хлоридов калия, железа (III) и магния. Какой из них будет иметь наиболее низкий порог коагуляции? почему?
Решение. Мицелла в данном случае несёт отрицательный заряд, поэтому коагуляция вызывается катионом. Чем выше заряд катиона - тем ниже порог коагуляции. Следовательно, самый низкий порог будет у хлорида железа(III).
Пример 35. Порог коагуляции отрицательно заряженного гидрозоля As2S3 под действием KCl равен 4,9*10 -2 моль/л. С помощью правил Шульца-Гарди и Дерягина-Ландау для этого золя рассчитайте пороги коагуляции, вызываемой следующими электролитами: K2SO4, MgCl2, MgSO4, AlCl3 и Al2(SO4)3.
Решение. Согласно правилу Шульца-Гарди, теоретически обоснованному Дерягиным и Ландау, порог коагуляции обратно пропорционален заряду противоиона в шестой степени. Для KCl (заряд K = +1) порог составляет 4,9*10 -2 моль/л K2SO4 – противоион тот же, порог тот же. Для MgCl2, MgSO4 – противоион Mg 2+ , порог равен 4,9*10 -2 /2 6 = 7,6*10 -4 . AlCl3 и Al2(SO4)3 – противоион Al 3+ , порог равен 4,9*10 -2 /3 6 = 6.7*10 -5 .
Пример 36. В электрическом поле гранула золя карбоната железа перемещается к аноду(+). Напишите формулу мицеллы золя, если он был получен смешиванием растворов нитрата железа и карбоната калия. Одинаковы ли исходные концентрации электролитов, если объемы растворов одинаковы?
Решение.
Концентрации разные (концентрация карбоната калия выше, чем соли железа).
Пример 37. Коагулирующая способность сульфата натрия по отношению к данному коллоидному раствору выше коагулирующей способности хлорида кальция. Как заряжены частицы золя?
Решение. По правилу Шульце-Гарди коагулирующая способность электролита тем выше, чем больше заряд коагулирующего иона. У Na2SO4 заряд анионов (SO4 2- ) больше, чему CaCl2 (ионов Cl - ), значит, коагулирующими ионами являются анионы. Следовательно, частицы коллоидного раствора заряжены положительно.
Пример 38. Коллоидный раствор иодида серебра получен при некотором избытке KI по реакции:
Его коагулируют растворами сульфата натрия и ацетата кальция. У какого электролита коагулирующая способность выше?
Решение. Т.к. стабилизатором является KI (AgI→ Ag + + I - ), то мицелла имеет строение:
Коллоидная частица (гранула) заряжена отрицательно. Следовательно, коагулирующими ионами являются катионы. Т.к. заряд иона Са 2+ больше заряда иона Na + , то коагулирующая способность ацетата кальция выше, чем сульфата натрия.
Пример 39. Какие золи: гидроксида железа(III) (при избытке FeCl3), иодида серебра (при избытке AgNO3), иодида серебра (при избытке KI), следует смешать, чтобы произошла взаимная коагуляция?
Решение. Взаимная коагуляция возможна при смешивании золей с противоположными знаками заряда гранул. Гранулы золя гидроксида железа (III) заряжены положительно
Гранулы золя иодида серебра при избытке AgNO3 (потенциалопределяющие ионы Ag + ) заряжены положительно: · nAg + · (n-x)NO3 - > x , а при избытке KI (потенциал-определяющие ионы I - ) заряжены отрицательно: · nI - · (n-x)K + > x - .
Следовательно, взаимная коагуляция возможна при сливании золей а) гидроксида железа(III) и иодида серебра при избытке KI, и б) иодида серебра (при избытке AgNO3) и иодида серебра (при избытке KI).
Типовые задачи.
36. Коагуляция 1,5 мл золя сульфида золота наступила при добавлении к нему 570 мл раствора хлорида натрия концентрацией 0,2 моль/л. Вычислите порог коагуляции золя ионами натрия и коагулирующую способность электролита.
37. Частицы золя при электрофорезе перемещаются к аноду. Коагулирующая способность какого из веществ: Na2SO4, CaCl2 или K3PO4 – будет наибольшей по отношению к данному золю? Дайте пояснения.
38. Получены два золя иодида серебра из раствора AgNO3 и KI с молярными концентрациями по 0,05моль/л каждый. Один золь получен приливанием раствора AgNO3 объемом 16мл к раствору KI объемом 20мл, другой раствора KI объемом 16мл к раствору AgNO3 объемом 20мл. Будут ли наблюдаться какие-либо явления при смешивании этих золей? Ответ мотивируйте. Напишите формулы мицелл золя.
39. Золь кадмия сульфида получен смешиванием растворов Na2S и Cd(NO3)2. Пороги коагуляции электролитов к данному золю оказались равными (ммоль/л): Спор(Ca(NO3)2)=265, Cпор (NaCl) = 250, Cпор (MgCl2) = 290, Cпор (Na3PO4) = 0,4, Cпор (Na2SO4) = 15, Cпор (AlCl3) = 300. Какой из электролитов Na2S или Cd(NO3)2, взят в избытке для получения золя? Составьте схему строения мицеллы золя.
Продолжение. См. № 4–14, 16–28, 30–34, 37–44, 47, 48/2002;
1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23,
24, 25-26, 27-28, 29, 30, 31, 32, 35, 36, 37, 39, 41, 42, 43, 44, 46, 47/2003;
1, 2, 3, 4, 5, 7, 11, 13, 14, 16, 17, 20, 22, 24, 29, 30, 31, 34, 35, 39, 41, 42, 45/2004;
2, 3, 5, 8, 10, 16, 17/2005;
1, 2, 10, 12, 15/2006
(продолжение)
Различают лиофильные и лиофобные золи. Лиофильные золи образуются самопроизвольно и не разрушаются со временем. Лиофобные золи постепенно разрушаются вследствие самопроизвольного слипания твердых частиц (коагуляция) или слияния жидких частиц (коалесценция), хотя при наличии стабилизатора эти процессы могут быть очень длительными.
Имеется много методов лабораторного и производственного получения коллоидных систем. Один из них состоит в образовании нерастворимых веществ в химической реакции (конденсационный метод). Например, при окислении сероводорода сера выделяется в коллоидном состоянии:
Распад тиосульфат-иона в кислотной среде также приводит к образованию золя серы:
При гидролизе ионов Fe 3+ образуется золь гидроксида железа:
Эти и подобные им реакции проходят в природе при слиянии природных вод различных составов и кислотности.
Дисперсные вещества получают в лаборатории растиранием в ступках пестиком или в мельницах с шарами. В природе подобное случается при трении камней в быстрых потоках воды или на каменистых побережьях морей (вспомните форму гальки).
Процесс химического образования частиц дисперсной фазы очень сложен, но упрощенно его можно описать следующим образом. Рассмотрим образование золя и строение его частиц на примере хлорида серебра AgCl. Этот золь образуется при медленном приливании водного раствора хлорида натрия NaCl к водному раствору нитрата серебра AgNO3, взятому в избытке (если ввести сразу большую порцию раствора NaCl, то мгновенно выпадет осадок хлорида серебра и золь не получится). Реакция протекает по уравнению:
При постепенном приливании раствора NaCl в раствор AgNO3 в первый момент из ионов Ag + и Cl – образуется агрегат (AgCl)n, в котором ионы расположены в том же порядке, что и в кристаллической решетке AgCl.
Далее агрегат (AgCl)n адсорбирует на своей поверхности преимущественно те ионы, которые входят в его состав (или изоморфны по типу кристаллической решетки) и находятся в растворе в избытке. Этим условиям в данном случае отвечают ионы серебра. В результате адсорбции ионов Ag + агрегат из хлорида серебра со слоем ионов серебра приобретает положительный заряд.
Ионы, адсорбирующиеся на поверхности агрегата, придают частице заряд и называются потенциалопределяющими. Наличие одноименных зарядов на агрегатах препятствует их объединению и росту кристалла AgCl. Таким образом агрегаты AgCl с адсорбированными на них ионами приобретают состояние агрегативной устойчивости.
Агрегат (AgCl)n вместе с потенциалопределяющими ионами Ag + составляет ядро. К заряженному ядру притягиваются ионы противоположного заряда – противоионы. В данном случае такими ионами будут ионы, содержащиеся в растворе (но не входящие в состав агрегата), – нитрат-ионы NO3 – . Противоионы, непосредственно примыкающие к ядру, образуют адсорбционный слой противоионов.
За адсорбционным слоем противоионов следует диффузный слой тех же противоионов. Количество противоионов диффузного слоя постепенно понижается по мере удаления от ядра. Противоионы диффузного слоя ориентируют вокруг себя полярные молекулы растворителя, создавая дополнительную сольватную (гидратную) оболочку.
Ионы адсорбционного слоя сравнительно прочно связаны с агрегатом, а противоионы диффузного слоя находятся под действием двух факторов: электростатического притяжения ионами противоположного заряда, которое удерживает их вблизи ядра, и броуновского движения, стремящегося распределить их в дисперсионной среде.
Ядро вместе с противоионами адсорбционного слоя составляет коллоидную частицу, или гранулу. Гранула с противоионами диффузного слоя называется мицеллой. Следует иметь в виду, что знак заряда гранулы соответствует знаку заряда потенциалопределяющих ионов. Мицелла в отличие от гранулы электронейтральна.
Формулу мицеллы гидрозоля хлорида серебра записывают так:
В фигурные скобки заключена гранула. Ионы, указанные за фигурными скобками, составляют внешнюю часть мицеллы. Строение мицеллы хлорида серебра представлено на рис. 8.34. Подобный механизм мицеллобразования относится к лиофобным коллоидам.
Рис. 8.34.
Строение (разрез)
мицеллы хлорида серебра
Строение мицеллы и заряд гранулы зависят от способа получения коллоидного раствора. Если медленно приливать разбавленный раствор нитрата серебра к раствору хлорида натрия, взятому в избытке, то на поверхности агрегата n(AgCl) будут адсорбироваться хлорид-ионы, имеющиеся в растворе в избытке (образуется слой потенциалопределяющих ионов), а в качестве противоионов адсорбционного и диффузионного слоев будут выступать ионы натрия. Состав мицеллы полученного гидрозоля записывается формулой:
Основу мицеллы составляет нерастворимое в данной среде ядро, микрокристалл или совокупность микрокристаллов.
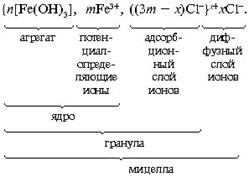
Рассмотрим другие наиболее важные для обсуждения природных процессов примеры образования дисперсной фазы. Прильем к раствору хлорида железа FеCl3 по каплям раствор гидроксида натрия NaОН до помутнения раствора или образования хлопьев малорастворимого гидроксида железа
Fe(ОН)3:
Образовавшаяся мицелла имеет такое строение:

В слой потенциалопределяющих ионов могут входить не только ионы Fe 3+ , но и образующиеся при гидролизе ионы Fe(OH) 2+ , Fe(OH) 2+ и др. Примерно таково же строение мицеллы гидроксида алюминия.
При медленном приливании раствора хлорида железа в раствор гидроксида натрия процесс образования мицеллы протекает намного сложнее, но теоретически можно предположить, что гидроксид-ионы могут быть потенциалопределяющими, а ионы натрия входят в состав адсорбционного и диффузного слоев.
Состав мицеллы кремниевой кислоты, образующейся при приливании к раствору силиката натрия (избыток) сильной кислоты, может быть выражен такой формулой:
<[nH2SiO3], mHSiO3 – , (m – x)Na + > х– xNa + .
Изучение заряда гранулы имеет большое значение для объяснения и предсказания поведения дисперсных систем. Слой ионов вокруг агрегата и противоинов адсорбционного и диффузного слоев представляет собой двойной электрический слой. Число положительных и отрицательных зарядов в нем одинаково, поэтому мицелла электронейтральна.

Между ядром и раствором возникает полный электрический потенциал или термодинамический
(фи)-потенциал. Это – разность потенциалов, созданных всеми положительными и отрицательными зарядами мицеллы. Другой потенциал, называемый электрокинетическим, или
(дзета)-потенциалом, существует между слоем ионов адсорбционного слоя и диффузного слоя. Электрокинетический потенциал назван так потому, что диффузный слой подвижен и может смещаться при движении мицеллы. Этот потенциал составляет часть термодинамического потенциала и всегда меньше его (рис. 8.35).
Рис. 8.35.
Сопоставление термодинамического ( )
и электрокинетического (![]()
) потенциалов
Слой ионов вокруг агрегата образуется за счет электростатического взаимодействия и химических связей с ионами агрегата. Это прочный и плотный слой, сохраняющийся при изменении условий существования гранулы (если, конечно, дисперсная система не разрушается). Адсорбционный слой противоионов вокруг ядра образуется также за счет электростатического взаимодействия с ионами потенциалобразующего слоя и благодаря взаимодействиям типа сил Ван-дер-Ваальса. Это плотный слой, и ионы в нем закреплены довольно прочно. Ионы диффузного слоя не закреплены прочно и могут смещаться и даже отрываться от гранулы в электрическом поле или при движении мицеллы.
Электрокинетический потенциал снижается по мере удаления от поверхности гранулы (или твердого тела). На -потенциал влияет концентрация ионов в растворе. При увеличении концентрации ионов
-потенциал уменьшается за счет перехода части ионов диффузного слоя в адсорбционный слой или благодаря замене ионов с зарядом одного знака на ионы с зарядом другого знака.

Добавление ионов, особенно многозарядных, может привести к их адсорбции в таких количествах, что произойдет перезарядка гранулы и изменение знака электрокинетического потенциала. Когда все противоионы находятся в адсорбционном слое, -потенциал становится равным нулю. Подобное состояние называется изоэлектрическим состоянием (изоэлектрической точкой).
С увеличением концентрации ионов электрокинетический потенциал уменьшается, проходит через изоэлектрическую точку, изменяет знак и снова увеличивается. В изоэлектрическом состоянии электрокинетический потенциал равен нулю, и в этом состоянии дисперсные системы наименее устойчивы, частицы укрупняются, выпадают в осадок, и из ядра, играющего роль кристаллического зародыша, вырастает кристалл. Лиофильные системы в отличие от лиофобных в изоэлектрическом состоянии устойчивы (кроме некоторых белков).
Знак заряда гранулы может меняться при смене растворителя, а также при изменении среды раствора. У амфотерного гидроксида алюминия знак заряда гранулы в кислотной и нейтральной средах положителен и потенциалопределяющими являются ионы алюминия; в слабощелочной среде знак заряда гранулы становится отрицательным (потенциалопределяющие ионы – алюминат- или гидроксид-ионы, противоионы – катионы). Смена знака заряда происходит при переходе через значение рН, соответствующее изоэлектрической точке.
Знак заряда коллоидной частицы устанавливается по направлению ее движения к соответствующему электроду при пропускании постоянного электрического тока. Знак заряда может быть определен другим очень простым способом – по характеру взаимодействия окрашенных коллоидных частиц с целлюлозой бумаги. В водной среде капилляры целлюлозы заряжаются отрицательно, а находящаяся в них вода – положительно. Вдоль полоски фильтровальной бумаги (целлюлоза) по ее капиллярам могут передвигаться частицы, имеющие тот же заряд, что и целлюлоза, т.е. отрицательно заряженные частицы. Положительно заряженные частицы задерживаются на стенках капилляров в самом начале пути.
При исследовании бесцветного коллоидного раствора пропитанную раствором бумагу следует высушить и обработать реактивом, окрашивающим коллоидные частицы. Подобный анализ представляет собой вариант хроматографического анализа на бумаге.
Положительный знак заряда имеют гранулы гидроксидов Fe(OH)3, Al(OH)3, Cr(OH)3, Ti(OH)3 и др. Отрицательный знак заряда имеют гранулы некоторых гидроксидов, оксидов MnO2, SnO2, SiO2, золи кремниевой кислоты, сульфидов As2S3, PbS и других, коллоиды высокодисперсных металлов Au, Ag, Pt и серы S, а также глинистые коллоиды и гуминовые кислоты почвы.
Явления смещения диффузного слоя в мицелле и даже его отрыва или, наоборот, возникновения разности потенциалов при движении мицеллы называют электрокинетическими явлениями. Все электрокинетические явления связаны с наличием двойного электрического слоя и определяются электрокинетическим потенциалом. Эти явления наблюдаются в дисперсных системах и в капиллярах и связаны с подвижностью диффузного слоя ионов. На электрокинетических явлениях основаны некоторые методы очистки воды. Из этих явлений наиболее важны электроосмос и электрофорез.
В плоскую чашку положим влажную глину и воткнем в нее две стеклянные трубки, в которые нальем воду с добавкой небольшого количества электролита для увеличения электропроводности (рис. 8.36). В воду опустим электроды и соединим их с источником постоянного тока.
Рис. 8.36.
Электрофорез частиц глины
Через некоторое время жидкость в трубке с положительным электродом становится мутной из-за подъема частиц глины к электроду. Одновременно уровень жидкости в этой трубке понизится, а в другой поднимется. Этот опыт показывает, что частицы глины имеют отрицательный заряд и перемещаются в электрическом поле.
Движение дисперсных частиц относительно дисперсионной среды (жидкой и газообразной) под действием электрического поля называется электрофорезом. В водной среде частица двигается к электроду, знак заряда которого противоположен знаку электрокинетического потенциала.
Диффузный слой ионов мицеллы непрочен, при перемещении мицеллы происходит его частичное разделение, при этом дисперсная фаза и дисперсионная среда приобретают противоположные заряды. В электрическом поле гранула перемещается к одному полюсу, а часть противоионов диффузного слоя отрывается от мицеллы и передвигается к противоположному полюсу (рис. 8.37).
Рис. 8.37.
Схема электрофореза
В отличие от электролиза при электрофорезе не происходит выделения дисперсного вещества, мицеллы не разрушаются, а наблюдается концентрирование коллоидных примесей с последующим удалением их из приэлектродной зоны.
Если в электрическом поле коллоидная частица не перемещается, то у нее нет заряда, она электронейтральна, что может указывать на ее изоэлектрическое состояние.
На электрофорезе основаны очистка воды, улавливание частиц дыма или пыли, выделение белков, аминокислот, витаминов и т.п. Поскольку вместе с гранулами передвигаются молекулы жидкости, составляющие их сольватные оболочки, электрофорезом производят частичное обезвоживание различных материалов (глины, почвы, мокрого торфа).
В медицине электрофорезом через кожу или слизистые оболочки вводят лекарственные вещества. При электрофорезе частицы могут перезаряжаться и заряжаться. Например, хотя частицы белка электронейтральны, в кислотной среде белок передвигается к катоду, а в щелочной – к аноду.
Если вместо глины взять пористую диафрагму (мембрану) или перегородку из пористого фарфора или стекла, плотной или смерзшейся почвы, то через мембрану в электрическом поле будет проходить жидкость без дисперсных частиц (рис. 8.38). Это явление называется электроосмосом. Электроосмос – перемещение дисперсионной среды под действием электрического поля: противоионы диффузного слоя притягиваются к соответствующему электроду и увлекают за собой жидкость дисперсионной среды. Электроосмос проявляется также при движении жидкости дисперсной системы через капилляры или поры диафрагмы под действием электрического тока. Электроосмосом можно объяснить некоторые природные процессы. Электроосмос используют для обезвоживания древесины, грунта, торфа и других материалов.
Читайте также:

