Сера в природе самородная сульфидная и сульфатная сера кратко
Обновлено: 02.07.2024
Сера, её физические и химические свойства. Биологическое значение серы, её применение (демеркуризация).
СЕРА S
Cера в природе
PbS - свинцовый блеск
Cu2S – медный блеск
ZnS – цинковая обманка
FeS2 – пирит, серный колчедан, кошачье золото
H2S – сероводород (в минеральных источниках и природном газе)
CaSO4 * 2H2O - гипс
MgSO4 * 7H2O – горькая соль (английская)
Na2SO4 *10H2O – глауберова соль (мирабилит)
Твердое кристаллическое вещество желтого цвета , нерастворима в воде, водой не смачивается (плавает на поверхности), t°кип = 445°С.
Одно из особенных физических свойств серы - флотация, способность мелкого порошка серы всплывать, тогда, как ее крупные кристаллы тонут в воде. Дело в том, что сера не смачивается водой, и ее частички держатся на поверхности воды за счет прилипших к ним мелких пузырьков воздуха. Это свойство используют при отделении самородной серы от примесей. Руду размалывают, заливают водой, а снизу продувают воздухом, сера всплывает, а примеси остаются на дне.
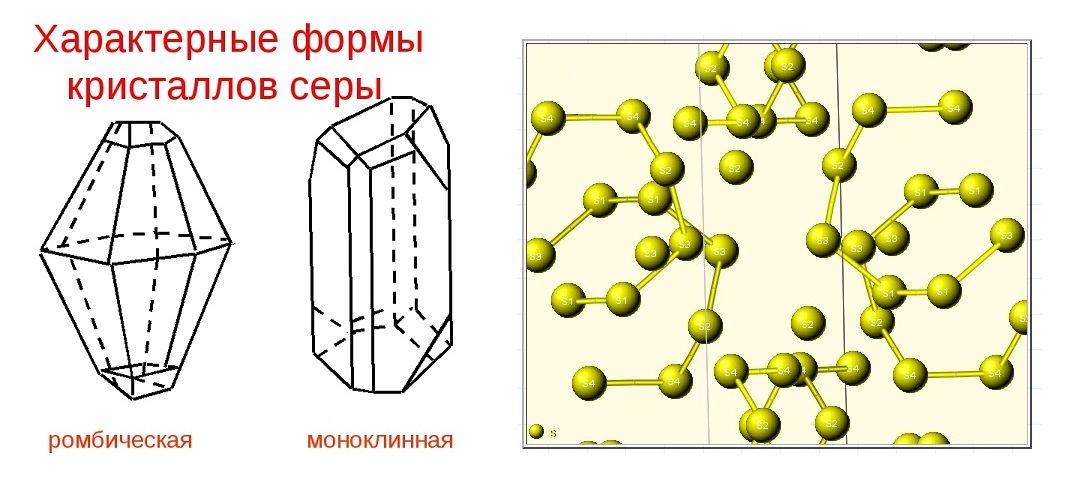
Для серы характерны несколько аллотропных модификаций, но наиболее известные видоизменения: ромбическая (кристаллическая), моноклинная (игольчатая) и пластическая.
Ромбическая (a - сера) - S8
t°пл. = 113°C; ρ = 2,07 г/см 3 . Наиболее устойчивая модификация.
Моноклинная (b - сера) - S8
темно-желтые иглы, t°пл. = 119°C; ρ = 1,96 г/см3. Устойчивая при температуре более 96°С; при обычных условиях превращается в ромбическую.
коричневая резиноподобная (аморфная) масса. Неустойчива, при затвердевании превращается в ромбическую.
Строение атома серы
Размещение электронов по уровням и подуровням
Основное состояние
1s 2 2s 2 2p 6 3s 2 3p 4
Размещение электронов по
орбиталям (последний слой)
В основном состоянии
Первое возбуждённое состояние
Второе возбуждённое состояние
Получение серы
1. Промышленный метод - выплавление из руды с помощью водяного пара.
2. Неполное окисление сероводорода (при недостатке кислорода).
3. Реакция Вакенродера
Химические свойства серы
Сера - окислитель S 0 + 2ē→ S -2
1. Взаимодействие серы со всеми щелочными и щелочноземельными металлами, медью, ртутью, серебром без нагревания:
Ртуть обладает высокой летучестью. Её пары ядовиты. Эта реакция лежит в основе удаления и обезвреживания ртути, например из разбитого медицинского термометра. Места, из которых нельзя извлечь капельки ртути, засыпают порошком серы. Сера и ртуть вступают в реакцию при соприкосновении. В результате образуется химически инертное и безвредное вещество.
Этот процесс называется демеркуризацией
2. Взаимодействие серы c остальными металлами (кроме Au,Pt) при повышенной t°:
3.Взаимодействие серы с некоторыми неметаллами с образованием бинарных соединений:
Сера - восстановитель: S - 4ē → S +4 ;
1. Взаимодействие серы c кислородом:
2. Взаимодействие серы c галогенами (кроме йода):
**Взаимодействие серы с кислотами - окислителями:
Вулканизация каучука, получение эбонита, производство спичек, пороха, в борьбе с вредителями сельского хозяйства, для медицинских целей (серные мази для лечения кожных заболеваний), для получения серной кислоты и т.д.
Домашнее задание параграф 21; упражнения 1, 3, 4 стр. 99-100.
Закончите уравнения реакций, расставьте коэффициенты методом электронного баланса, укажите окислитель, восстановитель.
№2. Осуществите превращения по схеме:
Содержание серы в организме человека массой 70 кг - 140 г.
В сутки человеку необходимо 1 г серы.
Серой богаты горох, фасоль, овсяные хлопья, пшеница, мясо, рыба, плоды и сок манго.
Сера входит в состав гормонов, витаминов, белков, она есть в хрящевой ткани, в волосах, ногтях. При недостатке серы в организме наблюдается хрупкость ногтей и костей, выпадение волос.
Следите за своим здоровьем!
Соединения серы могут служить лекарственными препаратами;
Сера – основа мази для лечения грибковых заболеваний кожи, для борьбы с чесоткой. Тиосульфат натрия Na2S2O3 используется для борьбы с нею.
Многие соли серной кислоты содержат кристаллизационную воду: ZnSO4×7H2O и CuSO4×5H2O. Их применяют как антисептические средства для опрыскивания растений и протравливания зерна в борьбе с вредителями сельского хозяйства.
Железный купорос FeSO4×7H2O используют при анемии.
BaSO4 применяют при рентгенографическом исследовании желудка и кишечника.
Алюмокалиевые квасцы KAI(SO4)2×12H2O - кровоостанавливающее средство при порезах.
Тысячелистник обладает повышенной способностью извлекать из почвы серу и стимулировать поглощение этого элемента с соседними растениями.
Чеснок выделяет вещество – альбуцид, едкое соединение серы. Это вещество предотвращает раковые заболевания, замедляет старение, предупреждает сердечные заболевания.
Сера в природе (кратко) находиться в основном в виде соединений с другими веществами: например нефть, уголь, живые организмы, пирит, арсенопирит и т.д. , а также в виде самородной серы которая образует красивые пушистые игольчатые налеты.
Что такое сера в природе получение серы
В бывшем Советском Союзе месторождения самородной серы находятся в Туркмении в пустыне Кара-Кум. Залежи серы имеются также в Узбекской ССР, по берегам Волги и в некоторых других местах. За рубежом нашей страны наиболее крупные месторождения серы находятся в США, Италии и Японии.
Очень распространены соединения серы с различными металлами. Многие из них являются ценными рудами и служат для добывания цветных металлов (например: свинцовый блеск PbS, цинковая обманка ZnS, медный блеск Cu2S и др.).
Большое распространение имеют также некоторые соли серной кислоты. Так, кальциевая соль CaSO4 встречается в природе в виде минералов гипса и ангидрита, образующих местами целые горы.
Магниевая соль MgSO4 содержится в морской воде и вместе с MgCl2 придает ей характерный горьковатый вкус. Наконец, сера входит в состав веществ, находящихся в растениях и животных.
Сера играет одну из важнейших ролей в организме человека, поскольку является незаменимым звеном в строении клеток, хрящевой, костной и нервной ткани, тканей органов, а также в росте ногтей, кожи и волос человека.
Сера составляет 0.25 процентов от общей массы человеческого тела.
Круговорот серы в природе
Круговорот серы в природе очень тесно связан с живыми существами, живой природой. Основная часть самородной серы выбрасывается вулканами в атмосферу, которая частично или со временем полностью вступает в реакцию с другими химическими веществами.
Соединения серы в природе в виде минералов железа, свинца, цинка, мышьяка частично окисляется многочисленными микроорганизмами до сульфатной серы, которая накапливается в почве, водоемах.
Эти сульфаты частично поглощаются растениями и восстанавливают их до сульфидов, далее они включаться в состав аминокислот, а также входят в состав эфирных масел и т.д.
В организмах сера входит в состав аминокислот и белков. Процессы разрушения остатков организмов в почвах и в иле морей сопровождаются очень сложными превращениями серы.
Разрушение этих белков при участи микроорганизмов приводит к частичному образованию сероводорода, сероводород окисляется до элементарной серы или до сульфидов.
В этой процессе участвуют множество микроорганизмов, которые в свою очередь создают многочисленные соединения серы.
Схема круговорота серы в природе
Схематически можно представить в виде такой схемы:
Химические заводы → осадки в виде кислот → соли, минералы → микроорганизмы → мертвые микроорганизмы → гетеротрофные микроорганизмы → сероводород → осадки в виде кислот → и т.д.
Если в лаборатории разлили ртуть (возникла опасность отравления ртутными парами!), её первым делом собирают, а те места, из которых серебристые капли не извлекаются, засыпают порошкообразной серой.
Ртуть и сера вступают в реакцию даже в твёрдом состоянии — при простом соприкосновении.
Что такое сера
Природная сера состоит из стабильных изотопов 32S (95,02%), 33S (0,75%), 34S (4,21%) и 36S (0,02%), химически очень активное вещество.
Известны искусственные радиоактивные изотопы 29S, 30S, 31S, 36S, 37S и 38S. Серу с давних времен применяли как краску, отбеливания тканей, для дезинфекции, для получения греческого огня (дымный порох) и т.д.
Ромбическая сера имеет желтый цвет, практически нерастворима в воде, но растворяется в органических соединения, толуол, четыреххлористый углерод и т.д.
Выплавка серы
Общее содержание серы в земной коре составляет около выделяющегося при горении самой серы или какого-либо топлива. Этот способ был распространен в странах, обладающих большими запасами серных руд, например в Италии, но в настоящее время утратил свое значение.
Другой способ выплавки серы, получивший развитие главным образом в СНГ, заключается в нагревании предварительно обогащенной руды в автоклавах перегретым водяным паром.
Служащие для этой цели автоклавы (рис. 2) представляют собой железные цилиндры, рассчитанные на давление до 6 ат. Через верхний люк 1 в автоклав загружают 3—4 т измельченной руды, смешанной с небольшим количеством воды, после чего в автоклав пропускают перегретый водяной пар, нагревающий всю массу руды до 140—150°.
Процесс плавления длится около 3 час. Выплавленная жидкая сера выпускается под давлением через нижний патрубок 2 и по желобам разливается в ящики-вагонетки, откуда поступает в формы: пар выпускается через верхний патрубок, а через нижний люк 3 выгружается отработанная порода.
Большой интерес представляет способ подземной выплавки серы (способ Фраша), широко распространенный в США.
Серная кислота может выделяться и при сильных извержениях вулкана. Такие явления достаточно опасны для людей и окружающей среды. Одними из последствий попадания H2SО4 в атмосферу могут стать климатические изменения.
Серная кислота считается главной причиной, по которой выпадают кислотные дожди, а выделяется она из-за попадания в воздух диоксида серы.
Плавление серы способом Фраша
Этот способ заключается в том, что серу расплавляют под землей, непосредственно в месте ее залегания, с помощью перегретой воды, подаваемой под давлением 10—18 ат через систему из трех труб, вложенных одна в другую.
В промежуток между наружной и средней трубами нагнетают воду, имеющую температуру около 170°, а по внутренней трубе подают под давлением горячий воздух, который вытесняет расплавленную серу на поверхность земли.
Избыточная вода удаляется через специальные скважины, расположенные на некотором расстоянии от серных.
Полученная выплавкой из руды сера обычно содержит много примесей. Называется она комовой серой. Дальнейшая ее очистка производится путем перегонки.
Для перегонки серы используют так называемые рафинировочные печи. В этих печах сера нагревается до кипения.
Образующиеся при кипении пары поступают в огромную выложенную кирпичом камеру. Вначале, пока камера холодная, пары серы прямо переходят в твердое состояние и осаждаются на 0,10%.
Самородная сера обычно содержит большее или меньшее количество посторонних веществ. Для отделения серы от примесей: пользуются ее способностью легко плавиться.
Выплавка серы производится различными способами. Выбор того или иного из них определяется в основном содержанием серы в руде, а также составом и свойствами пустой породы.
Наиболее старый из способов выплавки серы заключается в ее нагревании до температуры плавления за счет тепла, стенках камеры в виде светло-желтого порошка, известного под названием серного цвета.
Когда камера нагреется выше 120°, сера начинает сгущаться в жидкость, которую выпускают-из камеры в деревянные формы, где она и застывает в виде палочек. Полученная таким путем сера называется черенковой.
Весьма важным источником получения серы являются железный колчедан, или пирит FeS2, и полиметаллические сернистые руды, содержащие сернистые соединения меди, цинка и других цветных металлов наряду с железным колчеданом и пустой породой.
Получение серы из пирита
Из пирита серу получают, нагревая руду в шахтной печи при температуре выше 600°. Процесс выражается уравнением:
Из полиметаллических руд серу получают одновременно с металлом при восстановительной плавке руды.
Некоторое количество серы (газовая сера) получают из газов, образующихся при коксовании и газификации угля.
Мировая (без СНГ) добыча серы составляет в настоящее-время около 4 млн. т .
Статья на тему Сера в природе
Похожие страницы:
Соединения серы с галогенами При пропускании хлора в расплавленную серу образуется однохлористая сера, представляющая собой оранжевую жидкость, кипящую при 138°.
Водород в природе Водород (Hydrogenium; ат. вес 1,008) в свободном состоянии встречается в природе лишь в незначительных количествах, главным образом.
Железо в природе Железо (Ferrum); ат. вес 55,85 — самый распространенный после алюминия металл на земном шаре, составляющий 4,2% веса.
Что такое сера самородная Это минерал с формулой S — класса самородных неметаллов. В природе встречается в трех кристаллических полиморфных.
Содержание статьи1 СЕРА ИСТОРИЯ1.1 Сера это1.2 Происхождение серы СЕРА ИСТОРИЯ Одно из немногих веществ, которыми уже несколько тысяч лет назад.
Круговорот азота При гниении органических веществ значительная часть содержащегося в них азота превращается в аммиак, который под влиянием живущих в.

Чистая желтая сера
Сера — минерал из класса самородных элементов. Сера представляет собой пример хорошо выраженного энантиоморфного полиморфизма. В природе образует 2 полиморфные модификации: a-сера ромбическая и b-сера моноклинная. При атмосферном давлении и температуре 95,6°С a-сера переходит в b-серу. Сера жизненно необходима для роста растений и животных, она входит в состав живых организмов и продуктов их разложения, ее много, например, в яйцах, капусте, хрене, чесноке, горчице, луке, волосах, шерсти и т.д. Она присутствует также в углях и нефти.
Смотрите так же:
СТРУКТУРА
Кристаллическая структура и две сингонии серы
СВОЙСТВА

Самородная сера жёлтого цвета, при наличии примесей – жёлто-коричневая, оранжевая, бурая до чёрной; содержит включения битумов, карбонатов, сульфатов, глины. Кристаллы чистой серы прозрачны или полупрозрачны, сплошные массы просвечивают в краях. Блеск смолистый до жирного. Твердость 1-2, спайности нет, излом раковистый. Плотность 2,05 -2,08 г/см 3 , хрупкая. Легко растворима в канадском бальзаме, в скипидаре и керосине. В HCl и H2SO4 нерастворима. HNO3 и царская водка окисляют серу, превращая её в H2SO4. Сера существенно отличается от кислорода способностью образовывать устойчивые цепочки и циклы из атомов.
Наиболее стабильны циклические молекулы S8, имеющие форму короны, образующие ромбическую и моноклинную серу. Это кристаллическая сера — хрупкое вещество жёлтого цвета. Кроме того, возможны молекулы с замкнутыми (S4, S6) цепями и открытыми цепями. Такой состав имеет пластическая сера, вещество коричневого цвета, которая получается при резком охлаждении расплава серы (пластическая сера уже через несколько часов становится хрупкой, приобретает жёлтый цвет и постепенно превращается в ромбическую). Формулу серы чаще всего записывают просто S, так как она, хотя и имеет молекулярную структуру, является смесью простых веществ с разными молекулами.
Плавление серы сопровождается заметным увеличением объёма (примерно 15 %). Расплавленная сера представляет собой жёлтую легкоподвижную жидкость, которая выше 160 °C превращается в очень вязкую тёмно-коричневую массу. Наибольшую вязкость расплав серы приобретает при температуре 190 °C; дальнейшее повышение температуры сопровождается уменьшением вязкости и выше 300 °C расплавленная сера снова становится подвижной. Это связано с тем, что при нагревании серы она постепенно полимеризуется, увеличивая длину цепочки с повышением температуры. При нагревании серы свыше 190 °C полимерные звенья начинают рушиться.
Сера может служить простейшим примером электрета. При трении сера приобретает сильный отрицательный заряд.
МОРФОЛОГИЯ

Образует усечённо-дипирамидальные, реже дипирамидальные, пинакоидальные или толстопризматические кристаллы, а также плотные скрытокристаллические, сливные, зернистые, реже тонковолокнистые агрегаты. Главные формы на кристаллах: дипирамиды (111) и (113), призмы (011) и (101), пинакоид (001). Также сростки и друзы кристаллов, скелетные кристаллы, псевдосталактиты, порошковатые и землистые массы, налёты и примазки. Для кристаллов характерны множественные параллельные срастания.
ПРОИСХОЖДЕНИЕ

Сера образуется при вулканических извержениях, при выветривании сульфидов, при разложении гипсоносных осадочных толщ, а также в связи с деятельностью бактерий. Главные типы месторождений самородной серы – вулканогенные и экзогенные (хемогенно-осадочные). Экзогенные месторождения преобладают; они связаны с гипсо-ангидритами, которые под воздействием выделений углеводородов и сероводорода восстанавливаются и замещаются серно-кальцитовыми рудами. Такой инфильтрационно-метасоматический генезис имеют все крупнейшие месторождения. Самородная сера часто образуется (кроме крупных cкоплений) в результате окисления H2S. Геохимические процессы её образования существенно активизируются микроорганизмами (сульфатредуцирующими и тионовыми бактериями). Сопутствующие минералы – кальцит, арагонит, гипс, ангидрит, целестин, иногда битумы. Среди вулканогенных месторождений самородной серы главное значение имеют гидротермально-метасоматические (например, в Японии), образованные сероносными кварцитами и опалитами, и вулканогенно-осадочные сероносные илы кратерных озёр. Образуется также при фумарольной деятельности. Образуясь в условиях земной поверхности, самородная сера является всё же не очень устойчивой и, постепенно окисляясь, даёт начало сульфатам, гл. образом гипсу.
Используется в производстве серной кислоты (около 50% добываемого количества). В 1890 г. Герман Фраш предложил плавить серу под землёй и извлекать на поверхность через скважины, и в настоящее время месторождения серы разрабатывают главным образом путём выплавки самородной серы из пластов под землёй непосредственно в местах её залегания. Сера также в больших количествах содержится в природном газе (в виде сероводорода и сернистого ангидрида), при добыче газа она откладывается на стенках труб, выводя их из строя, поэтому её улавливают из газа как можно быстрее после добычи.
ПРИМЕНЕНИЕ

Сера входит в состав спичечной головки
Примерно половина производимой серы используется в производстве серной кислоты. Серу применяют для вулканизации каучука, как фунгицид в сельском хозяйстве и как сера коллоидная — лекарственный препарат. Также сера в составе серобитумных композиций применяется для получения сероасфальта, а в качестве заместителя портландцемента — для получения серобетона. Сера находит применение для производства пиротехнических составов, ранее использовалась в производстве пороха, применяется для производства спичек.

Сера представляет собой химический элемент в группе кислорода. Горит в воздухе синим пламенем и выделяет едкий запах. Сера является важнейшим элементом для всех живых существ, она находится в аминокислотах и ферментах, играет важную роль в анаэробном производстве энергии.
Наиболее термодинамически стабильной модификацией серы при комнатной температуре является ромбическая кристаллизация α-серы (ромбическая сера), без запаха и вкуса, обладает типичным серно-желтым цветом.
Физико-химические свойства
Сера — мягкий, хрупкий минерал, не растворяется в воде и неокисляющих кислотах. Природные кристаллы серы чувствительны к свету и теплу, их необходимо хранить в темном, прохладном и сухом месте. При нормальных условиях сера является твердым веществом без запаха. Существует несколько неметаллических модификаций серы.
Кристаллы серы показывают типичные формы ромбической системы, такие как пинакоиды, призмы или дипирамиды. Прозрачные, неповрежденные, хорошо сформированные кристаллы в форме бочек или толстых брусков очень популярны среди коллекционеров.
Ромбическая сера также называется α-серой. При нагревании от 95,2 C она превращается в желтый жидкий расплав, и получается λ-сера. Если смесь продолжать нагревать от 159 С она постепенно становится вязкой, образуя при 200 С μ-серу. Свыше 250 C вязкость уменьшается, температура кипения составляет 444 C. Если расплавленная сера затвердевает на поверхности в больших тиглях, образуются длинные моноклинные кристаллические иглы. Эта модификация называется моноклинной серой или β-серой. Когда она остывает до температуры ниже 115,2 C, то медленно превращается обратно в ромбическую серу. Если наливать жидкий расплав в стакан с холодной водой, образуются эластичные нити или желто-коричневая вязкая масса, которая называется пластичной серой, которая затем постепенно превращается обратно в ромбическую серу.
Сера очень реактивна и образует химические соединения со многими элементами. Исключение составляют золото, платина, иридий, азот, теллур, йод и благородные газы. На воздухе сера горит голубоватым пламенем с образованием токсичного и едко пахнущего газа диоксида серы (SO2). Когда диоксид серы растворяется в воде, образуется раствор диоксида серы и, в небольших количествах, серная кислота.
Сера подвергается воздействию окисляющих кислот, таких как концентрированная азотная кислота. Другими важными соединениями серы являются серная кислота и ее соли, сульфаты.
Сера становится жидкой при 113 С (ромбическая) или при 119 С (моноклинная). Сначала жидкость становится желтой, а при дальнейшем нагревании темно-коричневой. Если сера нагревается до температуры выше 400 C, вязкий расплав снова становится жидким. Жидкая сера кипит при 445 С. Сублимированная сера получается путем охлаждения паров серы (светло-желтый порошок). Однако, если расплав быстро охлаждается (закалка), образуется пластичная сера.
Нахождение в природе
Сера встречается в земной коре с долей 0,048% (15-й элемент по частоте распространения). Огромные месторождения расположены в Сицилии, Польше, Ираке, Иране, Луизиане, Техасе и Мексике. Распространена сера в сульфидных минералах, таких как пирит (FeS2), халькопирит (CuFeS2), галенит (PbS) и сфалерит (ZnS). Большинство металлов (особенно тяжелых металлов) встречаются в природе в виде плохо растворимых сульфидов.
Важным источником серы являются ископаемые виды топлива, такие как нефть, природный газ и уголь. В частности, природный газ содержит относительно большое количество сероводорода (H2S).
Важными минералами, содержащими соединения серы, являются гипс (сульфат кальция), пирит и марказит (сульфид железа), цветной гравий меди (сульфид меди), галенит (сульфид свинца), цинковая обманка (сульфид цинка) или киноварь (сульфид ртути). Большие количества серы также содержатся в ископаемом топливе, нефти и угле. Природный газ часто загрязнен сероводородом.
Получение
Сера является одним из наиболее распространенных элементов на земле. Большие месторождения серы расположены в США, Канаде, странах СНГ, Китае, Мексике, Саудовской Аравии и Польше. Также присутствует в виде различных ионов из растворимых соединений в морях и океанах или в природных источниках. Один из самых известных серных источников находится в Карловых Варах.
Раньше только твердые минералы являлись источником серы: 3,5 миллиона тонн добывалось ежегодно с использованием процесса Фраша, разработанного Германом Фрашем, главным образом в США и Польше. Наибольшую долю составляла сера, извлекаемая из сульфидных руд. Сегодня сера производится в больших количествах в качестве отходов при десульфурации нефти с использованием процесса Клауса. В ископаемом топливе, таком как уголь и нефть, содержится большое количество серы. Поэтому нефтяные фракции, которые используются для выработки энергии, обессеривают перед дальнейшей обработкой.
Поскольку месторождения серы не удовлетворяют современные потребности в этом сырье, сера извлекается из других природных соединений и руд. Сера, которая образуется как токсичный продукт отходов многих процессов сгорания, может быть получена путем восстановления. Например, сероводород производится в процессе переработки природного или коксового газа. Это высокотоксичный газ, который можно преобразовать в воду и серу с помощью кислорода и катализатора.
Около половины от общего объема получается из твердой серы и последующей очистки дистилляцией. Труба длиной от 150 до 800 метров под давлением подает горячую воду в серосодержащие породы. Подземная сера плавится и затем транспортируется вверх горячим сжатым воздухом. Полученная чистота серы составляет от 99,5 до 99,8%. Одна скважина может добывать до 300 тонн серы в день. Другая большая часть получается в результате десульфурации сырой нефти и природного газа с использованием процесса Клауса. Одна треть сероводорода H2S, содержащегося в природном газе или коксовых газах, сжигается с кислородом в камере сгорания с образованием диоксида серы.
Серу также можно получить обжигом пирита. Когда руду нагревают, получают диоксид серы, который затем восстанавливают с помощью углерода или кокса.
Применение
Сера используется как в химической, так и в фармацевтической промышленности, включая производство серной кислоты, красителей, инсектицидов и искусственных удобрений. Только около 10% общего производства серы перерабатывается в элементарной, то есть в чистой форме. Основное применение элементарной серы — производство вулканизированной резины и красителей.
Чистая сера необходима для производства спичек и фейерверков. Она также является компонентом средств защиты растений, используется для обессеривания бочек (дезинфекция диоксидом серы путем сжигания чистой серы) и в качестве отбеливающего агента для натуральных волокон, таких как шелк и шерсть.
Фармацевтическое использование серы было известно в древние времена в качестве слабительного средства. Сера раздражает слизистую оболочку кишечника, а вырабатываемый бактериями сероводород стимулирует перистальтику. Серные составы использовались для лечения кожных заболеваний, таких как прыщи, экзема, чесотка, микозы и тому подобное. Сера — одно из самых популярных лекарств в классической гомеопатии.
В тяжелой промышленности сера является важным легирующим элементом для стали. Также используется как нитратная сера в фейерверках и в других взрывчатых веществах. В сельском хозяйстве сера убивает вредителей, таких как паутинный клещ и мучнистая роса.
Биологическое значение
Сера содержится в аминокислотах цистеина и метионина, а также во всех полипептидах, белках и ферментах на их основе. Дисульфидные связи широко используются и способствуют образованию и стабилизации белковых структур. Поэтому сера является важным элементом всех живых клеток.
Некоторые подгруппы протеобактерий способны выполнять фотосинтез в отсутствие кислорода. Они используют сероводород (H2S) или элементарную серу вместо воды в качестве донора электронов для восстановления CO2, например, Thiomargarita namibiensis.
Растения поглощают серу из корней в форме сульфат-ионов, которые затем восстанавливаются до сульфида и используются для образования цистеина и других органических соединений серы.
Физиология
Растения поглощают элементную серу в виде сульфатов через корни. При восстановлении в хлоропластах сульфат ассимилируется с аминокислотами цистеином и метионином. Сера также является важным биоэлементом в организме человека. Тиольная группа RSH содержится во многих пептидах, белках или коферментах. Атомы серы также интегрированы в молекулу биотина (витамин Н) или молекулу тиаминпирофосфата (витамин В1).
Острая токсичность элементарной серы не классифицируется как особо высокая. Однако сера может раздражать кожу и особенно слизистые оболочки (глаза).
Усвоение серы у растений
Сера поглощается через корни в виде сульфата. Ассимиляция происходит в корнях, но большая часть сульфата транспортируется к листьям через элементы ксилемы и восстанавливается там в хлоропласте.
Влияние серы на здоровье человека
Сера известна своими целебными свойствами на протяжении тысячелетий. При наружном применении она используется для лечения кожных заболеваний, таких как псориаз и экзема. Серные ванны считаются противовоспалительными при кожных и заживляющими при ревматических заболеваниях. В области альтернативной медицины серосодержащие аминокислоты используются для вывода токсинов.
Сера необходима для нашего организма. В отличие от многих других веществ, которые наш организм может производить самостоятельно, это невозможно с серой. Организм человека содержит около 0,2% серы. Это означает, что содержание серы в организме в 40 раз выше, чем, например, содержание гораздо более широко известного железа.
Сера является важным компонентом многих аминокислот, таких как L-метионин, L-цистеин и L-цистин, и, следовательно, участвует в многочисленных метаболических процессах. Серосодержащие аминокислоты важны для функционирования суставных хрящей, сухожилий, мышц, а также для крепких костей. Кроме того, сера связывает накопленные в организме токсины, такие как никотин и алкоголь, и обеспечивает их вывод из организма. Метаболизм некоторых аминокислот вырабатывает серную кислоту, которая выделяется с мочой.
Суточная доза элемента составляет около 900 мг, поступающих в организм в основном в виде мяса, рыбы и сои. Дефицит серосодержащего витамина B1 приводит к болезни бери-бери, которая может проявляться тремором, раздражительностью, нервным параличом и даже сердечной недостаточностью.
Элементарная сера относительно нетоксична для человека, но это не относится ко всем ее соединениям. Серная кислота оказывает разъедающее действие, пероральный прием около 5 мл приводит к смерти. В целом вещества, содержащие серу, оказывают на здоровье человека следующие негативные эффекты:
- Нарушения кровообращения;
- Поражение сердца;
- Нарушение зрения;
- Нарушения репродуктивной системы;
- Повреждение иммунной системы;
- Проблемы с желудком и кишечником;
- Поражение печени и почек;
- Гормональные нарушения;
- Кожная сыпь;
- Тромбоэмболия легочной артерии.
Исследования на животных показали, что сера может вызвать серьезное повреждение сосудов головного мозга, сердца и почек. Кроме того, эти эксперименты показали, что сера представляет опасность для плода и вызывает врожденные нарушения.
Продукты, содержащие серу
Сера играет ключевую роль в ряде важных функций организма, и по этой причине важно регулярно снабжать организм достаточным количеством этого минерала. Многие продукты содержат серу. В частности, молоко, яйца, йогурт, творог, сыр, рыба, мясо, орехи, чеснок, горчица и лук.
Как правило, нет необходимости добавлять серу в организм в виде пищевой добавки.
Токсичность
Сера является важным минералом для человека, но при определенных условиях она может быть очень токсичной. Сера является элементом, который используется в организме для детоксикации и белкового обмена. Она поступает в организм с пищей и не представляет опасности для человека, так как содержится в многочисленных белках. Поэтому передозировка серой в большинстве случаев невозможна при приеме или приготовлении пищи.
В других формах, однако, сера может быстро привести к серьезному отравлению. Природные газы часто содержат соединения серы, которые являются токсичными для человека.
Сероводород
Сероводород (H2S) является газом, обладает резким запахом тухлых яиц и через некоторое время блокирует обонятельные нервы. Это особенно опасно, потому что создается ощущение, что сероводорода больше нет, что может привести к отравлению и смерти. Для отравления сероводородом характерны следующие симптомы:
- Сильным приступ кашля;
- Тошнота;
- Рвота;
- Боли в животе.
Диоксид серы
Диоксид серы (SO2) также является газом и обладает примерно такими же свойствами для человека, что и сероводород. Диоксид серы является основным компонентом кислотных дождей.
Сера и вода
Концентрация серы в морской воде составляет около 870-930 частей на миллион, в то время как речная вода обычно содержит только около 4 частей на миллион этого элемента.
Как и в каких соединениях сера реагирует с водой?
Элементарная сера стабильна, поэтому не вступает в реакцию с водой. Но некоторые соединения серы активно реагируют с водой. Одним из примеров является диоксид серы, который при добавлении в воду реагирует с образованием серной кислоты: SO2 + H2O -> H2SO4
Сульфурилхлорид бурно реагирует с водой с образованием агрессивной хлорсульфоновой кислоты. Соединение реагирует с образованием хлористого водорода и серной кислоты.
Растворимость серы и / или ее соединений в воде
Сама сера не растворяется в воде. Сульфиды тяжелых металлов также считаются почти нерастворимыми. С другой стороны, сероводород имеет растворимость в воде 94 г / л, гексафторид серы — 40 мг / л. Сульфаты также обычно хорошо растворяются в воде.
Как сера может попасть в воду?
Некоторые минералы содержат серу, например халькопирит, борнит или миллерит. Кроме того, в виде сульфата она входит в состав гипса. Сера также может быть найдена в отложениях с высоким содержанием органических веществ, в основном в форме сульфидов. Однако этот элемент также встречается в природе в элементарной форме. Сероводород входит в состав природного газа и сероорганических соединений угля и нефти.
Сжигание угля, природного газа и сырой нефти с образованием диоксида серы также играет важную роль в выбросе серы в окружающую среду. Например, в угле содержание серы составляет 2-3%. Однако современные технологии позволяют превращать двуокись серы, полученную при производстве металлов, в серную кислоту, и, как следствие, топочный мазут содержит меньше серы.
Какие экологические проблемы может вызвать загрязнение воды серой?
Сера — главный компонент почвы. Нормальные воздушно-сухие почвы содержат 200-2000 ppm элемента. В верхних горизонтах почв он в значительной степени связан органически. В болотах содержание серы может достигать 35 000 частей на миллион, а в гипсовых почвах это значение часто ещё выше. Концентрация серы около 0,06–1% от ее сухого вещества может быть обнаружена в растительном материале.
Диоксид серы является одной из причин кислотных дождей и зимнего смога. Газообразный диоксид серы, который встречается в природе в низких концентрациях, но выделяется в больших количествах в результате деятельности человека, растворяется в каплях дождя, образуя сернистую кислоту. Другая возможность — предыдущее окисление до триоксида серы, которое образует серную кислоту в воде. Кислотные дожди вызывают закисление почвы, что, в свою очередь, приводит к повреждению растений и повышению кислотности водоемов.
Сама сера не считается опасной для воды. С другой стороны, некоторые соединения серы могут нанести больший ущерб водоемам. Сульфурилхлорид, например, является одним из веществ, которые незначительно опасны для воды, тогда как сероуглерод представляет большую опасность для природных вод.
Другие соединения серы с большей вероятностью будут играть роль в экологических проблемах. Например, гексафторид серы — это соединение, потенциал глобального потепления которого примерно в 10 000 раз выше, чем у диоксида углерода. Сера имеет четыре стабильных и шесть нестабильных, следовательно, радиоактивных изотопов.
Читайте также:

