Реакция галогенирования это кратко
Обновлено: 08.07.2024
Химические свойства, получение и применение алканов
Существует огромное число различных алканов. Их многообразие объясняется как возможностью образования углеродных цепей различной длины, так и изомерией. В связи с этим изучать химические свойства каждого алкана отдельно не представляется возможным. В то же время молекулы различных алканов имеют сходное строение: атомы углерода соединены между собой и атомами водорода одинарными ковалентными связями. Учитывая это, можно ожидать, что химические свойства различных алканов будут во многом сходными.
Все алканы характеризуются низкой химической активностью. Они не взаимодействуют с растворами кислот, оснований, солей. На них не действует такой сильный окислитель, как KMnO4, и такие сильные восстановители, как щелочные металлы. Вы знаете, что щелочные металлы очень активны и реагируют практически со всеми веществами, с которыми соприкасаются, в том числе легко окисляются кислородом воздуха. Чтобы уберечь щелочные металлы от окисления, их хранят под слоем керосина — смеси, состоящей в основном из насыщенных углеводородов. При этом алканы, входящие в состав керосина, не реагируют со щелочными металлами.
Из-за низкой химической активности алканов реакции с их участием протекают в жёстких условиях (при нагревании или облучении ультрафиолетовым излучением).
Мы изучим реакции алканов с галогенами (Cl2 и Br2) и кислородом (O2), а также превращения, которые они претерпевают при нагревании.
1. Галогенирование. Взаимодействие с галогенами
Взаимодействие алканов с галогенами — хлором и бромом — протекает при нагревании или облучении ультрафиолетовым излучением.
Если смесью газообразных метана и хлора заполнить стеклянный сосуд и поместить его в тёмное место, реакция протекать не будет. Однако при нагревании смеси или облучении её ультрафиолетовым излучением протекает химическая реакция замещения атомов водорода в молекуле метана на атомы хлора:
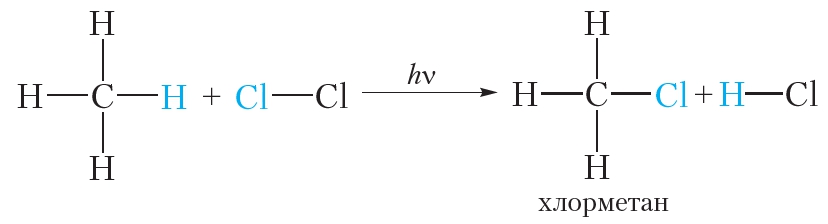
В уравнениях реакций, протекающих при облучении, над стрелкой записывают буквы hv. Данная реакция называется реакцией галогенирования и относится к реакциям замещения.
Если только один атом водорода в молекуле замещается на атом галогена, то реакцию называют моногалогенированием. Приведённая выше реакция является реакцией монохлорирования метана. В избытке хлора оставшиеся три атома водорода молекулы метана могут последовательно замещаться на галоген:
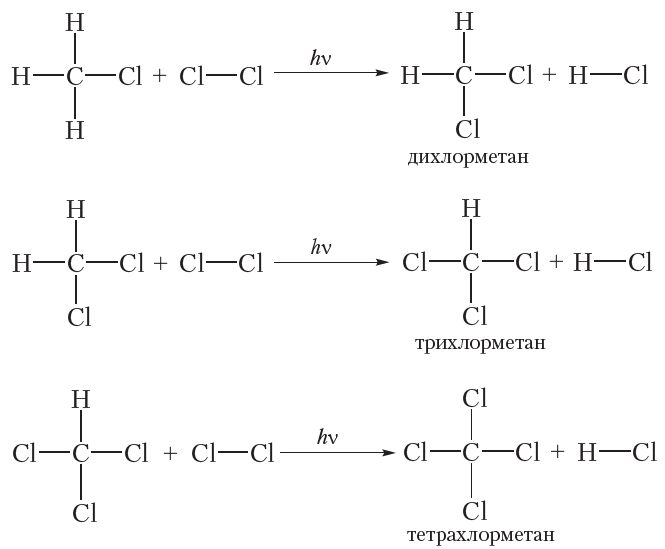
Приведём уравнения реакций всех четырёх стадий хлорирования метана с использованием молекулярных формул:
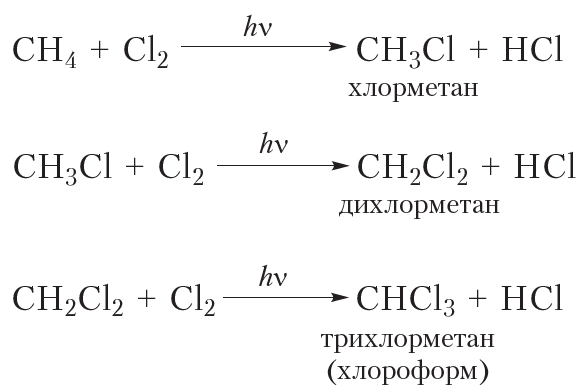
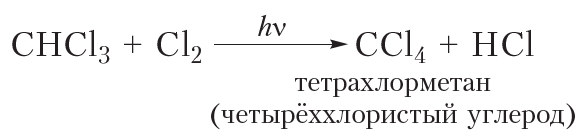
Рассмотрим реакции монохлорирования гомологов метана.
Монохлорирование этана
Для этана уравнение реакции следующее:
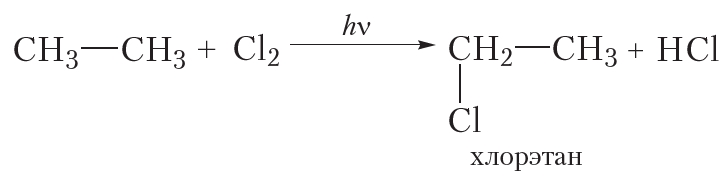

Таким образом, при монохлорировании этана так же, как и в случае метана, получается только одно органическое вещество — хлорэтан.
Монохлорирование пропана
При монохлорировании пропана образуется смесь двух органических веществ:
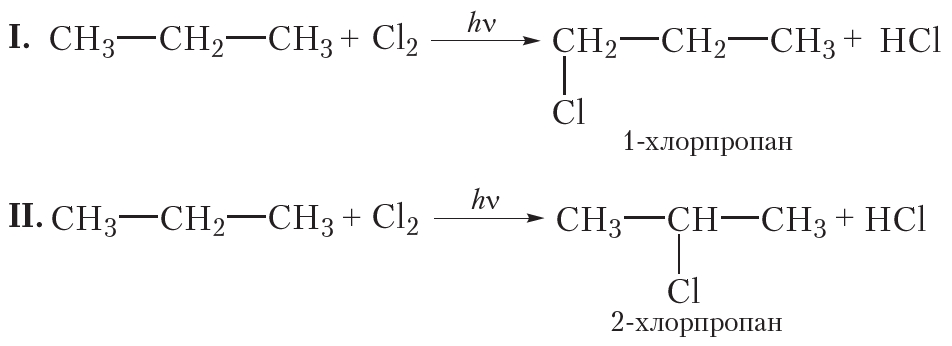
В случае I происходит замещение на галоген атома водорода при первом атоме углерода, продукт реакции 1-хлорпропан. В случае II замещается атом водорода при втором атоме углерода, продуктом реакции является 2-хлорпропан. Обратите внимание на то, что при построении названий нумерацию атомов углерода начинают с того конца углеродной цепи, к которому ближе расположен атом хлора.
В результате реакции монохлорирования пропана образуются два продукта: 1-хлорпропан и 2-хлорпропан, имеющие одинаковые молекулярные формулы C3H7Cl. Это неудивительно, ведь 1-хлорпропан и 2-хлорпропан — изомеры.
Если мы запишем уравнение реакции монохлорирования пропана с использованием молекулярных формул, оно будет выглядеть следующим образом:
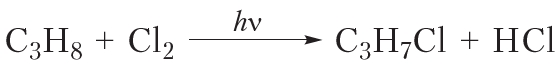
Уравнение реакции, записанное в таком виде, не только не позволяет определить, какой именно продукт (1-хлорпропан или 2-хлорпропан) имеется в виду, но и приводит к распространённому заблуждению, что при монохлорировании пропана образуется только один органический продукт — C3H7Cl, хотя на самом деле их два. Поэтому в органической химии при записи уравнений реакций обычно используют структурные, а не молекулярные формулы веществ.
В результате хлорирования алканов происходит замещение одного или нескольких атомов водорода в молекуле алкана на атомы галогена. Поэтому получающиеся органические вещества называют галогенпроизводными алканов.
Пример. Замещение двух атомов водорода хлором в молекуле этана.
Реакция протекает в два этапа.
а) Первая стадия хлорирования этана. На первой стадии происходит замещение одного атома водорода. При этом образуется только одно органическое вещество — хлорэтан:

б) Вторая стадия хлорирования этана. На данной стадии происходит взаимодействие молекулы хлора с молекулой хлорэтана, образовавшегося на первой стадии. Очевидно, что при этом могут образоваться два органических вещества:
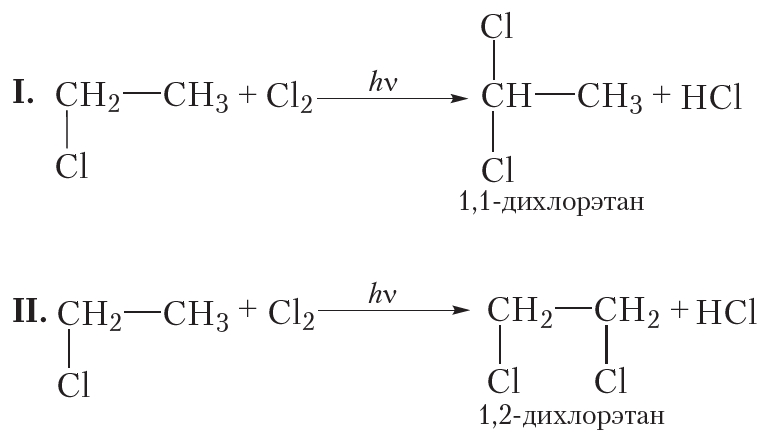
Действительно, в результате хлорирования этана можно получить смесь двух дихлорпроизводных.
Алканы вступают в реакции замещения также с бромом. Например:
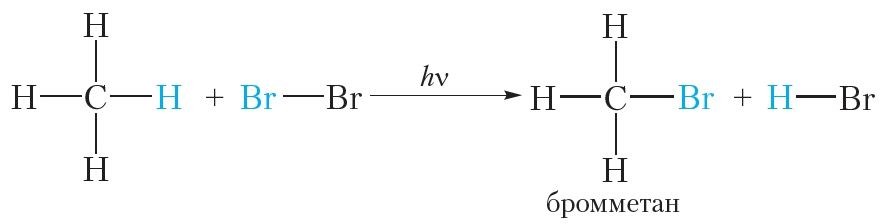

В заключение ещё раз обратим внимание, что реакции алканов с хлором и бромом протекают в жёстких условиях: при облучении или нагревании.
С механизмом реакции галогенирования алканов вы можете познакомиться, перейдя по ссылке в QR-коде.
В реакциях галогенирования атомы водорода в молекуле алкана замещаются на атомы галогена, при этом углеродная цепь молекулы сохраняется. В других реакциях алканов их углеродный скелет изменяется или полностью разрушается. Рассмотрим такие реакции.
2. Пиролиз
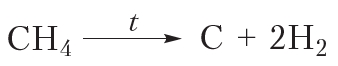
При сильном нагревании алканов в их молекулах происходит разрыв связей и . В результате молекулы алканов могут быть полностью разрушены с образованием углерода и водорода. Разложение веществ при высоких температурах называют пиролизом (от греч. пиро — огонь, жар и лизис — разложение, распад). Например:
Общая схема реакции пиролиза алканов (n — число атомов углерода в молекуле алкана):
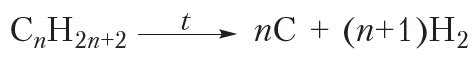
Эту реакцию используют в промышленности для получения сажи и водорода.
3. Изомеризация
Ещё одним химическим свойством алканов является изомеризация, то есть превращение одного изомера в другой. Это свойство возможно для алканов, начиная с бутана, так как метан, этан и пропан изомеров не имеют. Реакция изомеризации протекает при пропускании алкана через реактор, нагретый до высокой температуры, в присутствии катализатора. При этом молекулы алканов линейного строения превращаются в молекулы разветвлённого строения, например реакция изомеризации н-бутана:
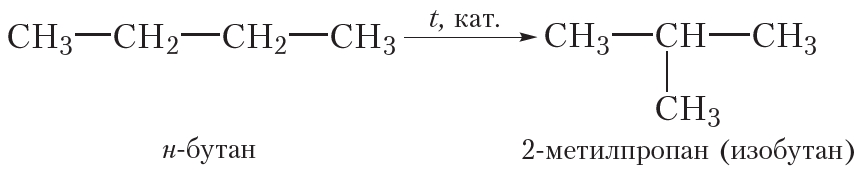
4. Горение. Взаимодействие с кислородом
Важнейшее свойство алканов — горение. Алканы воспламеняются при поджигании. Уравнение реакции горения метана:

Эта реакция вам хорошо знакома, она протекает при поджигании газа в кухонной газовой плите, ведь метан — основной компонент природного газа. Смесью пропана и изомерных бутанов наполняют газовые баллоны. Уравнения реакций горения этих алканов:
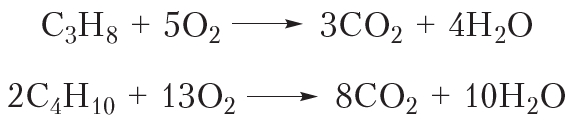
Последующие члены гомологического ряда алканов также горят при поджигании. Можно записать общее уравнение реакции горения:
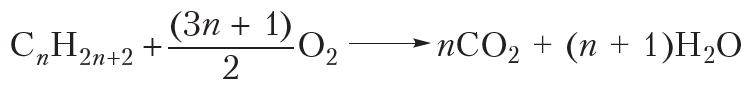
Видно, что при горении атомы водорода из молекулы алкана переходят в молекулы воды, а атомы углерода — в молекулы углекислого газа. Если горение алкана происходит в условиях недостатка кислорода, то, наряду с углекислым газом (СО2), может образоваться угарный газ (СО) или углерод (С) в виде сажи:
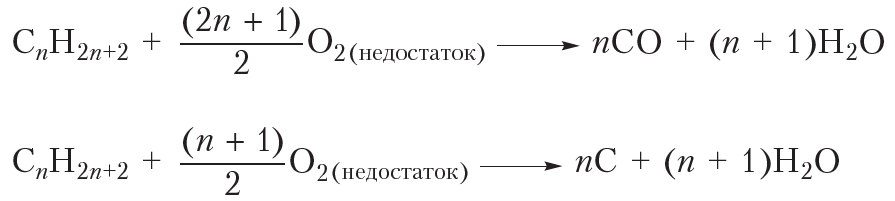
Отметим, что свойство гореть в кислороде присуще почти всем органическим соединениям. Поскольку все органические вещества содержат углерод, то при их горении могут образовываться оксиды углерода и сажа.
Образование угарного газа (CO) при неполном сгорании органического вещества смертельно опасно из-за высокой токсичности СО. Отравление угарным газом может произойти при неправильной эксплуатации печей и каминов.
Как видно, химические свойства алканов не отличаются большим разнообразием. Для них характерны в основном реакции окисления (в частности, горения), разложения и изомеризации при высокой температуре, а также реакции замещения, в результате которых получают галогенпроизводные алканов.
Получение и применение алканов
Алканы входят в состав природного газа и нефти, поэтому основной метод их получения — выделение из природных источников (природного газа и нефти).
Вместе с тем, алканы могут быть получены из других органических веществ. Эти реакции мы будем рассматривать по мере дальнейшего изучения органической химии.
При горении алканов выделяется большое количество теплоты. В связи с этим алканы используются в качестве топлива. Мы уже говорили, что метан является основным компонентом природного газа. Смесью пропана и изомерных бутанов заполняют газовые баллоны. Жидкие алканы входят в состав бензина и дизельного топлива.
Другим направлением использования алканов является получение из них различных веществ. То есть алканы применяются в качестве сырья в химической промышленности. Взаимодействием метана с водяным паром получают водород:
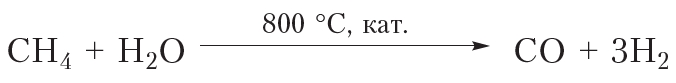
Из алканов получают углеводороды с двойными и тройными связями (ненасыщенные углеводороды). Эти углеводороды являются химически более активными, и из них синтезируют множество полезных органических веществ. Способы получения и свойства ненасыщенных углеводородов рассмотрим в следующих параграфах.
Молекулы различных алканов имеют сходное строение, поэтому алканы обладают сходными химическими свойствами.
Алканы при повышенной температуре или облучении вступают в реакции замещения с галогенами (хлором и бромом), в результате которых углеродный скелет молекулы алкана сохраняется, а атомы водорода замещаются атомами галогенов.
При сильном нагревании алканов в их молекулах происходит разрыв связей и . В результате молекулы алканов могут быть полностью разрушены с образованием углерода и водорода (пиролиз).
Нагревая алканы неразветвлённого строения в присутствии катализатора, можно получить разветвлённые алканы (изомеризация).
Алканы сгорают в кислороде. В результате реакции могут образовываться СО2, СО, С и Н2О.
Алканы содержатся в природном газе и нефти.
Алканы в основном используются в качестве топлива, а также для получения других веществ (водород, ненасыщенные углеводороды).
*Механизм реакции галогенирования алканов
Для того чтобы метан вступил в реакцию замещения с хлором, необходимо облучение смеси ультрафиолетовым излучением. Интересно, что данная реакция продолжается и после прекращения облучения.
Какое же воздействие оказывает ультрафиолетовое излучение на смесь метана с хлором? Сначала под действием излучения молекула хлора распадается на два атома хлора, каждый из которых имеет неспаренный электрон. Эта реакция называется инициированием:
![]()
Частицы, имеющие неспаренный электрон, называются радикалами. Радикалы при обычных условиях чрезвычайно неустойчивы и сразу же вступают во взаимодействие с другими молекулами.
Так, образовавшийся в результате распада молекулы хлора радикал Cl• взаимодействует с молекулой метана. При этом образуется молекула хлороводорода и радикал метил •CH3:
Радикал •CH3, в свою очередь, взаимодействует со следующей молекулой хлора, образуя хлорметан и новый радикал хлор:
Далее снова повторяются превращения (1) и (2). Цепочка этих превращений может повторяться сотни раз, поэтому подобные реакции называют цепными. Реакции (1) и (2) называются ростом цепи:
![]()
Цепь может оборваться в результате взаимодействия двух радикалов. Такая реакция называется обрывом цепи :
![]()
Следует отметить, что облучение смеси ультрафиолетовым светом необходимо лишь для распада молекулы хлора на атомы — стадии инициирования. Так как на стадии роста цепи в реакциях участвуют активные частицы (радикалы), то на этой стадии подвод энергии уже не требуется. Поэтому реакция хлорирования метана продолжает протекать даже после прекращения облучения.
По цепному радикальному механизму протекает реакция между водородом и кислородом, известная вам из курса неорганической химии. Такие реакции идут с очень большими скоростями и могут сопровождаться взрывом.
*Получение алканов
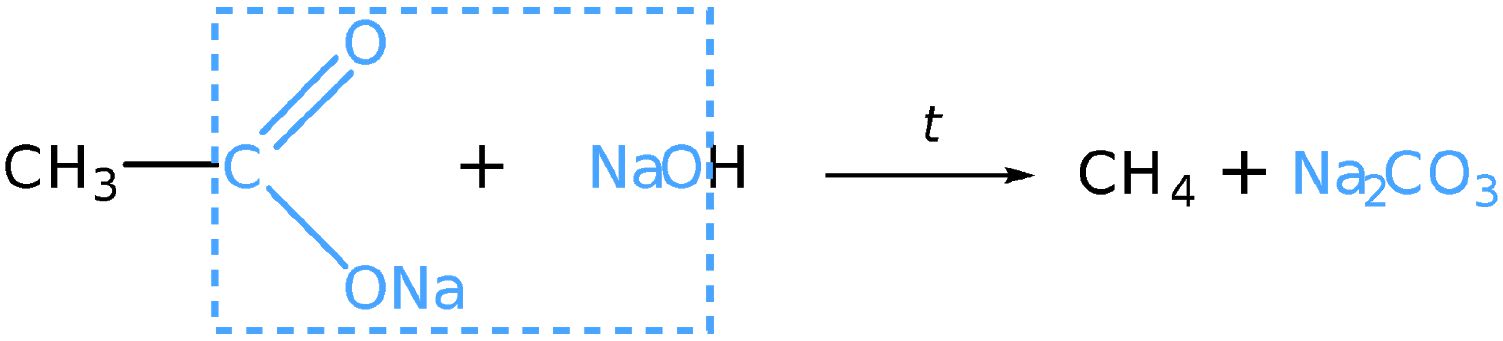
Нагревание солей карбоновых кислот со щёлочью
Алканы можно получить нагреванием натриевых солей карбоновых кислот с гидроксидом натрия. Так, при нагревании твёрдой смеси натриевой соли уксусной кислоты (ацетата натрия) с гидроксидом натрия образуется метан. Уравнение реакции:
Реакция Вюрца
Одним из методов получения алканов является реакция Вюрца, которая заключается во взаимодействии галогенпроизводных алканов с металлическим натрием. В качестве примера приведём реакцию получения этана:
![]()
Очевидно, что данную реакцию следует использовать для получения алканов симметричного строения, т. е. состоящих из двух одинаковых частей.
Реакция названа в честь её первооткрывателя — французского химика Шарля Адольфа Вюрца (1817–1884).
Вопросы и задания
1. Напишите уравнение реакции монобромирования этана.
2. Напишите уравнения реакций, которые протекают при взаимодействии н-бутана с хлором. Считайте, что только один атом водорода в молекуле н-бутана замещается на хлор. Подпишите названия образующихся органических веществ.
3. Сколько хлорпроизводных можно получить в результате хлорирования этана? Напишите уравнения реакций получения всех возможных хлорпроизводных этана, назовите хлорпроизводные. Можно ли при записи уравнений реакций в данном случае использовать молекулярные формулы?
4. Напишите уравнение реакции горения бутана в избытке кислорода. Какой объём (н. у.) углекислого газа образуется при сжигании 1 моль бутана?
5. Напишите уравнение реакции пиролиза метана с образованием водорода и углерода. Найдите массу углерода, который может быть получен при полном разложении 44,8 дм 3 (н. у.) метана.
6. Назовите основные области применения алканов.
7*. Напишите уравнения реакций, при помощи которых из этана и неорганических веществ можно получить н-бутан .
8*. В результате реакции хлорирования этана образуется небольшое количество н-бутана . Объясните данное явление, напишите уравнения соответствующих реакций.
9*. Напишите структурную формулу вещества состава С3Н6О2, если известно, что его водный раствор имеет кислую реакцию, а при прокаливании его натриевой соли с NaOH образуется этан. Напишите уравнения протекающих реакций. (Ответ: пропановая кислота.)
10*. Предложите две возможные структурные формулы вещества состава С4Н8О2, если известно, что его раствор имеет кислую реакцию. При прокаливании натриевой соли вещества с гидроксидом натрия образуется пропан. (Ответ: бутановая кислота и 2-метилпроановая кислота.)
11*. Установите строение углеводорода С6Н14, при монобромировании которого образуется третичное бромпроизводное. Этот углеводород может быть получен по методу Вюрца без побочных продуктов. Напишите схемы протекающих реакций. (Ответ: 2,3-диметилбутан. )
12*. Получите пропан из уксусной кислоты.
13*. В газообразной смеси метана и хлора на три молекулы метана приходится одна молекула хлора.
а) Рассчитайте массовые доли метана и хлора в этой смеси.
б) Исходную смесь объёмом 45 л (н. у.) поместили в замкнутый сосуд и облучили светом. Считая, что только один атом водорода в молекуле метана замещается на хлор, рассчитайте массы всех веществ в смеси, образовавшейся после окончания реакции.
(Ответ:
а) Массовые доли: метана — 40,3 %; хлора — 59,7 %.
б) m(CH4) = 16 г; m(CH3Cl) = 25,25 г; m(HCl) = 18,25 г.)
Галогенирование – процесс присоединения к молекуле органического соединения атома галогена – это одно из химических взаимодействий, в которых участвуют углеводороды ряда алканов. Благодаря общности структуры молекул у всех членов гомологического ряда реакции с галогеном обладают единым характером. При этом галогенирование пропана и следующих за ним в гомологическом ряду соединений имеет особенности, связанные с наличием в молекулах вторичных, третичных и четвертичных атомов углерода.
Краткая характеристика алканов
К простейшим органическим соединениям относятся ациклические насыщенные, или предельные углеводороды (алканы). Их отличают следующие структурные особенности:
- неразветвленные (прямые) или разветвленные молекулы, не содержащие циклических образований;
- все химические связи в молекуле – одинарные.

Общая формула имеет вид . Углеродная цепь в молекулах алканов характеризуется полным насыщением водородными атомами, вследствие чего эти соединения проявляют слабую химическую активность. Они вступают в реакции замещения, окисления, разложения и изомеризации.

Механизм замещения у алканов носит радикальный характер, так как разрыв слабополярной связи C-H протекает с образованием пары свободных радикалов – нейтральных частиц, имеющих по одному неспаренному электрону. Атом водорода может замещаться галогеном, нитрогруппой или сульфогруппой.
Галогенирование алканов
Реакция свободно-радикального замещения (обозначается символом SR – от англ. substitution radical reaction) водородного атома в молекуле алкана атомом галогена называется галогенированием. Ее инициирование требует воздействия ультрафиолетового облучения или повышенной температуры. Реакция носит цепной характер, так как в каждом ее акте образуются свободные радикалы, генерирующие следующий акт.
Замещение фтором – фторирование – чрезвычайно экзотермический процесс, сопровождающийся взрывом и разрушением молекулы алкана. Реакция с участием йода, наоборот, является эндотермической и обратимой – в ходе ее происходит восстановление продукта реакции йодоводородом, поэтому прямое йодирование неэффективно. Практический интерес представляют реакции алканов с хлором и бромом.

Стадии галогенирования
Удобнее всего рассмотреть, какой механизм имеет реакция хлорирования алканов, на примере метана. При облучении или нагреве реакционной смеси реакция инициируется, и далее цепная реакция протекает в несколько стадий.
В общем виде уравнение галогенирования метана хлором записывается в форме:


Процесс замещения не ограничивается образованием хлорметана, на молекулы которого также воздействуют радикалы . Реакция приводит к образованию смеси всех возможных продуктов хлорирования метана:

Выход продуктов зависит от мольного соотношения реагентов и условий реакции. Так, при эквимолярном количестве метана и хлора и температуре 440° C соотношение молярных долей продуктов в процентах составляет около 39:41:19:1.
Реакция бромирования отличается меньшим выделением энергии и протекает медленнее, так как его реакционная способность ниже, чем у хлора.

Региоселективность
Селективность зависит от следующих факторов:
- Активность реагента. Чем активнее галоген, тем слабее проявляется избирательность при замещении водорода. Так, при взаимодействии алкана с хлором региоселективность значительно меньше, чем в реакциях с бромом, или не наблюдается.
- Температура. Нагревание ведет к снижению селективности.
Хлорирование и бромирование пропана

В реакции пропана с хлором при низкой температуре селективная направленность выражена слабо. Несмотря на то, что образующиеся в ходе реакции радикалы менее энергичны и, следовательно, более устойчивы, свободные атомы хлора чрезвычайно активны и воздействуют как на вторичные, так и на первичные атомы, особенно при высокой температуре.

При нагревании радикалы хлора атакуют первичные атомы даже более активно, так как на разрыв их связи с водородом затрачивается меньше энергии.
При бромировании пропана региоселективность вследствие меньшей активности брома достигает высоких значений:

Бромирование протекает аналогично реакции с участием простейших алканов с преимущественным замещением водорода у вторичных атомов:

Продуктом этой реакции является 2-бромпропан.
Галогенирование бутана
В реакциях бутана с хлором селективность не играет заметной роли. Даже при низкой температуре соотношение продуктов хлорирования может быть различным:

Бромирование бутана демонстрирует большую селективность:

Реакция отщепления
Активные двухвалентные металлы (как правило, магний или цинк) отщепляют от молекул дигалогеналканов атомы хлора или брома, если они замещают водород у двух соседних атомов углерода. Между последними образуется двойная связь. Продуктом такой реакции является алкен.
Пример реакции дегалогенирования алканов – отщепление цинком атомов хлора от 1,2-дихлорпропана с образованием пропилена (пропена) и хлорида цинка:

Применение галогеналканов
Хлорированные и бромированные алканы применяются в качестве промежуточных соединений в различных отраслях, таких как синтез высокомолекулярных соединений, производство лаков, красок и растворителей. Хлоралканы служат сырьем для фторалканов, которые нельзя получить прямым фторированием.
Токсичность галогеналканов тем меньше, чем активнее входящий в их состав галоген. Поэтому фторалканы наиболее безопасны. Фторсодержащие фреоны широко используются в качестве вспенивателей, хладагентов и пропеллентов.
При протекании химических реакций происходит разрыв одних и возникновение других связей. Химические реакции условно делят на органические и неорганические. Органическими реакциям принято считать реакции, в которых, по крайней мере, одно из реагирующих веществ является органическим соединением, изменяющим свою молекулярную структуру в процессе реакции. Отличием органических реакций от неорганических является то, что, как правило, в них участвуют молекулы. Скорость таких реакции низка, а выход продукта обычно составляет всего лишь 50-80 %. Для повышения скорости реакции применяют катализаторы, повышают температуру или давление. Далее рассмотрим типы химических реакций в органической химии.
Классификация по характеру химических превращений
- Реакции замещения
- Реакции присоединения
- Реакция элиминирования (отщепления)
- Реакция изомеризации и перегруппировка
- Реакции окисления
- Реакции конденсации и поликонденсации
- Реакции разложения
Реакции замещения
В ходе реакций замещения один атом или группа атомов в начальной молекуле замещается на иные атомы или группы атомов, образуя новую молекулу. Как правило, такие реакции характерны для насыщенных и ароматических углеводородов, например:
Реакции присоединения
При протекании реакций присоединения из двух или более молекул веществ образуется одна молекула нового соединения. Такие реакции характерны для ненасыщенных соединений. Различают реакции гидрирования (восстановления), галогенирования, гидрогалогенирования, гидратации, полимеризации и т.п:
- Гидрирование – присоединение молекулы водорода:

Реакция элиминирования (отщепления)
В результате реакций отщепления органические молекулы теряют атомы или группы атомов, и образуется новое вещество, содержащее одну или несколько кратных связей. К реакциям элиминирования относятся реакции дегидрирования, дегидратации, дегидрогалогенирования и т.п.:
Реакции изомеризации и перегруппировка

В ходе таких реакций происходит внутримолекулярная перестройка, т.е. переход атомов или групп атомов с одного участка молекулы в другое без изменения молекулярной формулы вещества, участвующего в реакции, например:

Реакции окисления

В результате воздействия окисляющего реагента происходит повышение степени окисления углерода в органическом атоме, молекуле или ионе процесс за счет отдачи электронов, вследствие чего образуется новое соединение:
Реакции конденсации и поликонденсации
Заключаются во взаимодействии нескольких (двух и более) органических соединений с образованием новых С-С связей и низкомолекулярного соединения:

Поликонденсация – образование молекулы полимера из мономеров, содержащих функциональные группы с выделением низкомолекулярного соединения. В отличие от реакции полимеризации, в результате которых образуется полимер, имеющий состав, аналогичный мономеру, в результате реакций поликонденсации состав образованного полимера отличается от его мономера:

Реакции разложения
Это процесс расщепления сложного органического соединения на менее сложные или простые вещества:

Классификация химических реакций по механизмам
Протекание реакций с разрывом ковалентных связей в органических соединениях возможно по двум механизмам (т.е. пути, приводящему к разрыву старой связи и образованию новой) – гетеролитическому (ионному) и гомолитическому (радикальному).
Гетеролитический (ионный) механизм

В реакциях, протекающих по гетеролитическому механизму образуются промежуточные частицы ионного типа с заряженным атомом углерода. Частицы, несущие положительный заряд называются карбкатионы, отрицательный – карбанионы. При этом происходит не разрыв общей электронной пары, а ее переход к одному из атомов, с образованием иона:
Склонность к гетеролитическому разрыву проявляют сильно полярные, например Н–O, С–О и легко поляризуемые, например С–Вr, С–I связи.
Реакции, протекающие по гетеролитическому механизму делят на нуклеофильные и электрофильные реакции. Реагент, располагающий электронной парой для образования связи называют нуклеофильным или электронодонорным. Например, HO — ,RO — , Cl — , RCOO — , CN — , R — , NH2, H2O, NH3, C2H5OH, алкены, арены.
Реагент, имеющий незаполненную электронную оболочку и способные присоединить пару электронов в процессе образования новой связи.называют электрофильным реагентам относятся следующие катионы: Н + , R3C + , AlCl3, ZnCl2, SO3, BF3, R-Cl, R2C=O
Реакции нуклеофильного замещения

Характерны для алкил- и арилгалогенидов:

Реакции нуклеофильного присоединения
Реакции электрофильного замещения


Реакции электрофильного присоединения
Гомолитический (радикальный механизм)
В реакциях, протекающих по гомолитическому (радикальному) механизму на первой стадии происходит разрыв ковалентной связи с образованием радикалов. Далее образовавшийся свободный радикал выступает в качестве атакующего реагента. Разрыв связи по радикальному механизму свойственен для неполярных или малополярных ковалентных связей (С–С, N–N, С–Н).
Различают реакции радикального замещения и радикального присоединения
Реакции радикального замещения

Характерны для алканов
Реакции радикального присоединения

Характерны для алкенов и алкинов
Таким образом, мы рассмотрели основные типы химических реакций в органической химии
Общая формула: СnН2n+1На1.
1.2.1. Способы получения
Существует много разнообразных методов введения галогена в молекулу соединения. Рассмотрим наиболее общие.
1. Галогенирование алканов. Взаимодействие алканов с галогенами протекает по свободнорадикальному механизму SR при УФ-облучении.

Недостатком этого способа является образование смеси моно-, ди- и полигалогеналканов.
2. Присоединение галогеноводородов к алкенам. Реакция идет обычно на холоду, способ особенно удобен для получения моногалогенопроизволных, так как реакция не сопровождается образованием побочных продуктов полигалогенопроизводных.

Механизм реакции АЕ – электрофильное присоединение.
3. Взаимодействие спиртов с галогенирующими реагентами. Часто галогенопроизводные получают замещением гидроксильной группы спиртов на галоген. Для этого используют галогеноволороды (НС1, НВг, HI), галогениды фосфора (РС13, РС15, РВг3, РВг5), тионилхлорид (SOCl2).
Взаимодействие спиртов с галогеноводородами протекает по схеме:

Легче всего замещается на галоген гидроксильная группа у третичного атома углерода. Проводить реакцию с первичными спиртами необходимо в присутствии катализаторов: минеральных кислот, галогенидов цинка и т. д.
С более высокими выходами галогеналканы образуются при взаимодействии спиртов с галогенидами фосфора (III) ити фосфора (V), а также тионилхлоридом:

4. Взаимодействие галогеналканов с солями галогеноводородных кислот (реакция Финкельштейна). Реакцию используют для получения фтор- или йодалканов из более доступных хлор- или бромпроизводных:

1.2.2. Физические свойства
Низшие галогеналканы – газы или жидкости со своеобразным сладковатым запахом, средние – жидкости, высшие – твердые вещества. Большинство из них практически нерастворимы в воде, но легко растворяются в органических растворителях.
1.2.3. Химические свойства
Галогеналканы обладают высокой реакционной способностью и для них характерны реакции нуклеофильного замещения (SN), элиминирования (отщепления) (Е). Они также вступают в реакции восстановления и взаимодействуют с некоторыми металлами.
1.2.3.1. Реакции нуклеофильного замещения
Способность галогеналканов вступать в реакции SN обусловлено полярностью связи углерод-галоген. Атом галогена, имея большую электроотрицательность, чем атом углерода, смешает на себя электронную плотность связи С-Hal. В результате атом галогена приобретает частичный отрицательный заряд ( δ –), а атом углерода – частичный положительный заряд ( δ +). Галогеналканы вступают в реакции с нуклеофильными реагентами, и при этом происходит замещение галогена на нуклеофил.

В зависимости от строения галогеналкана, природы нуклеофила и растворителя реакции SN протекают по двум основным направлениям: SN1 и SN2 .
Механизм SN2 (бимолекулярное нуклеофильное замещение) По механизму SN2 реагируют первичные и несколько труднее вторичные галогеналканы. Реакция протекает в одну стадию через образование переходного состояния. Вначале нуклеофил атакует атом углерода, связанный с галогеном (электрофильный центр), со стороны, противоположной связи С-Hal , т. е. атака идет с тыла. В результате происходит постепенное вытеснение нуклеофилом галогенид-иона (уходящей группы). Этот процесс включает переходное состояние, т. е. момент, когда связь С-Hal еще не разорвалась, а связь C-Nu еще не полностью образовалась.

Образование переходного состояния сопровождается изменением гибридного состояния атома углерода с sp3 на sp2. Одна доля негибридизованной р-атомной орбитали атома углерода в переходном состоянии частично перекрывается с орбиталью атакующего нуклеофила, а вторая – с орбиталью атома галогена.
Возвращение атома углерода в sр3-гибридное состояние после отщепления галогенид-иона происходит c обращением конфигурации.

Протеканию реакции по механизму SN2 способствуют активные нуклеофильные реагенты – они легче образуют переходное состояние – и апротонные растворители, поскольку протонные полярные растворители сольватируют нуклеофил, тем самым снижая его реакционную способность.
По предложению английского химика К. Ингольда описанный механизм получил обозначение SN2. Буква S указывает на замещение, N – на нуклеофильный тип реакции, а цифра 2 обозначает, что реакция является бимолекулярной, т. е. в стадии, определяющей скорость реакции в целом (в данном случае образование переходного состояния), участвует два реагента (галогеналкан и нуклеофил). Скорость реакции, протекающих по механизму SN2. зависит от концентрации обоих реагентов.
Механизм SN1 (мономолекулярное нуклеофильное замещение)
По этому механизму происходит нуклеофильное замещение в третичных и, в определенных условиях, во вторичных галогеналканах. В молекуле третичных галогеналканов объемные заместители при атоме углерода, связанном с галогеном, создают пространственные препятствия для подхода нуклеофила к электрофильному центру, и его атака с тыла становится невозможной. Вместе с тем третичные галогеналканы способны в сильнополярных средах к ионизации. По механизму SN1 реакция протекает в две стадии:

На первой стадии происходит диссоциация молекулы галогеналкана при участии молекул протонного полярного растворителя. В результате образуются карбкатион и галогенид-ион. Поскольку процесс ионизации протекает медленно, то 1 стадия определяет скорость всей реакции. На второй стадии образовавшийся карбкатион быстро реагирует с нуклеофилом.
Протеканию реакции по механизму SN1 способствуют высокая ионизирующая и сольватируюшая способность растворителя, а также стабильность образующегося карбкатиона. Устойчивость алкильных карбкатионов обусловлена делокализацией положительного заряда за счет +I-эффекта алкильных групп и возрастает в ряду:

Поэтому третичные галогенопроизводные легче всего подвергаются ионизации.
Механизм нуклеофильного замещения, протекающий по рассмотренной схеме, называется мономолекулярным, т. к. на стадии, определяющей скорость всего процесса (стадия 1), принимает участие молекула только одного реагента – галогеналкана. Такой механизм обозначают SN1.
Таким образом, на основании вышеизложенного можно сделать вывод, что первичные галогеналканы обычно реагируют по механизму SN2, третичные – по механизму SN1. Вторичные галогеналканы, в зависимости от природы нуклеофила и растворителя, могут реагировать как по механизму SN2, так и по механизму SN1.
1. Гидролиз галогеналканов. Галогеналканы гидролизуются до спиртов. Реакцию обычно проводят в присутствии водных растворов щелочей, т. к. с водой она протекает медленно.

2. Реакция Вильямсона. Эта реакция является одним из лучших способов получения простых эфиров. Она заключается во взаимодействии галогеналканов с алкоголятами или фенолятами.

3. Взаимодействие с солями карбоновых кислот (ацетолиз). При действии солей карбоновых кислот на галогеналканы образуются сложные эфиры. Реакцию проводят в среде апротонного полярного растворителя.

4. Взаимодействие с аммиаком, алкил- и ариламинами (аммонолиз и аминолиз). При взаимодействии с аммиаком и аминами галогеналка-ны алкилируют их с образованием смеси первичных, вторичных и третичных аминов, а также солей – четвертичных аммониевых оснований. Например, первичный амин образуется по схеме:

5. Взаимодействие с солями циановодородной кислоты. Первичные и вторичные галогеналканы с цианидом калия или натрия в среде апротонного полярного растворителя образуют нитрилы (SN2):

6. Взаимодействие с солями азотистой кислоты. Продукты, образующиеся в результате этой реакции, зависят от условий ее проведения. строения галогеналкана и соли.

1.2.3.2. Реакции элиминирования
Реакции элиминирования сопровождаются отщеплением галогеноводорода от галогеналкана и приводят к образованию алкенов.

Поскольку отщепление водорода происходит от β -атома углерода, то такие реакции называются β - или 1,2-элиминированием.
Реакции элиминирования (Е) и нуклеофильного замещения (SN) конкурируют друг с другом, но в определенных условиях каждая из них может стать доминирующей. Отщепление галогеноводорода от галогеналкана становится основным процессом в присутствии нуклеофильных реагентов, обладающих высокой основностью. К ним относятся спиртовые растворы гидроксидов щелочных металлов или алкоголяты щелочных металлов. Элиминированию способствуют также повышение температуры реакционной смеси и концентрации реагентов. Так, при взаимодействии йодэтана с водным раствором щелочи основным направлением реакции является нуклеофильное замещение, а продуктом реакции – этиловый спирт. При использовании спиртового раствора щелочи доминирующим процессом становится реакция элиминирования, продуктом реакции – этилен.

Реакции элиминирования галогеналканов могут протекать по мономолекулярному ( Е1 ) и бимолекулярному ( Е2 ) механизмам.
Механизм Е2 (бимолекулярное элиминирование).
В реакции отщепления по механизму Е2 наиболее легко вступают первичные галогеналканы.

Реакция отщепления, протекающая по бимолекулярному механизму, требует присутствия основания, идет в одну стадию с образованием переходного состояния, в формировании которого принимают участие молекулы двух реагентов. И поэтому скорость такой реакции зависит от концентрации обоих реагентов. Процессы разрыва и образования связей в переходном состоянии происходят синхронно.
В отличие от механизма SN2 в механизме Е2 частица с неподеленной парой электронов или несущая отрицательный заряд действует не как нуклеофил. а как основание, атакуя атом водорода при β -углеродном атоме.
Механизм Е1 (мономолекулярное элиминирование).
Наиболее легко происходит элиминирование по данному механизму у третичных галогеналканов. Реакция не требует основания как реагента, но для ее протекания необходим ионизирующий растворитель. Процесс является двустадийным.

Стадией, определяющей скорость реакции, является образование карбкатиона. Вторая стадия включает в себя стабилизацию карбкатиона путем отщепления протона.
Если в молекуле галогеналкана имеется несколько альтернативных путей отщепления галогеноводорода, то реализуется тот из них, при котором двойная связь образуется у наиболее замещенного атома углерода, то есть вместе с галогеном уходит водород от наименее гидрогенизированного соседнего атома углерода.
Эта закономерность получила название правила Зайцева:

1.2.3.3. Восстановление галогеналканов
При каталитическом гидрировании галогеналканов или действии на них водорода в момент выделения, а также иодоводородной кислотой происходит замещение атома галогена водородом:
Читайте также:

