Применение ацетилена кратко 10 класс
Обновлено: 05.07.2024
Как вы уже знаете, ацетилен — продукт неполного разложения метана. Этот процесс называют пиролизом (от греч. пир — огонь, лизис — разложение). Теоретически ацетилен можно представить как продукт дегидрирования этилена:

На практике ацетилен, кроме пиролизного способа, очень часто получают из карбида кальция:
Особенность строения молекулы ацетилена (рис. 21) состоит в том, что между атомами углерода имеется тройная связь, т. е. он является еще более непредельным соединением, чем этилен, молекула которого содержит двойную углерод-углеродную связь.

Рис. 21.
Модели молекулы ацетилена: 1 — шаростержневая; 2 — масштабная
Ацетилен является родоначальником гомологического ряда алкинов, или ацетиленовых углеводородов.
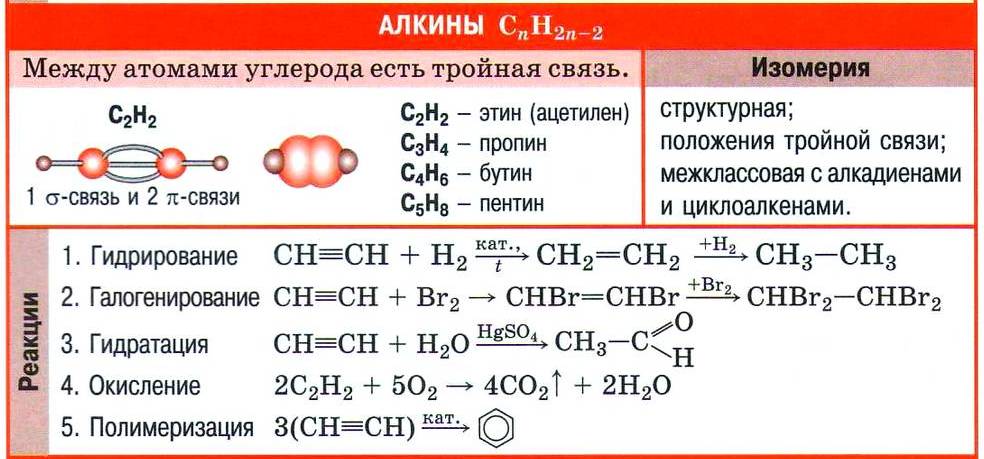
| Алкины — это непредельные углеводороды, молекулы которых содержат, помимо одинарных связей, одну тройную углерод-углеродную связь. Состав их отражает общая формула CnH2n-2 |
Ацетилен — это бесцветный газ без запаха, малорастворимый в воде.
Рассмотрим химические свойства ацетилена, которые лежат в основе его применения.
Ацетилен на воздухе горит коптящим пламенем из-за высокого содержания углерода в его молекуле, поэтому для сжигания ацетилена используют кислород:


Температура ацетиленокислородного пламени достигает 3200 °С. Таким пламенем можно резать и сваривать металлы (рис. 22).

Рис. 22.
Ацетиленокислородное пламя используют для резки и сварки металла
Как и все непредельные соединения, ацетилен активно вступает в реакции присоединения. 1) галогенов (галогенирование), 2) водорода (гидрирование), 3) галогеноводородов (гидрогалогенирование), 4) воды (гидратация).
Рассмотрим, например, реакцию гидрохлорирования — присоединения хлороводорода:

Почему продукт гидрохлорирования ацетилена называют хлорэтеном, вам понятно. А почему — винилхлоридом? Потому что одновалентный радикал этилена СН2=СН— называют винилом. Винилхлорид — это исходное соединение для получения полимера — поливинилхлорида, который находит широкое применение (рис. 23). В настоящее время винилхлорид получают не гидрохлорированием ацетилена, а другими способами.

Рис. 23.
Применение поливинилхлорида:
1 — искусственная кожа; 2 — изолента; 3 — изоляция проводов; 4 — трубы; 5 — линолеум; 6 — клеенка
Поливинилхлорид получают с помощью уже знакомой вам реакции полимеризации. Полимеризация винилхло-рида в поливинилхлорид может быть описана с помощью следующей схемы:

или уравнения реакции:

Реакция гидратации, протекающая в присутствии солей ртути, содержащих катион Hg 2+ , в качестве катализатора, носит имя выдающегося русского химика-органика М. Г. Кучерова и раньше широко использовалась для получения очень важного органического соединения — уксусного альдегида:

Реакцию присоединения брома — бромирование — используют как качественную реакцию на кратную (двойную или тройную) связь. При пропускании ацетилена (или этилена, или большинства других непредельных органических соединений) через бромную воду можно наблюдать ее обесцвечивание. При этом происходят следующие химические превращения:


Еще одной качественной реакцией на ацетилен и непредельные органические соединения является обесцвечивание раствора перманганата калия.
Ацетилен — важнейший продукт химической промышленности, который имеет широкое применение (рис. 24).

Рис. 24.
Применение ацетилена:
1 — резка и сварка металлов; 2—4 — производство органических соединений (растворителей 2, поливинилхлорида 3, клея 4)

Ацетиленовые углеводороды (алкины)
Ключевые слова конспекта: Ацетиленовые углеводороды (алкины). Межклассовая изомерия. Карбидный и метановый способы получения ацетилена. Винилхлорид. Поливинилхлорид. Реакция Кучерова.
Гомологический ряд алкинов
Как правило, любое научное открытие не только имеет теоретическую ценность, но и находит практическое применение. В химической науке есть немало примеров того, как практическое использование свойств вновь открытых веществ приводило к созданию новых материалов или технологий.
температура пламени достигала 3100 °С, что в 2 раза выше температуры плавления железа! Это свойство кислородно-ацетиленового пламени используют и сейчас при газовой резке и сварке металлов.
В XX в. было установлено строение молекулы ацетилена. Как оказалось, в ней два атома углерода связаны тройной углерод-углеродной связью:
H—C≡C—H

Ацетилен — первый представитель гомологического ряда ацетиленовых углеводородов.
Номенклатура и изомерия алкинов
Принадлежность углеводорода к алкинам обозначают суффиксом -ин, который указывает на тройную углерод-углеродную связь в молекуле. За основу названия алкина берут корень названия соответствующего алкана. Так, ацетилен в соответствии с номенклатурой ИЮПАК называют этином.

Формулы некоторых алкинов и их названия приведены в таблице.
Для алкинов, как и для алкенов, характерна изомерия положения кратной (тройной) связи. Например, изомерны бутин-1 и бутин-2.
Кроме этого, следует учесть, что гомологический ряд алкинов имеет такую же общую формулу, как и ещё один гомологический ряд уже знакомых вам углеводородов (алкадиенов): CnH2n–2. Такой вид структурной изомерии называют межклассовой изомерией.
Способы получения ацетилена
Рассмотрим способы получения важнейшего представителя класса алкинов — ацетилена.

Карбидный способ основан на взаимодействии карбида кальция с водой:

В промышленности карбид кальция получают сплавлением оксида кальция (негашёной извести) с коксом (углеродом):

Оксид кальция получают обжигом известняка по реакции:

В промышленном масштабе ацетилен получают метановым методом — пропусканием газообразного метана в специальных реакторах через зону с высокой (1500 °С) температурой:
Химические свойства алкинов
Тройную связь в молекулах алкинов обнаруживают с помощью двух качественных реакций — обесцвечивания бромной воды и раствора перманганата калия.

Непредельный характер алкинов обусловливает и наиболее характерные реакции веществ этого класса — реакции присоединения, которые протекают в две стадии. Например, реакция бромирования ацетилена:

Реакцию присоединения галогеноводородов к алкинам мы рассмотрим на примере важной в практическом отношении реакции хлороводорода с ацетиленом:
Хлорэтен называют также винилхлоридом, потому что одновалентный радикал этилена СН2=СН— носит название винил. Хлорэтен — исходное вещество для получения ценного полимера поливинилхлорида. Уравнение реакции полимеризации хлорэтена выглядит так:


Как и этилен, ацетилен вступает в реакцию гидратации, т. е. присоединяет воду. Однако отличие тройной углерод-углеродной связи от двойной отражается на строении продукта реакции гидратации. Схематично присоединение воды к ацетилену можно изобразить так:

или
Реакция гидратации ацетилена названа в честь русского учёного-химика Михаила Григорьевича Кучерова, предложившего для проведения этого процесса использовать в качестве катализатора соли ртути(II). Продукт реакции Кучерова — органическое вещество уксусный альдегид. До середины XX в. реакция Кучерова лежала в основе промышленного получения уксусного альдегида, но в настоящее время её не используют из-за токсичности солей ртути. Получение уксусного альдегида по реакции Кучерова было вытеснено так называемым Вакер-процессом — получением ацетальдегида прямым окислением этилена в присутствии катализатора — хлорида палладия(II).
Ацетилен применяют в органическом синтезе. Он является одним из исходных веществ в производстве синтетических каучуков, поливинилхлорида и других полимеров. Из ацетилена получают органические растворители. Ацетилен до сих пор используют для газовой сварки и резки металлов.
Ацетилен (этин) – газ без цвета и запаха, обладает слабым наркотическим действием (строение молекулы показано на рис. 1).
Мало растворим в воде и очень хорошо в ацетоне. В виде ацетонового раствора его хранят в стальных баллонах, заполненных каким-нибудь инертным пористым материалом. Смеси ацетилена с воздухом взрывоопасны.

Рис. 1. Строение молекулы ацетилена.
Таблица 1. Физические свойства ацетилена.
Молярная масса, г/моль
Температура плавления, o С
Температура кипения, o С
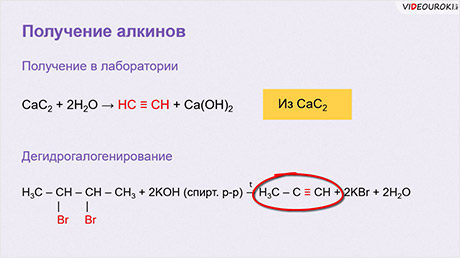
Получение ацетилена
Выделяют промышленные и лабораторные способы получения ацетилена. Так, в промышленности ацетилен получают путем высокотемпературного крекинга метана:
В лаборатории ацетилен получают гидролизом карбида кальция:
Кроме вышеперечисленных реакций, для получения ацетилена используют реакции дегидрирования алканов и алкенов:
Химические свойства ацетилена
Ацетилен вступает в реакции присоединения, протекающие по нуклеофильному механизму, такие как:
Кроме этого ацетилен способен образовывать соли при взаимодействии с активными металлами (1) и оксидом серебра (2):
2СH≡CH +2Na→2 СH≡C-Na + H2 (1);
Он способен тримеризоваться:
Применение ацетилена
Ацетилен является исходным продуктом для многих важнейших химических производств. Например, из ацетилена получают различные галогенпроизводные, такие как тетрахлорэтан и трихлорэтилен, являющиеся хорошими растворителями, а также винилхлорид, служащий мономером для получения поливинилхлорида. Кроме этого ацетилен используется для получения синтетических каучуков.
Примеры решения задач
| Задание | Эквимолекулярная смесь ацетилена и формальдегида полностью реагирует с 69,6 г Ag2O, растворенного в аммиаке. Определите состав исходной смеси. |
| Решение | Запишем уравнения реакций, указанных в условии задачи: |
Рассчитаем количество вещества оксида серебра (I):
n(Ag2O) = 69,6 / 232 = 0,3 моль.
По уравнению (2) количество вещества формальдегида будет равно 0,1 моль. По условию задачи смесь эквимолекулярна, следовательно, ацетилена тоже будет 0,1 моль.
Найдем массы веществ, составляющих смесь:
M(HC≡CH) = 26 г/моль;
M(H-C(O)H) = 30 г/моль;
m(HC≡CH) = 0,1 × 26 = 2,6 г;
m(H-C(O)H) = 0,1 × 30 = 3 г.
| Задание | При пропускании смеси пропана и ацетилена через склянку с бромной водой масса склянки увеличилась на 1,3 г. При полном сгорании такого же количества исходной смеси углеводородов выделилось 14 л (н.у.) оксида углерода (IV). Определите массовую долю пропана в исходной смеси. |
| Решение | При пропускании смеси пропана и ацетилена через склянку с бромной водой происходит поглощение ацетилена. Запишем уравнение химической реакции, соответствующее этому процессу: |
Таким образом, значение, на которое увеличилась масса склянки (1,3 г) представляет собой массу ацетилена. Найдем количество вещества ацетилена (молярная масса – 26 г/моль):
Запишем уравнение реакции сгоранияацетилена:
Согласно уравнению реакции, в неё вступило 2 моль ацетилена, однако, известно, что 0,05 моль из этого количества поглотилось бромной водой. Т.е. выделилось:
Найдем общее количество оксида углерода (IV):
Запишем уравнение реакции сгорания пропана:
Учитывая, что в реакции сгорания ацетилена выделилось 0,1 моль оксида углерода (IV), количество вещества оксида углерода (IV), выделившееся в ходе сгорания пропана равно:
0,625 — 0,1 = 0,525 моль СО2.
Найдем количество вещества пропана, вступившего в реакцию горения. Согласно уравнению реакции n(CO2) : n(С3Н8) = 3 : 1, т.е.
Свидетельство и скидка на обучение каждому участнику
Зарегистрироваться 15–17 марта 2022 г.

Описание презентации по отдельным слайдам:



Строение молекулы ацетилена

Строение молекулы ацетилена Образование двух π -связей Образование трех σ связей, одна связь C–C и две связи C–H H–C≡C–H

Строение молекулы ацетилена Запомните! 1. Длина связи 0,12 нм 2. Угол 180 3. Линейная молекула 4. Связи – σ и 2π 5. Sp- гибридизация

Физические свойства С2Н2 ацетилен – бесцветный газ, легче воздуха, с резким запахом, мало растворим в воде.

Изомерия. Номенклатура. 1. Составить все возможные изомеры гексина. 2. Построить следующие структурные формулы алкинов: а) 3метил пентин-1, б) 4,4диметил пентин-2, в) 2,5диэтилгексин-3



Химические свойства. Полимеризация При пропускании ацетилена над активированным углем при 450–500 °С происходит тримеризация ацетилена с образованием бензола (Н.Д.Зелинский, 1927 г.)

Поучение ацетилена Ацетилен химически активен, поэтому в природе не встречается. Его получают: из метана, т.е. основного компонента природного газа: 2СН4 → С2Н2+ 3H2

Поучение ацетилена Ацетилен в лаборатории получают карбидным способом. В карбид кальция наливают дистиллированную воду и опускают газоотводную трубку в перманганат калия. Раствор обесцвечивается. CaC2+2H2O → Ca(OH)2 + C2H2↑

ПРИМЕНЕНИЕ АЦЕТИЛЕНА Ацетилен используют для сварки и резки металлов. Температура пламени ацетиленовой горелки более 3000 , что позволяет разрезать и сваривать металлы.

ПРИМЕНЕНИЕ АЦЕТИЛЕНА 1. Из ацетилена поучают полихлорвинил из которого изготавливают новогодние искусственные елочки, искусственные кожи , клеенки, линолиум. 2. Ацетилен дешевое химическое сырье, из которого получают пластмассы, каучуки, резину, химические волокна. 3. Переработав ацетилен можно получить этиловый спирт, уксусную кислоту, растворители, ароматические углеводороды.

Обобщение и закрепление знаний: Закончите следующие фразы: 1 Алкины - это… 2 Общая формула алкинов… 3 Простейший алкин… 4 Связь в молекуле ацетилена между углеродными атомами… 5 Физические свойства ацетилена… 6 Характерные химические реакции алкинов… 7 Ацетилен применяется для…

Обобщение и закрепление знаний: Осуществить превращения: Метан → Ацетилен → Этилен → Этан → Хлорэтан

Данный видеоурок посвящён изучению физических и химических свойств алкинов, способам получения и применению отдельных представителей класса.
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Алкины: свойства, получение и применение"
Ацетилен при обычных условиях – газ, не имеет запаха. Он плохо растворим в воде и в органических растворителях, за исключением ацетона. При увеличении относительной молекулярной массы алкинов идёт увеличение температуры кипения.
Для алкинов характерны реакции присоединения. Это реакции электрофильного присоединения. Они присоединяют галогены. Присоединение идёт в две стадии: сначала разрывается одна π-связь, затем на второй стадии – другая. Так, ацетилен обесцвечивает раствор брома в тетрахлорметане. На первой стадии присоединения образуется 1,2-дибромэтен, на второй – 1,1,2,2-тетрабромэтан.
Присоединение водорода – реакция гидрирования идёт при нагревании и в присутствии катализатора. При присоединении водорода к бутину-1, на первой стадии образуется бутен-1, на второй – бутан.
Присоединение воды к ацетилену идёт в кислой среде и в присутствии катализатора – соли ртути. Эта реакция называется ещё реакцией Кучерова.
В результате реакции гидратации ацетилена образуется неустойчивый виниловый спирт, который затем переходит в уксусный альдегид.
В случае алкинов с более длинной цепью в соответствии с правилом Марковникова будет происходить образование енола с гидроксигруппой при менее гидрированном атоме углерода (водород присоединяется к крайнему атому углеродной цепи). Такие енолы превращаются в кетоны:
Для алкинов характерны реакции присоединения галогеноводородов. Реакция присоединения галогеноводорода, протекающая по электрофильному механизму, также идёт в две стадии, причём на обеих стадиях выполняется правило Марковникова.
Так, в реакции бутина-1 с хлороводородом образуется 2,2-дихлорбутан.
При пропускании ацетилена над активированным углём при 500 происходит образование бензола. Впервые подобную реакцию в 1866 году осуществил М. Бертло. При нагревании ацетилена до 600 °С ему удалось получить небольшое количество бензола. Спустя 60 лет русский химик Н. Д. Зелинский обнаружил, что катализатором данной реакции является углерод (активированный уголь). Даже при более низкой температуре в присутствии активированного угля скорость реакции значительно возрастала, а выход бензола увеличивался до 90%. С тех пор эта реакция носит имя Зелинского.
Помимо тримеризации ацетилена, возможна его димеризация. Под действием солей меди (I) образуется винилацетилен.
При полном окислении – горении ацетилена образуется углекислый газ и вода.
На этой реакции основано действие кислород-ацетиленовой горелки, пламя которой имеет очень высокую температуру (более 3000 °С), что позволяет использовать её для резки и сварки металлов.
На воздухе ацетилен горит коптящим пламенем, так как содержание углерода в его молекуле выше, чем в молекулах этана и этена.
Алкины, как и алкены, обесцвечивают подкисленный раствор перманганата калия. При этом происходит разрушение кратной связи.
В промышленности ацетилен раньше получали нагреванием метана. В 1868 году французский химик М. Бертло получил ацетилен, пропуская через метан электрический разряд:
В настоящее время ацетилен получают окислительным пиролизом:
Особенность этого метода состоит в том, что в реактор вводится расчётное количество кислорода. Помимо ацетилена в качестве продуктов реакции образуется оксид углерода (II) и водород, которые могут быть использованы для синтеза спиртов или синтетического бензина.
В лаборатории ацетилен получают обработкой карбида кальция с водой.
Сам карбид кальция получают сплавлением оксида кальция и угля в электропечах. А оксид кальция образуется при обжиге (термическом разложении) карбоната кальция.
CaO + 3C CaC2 + CO
Дегидрогалогенирование. При воздействии на дибромпроизводное, в котором атомы галогенов находятся при соседних атомах углерода (или при одном и том же атоме), спиртового раствора щёлочи происходит отщепление двух молекул галогеноводорода (дегидрогалогенирование) и образование тройной связи:
Ацетилен с кислородом используют для сварки и резки металлов. В настоящее время ацетилен мало используют для получения различных органических веществ. В 40-50-х годах прошлого столетия его заменили на более дешёвый – этилен.
Алкины являются сырьём для производства большого количества органических соединений и материалов: альдегидов, кетонов, растворителей (тетрагалогенэтанов), исходных веществ для получения синтетических каучуков, поливинилхлорида и других полимеров. Ацетилен — ценнейшее горючее с очень высокой теплотой горения.
Читайте также:

