Обмен простых белков биохимия кратко
Обновлено: 05.07.2024
1. КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ КАФЕДРА ФУНДАМЕНТАЛЬНОЙ И КЛИНИЧЕСКОЙ БИОХИМИИ
2. Катаболизм аминокислот
ОБЩИЕ ПУТИ
КАТАБОЛИЗМА
СО2
R
ИНДИВИДУАЛЬНЫЕ
ПУТИ
КАТАБОЛИЗМА
СН COOH
NH2
потеря
аминогруппы
- NH3
карбоновые
кислоты
декарбоксилирование
биогенные
амины
нии
м
а
дез вание
ро
- NH2
п ер
еа
ров миниани
е
-кетокислоты
3. Метионин
4. Обмен метионина
5. S-аденозилметионин (SAМ)
6. Трансметилирование – реакции переноса метильной группы от донора к акцептору
А-СН3 + В
донор
метильной
группы
акцептор
метильной
группы
ферменты – трансметилазы,
кофермент – ТГФК (витамин В9)
А + В-СН3
7. Использование СН3-радикалов
синтез
СН3
- адреналина
- креатина
- холина
- пиримидинов
- пуринов
обезвреживание
- эндогенных шлаков
- ксенобиотиков
- биологически активных веществ
8. Синтез креатина
NH2
NH2
С=NH
NH
+
(СН2) 3
СН
С=NH
NH2
NH2
COOH
СН2
COOH
глицинамидинотрансфераза
глицин
(СН2) 3
СН2
СН
COOH
COOH
SAМ
Креатин поступает в мышцы,
перефосфорилируется с АТФ
и в виде креатин-фосфата
является резервной формой
энергии в мышцах
+
NH
гуанидинацетат
аргинин
NH2
орнитин
метилтрансфераза
SAГ
NH2
С=NH
N
CH3
СН2
COOH
креатин
NH2
9. Синтез адреналина
О2
СН2
OH
OH
OH
Н 2О
СО2
OH
тирозингидроксилаза
СН2
СН NH2
СН NH2
COOH
COOH
тирозин
ДОФА-декарбоксилаза
ДОФА
Н2О
дофамингидроксилаза
СН2
СН2 NH2
дофамин
OH
OH
О2
OH
SАМ
OH
СН OH
SАГ
метилтрансфераза
СН2 NH2
норадреналин
OH
СН
OH
СН2
NH
адреналин
CH3
10. Синтез холина
СН2 OH
СО2
СН2 OH
СН NH2 декарбоксилаза
СН2 NH2
COOH
серин
SAМ
SAГ
метилтрансфераза
этаноламин
Холин входит в состав:
1. фосфатидилхолина – компонента
клеточных мембран
2. ацетилхолина – нейромедиатора
СН2 OH
СН2 N
холин
+
CH3
CH3
CH3
11. Синтез тимина
12. Инактивация гистамина
13. Обезвреживание никотинамида
14. Обезвреживание ксенобиотиков
15. Тетрагидрофолиевая кислота (ТГФК - Н4-фолат)
16. Одноуглеродные радикалы
17. Доноры одноуглеродных групп
18. Антивитамины фолиевой кислоты
H2N
COOH
H2 N
п-аминобензойная
кислота
SO2 NH R
общая формула
сульфаниламидов
где R:
Н
- стрептоцид
СОСН3 - сульфацил-натрий
(альбуцид)
N
H2N
N
H3C
CH3 - сульфадимезин
19. Обмен ароматических аминокислот
20. Синтез тирозина
21. Нарушения обмена фенилаланина
22. Скрининг-тест – это исследование, которое:
24. Йодтиронины
OH
I
OH
I
I
O
I
O
I
I
I
СН2
СН2
СН NH2
СН NH2
COOH
COOH
тироксин
(тетрайодтиронин)
трийодтиронин
Йодтиронины –
гормоны щитовидной
железы, участвующие
в общем обмене,
регулирующие
нервную
деятельность, рост и
дифференцировку
тканей, синтез белков,
энергетический обмен
и др.
25. Синтез меланина
СН2
О2
Н2О
OH
OH
тирозингидроксилаза
СН2
СН NH2
СН NH2
COOH
COOH
тирозин
дофахром
.
OH
ДОФА
Меланин – пигмент, входящий в
состав волос, кожи, радужной
оболочки глаза. Защищает организм
от УФО.
O
O
N
H
меланин
n
26. Распад тирозина
27. Нарушения обмена ароматических аминокислот
фенилаланин
гидроксилаза
ФЕНИЛКЕТОНУРИЯ
тирозин
пероксидаза
КРЕТИНИЗМ
тироксин
гидроксилаза
п-оксифенилпируват
ДОФА
ДОФА
декарбоксилаза
диоксигеназа
ПАРКИНСОНИЗМ
гомогентезиновая
кислота
дофахром
дофамин
оксидаза
АЛКАПТОНУРИЯ
ацетоацетат
фумарат
АЛЬБИНИЗМ
меланины
катехоламины
28. Алкаптонурия
29. Альбинизм
30. Конечные продукты обмена белков
31. Основные источники аммиака
32. Обезвреживание аммиака в месте образования
1. Восстановительное аминирование α-кетоглутарата
COOH
COOH
НАДН + Н+
CH2
+ NH3
CH2
С
O
COOH
α-кетоглутарат
НАД+
глутаматдегидрогеназа
CH2
CH2
СН NH2
COOH
глутамат
33. Обезвреживание аммиака в месте образования
2. Амидирование аминокислот (синтез амидов)
NH3 (или ГЛН)
COOH
СН2
СН NH2
АТФ
АДФ + Рi
глутаминаспарагинсинтетаза
синтетаза
СН NH2
COOH
аспартат
СН2
СН2
NH2
СН2
COOH
COOH
CO
аспарагин
NH3
CO NH2
АТФ
глутаминсинтетаза
АДФ + Рi
СН2
СН2
СН NH2
СН NH2
COOH
COOH
глутамат
глутамин
34. 3. Амидирование карбоксильных групп белков
Обезвреживание аммиака в
месте образования
3. Амидирование карбоксильных
групп белков
H3C
CO
СН
NH
СН2
NH3
H3C
CH3
АТФ
АДФ +Рi
CO
СН
NH
СН2
СН2
СН2
COOH
CO NH2
CH3
35. 4. Синтез карбамоилфосфата
Обезвреживание аммиака в
месте
образования
4. Синтез
карбамоилфосфат
а
2 АТФ
NH3 + СО 2 + Н2О
2 АДФ + Pi
карбамоилфосфатсинтетаза II
2+
Мg
NH2
С O
O ~ PO3H2
карбамоилфосфат
36. Транспортные формы аммиака
37. Роль глутамина
38. Синтез аммонийных солей (аммониегенез)
39. Биологическая роль аммониегенеза
1.
Обезвреживание и выведение
токсического аммиака
2.
Поддержание кислотноосновного состояния (КОС) за
счёт выведения избыточных
протонов
3.
Сохранение ионов натрия
42. Особенности цикла мочевинообразования
1.
На синтез одной молекулы
мочевины затрачивается 3
молекулы АТФ (но 4 макроэргических связи)
2.
В молекуле мочевины один атом
азота из молекулы аммиака, а
второй из аспартата
43. Биологическая роль орнитинового цикла
1.
Конечное
обезвреживание
токсического аммиака
2.
Синтез аргинина и
пополнение его фонда в
организме
44. Связь цикла мочевинообразования и ЦТК
1.
Оба цикла протекают в одном и
том же месте – в митохондриях
печени
2.
АТФ и СО2, образованные в ЦТК,
расходуется в орнитиновом цикле
3.
Фумарат из цикла
мочевинообразования поступает в
ЦТК
46. Нарушения синтеза мочевины
ГИПЕРАММОНИЕМИЯ
I типа
NH3 + СО2 + 2 АТФ
H2 N
карбамоилфосфатсинтетаза
карбамоил+ 2 АДФ + 2 Рi
фосфат
карбамоилтрансфераза
С NH2
O
ГИПЕРАММОНИЕМИЯ
II типа
орнитин-
орнитин
Н2О
аргиназа
аргинин
цитруллин
аспартат
АТФ
фумарат
аргининсукцинатсинтетаза
аргининсукцинатлиаза
АРГИНИНЯНТАРНАЯ
АМИНОАЦИДУРИЯ
аргинин-янтарная
кислота
ЦИТРУЛЛИНЕМИЯ
47. Нарушение синтеза и выведения мочевины
48. Соотношение азотсодержащих веществ в моче (%) при нормальном белковом питании
49. КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ КАФЕДРА ФУНДАМЕНТАЛЬНОЙ И КЛИНИЧЕСКОЙ БИОХИМИИ
50. Строение мононуклеотида
51. Пуриновые основания нуклеиновых кислот
52. Пиримидиновые основания нуклеиновых кислот
53. Углеводы нуклеотидов (пентозы)
54. Гидролиз нуклеопротеинов
ротовая
полость
ДНП и РНП пищи
белки
НСl, пепсин
желудок
(протамины, гистоны)
ДНК, РНК
(полинуклеотиды)
РНК-азы, ДНК-азы
ДПК
(эндонуклеазы)
аминокислоты
Н2О
олигонуклеотиды
фосфодиэстеразы
(экзонуклеазы)
Н2О
мононуклеотиды
тонкий
кишечник
ткани
нуклеотидазы
(фосфатазы)
Н2О
Н3РО4
нуклеозиды
нуклеозидазы
пурины,
пиримидины
(азотистые основания)
рибоза,
дезоксирибоза
(пентозы)
пентозофосфатный
путь
55. Катаболизм пуриновых оснований
NH2
Н2О
N
NH3
В
норме
гипоксантин
содерж
1/2 О
ание
мочево
1/2 О
й
ксантин
мочевая кислота
кислот
N
N
аденаза
N
OH
N
N
N
H
аденин
N
H
2
OH
OH
Н2О
N
H2N
NH3
N
N
гуанин
ксантиносидаза
N
H
OH
N
N
N
N
2
гуаназа
HO
N
N
H
ксантин- HO
осидаза
N
N
H
OH
56. Нарушения обмена пуринов
57. Ингибитор ксантиноксидазы
58. Распад пиримидиновых оснований
59. Особенности синтеза нуклеотидов
1.
2.
3.
4.
Синтез идёт из обычных простых
предшественников (ак, углекислого
газа и т.п.)
Синтезируются не отдельные
азотистые основания, а сразу
нуклеотиды
Синтезируются общие
предшественники (для пуриновых
нуклеотидов инозинмонофосфат –
ИМФ, для пиримидиновых –
уридинмонофосфат – УМФ)
Синтез протекает ферментативно, с
большой затратой энергии
61. Происхождение атомов пуринового кольца
62. Синтез пуриновых нуклеотидов
64. Синтез пиримидиновых нуклеотидов
65. Синтез дезоксирибонуклеотидов
66. Ингибиторы синтеза нуклеиновых кислот
67. Нарушения обмена нуклеотидов
Нарушение синтеза пиримидинов –
оротацидурия – дефект ОМФдекарбоксилазы (недостаток синтеза
пиримидиновых нуклеотидов, снижение
синтеза нуклеиновых кислот)
Нарушения обмена пуринов:
– ксантинурия – дефект
ксантиноксидазы (увеличение
содержания ксантина в моче, протекает
практически бессимптомно)
– подагра.
68. Первичная структура нуклеиновых кислот
69. Вторичная структура ДНК
71. Вторичная структура т-РНК
72. Строение нуклеосомы
73. Клеточный цикл
74. Строение мононуклеотида
Матрица – цепь ДНК
Растущая цепь НК
3'
Принцип
биосинтеза
НК
5'
х
3'
х
х
Поступающийоннуклеотид
Направление роста цепи
5'
→3'
5'
76. Биосинтез ДНК (репликация) является:
матричным (матрица – обе нити ДНК)
комплиментарным
фрагментарным (нити ДНК
синтезируются в виде фрагментов,
которые затем соединяются между
собой)
полуконсервативным (в каждой из
образовавшихся молекул ДНК одна
нить исходная – материнская, а одна
– вновь синтезированная – дочерняя)
77. Полуконсервативность биосинтеза ДНК
РЕПЛИКАТИВНАЯ СИСТЕМА
1. МАТРИЦА – ОБЕ НИТИ ДНК НА ВСЕМ ПРОТЯЖЕНИИ
2. СТРОИТЕЛЬНЫЙ МАТЕРИАЛ:
ДЛЯ СИНТЕЗА ПРАЙМЕРА – АТФ, ГТФ, ЦТФ, УТФ
ДЛЯ СИНТЕЗА ДНК – дАТФ, дГТФ, дЦТФ и дТТФ
3. ФЕРМЕНТАТИВНЫЕ БЕЛКИ
ТОПОИЗОМЕРАЗА (ГИРАЗА)
ХЕЛИКАЗА
ДНК - ПОЛИМЕРАЗЫ
α - праймаза
β - фермент репарации
γ - митохондриальный фермент
δ - строит ведущую цепь
ε - строит отстающую цепь
ДНК –ЛИГАЗА - сшивает фрагменты Оказаки
4. ДНК-СВЯЗЫВАЮЩИЕ БЕЛКИ (SSB-белки)
5. РЕГУЛЯТОРНЫЕ БЕЛКИ: факторы инициации,
элонгации, терминации
79. Особенности репликации
80. Этапы репликации
82. Инициация репликации
83. Инициация репликации
84. Этапы репликации
2. Элонгация
ДНК-полимераза
δ продолжает
удлинять нить из
дезоксирибонуклеотидов на
лидирующей нити, а ДНКполимераза ε – фрагменты
(фрагменты Оказаки) на
отстающей нити ДНК по мере
движения репликативной вилки
85. Элонгация репликации
Этапы репликации
Терминация
ДНК-полимераза
β (фермент
репарации) удаляет праймеры и
достраивает фрагменты ДНК
ДНК-лигаза соединяет фрагменты
между собой
88. Репарация ДНК
89. Для биосинтеза РНК (транскрипции) необходимы:
•МАТРИЦА – участок одной из нитей ДНК
– (транскриптон)
•СТРОИТЕЛЬНЫЙ МАТЕРИАЛ:
– АТФ, ГТФ, ЦТФ, УТФ
•ФЕРМЕНТАТИВНЫЕ БЕЛКИ
ДНК-зависимые РНК-полимеразы
I — для синтеза р-РНК
II — для синтеза м-РНК
III — для синтеза т-РНК
•РЕГУЛЯТОРНЫЕ БЕЛКИ: факторы инициации,
элонгации, терминации
90. Биосинтез РНК
91. Биосинтез РНК
РНК-полимераза
Транскрибируемая нить
ДНК
Нетранскрибируемая нить
мононуклеотиды
пре-РНК (первичный транскрипт)
Сайт терминации
92. Процессинг РНК (1. сплайсинг)
94. Состав зрелой м-РНК
5'-конец
"колпачок" (кэп)
5'-нетранслируемый
участок
инициирующий кодон
кодирующая часть
терминирующий кодон
3'-нетранслируемый
участок
3'-конец
поли(А)-фрагмент
Обмен белков занимает особое место в многообразных превращениях веществ, характерных для всех живых организмов. Выполняя ряд уникальных функций, свойственных живой материи, белки определяют не только микро- и макроструктуру отдельных субклеточных образований, специфику организации клеток, органов и целостного организма (пластическая функция), но и в значительной степени динамическое состояние между организмом и окружающей его средой. Белковый обмен строго специфичен, направлен и настроен, обеспечивая непрерывность воспроизводства и обновления белков организма. В течение всей жизнедеятельности в организме постоянно и с высокой скоростью совершаются два противоположных процесса: распад, расщепление органических макромолекул и надмолекулярных структур и синтез этих соединений. Эти процессы обеспечивают катаболические реакции и создание сложной структурной организации живого из хаоса веществ окружающей среды, причем ведущую роль в последнем случае играют именно белки. Все остальные виды обмена подчинены этой глобальной задаче живого – самовоспроизведению себе подобных путем программированного синтеза специфических белков. Для осуществления этого используются энергия обмена углеводов и липидов, строительный материал в виде углеродных остатков аминокислот, промежуточных продуктов метаболизма углеводов и др.
Белки способны также выполнять энергетическую функцию, особенно при избыточном их поступлении с пищей или в экстремальных ситуациях, когда белки тела подвергаются усиленному распаду, восполняя недостаток питательных веществ, например при голодании или патологии (сахарный диабет). Как известно, при сгорании 1 г белков освобождается энергия, равная 16,8 кДж. Эта энергия обычно может быть полностью заменена энергией окисления углеводов и липидов, однако при длительном исключении последних из пищи у животных не наблюдается существенных патологических отклонений, тогда как исключение белков из пищи даже на короткий срок приводит к выраженным нарушениям, а иногда и к необратимым патологическим явлениям. Если животные находятся на малобелковой диете, то у них очень быстро развивается белковая недостаточность – патологическое состояние, характеризующееся нарушением ряда важных физиологических функций организма. Аналогичные изменения наблюдаются у людей при недостаточном потреблении белка. Следовательно, белки являются незаменимыми для организма веществами, выполняющими прежде всего пластическую функцию. Специфическая роль белков, однако, этим не ограничивается. В опытах на крысах было показано, что белковая недостаточность у животных проявляется не столько в уменьшении массы органов и тканей, сколько в снижении активности ферментов, обусловленном замедлением процессов биосинтеза белка.
Таким образом, помимо пластической роли, белки выполняют уникальную каталитическую функцию, хотя, как было отмечено, некоторые РНК также наделены энзиматической активностью. Следует указать также, что белки (соответственно и продукты их гидролиза аминокислоты) принимают непосредственное участие в биосинтезе ряда гормонов и других биологически активных соединений, регулирующих процессы обмена веществ в организме. Следовательно, именно белковый обмен координирует, регулирует и интегрирует многообразие химических превращений в целостном живом организме, подчиняя его задачам сохранения вида и обеспечивая тем самым непрерывность жизни.
Характерной особенностью белкового обмена является его чрезвычайная разветвленность. Достаточно указать, что в обмене 20 аминокислот, входящих в состав белковых молекул, в организме животных участвуют сотни промежуточных метаболитов, тесно связанных с обменом углеводов и липидов. Число ферментов, катализирующих химические реакции азотистого обмена, также исчисляется сотнями. Следует добавить, что блокирование одного какого-либо специфического пути обмена даже одной аминокислоты, обычно наблюдаемое при врожденных пороках обмена, может привести к образованию совершенно неизвестных продуктов обмена, так как возникают условия для неспецифических превращений всех предшествующих компонентов в данной цепи реакций. Отсюда становятся понятными трудности интерпретации данных о регуляции процессов азотистого обмена в норме и особенно при патологии. Этими обстоятельствами можно объяснить исключительную перспективность изучения обмена белков с целью выяснения особенностей их катаболизма и синтеза, овладение тонкими молекулярными механизмами которых, несомненно, даст в руки исследователя ключ к пониманию развития и течения патологических процессов и соответственно к целенаправленному воздействию на многие процессы жизни.
Основная масса азота в потребляемой пище приходится на долю белков. Результаты многочисленных анализов разных компонентов в продуктах питания на содержание в них азота показывают, что без какой-либо значительной ошибки основное количество этого важнейшего элемента вводится в организм в составе белка. При обмене белков, содержащийся в них азот выделяется из организма в виде азотистых веществ, главными из которых являются мочевина и аммиак.
Для оценки общего состояния обмена белков большое значение приобретает определение азотистого баланса, т.е. разницы между количеством азота, введенного в организм с продуктами питания, и количеством азота, выведенного из организма в виде конечных азот-содержащих продуктов обмена. Азотистый баланс может быть положительным, равным нулю и отрицательным .
Если азота выводится меньше, чем его было введено, т.е. имеет место накопление данного элемента в организме, то в этом случае обмен белков характеризуется положительным азотистым балансом . В норме положительный азотистый баланс присущ растущему организму или отмечается у женщин во время беременности. Состояние положительного азотистого баланса можно представить в виде схемы, приведенной на рис. 2.1.
Схема, иллюстрирующая состояние основных метаболических путей, характерных для положительного азотистого баланса в организме млекопитающих и человека (Textbook of Biochemistry with clinical correlations, Devlin T.M., (ed.), WILEY-LISS, 1993).
Азотистый баланс может быть равен нулю, если азота выводится из организма столько же, сколько его поступило с пищей. В данном случае принято говорить об азотистом равновесии. Взрослый человек находится в состоянии азотистого равновесия, если он получает достаточное количество белка в продуктах питания. При некотором увеличении количества белка в пище соответственно увеличивается и количество экскретируемого азота. При небольшом уменьшении количества вводимого белка уменьшается и количество выведенного азота, но в обоих случаях баланс азота равен нулю.
Если азота выводится из организма больше, чем его было введено, то имеет место отрицательный азотистый баланс . Это означает, что в организме происходит процесс распада белков клеток, тканей и органов, который не компенсируется белками пищи (рис. 2.2). Отрицательный азотистый баланс наблюдается при различных заболеваниях, связанных с усиленным распадом тканевых белков (метаболический стресс), при нехватке в продуктах питания незаменимых аминокислот, а также при белковом голодании.
Схема, иллюстрирующая состояние основных метаболических путей, характерных для отрицательного азотистого баланса в организме млекопитающих и человека (Textbook of Biochemistry with clinical correlations, Devlin T.M., (ed.), WILEY-LISS, 1993).
Совершенно естественно возникает вопрос о пределах возможного увеличения или уменьшения количества белка в пище. Если кормить подопытных животных таким образом, чтобы полностью покрыть энергетические потребности организма углеводами и жирами, но исключить из рациона белки, то азотистый баланс неизбежно становится отрицательным. Это происходит по той причине, что организм продолжает выделять с мочой азотистые вещества, являющиеся продуктами обмена белков. Поскольку животные не получают белка извне, выделение азотистых веществ указывает на то, что в организме происходит распад белка собственных органов и тканей. Необходимость распада собственных белков при белковом голодании связана с функциональной деятельностью различных органов, а именно: продукцией белок-содержащих секретов эндокринных и экзокринных желез (синтез пептидных гормонов, пищеварительных ферментов), отмиранием и удалением некоторых тканей и образований (рост волос, ногтей, слущивание эпидермиса), разрушением и новообразованием клеток крови, слизистой кишечника и т.д. Естественно, что азотистый баланс при таком рационе все время остается отрицательным, и если эксперимент длится достаточно долго, то это неизбежно приводит к гибели животных.
В связи со сказанным выше должен возникать закономерный вопрос. Какое же количество белка должно присутствовать в продуктах питания, чтобы обеспечить сохранение здоровья и нормальную жизнедеятельность организма человека?
Возможность достижения азотистого равновесия у человека при потреблении 30-45 г белка в сутки послужила обоснованием для рекомендаций, высказываемых некоторыми учеными о допустимости пользования низкими нормами белка в питании. Однако, неполноценная диета может казаться безвредной лишь в определенные промежутки времени. Часто неполноценность той или иной диеты сказывается лишь на потомстве. Поэтому речь должна идти не о голодной норме белка в питании человека, а об оптимальном его содержании в рационе.
Рекомендованное количество белка в диете, обоснованное российскими врачами-диетологами составляет около 100 г/сутки в умеренном климате и не менее 120 г/сутки в жарком климате. Указанные нормы белка рекомендованы людям, занимающимся в первую очередь умственным трудом или полностью механизированным физическим трудом.
Одним из проявлений неправильного, несбалансированного по белку и энергетическим потребностям питания является истощение или, как его еще называют, маразм. Истощение вызывается хроническим недостатком калорий в пище у детей. Это заболевание развивается у грудных детей после перехода от кормления их грудным молоком на искусственную пищу, приготовленную из злаковых и других растений, и содержащую, как правило, мало калорий и неполноценный растительный белок. Для состояния маразма характерна задержка роста, резко выраженная атрофия мышечной системы, общая слабость и анемия. Недостаточное поступление пищевых белков в раннем детстве, даже если оно впоследствии компенсируется нормальной диетой, приводит в любом случае к отставанию в физическом и умственном развитии. Данные проявления недоедания особенно характерны для развивающихся стран, где чаще всего от этого страдают дети и подростки. Смертность детей из-за неполноценного питания в странах с нехваткой продовольствия очень велика – более половины детей не доживает до 5-летнего возраста. Маразм – это одно из проявлений большого числа заболеваний, главной причиной которых следует считать не столько общий недостаток продуктов питания, сколько их несбалансированность по полноценному белку.
Наиболее выраженным следствием нехватки белка в продуктах питания у детей, страдающих квашиоркором, является сильно сниженная способность организма противостоять инфекциям. Эти дети имеют резко сниженное количество Т-лимфоцитов, а также страдают от дефектов, связанных с генерацией фагоцитов и продукцией иммуноглобулинов, интерферона и других компонентов иммунной системы.
Говоря о необходимости поддерживать достаточное количество белков в рационе, не следует, однако, забывать и о том, что избыточное содержание белка в продуктах питания имеет свои отрицательные стороны.
Например, в США большинство населения употребляет белок в количествах гораздо бóльших, чем это необходимо для поддержания азотистого баланса. Средний американец потребляет 99 г белка, 68% которого приходится на долю продуктов животного происхождения. Многочисленные исследования показывают, что здоровый взрослый человек может употреблять такое количество белка без особого вреда для здоровья. Однако, исследования, проведенные в последнее время, показали, что высокое содержание белка в рационе может служить причиной нарушения обмена кальция ( Ca +2 ) в организме. В некоторых работах приводятся данные, свидетельствующие о том, что повышенное содержание белка в пище вызывает увеличение потерь кальция, который выводится почками, что, в свою очередь, сильно ускоряет процесс деминерализации костей с возрастом.
С другой стороны, более серьезные клинические проблемы могут возникать при одновременно высоком содержании в пище, как белка, так и высоко калорийных компонентов. Наиболее часто встречающимся заболеванием, вызванным неправильным избыточным питанием является ожирение. Биохимические механизмы предрасположенности к ожирению все еще не до конца ясны, но большинство исследователей придерживается мнения, что такие нарушения метаболизма являются результатом расстройства термопродукции. Обычно избыточное употребление высококалорийной пищи приводит к тому, что часть калорий превращается в тепло, а не запасается в виде жира. Этот процесс называется индуцированным диетой термогенезом. Существует предположение, что употребление высококалорийной пищи способствует гиперпродукции инсулина, который при участии симпатической нервной системы стимулирует метаболические процессы, обеспечивающие рассеивание энергии в виде тепла. У грызунов – крыс и мышей – за регуляцию теплопродукции отвечает специализированная адипозная ткань, называемая бурым жиром . У человека эта адипозная ткань дает незначительный вклад в теплопродукцию, а основным местом термогенеза является скелетная мускулатура. При склонности к ожирению, у отдельных людей наблюдается не теплопродукция, а эффективное превращение калорий в жир. Хотя, как упоминалось выше, биохимические механизмы теплопродукции в тканях-мишенях и их регуляция до сих пор не до конца выяснены – все же имеется предположение, что речь может идти о нарушении функционирования холостых циклов.
Весьма важно, что распад тканевых белков при отсутствии или ограничении белка в продуктах питания можно снизить, если в рацион ввести некоторое количество полноценного белка или, так называемых незаменимых аминокислот. (Shultz T.D., Craig W.J., Johnson P.K., Sancher A., Register U.D., Vegetarianism and Health, (Weininger J. and Briggs G.M. eds.) Nutrition Update, v. 2, New York: Wiley, 1985, p. 129; Shultz T.D., Craig W.J., Johnson P.K., Sancher A., Register U.D., First International Congress on Vegetarian Nutrition. Proc. Am. J. Clin. Nutr. 48 (Suppl.1), 1988, p. 707.) Незаменимые аминокислоты при этом способствуют вовлечению в ресинтез белка заменимых аминокислот, сберегая тем самым часть тканевых белков. Хорошо известно, что в ряде случаев врачи-диетологи вынуждены предлагать пациентам различные виды диеты, содержащие очень небольшое количество белка. Одним из таких патологических состояний является хроническая почечная недостаточность, которая характеризуется накоплением в организме конечных продуктов катаболизма белков, главным образом, мочевины. В этом случае необходимо ограничение белка в диете, поскольку образующиеся конечные токсические продукты в первую очередь ответственны за клиническое проявление почечной недостаточности . Очень легко поддерживать пациентов в состоянии азотистого равновесия в течение длительного времени, если их диета включает минимальное количество белка, равное 40 г/день. Однако диеты, содержащие более низкие количества белка, ставят ряд проблем. Проблема заключается в тонком балансировании между количеством белка, достаточном для того, чтобы избежать отрицательного азотистого баланса, но настолько малом, чтобы предотвратить накопление продуктов распада. (Goodship T.H.J., Mitch W.E. Nutritional approaches to preserving renal function. Adv. Intern. Med . , 1988, 33 , 377). Основными параметрами такой диеты являются необходимые количества полноценного белка и достаточное количество углеводов и жиров для восполнения ежедневных энергетических потребностей. Существенным моментом является присутствие незаменимых аминокислот для поддержания положительного азотистого баланса, с другой стороны организм должен быть в состоянии синтезировать заменимые аминокислоты из других азот-содержащих метаболитов и, наконец, диета должна включать углеводы и жиры, которые бы позволили сберегать белки пищи от энергетического метаболизма в ущерб пластическому обмену. При тщательном подходе к составлению подобных диет удается снизить количество белка в продуктах питания до 20 г/сутки.
Для удовлетворения потребностей организма в протеине существенным является не только количество, но и качество белков в составе пищи. Различные белки, как известно, отличаются процентным содержанием отдельных аминокислот. Поэтому в зависимости от аминокислотного состава, для покрытия потребности в белке требуется одного белка больше, а другого меньше. В этом смысле большое значение приобретает определение биологической ценности белков . Биологическая ценность белка определяется также степенью его усвоения организмом.
Биологическая ценность того или иного белка тем выше, чем ближе его аминокислотный состав к составу белков данного организма. В тесной связи с вопросом о биологической ценности белка находится представление о так называемых жизненно необходимых или незаменимых аминокислотах . В экспериментах на лабораторных животных потребность в белках обеспечивалась добавлением смесей чистых аминокислот, из которых исключалась та или иная аминокислота. На основании оценки состояния животного делали выводы о значении исследуемых аминокислот для роста и развития животных. Было показано, что для нормального роста крыс необходимо 10 незаменимых аминокислот. Дальнейшие эксперименты в этом же направлении свидетельствовали, что наличие незаменимых аминокислот имеет также непосредственное отношение к поддержанию азотистого баланса. Отсутствие в пище любой из незаменимых аминокислот приводит к отрицательному азотистому балансу. Следует, однако, иметь в виду, что механический перенос результатов экспериментов с одного вида животных на другие недопустим. Например, аминокислота глицин не является незаменимой для крыс, но незаменима для цыплят. Различные результаты были получены также на собаках и крысах.
Изучение азотистого обмена у взрослых здоровых людей, которым пищевой белок в рационе заменяли равноценным количеством смеси свободных аминокислот, позволило сделать вывод о том, что человеку для сохранения азотистого равновесия , поддержания массы тела , трудоспособности и удовлетворительного самочувствия необходимо присутствие в пище девяти аминокислот: триптофана, фенилаланина, лизина, гистидина, треонина, метионина, лейцина, изолейцина и валина. Суточная потребность в незаменимых аминокислотах варьирует от 0,5 г (для триптофана) до 2,0 г (для лейцина, фенилаланина и метионина) (см. табл. 2.1).
Новорожденным и растущим детям необходима еще одна, десятая, аминокислота – аргинин. У взрослых людей аргинин образуется в достаточных количествах в печени при функционировании цикла мочевинообразования (или, как его еще называют, орнитинового цикла), однако у детей для одновременного синтеза мочевины и синтеза, необходимых организму белков, вследствие еще недостаточно четкого функционирования цикла мочевинообразования аргинина не хватает.
Важный критерий пищевой ценности белков – доступность аминокислот. Аминокислоты большинства животных белков полностью высвобождаются в процессе пищеварения. Исключение составляют белки опорных тканей (коллаген и эластин). Белки растительного происхождения перевариваются в организме плотоядных плохо, т.к. содержат много волокон и иногда ингибиторы протеаз (соя, горох). У жвачных растительные белки перевариваются под действием ферментов микрофлоры рубца. Существенный критерий ценности пищевого белка – аминокислотный состав. Чем больше содержится незаменимых аминокислот, тем полезнее данный белок для организма.
Переваривание и всасывание белков
В ротовой полости не происходит.
В желудке главные клетки слизистой оболочки секретируют пепсиноген – предшественник протеолитического фермента пепсина . В результате аутокатализа в кислой среде желудочного сока фермент активируется. Соляная кислота поддерживает рН в пределах 1,5-2,0. Это оптимальные условия для активной работы фермента. В кислой среде белки корма подвергаются денатурации, что делает их более доступными ферментативному протеолизу. Пепсин быстро гидролизует в белках пептидные связи, образованые ароматическими аминокислотами и медленно связи между лейцином и дикарбоновыми аминокислотами.
Всасывание аминокислот происходит в тонком отделе кишечника. Это активный процесс и требует затраты энергии. Основной механизм транспорта – гамма-глутамильный цикл. В нем участвует 6 ферментов и трипептид глутатион (глутамилцистеинилглицин). Ключевой фермент – гамма-глутамилтрансфераза . Кроме того, процесс всасывания АК требует присутствия ионов Na + . Аминокислоты попадают в портальный кровоток – в печень и в общий кровоток. Печень и почки поглощают аминокислоты интенсивно, мозг избирательно поглощает метионин, гистидин, глицин, аргинин, глутамин, тирозин.
Переваривание белков у жвачных
Под действием ферментов микрофлоры рубца белки гидролизуются до АК, которые могут использоваться двумя путями:
1) идти на синтез белков микрофлоры рубца;
2) подвергаться процессу брожения;
Вновь образовавшаяся микрофлора поступает в сычуг и далее подвергается действию ферментов как и у моногастричных животных. Сбраживание АК завершается образованием летучих жирных кислот (ЛЖК: молочной, масляной, уксусной, пропионовой) и аммиака. Данные продукты в свою очередь идут:
1) на синтез белков микрофлоры рубца;
2) поступают в кровь и идут на энергетические нужды.
Пути использования АК в организме
1) синтез собственных белков организма (см. главу "Матричный биосинтез);
2) при дефиците энергии участие в ЦТК (рис. 4.9.1.);
3) участие в образовании биологически активных веществ (БАВ).
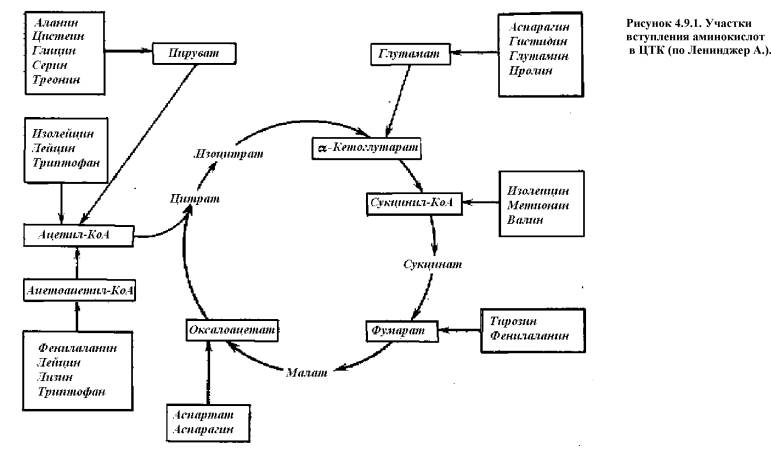
Ряд аминокислот в клетках подвергается химической модификации:
1) окислительное дезаминировние или отщепление аминогруппы катализируется ферментами класса аминооксидаз. Они очень специфичны и малоактивны. Единственный высокоактивный фермент работает в печени и мозге – это глутаматдегидрогеназа (ГДГ). Он катализирует превращение глутаминовой кислоты в альфа-кетоглутаровую ;
2) переаминироване. Происходит обмен аминогруппы на кетогруппу между амино- и кетокислотой. Глутаминовая кислота взаимодействует с пировиноградной , при этом образуется альфа-кетоглутаровая кислота и аланин ;
3) декарбоксилирование или отщепление карбоксильной группы с образованием СО2 и амина. Катализируют реакцию декарбоксилазы. В тканях этим процессам подвергаются в основном гистидин, тирозин, глутаминовая кислота. Из них образуются гистамин, тирамин, гамма-аминомаслянная кислота .
Гистамин - продукт декарбоксилирования гистидина. Накапливается в тучных клетках. В слизистой желудка активирует синтез пепсина и соляной кислоты. Является одним из медиаторов воспаления.
Серотонин образуется из триптофана преимущественно в нейронах гипоталамуса и стволе мозга. Является медиатором этих нейронов. Разрушается под действием моноаминоксидазы обычно в печени.
Дофамин – производное тирозина. Он является медиатором проведения нервного импульса, а также предшественником меланина, норадреналина и адреналина .
Процессы гниения в тонком отделе кишечника происходят также под действием декарбоксилаз.
Биосинтез аминокислот
Если незаменимые АК должны в обязательном порядке поступать в организм с пищей, то заменимые АК могут в случае их дефицита синтезироваться одна из другой. Полностью заменимыми являются 8 аминокислот: Ала, Аск, Асп, Глк, Глн, Сер, Глн и Про. Исходными соединениями для их биосинтеза являются компоненты гликолитической цепи и ЦТК. Добавление аминогруппы чаще осуществляется при участии глутаматдегидрогеназы. Аланин из пирувата, аспарагин – из фумарата, глутамин из - альфа-кетоглутарата, из него также пролин, орнитин и аргинин, серин и глицин - из 3-фосфоглицерата. Аспартат может также образовываться из оксалоацетата с использованием в качестве донора аминогруппы от глутамата (Ф: АсАт). Аланин при участии фермента АлАт из пирувата (аминогруппа также от глутамата). Ряд других АК могут синтезироваться в организме, но по более сложным механизмам.
Биосинтез сложных белков
Пуриновые и пиримидиновые нуклеотиды. Пуриновый скелет образуется в ходе нескольких реакций из аспартата, формила, глутамина, глицина и СО2. Пиримидиновый скелет из глутамина, аспарагиновой кислоты и СО2.
Катаболизм пуриновых нуклеотидов завершается образованием мочевой кислоты . Катаболизм пиримидиновых нуклеотидов – аланином и аминомасляной кислотой.
Синтез гемоглобина включает в себя образование глобина и гема. Глобин синтезируется как и все белки.
Предшественники гема – сукцинил КоА и глицин. Из них образуется аминолевулиновая кислота (Е: аминолевулитат-синтетаза). Две молекулы аминолевулиновой кислоты конденсируются с образованием порфобилиногена ( Е: порфобилиногенсинтетаза ). Четыре молекулы порфобилиногена конденсируются в тетрапиррольное соединение которое модифицируется в протопорфирин . Заключительный этап – присоединение железа (Е: феррохелатаза ).
Разрушение гемоглобина происходит в такой последовательности:
1) раскрытие пиррольного кольца с образованием вердоглобина;
2) удаление железа после чего получается биливердоглобин;
3) отщепление глобина с образованием биливердина;
4) восстановление метиновой группы с получением билирубина.
Билирубин с током крови доставляется в печень, где часть его этерифицируется при участии УТФ-глюкуронилтрансферазы. Этерифицированный билирубин называется прямым (связанным), а неэтерифицированный – непрямым (свободным).
Связанный билирубин выделяется с желчью в 12-перстную кишку, где после ряда превращений под действием ферментов микрофлоры он превращается в стеркобилин и выделяется с калом или в уробилин и выделяется с мочой. Повышение содержания билирубина в крови – билирубинемия.
Обезвреживание аммиака
Он образуется в основном при дезамировании аминокислот.
1) Восстановительное аминировние происходит в малом объеме и несущественно.
2) Образование амидов аспарагиновой и глутаминовой кислот (аспарагина и глутамина). Этот процесс в основном протекает в нервной ткани, где очень важно обезвреживать аммиак.
3) Образование солей аммония происходит в почечной ткани (хлорид аммония удаляется с мочой).
4) Основной путь – синтез мочевины. Происходит в цикле мочевины или орнитиновом цикле.
У большинства наземных позвоночных аммиачный азот выводится в виде мочевины, такие организмы называются уротелическими. Костные рыбы - аммониотелические организмы, они выделяют азот непосредственно в виде аммиака. Наземные рептилии и птицы вводят азот в виде мочевой кислоты - это урикотелические организмы.
Процесс образования мочевины протекает в печени и состоит из цикла реакций (Кребс и Хенселяйт, 1932). Называется цикл мочевины или орнитиновый цикл.
1) свободный аммиак и СО2 при участии 2АТФ образует макроэргическое соединение карбамоилфосфат .
2) Крабамоилфосфат отдает орнитину свою карбамильную группу, Е: орнитинтранскарбамилаза и образуется цитрулин и Н3РО4;
3) Цитрулин взаимодействует с аспарагиновой кислотой с образованием аргининсукцината , при этом АТФ переходит в АМФ. Катализирует реакцию Е: аргининсукцинатсинтаза;
4) Аргининсукцинат расщепляется на фумарат и аргинин под действием Е: аргининсукцинатлиазы ;
5) Аргинин под действием аргиназы расщепляется путем гидролиза на мочевину и орнитин . Орнитин вновь включается в цикл. Мочевина – безвредное соединение и выводится из организма с мочей.
ЛИТЕРАТУРА К ГЛАВЕ IV .9.
1. Бышевский А. Ш., Терсенов О. А. Биохимия для врача // Екатеринбург: Уральский рабочий, 1994, 384 с.;
2. Кнорре Д. Г., Мызина С. Д. Биологическая химия. – М.: Высш. шк. 1998, 479 с.;
3. Ленинджер А. Биохимия. Молекулярные основы структуры и функций клетки // М.: Мир, 1974, 956 с.;
4. Пустовалова Л.М. Практикум по биохимии // Ростов-на Дону: Феникс, 1999, 540 с.
5. Степанов В. М. Молекулярная биология. Структура и функции белков // М.: Высшая школа, 1996, 335 с.;
Читайте также:

