Гибридизация атома углерода в органических соединениях кратко
Обновлено: 02.07.2024
Гибридизация – это смешение атомных орбиталей (электронных облаков) разной формы, обладающих различной энергией; в результате образуются гибридные орбитали (облака) одинаковые по форме и энергии. Число образующихся гибридных орбиталей равно числу орбиталей, участвующих в гибридизации.
Гибридизация атомных орбиталей — гипотетический процесс смешения разных (s, p, d, f) орбиталей центрального атома многоатомной молекулы с возникновением одинаковых орбиталей, эквивалентных по своим характеристикам.
Объяснение этого факта впервые дал американский химик Лайнус Полинг.
Ввиду относительной близости значений энергии 2s- и 2р-электронов, эти электроны могут взаимодействовать между собой в ходе образования химической связи с электронами другого атома, давая четыре новых равноценных гибридных электронных облака.
Атом С в органических соединениях может находиться в трех валентных состояниях. Этим валентным состояниям соответствуют различные типы гибридизации электронных орбиталей атома углерода.
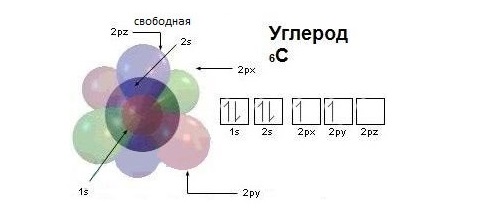
Модель атома углерода
Валентные электроны атома углерода располагаются на одной 2s-орбитали и двух 2р-орбиталях.
Электронная формула атома углерода в основном (стационарном) состоянии 1s 2 2s 2 2p 2 указывает на то, что внешние электроны углерода неодинаковы: s-электрон имеет орбиталь в виде шара, р-электроны – в виде объемных восьмерок, расположенных под углом 90 0 друг к другу.

Если бы такое различие существовало, то у четырехвалентного углерода должна была бы наблюдаться неравноценностей связей. На самом же деле все четыре связи равноценны.
Да и сама четырехвалентность углерода не согласуется с приведенной выше электронной формулой: ведь валентность равна числу неспаренных внешних электронов, которых в приведенной формуле только два.

Объясняется это противоречие следующим образом. При образовании связей атом углерода переходит в возбужденное состояние, один из двух s-электронов перемещается на свободную 2р-орбиталь, приобретая электронную конфигурацию 1s 2 2s 1 2p 3 . Атом углерода в возбужденном состоянии обладает четырьмя неспаренными электронами: одним s-электроном и тремя p-электронами.

Переход атома углерода из основного состояния в возбужденное.
Электронная конфигурация атома углерода в основном и возбужденном состоянии
Основное и возбужденное состояния атома углерода
Образовавшиеся электронные облака четырех неспаренных электронов гибридизируются — смешиваются.
В зависимости от числа вступивших в гибридизацию орбиталей атом углерода может находиться в одном их трёх состояний гибридизации: sp 3 , sp 2 , sp.
Большинство органических соединений имеют молекулярное строение. Атомы в веществах с молекулярным типом строения всегда образуют только ковалентные связи друг с другом, что наблюдается и в случае органических соединений. Напомним, что ковалентным называется такой вид связи между атомами, который реализуется за счет того, что атомы обобществляют часть своих внешних электронов с целью приобретения электронной конфигурации благородного газа.
По количеству обобществлённых электронных пар ковалентные связи в органических веществах можно разделить на одинарные, двойные и тройные. Обозначаются данные типы связей в графической формуле соответственно одной, двумя или тремя чертами:
Кратность связи приводит к уменьшении ее длины, так одинарная С-С связь имеет длину 0,154 нм, двойная С=С связь – 0,134 нм, тройная С≡С связь – 0,120 нм.
Типы связей по способу перекрывания орбиталей
Как известно, орбитали могут иметь различную форму, так, например, s-орбитали имеют сферическую, а p-гантелеобразную форму. По этой причине связи также могут отличаться по способу перекрывания электронных орбиталей:
• ϭ-связи – образуются при перекрывании орбиталей таким образом, что область их перекрывания пересекается линией, соединяющей ядра. Примеры ϭ-связей:
• π-связи – образуются при перекрывании орбиталей, в двух областях – над и под линией соединяющей ядра атомов. Примеры π-связей:
Как узнать, когда в молекуле есть π- и ϭ-связи?
При ковалентном типе связи ϭ-связь между любыми двумя атомами есть всегда, а π-связь имеет только в случае кратных (двойных, тройных) связей. При этом:
- Одинарная связь – всегда является ϭ-связью
- Двойная связь всегда состоит из одной ϭ- и одной π-связи
- Тройная связь всегда образована одной ϭ- и двумя π-связями.
Укажем данные типы связей в молекуле бутин-3-овой кислоты:
Гибридизация орбиталей атома углерода
Гибридизацией орбиталей называют процесс, при котором орбитали, изначально имеющие разные формы и энергии смешиваются, образуя взамен такое же количество гибридных орбиталей, равных по форме и энергии.
Так, например, при смешении одной s- и трех p-орбиталей образуются четыре sp 3 -гибридных орбитали:

В случае атомов углерода в гибридизации всегда принимает участие s-орбиталь, а количество p-орбиталей, которые могут принимать участие в гибридизации варьируется от одной до трех p-орбиталей.
Как определить тип гибридизации атома углерода в органической молекуле?
В зависимости от того, со скольким числом других атомов связан какой-либо атом углерода, он находится либо в состоянии sp 3 , либо в состоянии sp 2 , либо в состоянии sp-гибридизации:
| Количество атомов, с которыми связан атом углерода | Тип гибридизации атома углерода | Примеры веществ |
| 4 атома | sp 3 | CH4 – метан |
| 3 атома | sp 2 | H2C=CH2 – этилен |
| 2 атома | sp | HC≡CH — ацетилен |
Потренируемся определять тип гибридизации атомов углерода на примере следующей органической молекулы:
- Первый атом углерода связан с двумя другими атомами (1H и 1C), значит он находится в состоянии sp-гибридизации.
- Второй атом углерода связан с двумя атомами – sp-гибридизация
- Третий атом углерода связан с четырьмя другими атомами (два С и два Н) – sp 3 -гибридизация
- Четвертый атом углерода связан с тремя другими атомами (2О и 1С) – sp 2 -гибридизация.
Радикал. Функциональная группа
Под термином радикал, чаще всего подразумевают углеводородный радикал, являющийся остатком молекулы какого-либо углеводорода без одного атома водорода.
Название углеводородного радикала формируется, исходя из названия соответствующего ему углеводорода заменой суффикса –ан на суффикс –ил.
| Формула углеводорода | Название углеводорода | Формула радикала | Название радикала |
| CH4 | метан | -CH3 | метил |
| C2H6 | этан | -С2Н5 | этил |
| C3H8 | пропан | -С3Н7 | пропил |
| СnН2n+2 | …ан | -СnН2n+1 | … ил |
Функциональная группа — структурный фрагмент органической молекулы (некоторая группа атомов), который отвечает за её конкретные химические свойства.
В зависимости того, какая из функциональных групп в молекуле вещества является старшей, соединение относят к тому или иному классу.

R – обозначение углеводородного заместителя (радикала).
Радикалы могут содержать кратные связи, которые тоже можно рассматривать как функциональные группы, поскольку кратные связи вносят вклад в химические свойства вещества.
Если в молекуле органического вещества содержится две или более функциональных группы, такие соединения называют полифункциональными.
Углерод. Символ С, элемент IVA группы 2-го периода Периодической системы элементов ; атомный номер 6; атомная масса 12,01115.
Электронная конфигурация в основном состоянии 1s 2 2s 2 2p 2 .
Углерод – особый элемент. Ни один другой химический элемент не способен образовывать такое многообразие соединений. Причина этого многообразия в том, что атомы углерода способны:
1) соединяться друг с другом в цепи различного строения – открытые (неразветвленные, разветвленные), замкнутые.
2) образовывать не только простые (одинарные), но и кратные (двойные, тройные) связи:
3) образовывать прочные связи почти с любым другим элементом.
Эти уникальные свойства углерода объясняются сочетанием двух факторов:
- наличие на внешнем энергетическом уровне (2s и 2p) четырех электронов (поэтому атом углерода не склонен ни терять, ни приобретать свободные электроны с образованием ионов);
- малый размер атома (в сравнении с другими элементами IV группы).
Вследствие этого углерод образует главным образом ковалентные, а не ионные связи, и проявляет валентность, равную 4.
Гибридизация. Атом углерода в возбужденном состоянии обладает четырьмя неспаренными электронами: одним s-электроном и тремя p-электронами — 1s 2 2s 2 2p 3 .

Гибридизация электронных орбиталей – это процесс их взаимодействия, приводящий к выравниванию по форме и энергии. Гибридные орбитали отталкиваются и располагаются на максимальном расстоянии друг от друга. Объяснение этого факта впервые было дано американским химиком Л. Полингом. Ввиду относительной близости значений энергии 2s- и 2р-электронов, эти электроны могут взаимодействовать между собой в ходе образования химической связи с электронами другого атома, давая четыре новых равноценных гибридных электронных облака.
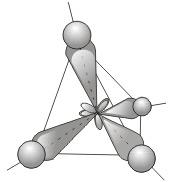
1) sp 3 – гибридизация. В процессе гибридизации принимает участие одна s и 3 p орбитали. Четыре совершенно одинаковые sp 3 -гибридные орбитали атома углерода расположены под углом 109,5° друг к другу и направлены к вершинам тетраэдра, в центре которого находится атом углерода .
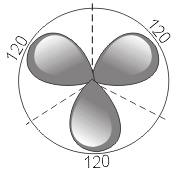
2) sp 2 – гибридизация. В этом случае при образовании соединений происходит гибридизация одной s- и двух р-орбиталей (sp 2 -гибридизация), при этом образуются три одинаковые sp 2 - гибридные орбитали, расположенные под углом 120° друг к другу
.
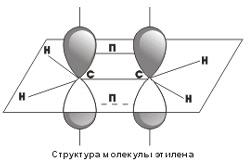
Посредством образования sp 2 -гибридных орбиталей как раз и объясняются структуры непредельных углеводородов с двойными связями. Например, для такой молекулы, как этилен,
схематично можно изобразить следующую структуру
.
Как видно, у каждого атома углерода есть σ-связи, образованные sp 2 -гибридными облаками, кроме того, между атомами углерода образуется П-связь за счет перекрывания p-орбиталей. Таким образом, двойные углерод-углеродные связи состоят из одной σ- и одной П-связи.
3) sp – гибридизация. В этом случае при образовании соединений происходит гибридизация одной s- и одной р-орбитали. Эти две различные орбитали превращаются в две одинаковые гибридные орбитали (тип гибридизации - sp), направленные под углом 180° друг к другу, т.е. эти две связи имеют противоположное направление
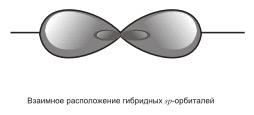
.
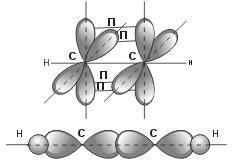
Остановимся подробнее на структуре молекулы ацетилена С2Н2. В молекуле ацетилена каждый атом углерода находится в sp-гибридном состоянии, образуя две гибридные связи, направленные под углом 180° друг к другу. Как в случае связей С-С, так и в случае связей С-Н возникает общее двухэлектронное облако, образующее σ-связи. σ-связью называют связь, возникающую при обобществлении электронных облаков двух атомов, если облака перекрываются по линии, соединяющей атомы.

Углерод. Символ С, элемент IVA группы 2-го периода Периодической системы элементов ; атомный номер 6; атомная масса 12,01115.
Электронная конфигурация в основном состоянии 1s 2 2s 2 2p 2 .
Углерод – особый элемент. Ни один другой химический элемент не способен образовывать такое многообразие соединений. Причина этого многообразия в том, что атомы углерода способны:
1) соединяться друг с другом в цепи различного строения – открытые (неразветвленные, разветвленные), замкнутые.
2) образовывать не только простые (одинарные), но и кратные (двойные, тройные) связи:
3) образовывать прочные связи почти с любым другим элементом.
Эти уникальные свойства углерода объясняются сочетанием двух факторов:
- наличие на внешнем энергетическом уровне (2s и 2p) четырех электронов (поэтому атом углерода не склонен ни терять, ни приобретать свободные электроны с образованием ионов);
- малый размер атома (в сравнении с другими элементами IV группы).
Вследствие этого углерод образует главным образом ковалентные, а не ионные связи, и проявляет валентность, равную 4.
Гибридизация. Атом углерода в возбужденном состоянии обладает четырьмя неспаренными электронами: одним s-электроном и тремя p-электронами — 1s 2 2s 2 2p 3 .

Гибридизация электронных орбиталей – это процесс их взаимодействия, приводящий к выравниванию по форме и энергии. Гибридные орбитали отталкиваются и располагаются на максимальном расстоянии друг от друга. Объяснение этого факта впервые было дано американским химиком Л. Полингом. Ввиду относительной близости значений энергии 2s- и 2р-электронов, эти электроны могут взаимодействовать между собой в ходе образования химической связи с электронами другого атома, давая четыре новых равноценных гибридных электронных облака.
1) sp 3 – гибридизация. В процессе гибридизации принимает участие одна s и 3 p орбитали. Четыре совершенно одинаковые sp 3 -гибридные орбитали атома углерода расположены под углом 109,5° друг к другу и направлены к вершинам тетраэдра, в центре которого находится атом углерода .

2) sp 2 – гибридизация. В этом случае при образовании соединений происходит гибридизация одной s- и двух р-орбиталей (sp 2 -гибридизация), при этом образуются три одинаковые sp 2 - гибридные орбитали, расположенные под углом 120° друг к другу

.
Посредством образования sp 2 -гибридных орбиталей как раз и объясняются структуры непредельных углеводородов с двойными связями. Например, для такой молекулы, как этилен,
схематично можно изобразить следующую структуру

.
Как видно, у каждого атома углерода есть σ-связи, образованные sp 2 -гибридными облаками, кроме того, между атомами углерода образуется П-связь за счет перекрывания p-орбиталей. Таким образом, двойные углерод-углеродные связи состоят из одной σ- и одной П-связи.
3) sp – гибридизация. В этом случае при образовании соединений происходит гибридизация одной s- и одной р-орбитали. Эти две различные орбитали превращаются в две одинаковые гибридные орбитали (тип гибридизации - sp), направленные под углом 180° друг к другу, т.е. эти две связи имеют противоположное направление

.
Остановимся подробнее на структуре молекулы ацетилена С2Н2. В молекуле ацетилена каждый атом углерода находится в sp-гибридном состоянии, образуя две гибридные связи, направленные под углом 180° друг к другу. Как в случае связей С-С, так и в случае связей С-Н возникает общее двухэлектронное облако, образующее σ-связи. σ-связью называют связь, возникающую при обобществлении электронных облаков двух атомов, если облака перекрываются по линии, соединяющей атомы.
Для органических соединений характерно молекулярное строение. В веществах, которые имеют молекулярное строение, атомы соединены только ковалентной связью. Реже можно наблюдать водородную связь атомов.
Ковалентная связь – это связь между двумя атомами, которая образуется путем слияния внешних электронов для общего пользования. Эти пары электронов принадлежат обоим атомам.

По степени полярности ковалентной связи выделяют:
- Ковалентная неполярная – слияние атомов с одинаковой электроотрицательностью.
- Ковалентная полярная – слияние атомов с разной электроотрицательностью.
Орбитали атомов имеют различные формы. На этом основании выделяют связи разные по перекрыванию орбиталей:
- σ-связи – поперек области перекрытия орбиталей проходит линия, соединяющая ядро.
- π-связи - перекрывание происходит в 2 областях – над и под линией.
Распознать способ перекрывания орбиталей не сложно. В связях только с одной электронной парой будет всегда σ-связь. Если пар больше, то в связи будет уже присутствовать и π-связь.

По количеству электронных пар выделяют:
- 1.одинарная, простая s—связь
- 2.двойная — 2 пары электронов
- 3. тройная, кратная —3 пары электронов
Водородная связь - связь, между положительно заряженным атомом водорода и отрицательно заряженным атомом, к таким атомам относят фтор, азот, кислород. Различают внутри- и межмолекулярные водородные связи.
Гибридизация атомных орбиталей углерода
В молекуле метана (СН4) взаимодействуют 1 s- электрон и 3 р –атома углерода. Несмотря на разные характеристики эти электроны образуют 4 равносильные ковалентные связи. Это связано с видоизменением орбиталей атома углерода.
В процессе взаимодействия атомных орбиталей отличимых по виду, но схожих по энергии возникают одинаковые гибридные орбитали. Это явление принято называть гибридизацией АО. Образуя связь с орбиталями других атомов, процесс гибридизации способствует появлению более прочных химических связей.
Новые орбитали по форме напоминают одинаковые, ассиметричные гантели и не похожи на начальные электронные облака. Энергия, которая потрачена на гибридизацию компенсируется, и равно распределяется в гибридизированных орбиталях.
Определение вида гибридизации атома углерода
От атома углерода участвует только s – орбиталь. Соответственно, вид гибридизации на прямую будет связан с кол-вом вступивших в связь р-орбиталей (от 1 до 3).
Виды и свойства гибридизации атома углерода
Орбитали атома углерода, участвующие в гибридизации
Тип гибридизации орбиталей атома углерода
Количество гибридных орбиталей и образуемых ими
s-связей
Расположение в пространстве гибридных орбиталей и валентные углы
s-связей
1 s- орбиталь и 3 р-орбитали
sр 3 – гибридизация
(характерна для алканов)
Валентный угол 109 0
1 s- орбиталь и 2 р-орбитали
sр 2 – гибридизация
(характерна для алкенов)
В одной плоскости, под углом 120 0
Негибридизированная р –орбиталь располагается перпендикулярно
sр – гибридизация
(характерна для алкинов)
Расположение по одной прямой,под углом180 0
2 негибридизированные располагаются перпендикулярно
Алгоритм определения вида гибридизации:
- Написать структурную формулу вещества.
- Определение количества валентных электронов, которые нужны для образования связи.
- Определение количества пар электронов образующие взаимосвязь:
если 1 пара— это σ-связь, относится к sp3-гибридизации;
если 2 пары — одна π-связь и одна σ-связь, относится к sp2-гибридизации;
если 3 пары — две π- и одна σ-связи, относится к sp-гибридизации.
Функциональная группа и углеводородный радикал
Органические соединения имеют в составе не только углерод и водород. Такие элементы, как кислород и азот образуют новые группы атомов – функциональные группы.
Функциональная группа – часть органической молекулы, которая отвечает за физические и химические свойства.
Заместителем в соединении может выступать и углеводородный радикал –остаток углеводорода, один атом водорода, в котором отсутствует. Обозначается буквой R. Каждому радикалу соответствует определенный углеводород (в названии меняется суффикс –ан на –ил, например метан и метил).
Читайте также:

