Двойной электрический слой кратко
Обновлено: 06.07.2024
На поверхности твердого тела при его контакте с жидкостью самопроизвольно возникает избыточный электрический заряд, который компенсируется противоионами. В результате, на границе Ж-Т возникает ДЭС. Образование ДЭС происходит самопроизвольно, вследствие стремления поверхностной энергии к минимуму и в связи с особыми свойствами границы раздела.
Возникновение на границе электрических зарядов характерно, прежде всего, для золей и суспензий, дисперсная фаза которых формируется из твердых частиц.
При погружении металла в раствор электролита, содержащего ионы этого металла, устанавливается электрохимическое равновесие. Если химический потенциал ионов металла m М больше химического потенциала этих же ионов в растворе m р , то ионы переходят из металла в раствор, и поверхность металла заряжается отрицательно. И, наоборот, при помещении медной пластинки в раствор сульфата меди с достаточно высокой концентрацией соли, металлическая поверхность заряжается положительно.
Возникновение зарядов на твердом теле приводит к тому, что на границе раздела фаз возникает электрический потенциал, обозначаемый через j .
Если j -потенциал определяется активностью ионов в растворе, то есть твердое тело играет роль электрода, то для выражения его можно воспользоваться уравнением Нернста:
где n - заряд иона, F - число Фарадея, ап и ар -активности ионов у поверхности и в растворе.
ОБРАЗОВАНИЕ ДЭС
Поверхность твердого тела приобретает ионы определенного знака. Эти ионы называют потенциалоопределяющими. К твердой поверхности из жидкой среды притягиваются ионы противоположного знака, их называют противоионами. Возникает ДЭС.
Было предложено несколько теорий образования ДЭС.
Простейшей из них является модель плоского конденсатора Гельмгольца (5.1.а), согласно которой потенциалоопределяющие ионы и противоионы находятся на молекулярном расстоянии друг от друга, взаимодействие между ними осуществляется только за счет электростатических сил, а падение потенциала между слоями происходит линейно.

Дальнейшее развитие теория ДЭС получила в работах Гуи и Чепмена на основе сопоставления электростатического взаимодействия противоионов с энергией их теплового движения. Согласно модели Гуи и Чепмена противоионы рассматриваются как точечные заряды, не имеющие собственных размеров, расположенные в диффузном слое (5.1.б), а потенциал экспотенциально снижается по мере удаления от поверхности.
Согласно теории Штерна , которую можно рассматривать как основу современного представления о структуре ДЭС (5.1.в), противоионы находятся в двух положениях: одна их часть образует адсорбционный слой (иногда его называют плотным слоем или слоем Гельмгольца).Другая часть противоионов находится в диффузном слое. В отличии от адсорбционного слоя противоионы диффузного слоя не закреплены, в результате диффузии и взаимного отталкивания они способны перемещаться в пределах диффузного слоя в глубь жидкости.
ДЭС может возникнуть на частицах, находящихся в полярной среде, и в отсутствии электролитов, вследствие ориентации диполей, а также частичной поверхностной диссоциации полярных частиц, если в жидкой среде присутствуют хотя бы следы воды.
Потенциал, возникающий на границе между адсорбционным и диффузным слоем, называется потенциалом диффузного слоя j д .
Толщина адсорбционного слоя d определяется размерами противоионов, обычно она незначительна и не превышает 1 нм. В диффузном слое противоионы движутся хаотично, их положение изменяется. По этой причине толщина диффузного слоя будет величиной приведенной l .
ТЕРМОДИНАМИЧЕСКИЕ СООТНОШЕНИЯ МЕЖДУ ПОВЕРХНОСТНЫМ НАТЯЖЕНИЕМ И ЭЛЕКТРИЧЕСКИМ ПОТЕНЦИАЛОМ ДЭС.
Образование ДЭС происходит самопроизвольно, в результате стремления
системы уменьшить энергию Гиббса поверхностного слоя.
Обозначим изменение электрической энергии через j d q ( j - электрический потенциал ДЭС, q - заряд поверхности).
Тогда, в соответствии с обобщенным уравнением первого и второго начал термодинамики (без учета химической энергии), изменение энергии Гиббса на поверхности можно записать следующим образом:
dG = - S dT + s dS + j dq (5.2)
s dS - изменение поверхностной энергии
dG = s dS + j dq (5.3)
Полный дифференциал энергии Гиббса :
dG = s dS +S d s + j dq +q d j
Вычитая это уравнение из 5.3, получим:
S d s + q d j = 0 (5.4)
Разделим 5.4 на S (площадь межфазной поверхности) и обозначим q / S через qS (плотность заряда), получим:
I уравнение Липпмана
Если знаки потенциала и заряда совпадают, то поверхностное натяжение уменьшается с увеличением потенциала, если их знаки противоположны, то с увеличением потенциала увеличивается поверхностное натяжение.
Дифференциальная емкость ДЭС, как и любого конденсатора, определяется соотношением:
Дифференцируем 5.5 по j и подставляем в него соотношение 5.6, получаем второе уравнение Липпмана:
II уравнение Липпмана
Это уравнение показывает возможность определения емкости ДЭС, если известна зависимость поверхностного натяжения от потенциала.
Если ДЭС возникает вследствие перераспределения ионов, то для описания адсорбции ионов можно воспользоваться адсорбционным уравнением Гиббса. Если на поверхности адсорбируется катионы:
Г+ - гиббсовская адсорбция потенциалоопределяющих катионов.
Поверхностная плотность заряда:
Подставляем это выражение в уравнение Липпмана:
-d s = qs d j = F n Г+ d j
сравниваем 5.8 и 5.9:
a o и ap - активности иона на поверхности и в растворе
Полученное уравнение называется уравнением электродного потенциала Нернста. Приведенный вывод указывает на связь между уравнениями Гиббса и Липпмана и показывает, что потенциалоопределяющие ионы, адсорбируясь, изменяют поверхностное натяжение.
СПЕЦИФИЧЕСКАЯ АДСОРБЦИЯ ИОНОВ
Штерн попытался учесть влияние специфической адсорбции ионов на электрический потенциал, обусловленный действием ковалентных сил дополнительно к электростатическим силам. Так как радиус действия сил такой адсорбции соизмерим с размером ионов, это дает основание учитывать ковалентные силы только для ионов, входящих в плотный слой Гельмгольца.
Плотность поверхностного заряда противоионов можно разделить на две части: плотность заряда qr, обусловленную слоем Гельмгольца и q d диффузного слоя Гуи.
Общая поверхностная плотность заряда ДЭС:
Штерн предположил, что поверхность имеет определенное число адсорбционных центров, каждый из которых взаимодействует с одним противоионом.
Константа такой квазихимической реакции равна фактору Больцмана, в котором общий адсорбционный потенциал составляет сумму адсорбционных потенциалов электростатического и специфического взаимодействия:
F n j - электростатический адсорбционный потенциал,
F - потенциал специфической адсорбции.
Такой подход позволил Штерну получить уравнение для плотности поверхностного заряда в слое Гельмгольца:
где q ¥ - предельно возможная плотность поверхностного заряда
xo - мольная доля противоионов в растворе.
При малых концентрациях электролита можно пренебречь единицей в знаменателе.
Теория Штерна позволяет рассчитать заряд в плотном и диффузном слоях.
Из теории Ш. следует, что лучше адсорбируются и ближе подходят к Пв менее гидратированные ионы.
Специфическая адсорбция зависит от сродства адсорбируемых ионов к поверхности, их способности образовывать недиссоциирующие поверхностные соединения. Большими адсорбционными потенциалами обладают многозарядные ионы (Al 3+ , Th 4+ и др.), органические ионы.
Сильно адсорбирующиеся ионы в плотном слое способны создать избыточный заряд со знаком заряда противоионов. Это явление называется перезарядкой. (рис. 5.2)

Рис. 5.2. Изменение потенциала поверхности при ее перезарядке.
При перезарядке j o и j d имеют разные знаки. Общую поверхностную плотность заряда можно представить в виде разности между величинами адсорбции потенциалоопределяющих ионов разного знака :
Пример:
1) водный р-р - поверхность AgI. При избытке в растворе Ag + (при добавлении AgNO3 ) эти ионы являются потенциалоопределяющими
В роли противоионов выступают NO3 - , часть которых, находится в плотном слое, часть - в диффузном.
Ф - ла ДЭС :[AgI]m · nAg + |(n - x)NO3 - |x NO 3 -
n-число потенциалопределяющих ионов
x-число противоионов в диффузной части
Если в систему с AgI добавить KNO3 , то потенциалопределяющими станут иодид - ионы:
[ AgI ] m · nI - |( n - x ) K + | x K +
2) В ДЭС на поверхности оксидов в растворе в качестве потенциалопределяющих ионов выступают Н + или OH - (в зависимости от среды).
В результате преобладающей адсорбции одного и этих ионов поверхность оксида приобретает соответствующий знак заряда поверхности. Например: SiO2 обладает кислотными свойствами, поэтому его поверхность заряжена отрицательно:
[SiO2]m · nOH - |(n - x)H + |x H +
FeO имеет основные свойства, его поверхность будет заряжена положительно:
[FeO]m · nH + |(n - x)OH - |x OH -
Al2O3 - в кислой среде поверхность заряжена положительно, в щелочной - отрицательно.
В дисперсионных системах ДЭС возникает на поверхности частиц.
Частицу дисперсной фазы в гетерогенно-дисперсной системе вместе с ДЭС называют мицеллой.
Строение мицеллы можно показать той же формулой, что и строение ДЭС.
Внутренняя части мицеллы - агрегат основного вещества, на поверхности агрегата - потенциалопределяющие ионы:
Агрегат + потенциалопределяющие ионы = ядро.
Ядро + противоионы = гранула.
Гранулу окружают противоионы диффузного слоя. Вся мицелла электронейтральна.
Мицеллы создают в дисперсионной системе соответствующую противоионам ионную среду - суспензионный эффект. Если противоионами являются Н + и ОН - - ионы, то среда приобретает соответственно кислый или щелочной характер. При удалении частиц, например, фильтрацией, противоионы уходят вместе с ними в количествах, эквивалентных заряду частиц. Отсюда суспензионный эффект количественно можно определить как разность между концентрационными характеристиками противоионов в суспензии (дисперсионной системе) и в фильтрате. При определении кислотно-основных свойств дисперсной фазы суспензионный эффект рассчитывается по соотношению:
рНсэ = рНс - рНф, то есть по разности значений рН суспензии и фильтрата. Суспензионный эффект возрастает с увеличением концентрации дисперсной фазы, с увеличением ее дисперсности, и уменьшается с повышением концентрации электролита (это связано со сжатием ДЭС).
Двойной электрический слой (межфазный) (ДЭС) — слой ионов, образующийся на поверхности частиц в результате адсорбции ионов из раствора, диссоциации поверхностного соединения или ориентировании полярных молекул на границе фаз. Ионы, непосредственно связанные с поверхностью называются потенциалоопределяющими. Заряд этого слоя компенсируется зарядом второго слоя ионов, называемых противоионами.
Механизм образования ДЭС
Двойной электрический слой возникает при контакте двух фаз, из которых хотя бы одна является жидкой. Стремление системы понизить поверхностную энергию приводит к тому, что частицы на поверхности раздела фаз ориентируются особым образом. Вследствие этого контактирующие фазы приобретают заряды противоположного знака, но равной величины, что приводит к образованию двойного электрического слоя. Можно выделить три механизма образования ДЭС:
- Переход ионов или электронов из одной фазы в другую (поверхностная ионизация). Примером может служить диссоциация поверхностных функциональных групп, принадлежащих одной из фаз (как правило, твердой). Для определения знака заряда поверхности используется правило Фаянса — Панета
- Преимущественная адсорбция в межфазном слое ионов одного знака.
- Ориентирование полярных молекул в поверхностном слое. По этому механизму ДЭС образуется в случае, если вещества, составляющие фазы системы не могут обмениваться зарядами. Для определения знака заряда поверхности используют правило Кёна, гласящее, что из двух соприкасающихся фаз положительно заряжается та, которая имеет большую диэлектрическую проницаемость.
Строение ДЭС


В отсутствие теплового движения частиц, строение двойного электрического слоя подобно строению плоского конденсатора. Но в отличие от идеального случая, ДЭС в реальных условиях имеет диффузное (размытое) строение. Согласно современной теории структуру ДЭС составляют два слоя:
- Слой Гельмгольца или адсорбционный слой, примыкающий непосредственно к межфазной поверхности. Этот слой имеет толщину δ, равную радиусу потенциалопределяющих ионов в несольватированном состоянии.
- Диффузный слой или слой Гуи, в котором находятся противоионы. Диффузный слой имеет толщину λ, которая зависит от свойств системы и может достигать больших значений. Толщина диффузного слоя рассчитывается по формуле:
Электрической характеристикой ДЭС является потенциал φ. Существует несколько характеристических потенциалов:
- Потенциал диффузного слоя φδ, соответствующий границе адсорбционного и диффузного слоёв. Внутри диффузного слоя потенциал можно рассчитать по уравнению Гуи-Чепмена:
- Потенциал φx=λ, меньший, чем φδ в e раз и характеризующий толщину диффузного слоя.
- Электрокинетический потенциал или дзета-потенциал. Этот потенциал соответствует плоскости скольжения и является частью потенциала диффузного слоя. Плоскость скольжения образуется в результате того, что при движении дисперсных частиц наиболее удаленная часть диффузного слоя не участвует в движении, а остается неподвижной. Поэтому появляется нескомпенсированность поверхностного заряда частицы и становятся возможными электрокинетические явления. Дзета-потенциал является одной из важнейших характеристик двойного электрического слоя.
Ссылки
- Найти и оформить в виде сносок ссылки на авторитетные источники, подтверждающие написанное.
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Двойной электрический слой" в других словарях:
двойной электрический слой — – тонкий слой, образующийся на границе двух фаз из пространственно разделенных электрических зарядов противоположного знака, что сопровождается возникновением электрической разности потенциалов. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
ДВОЙНОЙ ЭЛЕКТРИЧЕСКИЙ СЛОЙ — образован двумя близкими друг к другу слоями электрических зарядов противоположного знака, но одинаковой поверхностной плотности. Возникает на границе раздела двух фаз. Строение слоя существенно влияет на механизм и кинетику электро химических… … Большой Энциклопедический словарь
ДВОЙНОЙ ЭЛЕКТРИЧЕСКИЙ СЛОЙ — совокупность электрич. зарядов противоположных знаков, распределённых вдоль границы соприкосновения двух фаз. В образовании Д. э. с. могут принимать участие эл ны, ионы и ориентированные полярные (обладающие собств. дипольным моментом) молекулы.… … Физическая энциклопедия
Двойной электрический слой — два весьма близких друг к другу слоя электрических зарядов разного знака, но с одинаковой поверхностной плотностью, возникающие на границе раздела двух фаз. Д. э. с. в целом электронейтрален. При пересечении Д. э. с. электрический… … Большая советская энциклопедия
двойной электрический слой — Electric Double Layer (EDL) Двойной электрический слой (ДЭС) Тонкий слой, образующийся на границе двух фаз из пространственно разделенных электрических зарядов противоположного знака. Пространственное разделение зарядов всегда сопровождается … Толковый англо-русский словарь по нанотехнологии. - М.
двойной электрический слой — образован двумя близкими друг к другу слоями электрических зарядов противоположного знака, но одинаковой поверхностной плотности, поэтому электрически нейтрален. Обычно возникает на границе раздела двух фаз, например твердого электрода и жидкости … Энциклопедический словарь
двойной электрический слой — Термин двойной электрический слой Термин на английском electrical double layer Синонимы double layer Аббревиатуры ДЭС, EDL, DL Связанные термины коллоидная химия, коллоидный раствор, наночастица Определение тонкий поверхностный слой из… … Энциклопедический словарь нанотехнологий
двойной электрический слой — dvigubasis elektrinis sluoksnis statusas T sritis chemija apibrėžtis Du priešingų krūvių sluoksniai fazių sąlyčio riboje. atitikmenys: angl. double electric layer rus. двойной электрический слой … Chemijos terminų aiškinamasis žodynas
ДВОЙНОЙ ЭЛЕКТРИЧЕСКИЙ СЛОЙ — тонкий поверхностный слой из пространственно разделенных электрич. зарядов противоположного знака, образующийся на границе двух фаз. Поскольку пространств. разделение зарядов всегда сопровождается возникновением электрич. разности потенциалов, Д … Химическая энциклопедия
ДВОЙНОЙ ЭЛЕКТРИЧЕСКИЙ СЛОЙ — образован двумя близкими друг к другу слоями электрич. зарядов противоположного знака, но одинаковой поверхностной плотности, поэтому электрически нейтрален. Обычно возникает на границе раздела двух фаз, напр. тв. электрода и жидкости в… … Естествознание. Энциклопедический словарь
Двойно́й электри́ческий слой (межфазный) (ДЭС) — слой ионов, образующийся на поверхности твёрдого тела в результате адсорбции ионов из раствора, диссоциации поверхностного соединения или ориентирования полярных молекул на границе раздела фаз. Ионы, непосредственно связанные с поверхностью, называются потенциалоопределяющими. Заряд этого слоя компенсируется зарядом второго слоя ионов, называемых противоионами.
Стадии электродных процессов.
Любая протекающая на электроде реакция в водном растворе, то есть электродный процесс, включает несколько последовательных стадий:
1) ион водорода из глубины раствора подходит к границе двойного электрического слоя и затем через диффузную часть двойного электрического слоя — к поверхности электрода на расстояние толщины двойного электрического слоя с высокой плотностью заряда, где может произойти переход электрона с электрода на ион;
2) подошедший к поверхности электрода ион водорода разряжается (то есть на него переходит электрон с электрода) и на электроде образуется адсорбированный атом водорода;
3) адсорбированный атомный водород удаляется с поверхности электрода с образованием молекулярного водорода, причем удаление атомного водорода с поверхности электрода может быть осуществлено различными путями.
ДВОЙНОЙ ЭЛЕКТРИЧЕСКИЙ СЛОЙ
ДВОЙНОЙ ЭЛЕКТРИЧЕСКИЙ СЛОЙ, тонкий поверхностный слой из пространственно разделенных электрич. зарядов противоположного знака, образующийся на границе двух фаз. Поскольку пространств. разделение зарядов всегда сопровождается возникновением электрич. разности потенциалов, двойной электрический слой можно рассматривать как своеобразный микроконденсатор, расстояние между обкладками к-рого определяется молекулярными размерами. Образование двойного электрического слоя оказывает существенное влияние на скорость электродных процессов, адсорбцию ионов и нейтральных молекул, устойчивость дисперсных систем, смачиваемость, коэф. трения и др. св-ва межфазных границ. В биол. системах процессы образования и разрушения двойного электрического слоя на клеточных мембранах сопровождают распространение электрич. импульсов вдоль нервных и мышечных волокон. Наиб. детально строение двойного электрического слоя изучено на границе между металлич. электродом и р-ром электролита. При погружении металлич. электрода М в р-р электролита, содержащий ионы этого металла М + (потенциалопределяющие ионы), устанавливается электрохим. равновесие, сопровождаемое выравниванием электрохим. потенциалов этих ионов в кристаллич. решетке металла и в р-ре. Если первоначально электрохим. потенциал ионов М + в металле был больше электрохим. потенциала этих ионов в р-ре , то в процессе выравнивания этих величин нек-рое кол-во ионов М + переходит из металла в р-р и пов-сть металла заряжается отрицательно. Притянутые к ней кулоновскими силами катионы из р-ра (не обязательно М + ) образуют положит. обкладку двойного электрического слоя. Возникающая при этом электрич. разность потенциалов препятствует дальнейшему переходу ионов М + из металла в р-р, что и приводит к установлению электрохим. равновесия. Если первоначально , то при установлении электрохим. равновесия часть ионов М + из р-ра переходит на металл, заряжая его пов-сть положительно. Отрицат. обкладку двойного электрического слоя в этом случае составляют притянутые к пов-сти металла анионы р-ра. Путем подбора концентрации потенциалопределяющих ионов в р-ре можно добиться такой ситуации, что условие не требует перехода ионов М + из металла в р-р или наоборот. В этом случае заряд пов-сти металла равен нулю, а его потенциал, измеренный относительно к.-л. электрода сравнения, наз. потенциалом нулевого заряда. Условия положительно заряженной, отрицательно заряженной и незаряженной пов-сти металла можно осуществить и в том случае, если в р-ре электролита нет потенциалопределяющих ионов.
Для этого необходимо внести в р-р кроме данного металлич. электрода М к.-л. вспомогат. электрод и подсоединить оба электрода к внеш. источнику постоянного напряжения. В зависимости от величины и знака напряжения источника можно произвольно изменять заряд q пов-сти металла М. При q > 0 ионную обкладку двойного электрического слоя образуют притянутые из р-ра анионы, при q При потенциале нулевого заряда, когда q = 0, ионный двойной электрический слой отсутствует, но разность потенциалов на границе р-р|металл (гальвани-потенциал) не равна нулю, т. к. на этой границе существуют т. наз. адсорбционный и электронный двойные электрические слои. Адсорбц. двойной электрический слой связан с некулоновской (специфической) адсорбцией ионов или полярных молекул. Так, напр., на границе ртуть|водный р-р KI при q = 0 донорно-акцепторное взаимод. приводит к специфич. адсорбции анионов I - , к-рые уже вследствие кулоновского взаимод. притягивают эквивалентное кол-во катионов К + . При этом электрич. центры анионов I - оказываются ближе к пов-сти ртути, чем электрич. центры катионов К + , и пространств. разделение зарядов ведет к образованию адсорбц. Двойной электрический слой, отрицат. обкладка к-рого обращена в сторону металла. Полярные молекулы р-рителя или растворенных нейтральных в-в, как правило, адсорбируются на электроде таким образом, что средняя нормальная к пов-сти составляющая дипольного момента не равна нулю. Ориентиров. адсорбция диполей поэтому также приводит к образованию адсорбц. двойного электрического слоя. Напр., при адсорбции молекул бутилового спирта из водного р-ра на незаряженной пов-сти ртути гидрофобные углеводородные радикалы С 4 Н 9 , несущие положит. заряд диполя, ориентированы в сторону пов-сти, а гидрофильные ОН-группы, на к-рых сосредоточен отрицат. заряд, ориентированы в сторону р-ра. Адсорбц. двойной электрический слой может образоваться также и при адсорбции неполярных частиц, если их донорно-акцепторное взаимод. с электродом сопровождается возникновением наведенного дипольного момента (напр., при адсорбции на электродах атомов Н или О). Электронный двойной электрический слой обусловлен квантовомех. св-вами электронов в металлах и полупроводниках. Согласно совр. моделям металла как электронного газа и ионного остова электронный двойной электрический слой связывают с тем, что электронный газ несколько выходит за пределы ионного остова, что и приводит к пространств. разделению зарядов. При этом своей положит. обкладкой двойной электрический слой обращен к металлу, отрицательной - к контактирующей с металлом фазе (р-ру или газу). В полупроводниках из-за малого кол-ва носителей тока (электронов в зоне проводимости и "дырок" в валентной зоне) при наложении внеш. напряжения возникает их неравномерное пространств. распределение в поверхностном слое, к-рое рассматривают как электронный двойной электрический слой внутри полупроводниковой фазы. В общем случае двойные электрические слои, вызванные разными причинами, накладываются друг на друга, что приводит к весьма сложной структуре границы раздела между электродом и р-ром. Возникновение двойного электрического слоя на границе непроводящего твердого тела с р-ром связано либо с адсорбцией, либо с взаимод. поверхностных ионогенных групп твердого тела с молекулами р-рителя. Так, напр., кристаллы AgI, полученные по р-ции KI + AgNO 3 : AgI + KNO 3 , в р-рах с избытком KI адсорбируют ионы I - и заряжаются отрицательно, в р-рах с избытком AgNO 3 адсорбируют ионы Ag + и заряжаются положительно. При этом к заряженной пов-сти AgI под действием электростатич. сил притягиваются ионы противоположного знака, образующие ионную обкладку двойного электрического слоя. С другой стороны, взаимод. поверхностных ионогенных групп разл. оксидов с ионами Н 3 О + , ОН - и молекулами воды в зависимости от рН р-ра может приводить либо к положит., либо к отрицат. заряжению пов-сти оксида.
Методы изучения. Для исследования двойного электрического слоя используют в осн. три группы методов. Во-первых, адсорбц. методы, к-рые основаны на том, что образование двойного электрического слоя связано с адсорбцией разл. компонентов р-ра и вызывает изменение их концентрации. В частности, адсорбц. методы широко используют для изучения двойного электрического слоя, образованного на мелкодисперсных частицах в коллоидных системах. Во-вторых, методы, основанные на электрокапиллярных явлениях. Их сущность состоит в том, что образование двойного электрического слоя уменьшает работу, необходимую для создания новой пов-сти раздела фаз, и тем самым приводит к зависимости межфазного натяжения от потенциала электрода. Применение электрокапиллярных методов ограничено границами раздела между жидкими фазами, на к-рых возможно непосредственное измерение межфазного натяжения; для твердых электродов эти методы дают лишь качеств. информацию о строении двойного электрического слоя. В-третьих, методы, регистрирующие кол-во электричества, затраченного на создание определенного заряда электрода (заряжение двойного электрического слоя). Сюда относятся разл. гальваностатич. и потенциостатич. импульсные методы, а также метод измерения электрич. емкости двойного электрического слоя с помощью синусоидального переменного тока (см. Импедансный метод). Для успешного применения этих методов необходимо, чтобы все подведенное к электроду электричество затрачивалось только на заряжение двойного электрического слоя и не расходовалось на электрохим. р-ции. Электроды, удовлетворяющие этому требованию, наз. идеально поляризуемыми. Сведения о строении двойного электрического слоя на границе р-р|изолятор можно получить на основе изучения электрокинетических явлений. Д войной электрический слой изучают также с помощью оптич. методов (эллипсометрия, разл. варианты электроотражения света, комбинационное рассеяние в адсорбц. слое и др.). На основе указанных методов можно определить заряд пов-сти электрода q, его зависимость от потенциала электрода Е, потенциал нулевого заряда E q = 0, электрич. емкость двойного электрического слоя, равную дq/дE, а также поверхностные избытки (адсорбции) разл. компонентов р-ра в зависимости от Е (или q)и их объемной концентрации.
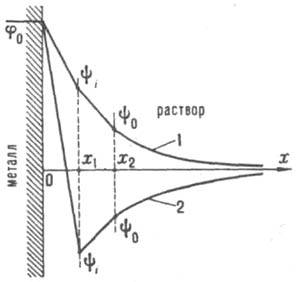
Современная теория двойного электрического слоя, основной вклад в развитие к-рой внесли работы Г. Гелъмгольца (1879), Ж. Гуи (1910), Д. Чапмена (1913), О. Штерна (1924) и Д. Грэма (1947-58), базируется на след. модели ионной обкладки двойного электрического слоя. Благодаря тепловому движению ионы, адсорбировавшиеся на электроде только под действием кулоновских сил, распределяются у пов-сти подобно молекулам газа в земной атмосфере и образуют диффузную часть двойного электрического слоя. Границей диффузной части является т. наз. внеш. плоскость Гелъмгольца х 2 (рис.), до к-рой могут дойти электрич. центры ионов, участвующих в тепловом движении. Между внеш. плоскостью Гельмголъца и пов-стью металла располагается плотная часть двойного электрического слоя, для к-рой характерна диэлектрич. проницаемость существенно меньшая, чем в объеме р-ра. В плотном слое локализуется дипольный двойной электрический слой, образованный ориентированными диполями р-рителя и орг. растворенного в-ва. Кроме того, в плотную часть двойного электрического слоя входят специфически адсорбирующиеся ионы; при этом их электрич. центры образуют т. наз. внутр. плоскость Гельмголъца х 1 .
Схема распределения потенциала в двойном электрическом слое: 1 - при |q 1 | 1 | > |q|
Читайте также:

