Донорно акцепторный механизм это кратко
Обновлено: 30.06.2024
Химической связью называется связь двух и более атомов (молекул) в органическом или неорганическом соединении. Она образуется при условии уменьшения общей энергии в системе.
Все ли элементы могут образовывать химические связи
Все элементы периодической системы имеют разную способность к образованию связи. Наиболее устойчивыми и, как результат, химически малоактивными являются атомы благородных (инертных) газов, так как содержат на внешней электронной оболочке два или восемь электронов. Они образуют небольшое количество связей. К примеру, неон, гелий и аргон не образуют химических связей ни с одним элементом, тогда как ксенон, криптон и радон способны реагировать с фтором и молекулами воды.
У атомов других элементов внешние уровни не завершены и имеют от одного до семи электронов, поэтому для повышения устойчивости оболочки образуют химические связи.
Типы химической связи
Выделяют несколько типов связи:
- Ковалентная.
- Ионная.
- Металлическая.
- Водородная.
Ковалентная связь
Данный тип связи формируется между атомами в молекуле в результате обобществления или перекрытия валентной электронной пары. Соответственно, существует обменный (а) и донорно-акцепторный (б) механизмы образования ковалентной связи. Отдельным случаем является дативная связь, которая будет рассмотрена ниже.
Ковалентная связь: обменный механизм
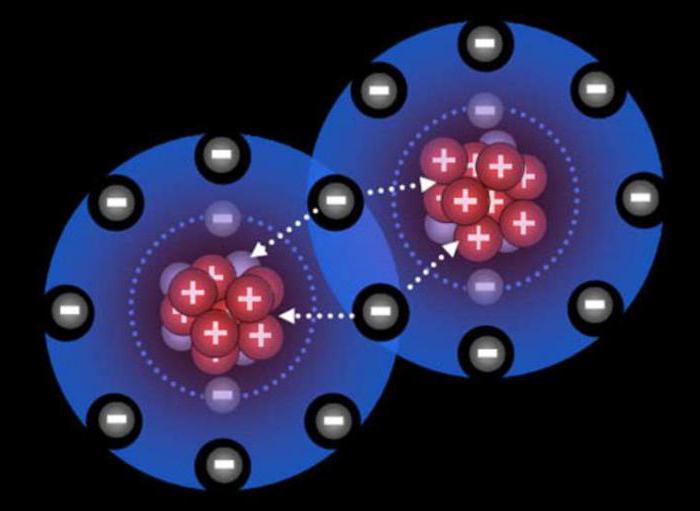
У атомов на внешнем уровне есть неспаренные электроны. При взаимодействии внешние оболочки перекрываются. Антипараллельные спины одиночных электронов, содержащихся на внешних уровнях, спариваются с образованием электронной пары, общей для обоих атомов. Данная пара электронов представляет, собственно, ковалентную связь, которая образована по обменному механизму, к примеру, в молекуле водорода.
Ковалентная связь: донорно-акцепторный механизм
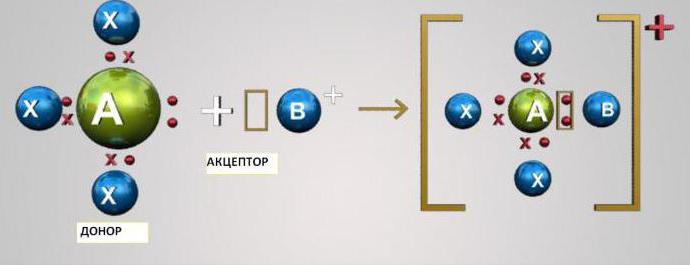
Данный механизм заключается в обобществлении двумя атомами двух находящихся на внешнем уровне электронов. При этом один из атомов выступает в качестве донора (предоставляет два электрона), а другой - акцептора (имеет вакантную орбиталь для электронов). Атомы s- и p-элементов могут быть либо акцепторами, либо донорами электронов. Атомы d-элементов способны быть и донорами, и акцепторами.
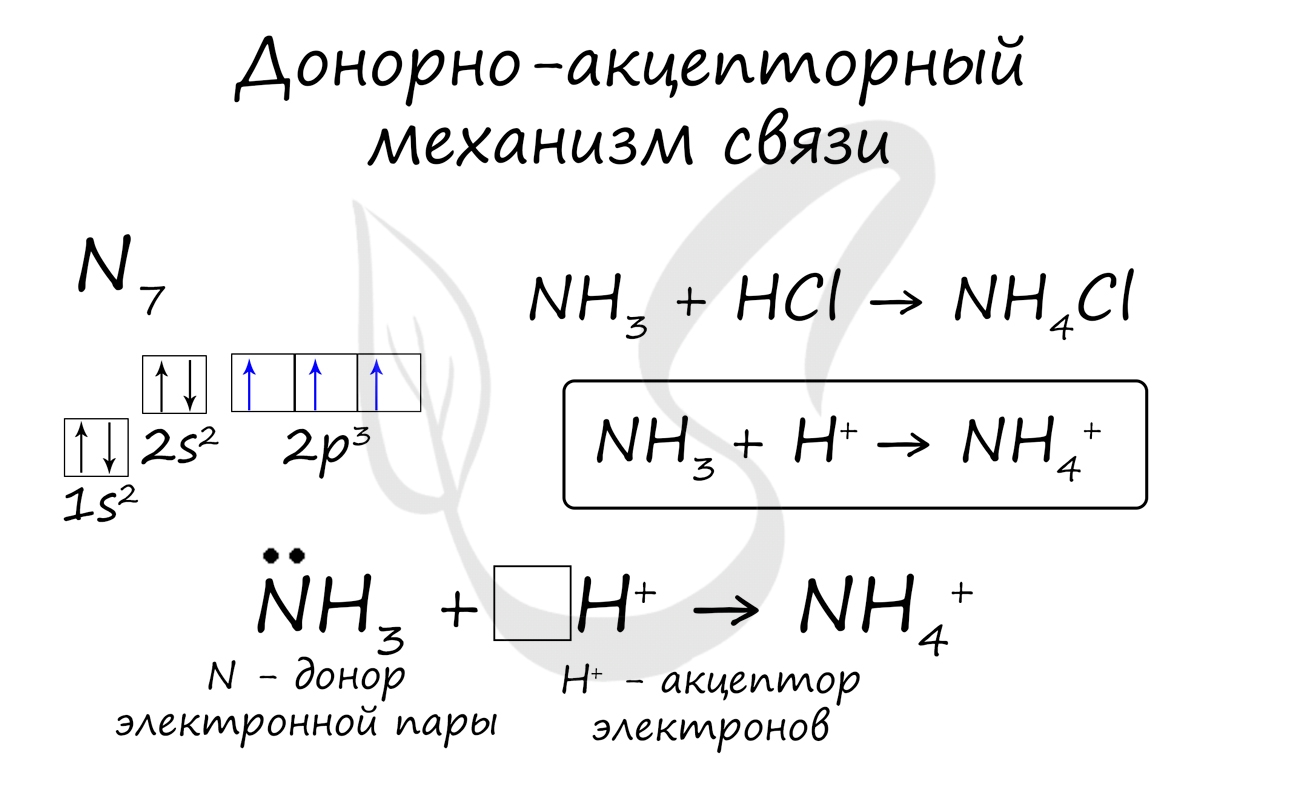
Чтобы понять, что такое донорно-акцепторный механизм, рассмотрим два простейших примера - образование катионов гидроксония H3O + и аммония NH4 + .
Пример донорно-акцепторного механизма - катион аммония
Схематически реакция образования частицы аммония выглядит следующим образом:
Электроны в атоме N распределены в следующем порядке: 1s 2 2s 2 2p 3 .
Электронная структура катиона H: 1s 0 .
Атом азота на внешнем уровне содержит два s- и три p-электрона. Три p-электрона участвуют в образовании трех ковалентных обменного типа связей азот-водород N-H. В результате этого образуется молекула аммиака NH3 с ковалентным типом связи. Поскольку атом азота N на внешнем уровне имеет еще пару электронов s, молекула NH3 может присоединить еще и катион водорода. Молекула аммиака является донором, а катион водорода H + – акцептором, который принимает донорские электроны от азота на собственную свободную s-орбиталь.

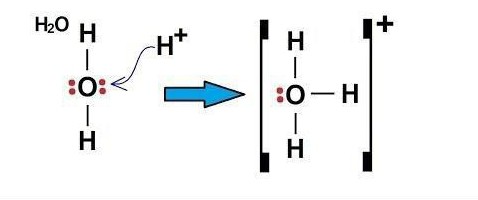
Пример донорно-акцепторного механизма – H3O (ион гидроксония)
Электроны в атоме кислорода распределены в следующем порядке: 1s 2 2s 2 2p 4 .
Атом кислорода на внешнем уровне имеет два s и четыре p-электрона. Исходя из этого, в образовании связей H-O принимают участие два свободных p-электрона и два s-электрона от двух атомов H. То есть 2 имеющиеся связи в молекуле H2O – ковалентные, образованные по обменному механизму.
Электронная структура катиона водорода: 1s 0 .
Так как у атома кислорода на внешнем уровне остались еще два электрона (s-типа), он может образовать третью связь ковалентного типа по донорно-акцепторному механизму. Акцептором может быть атом, имеющий свободную орбиталь, в данном примере это частица H + . Свободную s-орбиталь катиона H + занимают два электрона (s) атома кислорода.
Донорно-акцепторный механизм образования ковалентной связи между неорганическими молекулами
Рассмотрим первый пример - образование апротонной кислоты (кислоты Льюиса) NH3BF3. Данный неорганический комплекс образуется в реакции присоединения молекулы аммиака и фторида бора.
Электроны в атоме бора распределены в следующем порядке: 1s 2 2s 2 2p 1 .
При возбуждении атома B один электрон s-типа переходит на p-подуровень (1s 2 2s 1 2p 2 ). Таким образом, на внешнем уровне возбужденного атома бора находится два s- и два p-электрона.
В молекуле BF3 три ковалентные связи бор-фтор B-F образованы обменного типа (атомы бора и фтора предоставляют по одному электрону). После образования трех ковалентных связей у атома бора на внешней электронной оболочке остается свободный p-подуровень, за счет которого молекула фторида бора может выступать акцептором электронов.
Электроны в атоме азота распределены в следующем порядке:1s 2 2s 2 2p 3 .
По три электрона от атомов N и H участвуют в формировании связи азот-водород. После этого у азота остается еще два электрона s-типа, которые он может предоставить для образования связи по донорно-акцепторному механизму.
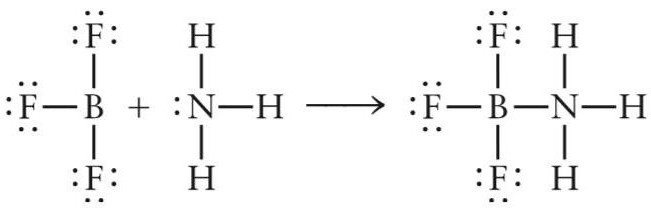
В реакции взаимодействия трифторида бора и аммиака молекула NH3 играет роль донора электронов, а молекула BF3 – акцептора. Пара электронов азота занимает свободную орбиталь фторида бора и образуется химическое соединение NH3BF3.
Другой пример механизма образования донорно-акцепторной связи - получение полимера фторида бериллия.
Схематически реакция выглядит следующим образом:
Электроны в атоме Be расположены так - 1s 2 2s 2 , а в атоме F - 1s 2 2s 2 2p 5 .
Две связи бериллий-фтор в молекуле фторида бериллия ковалентные обменного типа (участвуют два p-электрона от двух атомов фтора и два электрона s-подуровня атома бериллия).
Между парой атомов бериллия (Be) и фтора (F) формируются еще две ковалентные связи по донорно-акцепторному механизму. В полимере фторида бериллия атом фтора - это донор электронов, атом бериллия – их акцептор, имеющий вакантную орбиталь.
Донорно-акцепторный механизм образования ковалентной связи между органическими молекулами
Когда происходит формирование связи по рассматриваемому механизму между молекулами органической природы, образуются более сложные соединения - комплексы. В любом органическом соединении с ковалентной связью содержатся как занятые (несвязывающие и связывающие), так и пустые орбитали (разрыхляющие и несвязывающие). Возможность донорно-акцепторного образования комплексов определяется степенью устойчивости комплекса, которая зависит от прочности связи.
Рассмотрим пример - реакция взаимодействия молекулы метиламина с соляной кислотой с образованием хлорида метиламмония. В молекуле метиламина все связи ковалентные, образованные по обменному механизму – две связи H-N и одна связь N-CH3. После соединения с водородом и метильной группой у атома азота есть еще пара электронов s-типа. Являясь донором, он предоставляет эту электронную пару для атома водорода (акцептор), у которого есть свободная орбиталь.
Донорно-акцепторный механизм без формирования химической связи
Не во всех случаях донорно-акцепторного взаимодействия происходит обобществление электронной пары и образование связи. Некоторые органические соединения могут объединяться между собой за счет перекрывания заполненной орбитали донора с пустой орбиталью акцептора. Происходит перенос заряда – электроны делокализуются между акцептором и донором, расположенными очень близко друг к другу. Образуются комплексные соединения с переносом заряда (КПЗ).
Такое взаимодействие характерно для пи-систем, орбитали которых легко перекрываются, а электроны легко поляризуются. В роли доноров могут выступать металлоцены, ненасыщенные аминосоединения, ТДАЭ (тетракис(диметиламино)этилен). Акцепторами зачастую являются фуллерены, хинодиметаны, имеющие акцепторные заместители.
Перенос заряда может быть как частичным, так и полным. Полный перенос заряда происходит при фотовозбуждении молекулы. При этом образуется комплекс, который можно наблюдать спектрально.
Независимо от полноты переноса заряда, такие комплексы неустойчивы. Для повышения прочности и времени жизни такого состояния дополнительно внедряют мостиковую группу. В результате этого донорно-акцепторные системы успешно используются в устройствах преобразования солнечной энергии.
В некоторых органических молекулах связь по донорно-акцепторному механизму формируется внутри молекулы между донорной и акцепторной группой. Такой тип взаимодействия носит название трансаннулярного эффекта, характерного, к примеру, для атранов (элементоорганические соединения со связями N->B, N->Si).
Семиполярная связь, или Дативный механизм образования связи
Кроме обменного и донорно-акцепторного существует третий механизм – дативный (другие названия – семиполярная, полуполярная или координационная связь). Атом-донор отдает пару электронов на свободную орбиталь нейтрального атома, которому необходимы два электрона, чтобы завершить внешний уровень. Происходит своеобразный переход электронной плотности от акцептора к донору. При этом донор становится положительно заряженным (катион), а акцептор – отрицательно заряженным (анион).
Собственно химическая связь формируется за счет связывающей оболочки (перекрывания двух спаренных электронов одного из атомов внешней свободной орбиталью другого) и электростатической притяжения, возникающего между катионом и анионом. Таким образом, в семиполярной связи сочетаются ковалентный и ионный типы. Полуполярная связь характерна для d-элементов, которые в разных соединениях могут играть роли и акцептора, и донора. В большинстве случаев она встречается в комплексных и органических веществах.
Примеры дативной связи
Самый простой пример – молекула хлора. Один атом Cl отдает пару электронов другому атому хлора, у которого есть свободная d-орбиталь. При этом один атом Cl заряжается положительно, другой – отрицательно, и между ними возникает электростатическое притяжение. Из-за большой длины дативная связь имеет меньшую прочность в сравнении с ковалентной обменного и донорно-акцепторного типа, но ее наличие повышает прочность молекулы хлора. Именно поэтому молекула Cl2 более прочна, чем F2 (у атома фтора нет d-орбиталей, связь фтор-фтор только ковалентная обменная).
Молекула монооксида углерода CO (угарный газ) образована за счет трех связей C-O. Поскольку у атомов кислорода и углерода на внешнем уровне имеется по два одиночных электрона, между ними формируется две ковалентные обменные связи. После этого у атома углерода остается вакантная орбиталь, у атома O - две пары электронов на внешнем уровне. Поэтому в молекуле монооксида углерода (II) есть третья связь – семиполярная, формирующаяся за счет двух валентных спаренных электронов кислорода и свободной орбитали углерода.
Рассмотрим более сложный пример - образование данного вида связи на примере взаимодействия диметилового эфира (Н3С-О-СН3) с хлоридом алюминия AlCl3. Атом кислорода в диметиловом эфире связан двумя ковалентными связями с метильными группами. После этого у него остается еще два электрона на p-подуровне, которые он отдает атому-акцептору (алюминий) и становится положительным катионом. При этом атом-акцептор приобретает отрицательный заряд (превращается в анион). Катион и анион электростатически взаимодействуют друг с другом.
Значение донорно-акцепторной связи
Механизм образования донорно-акцепторной связи имеет важное значение в жизни человека и широко распространен в химических соединениях как органической, так и неорганической природы, что подтверждают рассмотренные выше примеры. Нашатырный спирт, в составе которого есть катион аммония, успешно применяется в быту, медицине и промышленном производстве удобрений. Ион гидроксония играет главную роль в растворении кислот в воде. Угарный газ применяется в промышленности (например, при производстве удобрений, лазерных систем) и имеет огромное значение в физиологических системах организма человека.
Химическая связь - связь между атомами в молекуле или молекулярном соединении, возникающая в результате переноса электронов с одного атома на другой, либо обобществления электронов для обоих атомов.
Различают несколько типов химических связей: ковалентная, ионная, металлическая, водородная.

Ковалентная связь ( лат. со - совместно + valens - имеющий силу)
Ковалентная связь возникает между двумя атомами по обменному механизму (обобществление пары электронов) или донорно-акцепторному механизму (электронов донора и свободной орбитали акцептора).
Ковалентной связью соединены атомы в молекулах простых веществ (Cl2, Br2, O2), органических веществ (C2H2), а также, в общем случае, между атомами неметалла и другого неметалла (NH3, H2O, HBr).
Если атомы, образующие ковалентную связь, имеют одинаковые значения электроотрицательности, то связь между ними называется ковалентной неполярной связью. В таких молекулах нет "полюса" - электронная плотность распределяется равномерно. Примеры: Cl2, O2, H2, N2, I2.
Если атомы, образующие ковалентную связь, имеют разные значения электроотрицательности, то связь между ними называется ковалентной полярной. В таких молекулах имеется "полюс" - электронная плотность смещена к более электроотрицательному элементу. Примеры: HCl, HBr, HI, NH3, H2O.

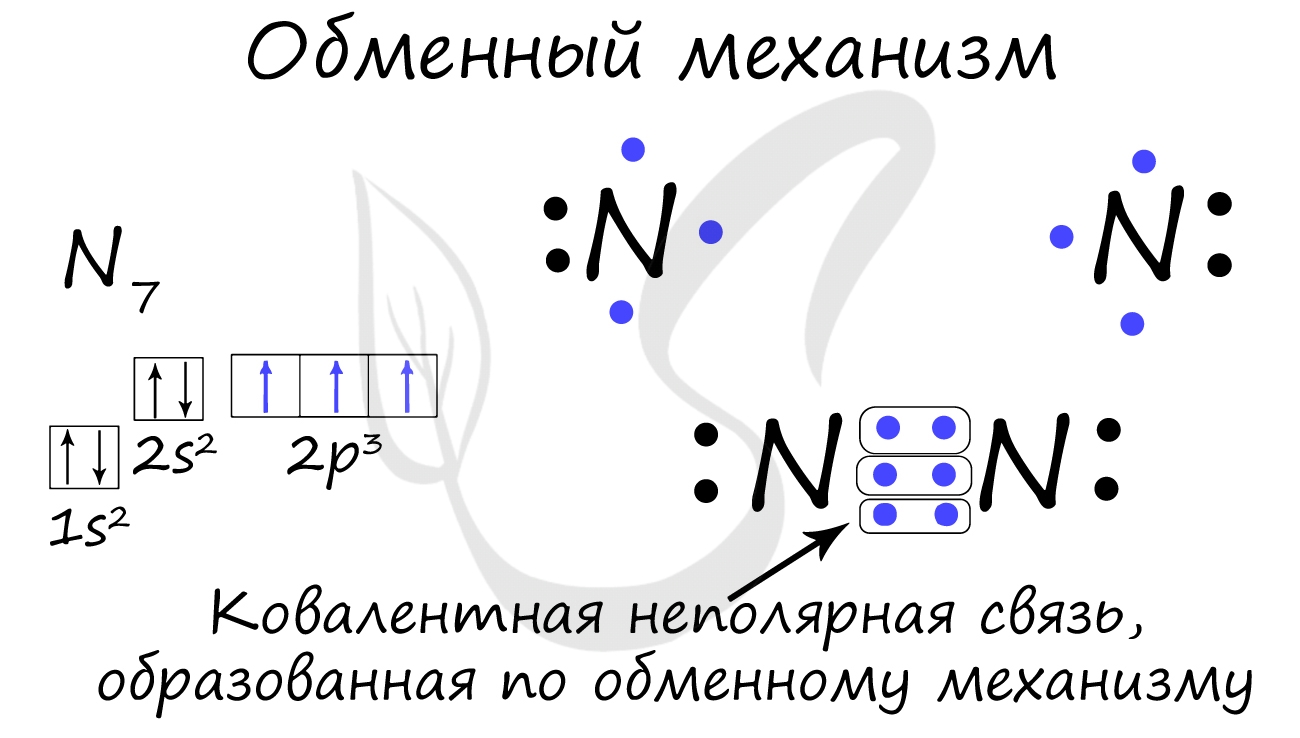
Ковалентная связь может быть образована по обменному механизму - обобществлению электронной пары. В таком случае каждый атом "одинаково" вкладывается создание связи. Например, два атома азота, образующие молекулу N2, отдают по 3 электрона с внешнего уровня для создания связи.
Существует донорно-акцепторный механизм образования ковалентной связи, при котором один атом выступает в качестве донора неподеленной электронной пары. Другой атом не тратит свои электроны, а только лишь предоставляет орбиталь (ячейку) для этой электронной пары.
- NH4 + - в ионе аммония
- NH4 + Cl, NH4 + Br - внутри иона аммония во всех его солях
- NO3 - - в нитрат ионе
- KNO3, LiNO3 - внутри нитрат иона во всех нитратах
- O3 - озон
- H3O + - ион гидроксония
- CO - угарный газ
- K[Al(OH)4], Na2[Zn(OH)4] - во всех комплексных солях есть хотя бы одна ковалентная связь, возникшая по донорно-акцепторному механизму
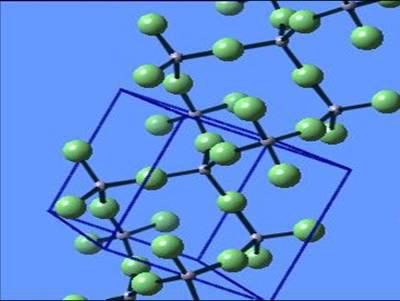
Ионная связь
Ионная связь - один из видов химической связи, в основе которого лежит электростатическое взаимодействие между противоположно заряженными ионами.
В наиболее частом случае ионная связь образуется между типичным металлом и типичным неметаллом. Примеры:
Большой подсказкой служит таблица растворимости, ведь все соли имеют ионные связи: CaSO4, Na3PO4. Даже ион аммония не исключение, между катионом аммония и различными анионами образуются ионные связи, например в соединениях: NH4I, NH4NO3, (NH4)2SO4.
Часто в химии встречаются несколько связей внутри одной молекулы. Рассмотрим, например, фосфат аммония, обозначив тип каждой связи внутри этой молекулы.
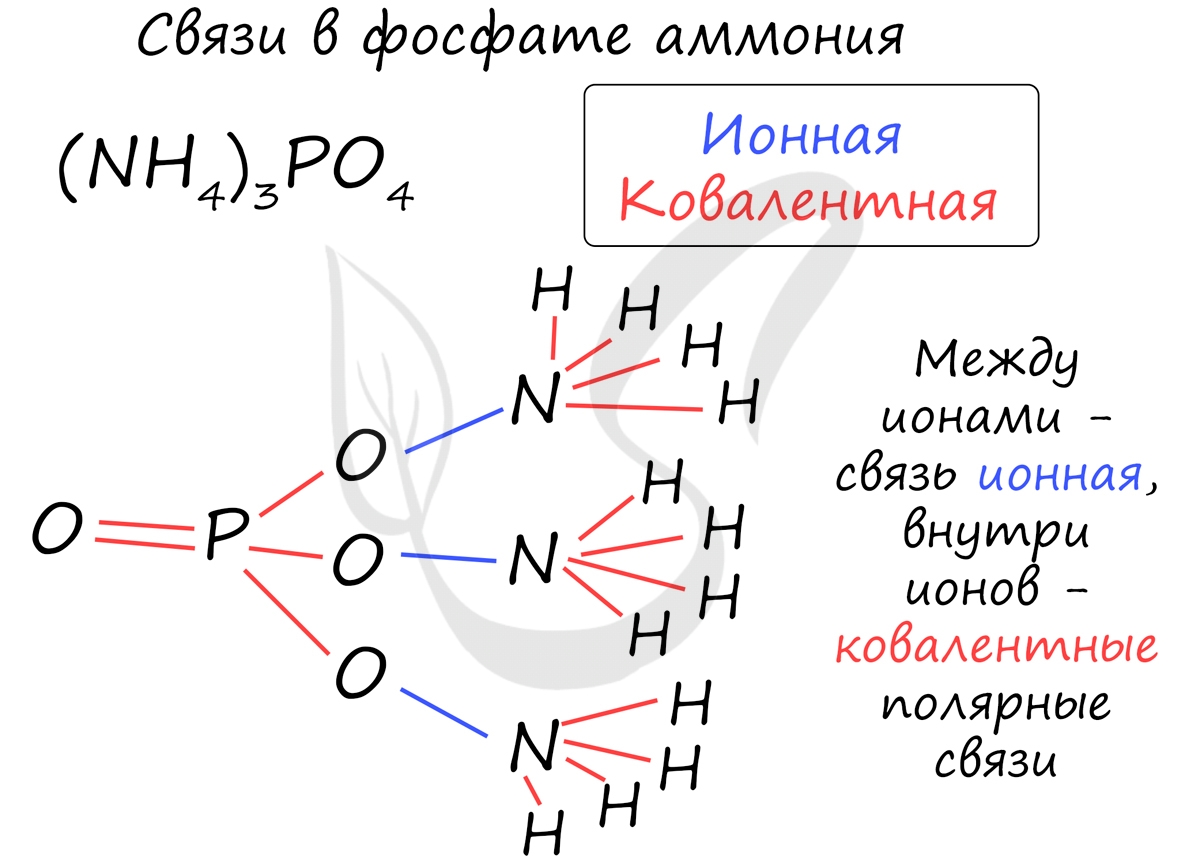
Металлическая связь
Металлическая связь - вид химической связи удерживающая вместе атомы металла. Этот тип связи выделен отдельно, так как его отличием является наличие высокой концентрации в металлах электронов проводимости - "электронного газа". По природе металлическая связь близка к ковалентной.
"Облако" электронов в металлах способно приходить в движение под различным воздействием. Именно оно является причиной электропроводности металлов.

Водородная связь
Водородная связь - вид химической связи, образующийся между некоторыми молекулами, содержащими водород. Одна из наиболее частых ошибок считать, что в самом газе, водороде, имеются водородные связи - это вовсе не так.
Водородные связи возникают между атомом водорода и другим более электроотрицательным атомом (O, S, N, C).
- H2O
- NH3
- HF
- Органических спиртов: С2H5OH, C3H7OH
- Органических кислот: CH3COOH, C2H5COOH

Отчасти за счет водородных связей наблюдается то самое исключение, связанное с усилением кислотных свойств в ряду галогеноводородных кислот: HF → HCl → HBr → HI. Фтор является самым ЭО-ым элементов, сильно притягивает к себе атом водорода другой молекулы, что снижает способность кислоты отщеплять водород и снижает ее силу.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Донорно-акцепторный механизм (иначе координационный механизм) — способ образования ковалентной химической связи между двумя атомами или группой атомов, осуществляемый за счет неподеленной пары электронов атома-донора и свободной орбитали атома-акцептора.


Донорами обычно выступают атомы азота, кислорода, фосфора, серы и др., имеющие неподелённые электронные пары на валентных орбиталях малого размера. Роль акцептора могут выполнять ионизированный атом водорода H + , некоторые p-металлы (напр., алюминий при образовании иона AlH4 - ) и, в особенности, d-элементы, имеющие незаполненные энергетические ячейки в валентном электронном слое.
Именно с позиций донорно-акцепторного механизма описывается образование локализованных ковалентных связей в молекулах и молекулярных ионах комплексных (координационных) соединений: связь формируется за счёт неподелённой пары электронов лиганда и свободной орбитали атома-комплексообразователя. Донорно-акцепторный механизм также описывает образование промежуточных продуктов (интермедиатов) реакции, например, комплексов с переносом заряда.
Модель донорно-акцепторного механизма существует только в рамках представлений о валентности как о локализации электронной плотности при образовании ковалентных связей (метод валентных схем). В рамках метода молекулярных орбиталей необходимости в подобных представлениях нет.
См. также
- Химическая связь
- Координационная химия
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Донорно-акцепторная связь" в других словарях:
ДОНОРНО-АКЦЕПТОРНАЯ СВЯЗЬ — (координационная связь), химическая связь между атомами, молекулами, радикалами, обычно не имеющими неспаренных эл нов. Одна из ч ц при образовании такой связи явл. донором пары эл нов, другая акцептором. Акцептор способен принимать эл ны, к ним… … Физическая энциклопедия
ДОНОРНО-АКЦЕПТОРНАЯ СВЯЗЬ — то же, что координационная связь … Большой Энциклопедический словарь
донорно-акцепторная связь — то же, что координационная связь. * * * ДОНОРНО АКЦЕПТОРНАЯ СВЯЗЬ ДОНОРНО АКЦЕПТОРНАЯ СВЯЗЬ, то же, что координационная связь (см. КООРДИНАЦИОННАЯ СВЯЗЬ) … Энциклопедический словарь
Донорно-акцепторная связь — координационная связь, термин, обозначающий один из способов образования химической ковалентной связи (См. Ковалентная связь). Обычная ковалентная связь между двумя атомами обусловлена взаимодействием двух электронов по одному от каждого… … Большая советская энциклопедия
ДОНОРНО-АКЦЕПТОРНАЯ СВЯЗЬ — то же, что координационная связь … Естествознание. Энциклопедический словарь
СВЯЗЬ ХИМИЧЕСКАЯ ДОНОРНО-АКЦЕПТОРНАЯ — связь, возникающая за счет использования одним атомом или ионом пары электронов, принадлежащих другому взаимодействующему атому. Простейшим примером может служить присоединение Н+ к NH3 с образованием NH4+, у N имеется s2 и р3 электрона. Три… … Геологическая энциклопедия
донорно-акцепторное взаимодействие — Термин донорно акцепторное взаимодействие Термин на английском coordination bond Синонимы донорно акцепторная связь, координационная связь Аббревиатуры Связанные термины акцептор, донор, супрамолекулярная химия Определение ковалентная химическая… … Энциклопедический словарь нанотехнологий
Координационная связь — Донорно акцепторная связь (координационная связь) химическая связь между двумя атомами или группой атомов, осуществляемая за счет неподеленной пары электронов одного атома (донора) и свободной орбитали другого атома (акцептора). Донорно… … Википедия

Существует еще один механизм образования связи. Рассмотрим его на примере взаимодействия молекулы аммиака с молекулой трифторида бора:

У атома азота в молекуле аммиака после образования связей с атомами водорода остается еще одна валентная орбиталь с неподеленной парой электронов (в структурной формуле обозначена точками). У атома бора в молекуле трифторида бора после образования связей с атомами фтора остается одна свободная валентная орбиталь (в структурной формуле обозначена • ). Неподеленную пару валентных электронов атом азота может предоставить атому бора " в совместное использование" , " поделиться" с ним этой электронной парой. При этом электроны бывшей неподеленной пары становятся общими для атомов азота и бора, то есть между ними образуется ковалентная связь. Но при этом у атомов бора и азота возникают еще и формальные заряды: – 1 е у атома бора и +1 е у атома азота:

В результате между атомами азота и бора возникает и ковалентная, и ионная связь. При этом атом азота является донором электронной пары (" дает" ее для образования связи), а атом бора – акцептором (" принимает" ее при образовании связи). Отсюда и название механизма образования такой связи – " донорно-акцепторный" .
Донорно-акцепторный механизм образования связи – механизм образования связи, при котором один из связываемых атомов является донором электронной пары, а другой – акцептором.
При образовании связи по донорно-акцепторному механизму образуются одновременно и ковалентная связь, и ионная.
Конечно, после образования связи за счет разницы в электроотрицательности связываемых атомов происходит поляризация связи, возникают частичные заряды, снижающие эффективные (реальные) заряды атомов.

Если рядом с молекулой аммиака окажется сильно полярная молекула хлороводорода, в которой на атоме водорода имеется значительный частичный заряд , то в этом случае роль акцептора электронной пары будет выполнять атом водорода. Его 1s-АО хоть и не совсем пустая, как у атома бора в предыдущем примере, но электронная плотность в облаке этой орбитали существенно понижена.

Пространственное строение получившегося катиона, иона аммония NH4 , подобно строению молекулы метана, то есть все четыре связи N—H совершенно одинаковы.
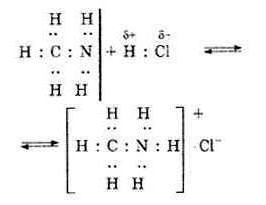
Образование ионных кристаллов хлорида аммония NH4Cl можно наблюдать, смешав газообразный аммиак с газообразным хлороводородом:
Донором электронной пары может быть не только атом азота. Им может быть, например, атом кислорода молекулы воды. С тем же хлороводородом молекула воды будет взаимодействовать следующим образом:

Образующийся катион H3O называется ионом оксония и, как вы скоро узнаете, имеет огромное значение в химии.
В заключение рассмотрим электронное строение молекулы угарного газа (монооксида углерода) СО:

В ней, кроме трех ковалентных связей (тройной связи), есть еще и ионная связь.
Условия образования связи по донорно-акцепторному механизму:
1) наличие у одного из атомов неподеленной пары валентных электронов;
2) наличие у другого атома свободной орбитали на валентном подуровне.
Донорно-акцепторный механизм образования связи распространен довольно широко. Особенно часто он встречается при образовании соединений d -элементов. Атомы почти всех d -элементов имеют много свободных валентных орбиталей. Поэтому они являются активными акцепторами электронных пар.
ДОНОРНО-АКЦЕПТОРНЫЙ МЕХАНИЗМ ОБРАЗОВАНИЯ СВЯЗИ, ИОН АММОНИЯ, ИОН ОКСОНИЯ, УСЛОВИЯ ОБРАЗОВАНИЯ СВЯЗИ ПО ДОНОРНО-АКЦЕПТОРНОМУ МЕХАНИЗМУ.
· ОБМЕННЫЙ МЕХАНИЗМ - в образовании связи участвуют одноэлектронные атомные орбитали, т.е. каждый из атомов предоставляет в общее пользование по одному электрону:

· ДOНОРНО-АКЦЕПТОРНЫЙ МЕХАНИЗМ - образование связи происходит за счет пары электронов атома-донора и вакантной орбитали атома-акцептора:

Чисто ионной связью называется химически связанное состояние атомов, при котором устойчивое электронное окружение достигается путём полного перехода общей электронной плотности к атому более электроотрицательного элемента.
На практике полный переход электрона от одного атома к другому атому-паренеру по связи не реализуется, поскольку каждый элемент имеет большую или меньшую, но не нулевую, электроотрицательность, илюбая связь будет в некоторой степени ковалентной.
Ионная связь возможна только между атомами электроположительных и электроотрицательных элементов, находящихся в состоянии разноименно заряженных ионов.
Ионы - это электрически заряженные частицы, образующиеся из нейтральных атомов или молекул путем отдачи или присоединени электронов.При отдаче электронов образуется положительно заряженный ион- катион , при присоединении-отрицательный- анион.
При отдаче или присоединении электронов молекулами образуются молекулярные или многоатомные ионы, например О 2+ - катион диоксигенила, NO 2- -нитрит-ион.
Одноатомные катионы и одноатомные анионы возникают при химической реакции между нейтральнами атомами путем взаимопередачи электронов. При этом атом электроположительного элемента, обладающий небольшим числом внешних электронов, переходит в более устойчивое состояние одноатомного катиона путем уменьшения числа этих электронов. Наоборот, атом электроотрицательного элемента, имеющий большое число электроно на внешнем слое , переходит в более устойчивое для него состояние одноатомного иона путем увеличения числа электронов.
Одноатомные катионы образуются, как правило, металлами, а одноатомные анионы-неметаллами. При передаче электронов металлического и неметаллического элементов стремятся сформировать вокруг своих ядер устойчивую конфигурацию электронной оболочки. Атом неметаллического элемента создает внешнюю оболочку последующего благородного газа, тогда как атом металлического элемента после отдачи внешних электронов получает устойчивую конфигурацию предыдущего благородного газа.

Кулоновские силы притяжения, возникающие при взаимодействии заряженных ионов, сильные и действуют одинаково во всех направлениях. В результате этого расположение ионов упорядочивается в пространстве определенным образом, образуя ионную кристаллическую решётку. Вещества с ионной КР при обычных условиях находятся в кристаллическом состоянии, они имеют высокие температуры плавления и кипения.
Читайте также:

