Актин миозин это кратко
Обновлено: 03.07.2024
Мышцы и PGC-1α
Движение человеческого тела обеспечивают около 600 скелетных мышц, которые составляют примерно 40–50% массы тела. Они состоят из миофибрилл, сформированных слившимися клетками-миобластами, а миофибриллы — из нитей актина и миозина, организованных в повторяющиеся блоки-саркомеры. Движение этих нитей друг относительно друга вызывает сокращение мышц. В отличие от гладкой и сердечной мускулатуры скелетные мышцы сокращаются произвольно по сигналу нейромедиатора ацетилхолина.
Работа требует энергии. При динамических сокращениях, для которых нужна выносливость (длительный бег, плаванье), и при поддержании позы энергию обеспечивает АТФ, получаемая за счет окислительного фосфорилирования, происходящего в митохондриях. Окисляются в первую очередь глюкоза и гликоген. При движениях, требующих большой силы и скорости (спринтерский бег, поднятие тяжестей), мышечные волокна расщепляют гликоген анаэробным путем в процессе гликолиза. При этом АТФ образуется в два-три раза быстрее, а механическая энергия, производимая мышцей, в два-три раза больше, чем при окислительном фосфорилировании. Но и усталость в этом случае наступает значительно быстрее.
В зависимости от типа совершаемой работы мышечные волокна синтезируют разные регуляторы транскрипции, ростовые факторы и другие молекулы, которые позволяют им адаптироваться к тому или иному виду нагрузки. Силовые тренировки приводят к преимущественному развитию так называемых быстрых волокон, которые используют гликолиз для синтеза АТФ. При соответствующих нагрузках увеличиваются их количество и площадь поперечного сечения. Волокна, которые совершают динамическую работу, называются медленными. Им нужны много митохондрий, развитая капиллярная сеть для снабжения кислородом, противодействие деградации белков, апоптозу и воспалению. Значительную роль в обеспечении этих потребностей играет регулятор транскрипции PGC-1α (коактиватор рецептора пролиферации пероксисом), который синтезируется при сокращении медленных волокон. Запомним этот белок, это один из главных персонажей нашего рассказа. Пожалуй, его роль в миофибриллах не меньше, чем у актина с миозином. У мышей он регулирует экспрессию более полутора тысяч генов: активность одних подавляет, других стимулирует, сколько у людей — пока не посчитали. У PGC-1α много функций, в том числе он стимулирует образование митохондрий, окисление жирных кислот и устойчивость к мышечной атрофии. Трансгенные мыши с избытком PGC-1α накачаны и мускулисты, а животные с неактивным геном обладают очень слабой выносливостью. Во время физических упражнений выделяются клеточные факторы, которые модифицируют белок PGC-1α, делая его более стабильным, а следовательно, и активным. По окончании тренировки уровень PGC-1α возвращается к норме в течение часа.
При длительных, систематических тренировках на выносливость доля медленных волокон возрастает за счет быстрых, и существенную роль в этих превращениях играет опять-таки PGC-1α (рис. 1). В тренированных мышцах уровень PGC-1α выше, чем в нетренированных, даже в состоянии покоя, а поскольку он регулирует метаболизм и работу многих генов в миофибриллах, то физическая нагрузка может быть полезна при некоторых заболеваниях, связанных с нарушением мышечной активности. Исследования на мышах подтвердили, что PGC-1α действительно смягчает последствия миопатии Дюшенна и митохондриальной миопатии (истощении мышц при нарушении работы митохондрий).
Рис. 1. Роль PGC-1α в мышечных волокнах, тренированных на выносливость
А еще PGC-1α подавляет активность фактора NFκB, основного регулятора экспрессии провоспалительных генов. Следовательно, сидячий образ жизни провоцирует синтез провоспалительных цитокинов и развитие местных и системных воспалений, прискорбные последствия которых мы уже обсуждали.
Все мы слышали, что в здоровом теле здоровый дух. И это действительно так, потому что PGC-1α оберегает и от депрессии. Эта болезнь отравляет жизнь миллионам людей во всем мире. Депрессия связана с образованием кинуренина — продукта деградации триптофана — под действием стресса и воспаления. Синтез кинуренина происходит главным образом в почках, печени и клетках иммунной системы, но оттуда вещество попадает в кровь и мозг. Кинуренин вызывает гибель нейронов и воспаление нервной ткани, приводит к депрессии. Специалисты Каролинского университета (Швеция), экспериментируя с мышами, обнаружили, что PGC-1α усиливает синтез фермента кинуренин-аминотрансферазы в скелетных мышцах (Cell, 2014, 159, 33–45, doi: 10.1016/j.cell.2014.07.051 ). Этот фермент тоже попадает в кровь и превращает кинуренин в кинуреновую кислоту, которая не может преодолеть гематоэнцефалический барьер. Содержание кинуренина в плазме сокращается, что защищает мозг от повреждений и стресс-индуцированной депрессии. Исследователи не исключают, что PGC-1α можно использовать в терапевтических целях, но не полезнее ли заняться физкультурой?
Итак, физическая активность, в основном тренировки на выносливость, повышает уровень и активность PGC-1α, который благотворно влияет на многие жизненно важные процессы или уберегает нас от проблем со здоровьем. Кроме того, мышечные сокращения и PGC-1α активизируют синтез белков, которые влияют на процессы, происходящие как в мышечной ткани, так и в других органах, поэтому скелетную мускулатуру можно с полным правом считать органом внутренней секреции (рис. 2). Эти регуляторные белки называют миокинами. Список миокинов постоянно растет, причем в него нередко попадают соединения, уже известные нам в другом качестве, например интерлейкины — продукт синтеза лейкоцитов и непременные участники иммунного ответа.
Рис. 2. Мышечная ткань — орган внутренней секреции
Интерлейкины
В списке миокинов пока три интерлейкина: ИЛ-6, ИЛ-8 и ИЛ-15. ИЛ-6 и ИЛ-15 известны как факторы воспаления, кроме того, ИЛ-6 вызывает инсулиновую резистентность, а также при определенных условиях повышает уровень противовоспалительных цитокинов. ИЛ-8 отвечает за привлечение нейтрофилов и ангиогенез. В мышечных клетках у них другие задачи. Все три белка — типичные миокины, их синтез в скелетной мускулатуре и концентрация в плазме крови возрастают после физической нагрузки, причем на ИЛ-8 влияют в основном упражнения, при которых нагруженная мышца удлиняется.
ИЛ-6 действует на разные ткани. Он запускает каскады биохимических реакций, в результате чего мышечные клетки потребляют больше глюкозы и активно окисляют жирные кислоты, в жировой ткани усиливается липолиз, в печени — расщепление гликогена и образование глюкозы, в поджелудочной железе — секреция инсулина. Образование глюкозы в печени и выделение жирных кислот из адипозной ткани обеспечивают энергией работающие мышцы.
Роль ИЛ-8 в скелетной мускулатуре пока неизвестна, но есть основания полагать, что этот фактор стимулирует рост новых сосудов.
ИЛ-15 изначально известен как мышечный анаболик, он также вызывает синтез сократительных белков, способствует поглощению глюкозы и окислению жирных кислот, у крыс противодействует раковой кахексии (истощению). Чем выше концентрация этого миокина в плазме у людей, тем меньше у них белого жира, а у крыс он усиливает термогенез.
Нейротрофические факторы
Эти белки, как следует из названия, синтезируются в нервных клетках и регулируют их развитие и деятельность. Например, нейротрофический фактор мозга BDNF влияет на обучение и память, его нехватка связана с ожирением и диабетом 2-го типа. Однако после физических упражнений уровень BDNF в крови существенно возрастает, причем 70–80% этого количества потребляет мозг. В скелетной мускулатуре BDNF усиливает окисление жиров и регулирует регенерацию клеток.
Другой белок, цилиарный нейротрофический фактор CNTF, отвечает за работу остеобластов — клеток, которые строят костную ткань. У мышей, дефицитных по этому гену, кости массивные и плохо минерализованные. У граждан, ведущих малоподвижный образ жизни, при нехватке CNTF часто развивается остеопороз (нарушение метаболизма костной ткани, влекущее за собой их хрупкость). При кальцификации мышц и разрастании надкостницы физическая активность, напротив, вредна, потому что усиленный синтез CNTF только усугубит эти признаки.
Факторы роста
Факторы роста фибробластов регулируют деление, рост и дифференцировку клеток и клеточный метаболизм. Один из них, FGF21, синтезируется преимущественно в печени, а также в жировой ткани, поджелудочной железе и скелетной мускулатуре. В зависимости от места синтеза FGF21 выполняет разные функции. Печеночный стимулирует экспрессию PGC-1α, которая, в свою очередь, активирует окисление жирных кислот и синтез глюкозы в печени. В жировой ткани FGF21 увеличивает потребление глюкозы, а трансгенных мышей избыток FGF21 защищает от развития ожирения. Этот белок снижает у грызунов-диабетиков уровень сахара и триглицеридов в крови, то есть теоретически может быть лекарством.
Синтез FGF21 в скелетной мускулатуре зависит не от мышечной нагрузки, а от избытка инсулина или низкой температуры. В первом случае FGF21 регулирует уровень инсулина, во втором стимулирует термогенез в клетках бурого жира.
Три миокина и термогенез
Недавно в списке миокинов появились три новых члена: иризин, метеорин-подобный белок Metrnl и β-аминоизомасляная кислота (BAIBA). Все три миокина стимулируют термогенез в клетках бурого жира.
Иризин образуется при сокращении и дрожании скелетной мускулатуры, он участвует в преобразовании белого жира в бурый и усиливает термогенез, не давая разрастаться жировой ткани. Под влиянием физической нагрузки и PGC-1α иризин синтезируется также в гиппокампе, стимулируя синтез BDNF и нейрогенез в этой области мозга. У мышей иризин ускоряет метаболизм скелетных мышц и увеличивает расход энергии в мышечных клетках, а как обстоит дело у людей, еще предстоит выяснить.
Metrnl — гормон, синтез которого усиливается в клетках скелетной мускулатуры при упражнениях и в белой жировой ткани на холоде. В отличие от иризина синтез Metrnl зависит не от РGC-1α, а от его сплайсированной формы РGC-1α4, которая образуется при силовых тренировках и регулирует работу другого набора генов. Metrnl увеличивает расход энергии, увеличивает толерантность к глюкозе при ожирении и диабете и способствует побурению белого жира.
BAIBA, хотя и не белок, ведет себя как классический миокин: синтезируется в активных мышцах по сигналу РGC-1α, активирует термогенез и побурение белого жира и усиливает окисление жирных кислот в клетках печени. Содержание BAIBA в крови обратно пропорционально факторам риска сердечно-сосудистых и метаболических расстройств, и ученые предполагают, что он защищает от метаболического синдрома.
Двое против рака
Активный образ жизни не только снижает риск развития метаболических расстройств, но, возможно, защищает от некоторых типов злокачественных опухолей. Так, по данным Всемирного фонда исследования рака, физические упражнения снижают вероятность развития рака молочной железы и толстого кишечника на 25–30%. Ученые по-разному объясняют это влияние. В частности, два недавно обнаруженных миокина, SPARC и OSM, подавляют деление раковых клеток в толстом кишечнике и молочной железе и вызывают их апоптоз. Какую роль выполняют эти белки в здоровом теле, пока неясно. Возможно, они регулируют деление и апоптоз клеток в сокращающихся мышечных волокнах, но не исключено, что действие SPARC и OSM на нераковые клетки вообще не связано с их делением и гибелью.
Список миокинов получился длинным и, возможно, утомил читателя. Однако он был бы неполным без миостатина, который можно назвать антимиокином: мышечные сокращения не стимулируют, а подавляют его синтез.
Мутация Геракла
Миостатин (MSTN) относится к группе факторов роста. Он синтезируется в неактивных мышцах и препятствует образованию мышечной ткани: горы мускулов, если ими не пользоваться, только напрасно поглощают энергию. Регулярные физические тренировки, как силовые, так и аэробные на выносливость, подавляют синтез миостатина, что способствует образованию рельефной мускулатуры. Ген MSTN очень консервативен, его последовательность у всех позвоночных практически одинакова. У лабораторных мышей, лишенных гена MSTN, масса мышечной ткани в два-три раза больше, чем у грызунов дикого типа. Мутации MSTN, нарушающие синтез белка, приводят к появлению чрезвычайно мясистых коров и овец с гипертрофированной мускулатурой. У всех миостатиновых мутантов понижено содержание жировой ткани. По-видимому, жировая масса уменьшилась главным образом вследствие увеличения мышечной, а не из-за отсутствия миостатина.
Рис. 3. Уиппеты дикого типа (+/+), а также гетерозиготные и гомозиготные по мутации mh, инактивирующей ген MSTN
Исследователи планировали поискать подобную мутацию у других видов. А медики из Германии и Соединенных Штатов несколькими годами ранее наблюдали чрезвычайно мускулистого мальчика, родившегося в берлинской клинике Шарите (The New England Journal of Medicine, 2004, 350, 2682-8, doi: 10.1056/NEJMoa040933 ). Новорожденный поразил специалистов развитой мускулатурой рук и ног, к четырем с половиной годам мальчик продолжал наращивать мышечную массу и мог держать на вытянутой руке трехкилограммовую гантель (рис. 4). Мальчик пока здоров.
Рис. 4. Мальчик с неактивным геном миостатина. Справа — новорожденный, слева — в возрасте семи месяцев. Обратите внимание на рельефные мышцы икр и бедер
В гене миостатина у малыша нашли мутацию, но не такую, как у собак; это замена одного нуклеотида, которая нарушает сплайсинг РНК и приводит к образованию неактивного белка. Эту мутацию мальчик, очевидно, получил по наследству. Хотя исследователи не смогли проанализировать ДНК его родных, известно, что брат, отец и дед матери отличались необыкновенной силой. Как тут не вспомнить Геракла, который в первый же день жизни задушил голыми руками двух змей одновременно, может, и он был мутантом?
Проводя жизнь в кресле, мы лишаем себя множества полезных белков, которые могли бы синтезировать наши мышцы. Время не упущено — заняться физкультурой никогда не поздно. Мы даже не можем себе представить в полной мере, насколько это полезно, потому что исследования миокинов продолжаются.

Разница между актином и миозином - Разница Между
Содержание:
Главное отличие - актин против миозина
Мышцы состоят из белков. Актин и миозин - два белка в мышцах, участвующие в сокращении мышц у животных. Они контролируют произвольные мышечные движения тела в сочетании с регуляторными белками, известными как тропомиозин, тропонин и меромиозин. Белки актина и миозина образуют нити, расположенные в миофибриллах в продольном направлении. главное отличие между актином и миозином в том, что актин образует тонкую нить, а миозин - толстую нить, Скольжение двух нитей друг над другом в серии повторяющихся событий приводит к сокращению мышц.
Ключевые области покрыты
1. Что такое актин
- определение, структура, функции
2. Что такое миозин
- определение, структура, функции
3. Каковы сходства между актином и миозином
- Краткое описание общих черт
4. В чем разница между актином и миозином
- Сравнение основных различий
Ключевые слова: сократительная нить, F-актин, G-актин, сокращение мышц, миозин, полимеризация.

Что такое актин
Актин относится к белку, который образует тонкую сократительную нить в мышечных клетках. Это самый распространенный белок в эукариотических клетках. Актин является высоко консервативным белком. Две формы актина являются мономерными (G-актин) и нитевидные (F-актин). В физиологических условиях G-актин легко полимеризуется с образованием F-актина с использованием энергии АТФ. Образование тонкой актиновой нити показано на Рисунок 1.

Рисунок 1: Формирование тонкой актиновой нити
Хотя полимеризация нитей актина начинается с обоих концов нити, скорость полимеризации на каждом конце не равна. Это приводит к внутренней полярности в нити. Быстро полимеризующийся конец называется заостренным (+) концом, а медленный полимеризующийся конец - заостренным (-) концом. Ассоциация тропомиозина и тропонина стабилизирует актиновую нить. Субдомены G-актина показаны в фигура 2.

Рисунок 2: Субдомены G-Actin
Форма и движение клетки зависят от актиновых филаментов. Основной функцией актиновых филаментов является формирование динамического цитоскелета клетки. Цитоскелет оказывает структурную поддержку и связывает внутреннюю часть клетки с окружающей средой. Актиновые филаменты также участвуют в образовании филоподий и ламеллоподий, которые способствуют подвижности клеток. Актиновые филаменты помогают в транспортировке органелл к дочерним клеткам во время митоза. Комплекс тонких нитей в мышечных клетках генерирует силы, поддерживающие сокращение мышц.
Что такое миозин
Миозин относится к белку, который образует толстые сократительные волокна в мышечных клетках. Все молекулы миозина состоят из одной или двух тяжелых цепей и нескольких легких цепей. В этом белке можно выделить три домена: голова, шея и хвост. Головной домен является глобулярным и содержит сайты связывания актина и АТФ. Область шеи содержит α-спираль. Хвостовой сайт содержит сайты связывания для разных молекул. Структура миозина показана в рисунок 3.

Рисунок 3: миозин
Тринадцать различных классов миозина могут быть идентифицированы как миозин I, II, III, IV и т. Д. миозин I участвует в транспорте везикул. миозин II отвечает за сокращение мышц. Структура скелетной мышцы показана на рисунок 4.

Рисунок 4: Структура скелетных мышц
Сокращение мышц описывается теорией скользящей нити. Тонкие нити актина скользят по толстой нити миозина, создавая напряжение в мышцах.
Сходства между актином и миозином
- И актин, и миозин являются белковыми молекулами в мышцах.
- И актин, и миозин являются типом моторных белков.
- И актин, и миозин образуют сократительные нити.
- Актин и миозин участвуют в сокращении мышц.
Разница между актином и миозином
Определение
актин: Актин относится к белку, который образует тонкую сократительную нить в мышечных клетках.
миозин: Миозин относится к белку, который образует толстые сократительные волокна в мышечных клетках.
Размер нити
актин: Актин образует тонкую (0,005 мкм) короткую (2 - 2,6 мкм) нить.
миозин: Миозин образует толстую (0,01 мкм) длинную (4,5 мкм) нить.
Регуляторные белки
актин: Актиновые филаменты состоят из тропомиозина и тропонина.
миозин: Миозиновые филаменты состоят из меромиозина.
Место нахождения
актин: Актиновые филаменты встречаются в полосах А и I.
миозин: Миозиновые филаменты обнаружены в полосах саркомера.
Крест мосты
актин: Актиновые филаменты не образуют поперечных мостиков.
миозин: Миозиновые филаменты образуют поперечные мостики.
поверхность
актин: Поверхность актиновых филаментов гладкая.
миозин: Поверхность миозиновых нитей шероховатая.
Число
актин: Актиновых филаментов очень много.
миозин: Одна нить миозина встречается на шесть актиновых нитей.
концы
актин: Актиновые филаменты свободны на одном конце.
миозин: Миозиновые нити свободны на обоих концах.
скольжение
актин: Актиновые филаменты скользят в зоне H во время сокращения.
миозин: Миозиновые нити не скользят во время сокращения.
Заключение
Актин и миозин - это два типа белков, которые образуют сократительные волокна в мышечных клетках. Актин образует тонкие и короткие нити, в то время как миозин образует толстые и длинные нити. Как актин, так и миозин находятся в других эукариотических клетках, образуя цитоскелет и участвуя в движении молекул. Основное различие между актином и миозином заключается в типе филаментов, образуемых каждым белком.

Взаимодействие мышечных белков лежит в основе нашего нынешнего понимания сокращения саркомера. Как оно происходит? Это как-то связано со скользящим взаимодействием между актином и миозином.
Основные понятия
Перед тем, как углубиться в физиологию, ознакомимся с основной терминологией.
На электронной микрофотографии тонкого среза мышечных волокон изображена группа нитей.
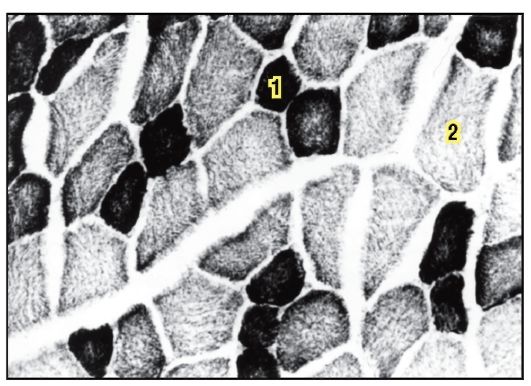
Рисунок 1. 1 — тонкие нити (I тип, красные нити) — не интенсивная, длительная работа.
2 — толстые нити (II тип, белые нити) — интенсивная и кратковременная работа.
Каждый массив нитей — миофибрилла — имеет форму цилиндра, внутри которого чередуются пучки тонких и толстых нитей. Внутри волокна нити находятся в строгом порядке, так что области с одинаковой плотностью находятся рядом друг с другом, за счет чего волокно имеет характерную полосатую окраску в поляризованном световом микроскопе. Единица между двумя темными полосами — саркомер.
В продольном разрезе группы миофибрилл имеется полоса низкой плотности, называемая I-полосой. В центре I-полосы имеется заметная плотная линия, называемая Z-диском. Область между двумя линиями Z — саркомером — может считаться основной структурной и функциональной единицей, непосредственно ответственной за сокращение мышц. Таким образом, миофибриллу можно рассматривать как группу саркомеров.
Группа миофибрилл образует симпласт. На поверхности мышечной клетки плазматическая мембрана (сарколемма) образует впячивания, где формируется система Т-трубочек, обеспечивающая сокращение миоцитов. Представляет собой сеть взаимосвязанных колец, каждое из которых окружает миофибриллу и обеспечивает важный путь коммуникации между наружной частью волокна и миофибриллами, которые расположены глубоко внутри волокна.
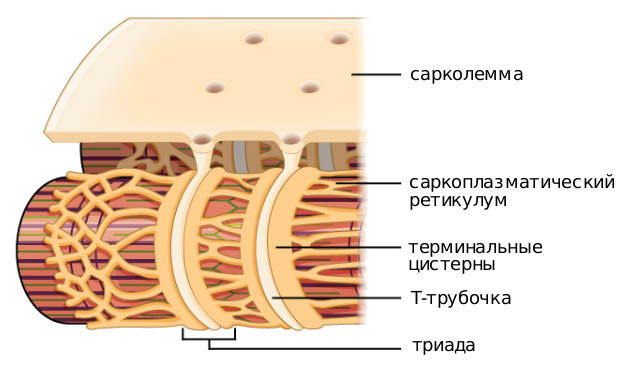
Другая мембранная система, которая окружает каждую миофибриллу — саркоплазматический ретикулум, образующий ряд закрытых мешковидных мембран. Участок, контактирующий с Т-трубочкой, образует увеличенный мешок, называемый терминальной цистерной. У большинства позвоночных каждая Т-трубочка имеет две цистерны, тесно связанные с ней, образуя трехэлементный комплекс, называемый триадой. Количество триад на саркомер зависит от вида. Например, в мышце лягушки есть одна на триаду, а в мышцах млекопитающих — две. У рыб и ракообразных только одна цистерна связана с каждой поперечной трубочкой, образуя диаду.
Мышечные белки
Основной составляющей толстых нитей является миозин. Каждая толстая нить состоит из около 250 молекул миозина. Миозин играет две важные роли: структурную как строительный блок для толстых нитей и функциональную как катализатор распада АТФ во время сокращения и взаимодействия с актином в составе силового генератора мышц. Хвост длиной около 120 нм состоит из двух цепей белка, каждая из которых намотана на так называемую α-спираль, вместе образуя структуру спиральных катушек. На другом конце молекулы две белковые цепи образуют две глобулярные головные области, которые обладают способностью сочетаться с белковым актином и несут ферментативные сайты для гидролиза АТФ.
В средней части толстой нити молекулы собраны в хвост-хвост. Вдоль остальной части нити наматываются с головы до хвоста. Хвостовые части молекул образуют сердцевину нити; головные части выступают из нити.
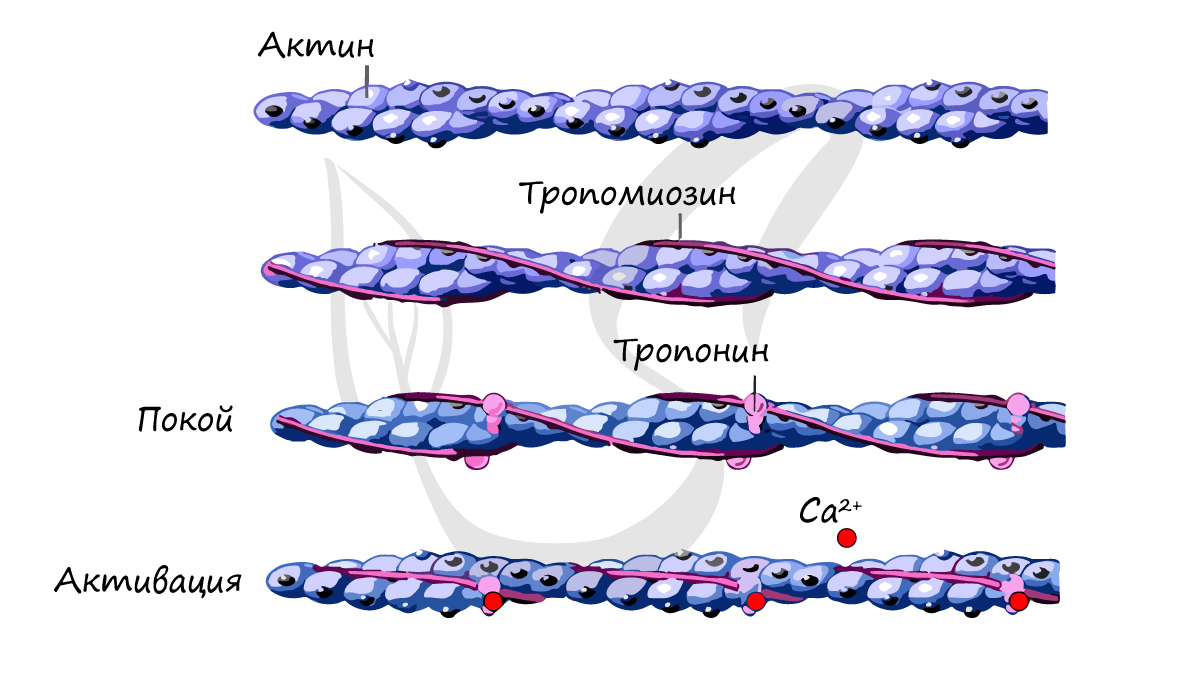
Тонкие нити содержат три разных белка: актин, тропомиозин и тропонин. Актин, составляющий около 25 % белка миофиламентов, является основным компонентом тонких нитей в мышцах. Актиновые молекулы повторяются каждые 2,75 нм вдоль тонкой нити. Они создают спиральную структуру, которая может рассматриваться как двойная или одинарная спираль.
Тропомиозин представляет собой стержнеобразную молекулу длиной около 40 нм. Имеет структуру, аналогичную структуре хвоста миозина, являющейся спиральным звеном двух белковых цепей. Каждая молекула тропомиозина находится в контакте с семью актиновыми единицами.
Тропонин представляет собой комплекс из трех различных субъединиц белка: I, T и C. Тропонин С может связывается с кальциевыми ионами. Тропонин T присоединяется к тропомиозину, образуя с ним тропонин-тропомиозиновый комплекс. Тропонин I соединяется с актином в тонких филаментах. Один тропониновый комплекс связан с каждой молекулой тропомиозина. Молекула тропонина расположена примерно каждые 40 нм вдоль нити.
Тропонин и тропомиозин участвуют в регуляции сокращения и расслабления мышц. Одной из субъединиц является рецептор для Ca 2+ , высвобождаемый из саркоплазматического ретикулума при активации мышцы. Считается, что связывание кальция затем приводит к дальнейшим структурным изменениям взаимодействия актина, тропомиозина и другой субъединицы тропонина, которые приводят к сокращению путем активации взаимодействия актин-миозин.
Историческая справка

Механизм сжатия
Когда нервный импульс от головного и спинного мозга переносится по двигательному нейрону в мышечное волокно, Ca 2+ ионы высвобождаются в терминальном аксоне.
Увеличение концентрации ионов кальция стимулирует высвобождение нейротрансмиттера ацетилхолина в синаптической щели.
Нейротрансмиттер связывается с рецептором на сарколемме, происходит деполяризация, и генерируется потенциал действия через мышечное волокно для сокращения мышц. Потенциал действия распространяется по всему мышечному волокну и перемещается в соседние волокна вдоль Т-трубочек.
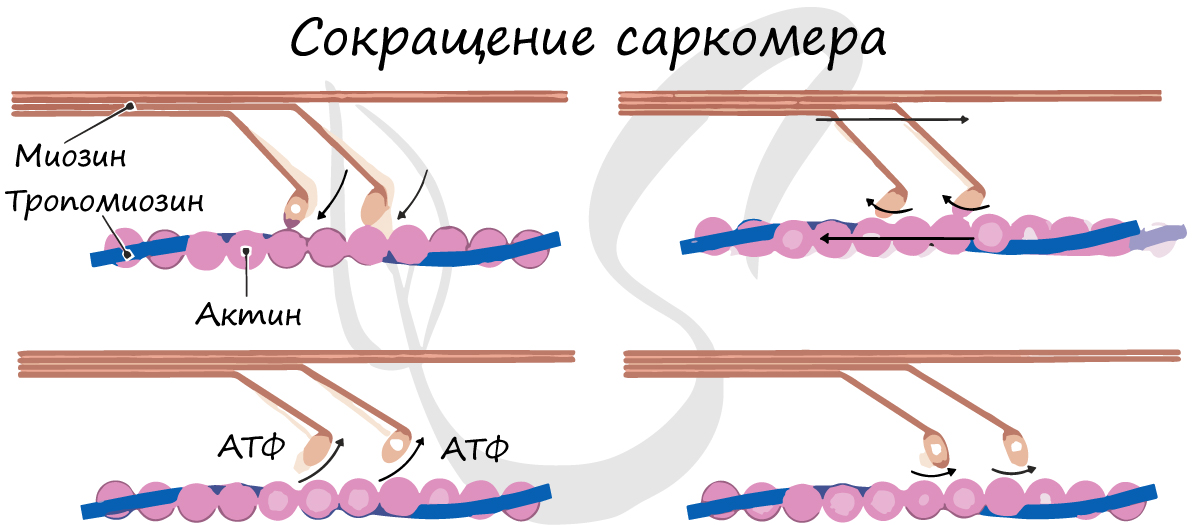
Инициируется выделение ионов кальция из саркоплазматического ретикулума, которые стимулируют сокращение мышц. Последовательность сокращения мышц, объясняемая моделью скользящих нитей, выглядит следующим образом:
1. Блокировка головной части миозина:
Актин и миозин перекрывают друг друга, образуя поперечный мостик. Поперечный мостик активен только тогда, когда головка миозина прикреплена, как крючок, к нити актина. Когда мышца находится в состоянии покоя, перекрытие актиновой нити к головке миозина блокируется тропомиозином. Миофиламент актина находится в положении покоя.
2. Выделение иона кальция:
Нервный импульс, вызывающий деполяризацию и потенциал действия в сарколемме, вызывает выброс ионов кальция. Ион кальция связывается с тропониновым комплексом на нити актина, сдвигая тропомиозин из его места блокировки. Миофиламент актина находится в активном положении.
3. Поперечный мостик:
Поперечный мостик между актином и миозином действует как фермент (миозин АТФ-аза), который гидролизует АТФ, хранящийся в головке миозина, в АДФ, вследствие чего высвобождается энергия. Эта освобожденная энергия используется для перемещения головки миозина в направлении актиновой нити. Головка миозина наклоняется и тянет актиновую нить так, что миозин и актиновая нить скользят друг к другу. Противоположные концы нитей актина в саркомере движутся в направлении друг к другу, что приводит к сокращению мышцы. После сближения поперечный мостик отсоединяется, а актин и миозиновая нить возвращаются в исходное положение.

Аналогия, наглядно иллюстрирующая теорию
Представьте, что вы стоите между двумя большими шкафами с книгами. Они находятся на расстоянии нескольких метров друг от друга и расположены на рельсах, так что их можно легко перемещать. Вам дается задача объединить два книжных шкафа, но вы ограничены использованием только ваших рук и двух веревок. Стоя в центре между книжными шкафами, вы тянете за две веревки (по одной на руку), которые надежно привязаны к каждому книжному шкафу. Повторяющимися движениями вы подтягиваете каждую веревку к себе, перехватываете ее, а затем снова тянете. В конце концов книжные шкафы движутся вместе и приближаются к вам. В этом примере ваши руки похожи на молекулы миозина, веревки — это актиновые нити, а книжные шкафы — это z-диски, на которых закреплен актин и которые составляют боковые концы саркомера. Подобно тому, как вы остаетесь в центре между книжными шкафами, миозиновые нити остаются центрированными во время нормального сокращения мышц.
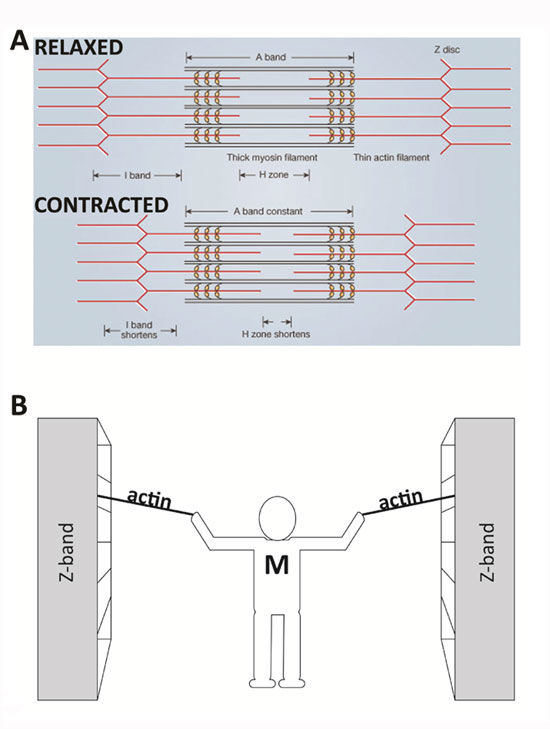
Регуляция
АТФ поставляет энергию, как и было описано выше, но что делает кальций? Кальций требуется двум белкам (тропонину и тропомиозину), которые регулируют сокращение мышц. В покоящемся саркомере тропомиозин блокирует связывание миозина с актином. В вышеупомянутой аналогии вытягивания шкафов тропомиозин будет мешать вашей руке, поскольку он будет удерживать актин-веревку.
В 1994 году Уильям Леман и его коллеги продемонстрировали, как тропомиозин вращается, изучая форму актина и миозина в богатых кальцием растворах и растворах, содержащих низкий уровень кальция (Lehman, Craig, & Vibertt, 1994). Сравнивая действие тропонина и тропомиозина в этих двух условиях, они обнаружили, что присутствие кальция является существенным для механизма сжатия. В отсутствие свободного кальция связывание актина и миозина не происходит, поэтому наличие свободного кальция является важным регулятором мышечного сокращения.
Нерешённые вопросы
Мышечные ткани - это ткани, для которых способность к сокращению является главным свойством. Мышечные ткани составляют активную часть опорно-двигательного аппарата (пассивной частью являются кости, соединения костей).
Общими свойствами всех мышечных тканей является сократимость и возбудимость. К данной группе тканей относятся гладкая, поперечнополосатая скелетная и поперечнополосатая сердечная мышечные ткани. Клетки мышечной ткани имеют хорошо развитый цитоскелет, содержат много митохондрий.
Гладкая (висцеральная) мускулатура
Эта мышечная ткань встречается в стенках внутренних органах (бронхи, кишечник, желудок, мочевой пузырь), в стенках сосудов, протоках желез. Эволюционно является наиболее древним видом мускулатуры.
Состоит из веретенообразных миоцитов - коротких одноядерных клеток. Между клетками имеются межклеточные контакты - нексусы (лат. nexus - связь). Благодаря нексусам возбуждение, возникшее в одной клетке, волнообразно распространяется на все остальные клетки.
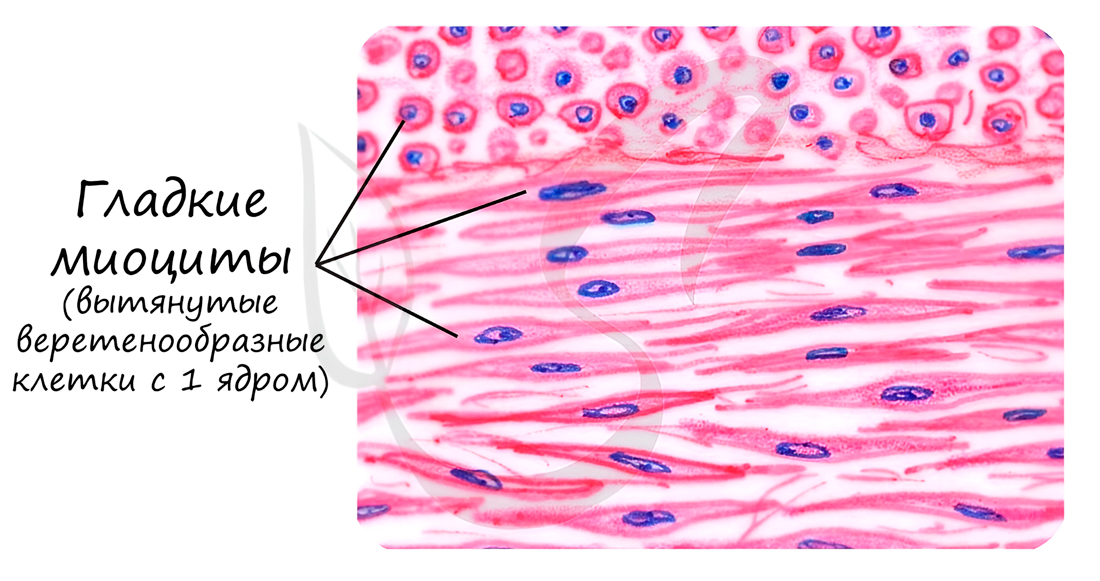
Гладкая мышечная ткань отличается своей способностью к длительному тоническому напряжению, что очень важно для работы внутренних органов (к примеру мочевого пузыря), сокращается медленно, практически не утомляется. Скелетная мышечная ткань, которую мы изучим чуть позже, такой способностью не обладает - сокращается и утомляется быстро.
Осуществляется сокращение с помощью клеточных органоидов - миофиламентов, которые расположены в клетке хаотично и не имеют такой упорядоченной структуры, как миофибриллы в скелетной мускулатуре (все познается в сравнении, уже скоро мы их тоже изучим).
Особо заметим, что в гладкой мышечной ткани миофиламенты собираются в миофибриллы только во время сокращения. У таких временных миофибрилл не может быть регулярной организации, а значит ни у таких миофибрилл, ни у гладких миоцитов не может быть поперечной исчерченности.
Гладкая мышечная ткань сокращается непроизвольно (неподвластна воле человека). Работа гладких мышц обеспечивается вегетативной (автономной) нервной системой. К примеру невозможно по желанию сузить или расширить бронхи, кровеносные сосуды, зрачок.
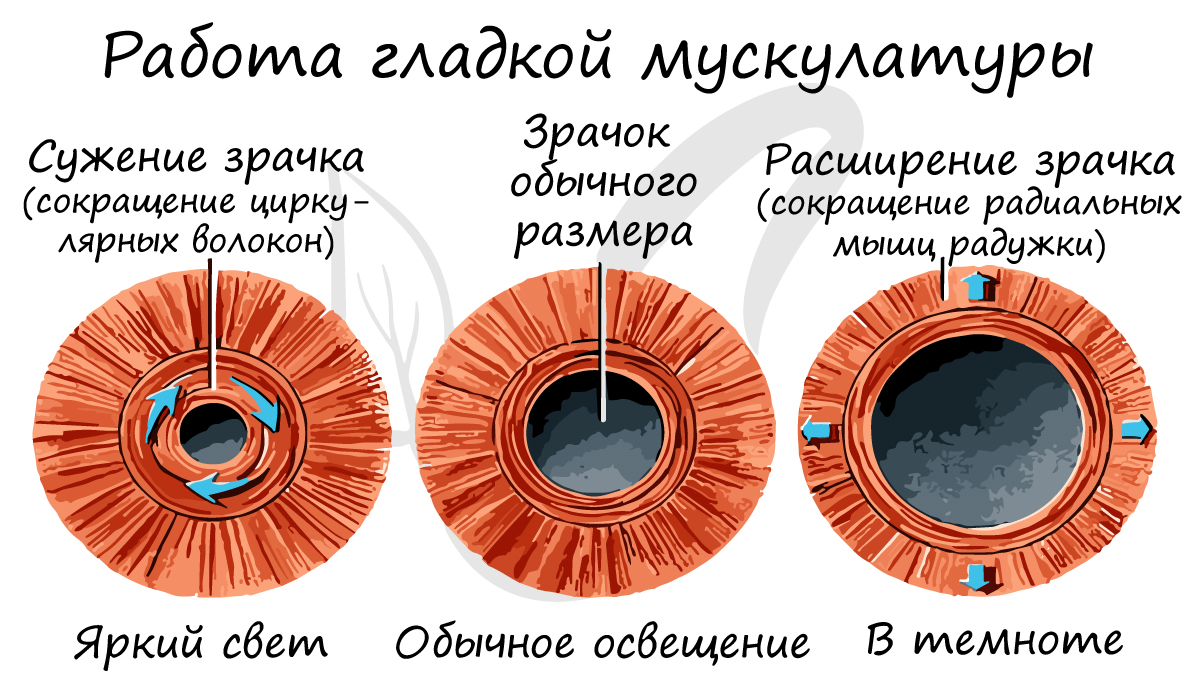
Гладкая мышечная ткань называется неисчерченной, так как не обладает поперечной исчерченностью, характерной для поперечнополосатых скелетной и сердечной мышечных тканей.
Скелетная (поперечнополосатая) мышечная ткань
Скелетная мышечная ткань образует диафрагму (дыхательную мышцу), мускулатуру туловища, конечностей, головы, голосовых связок.
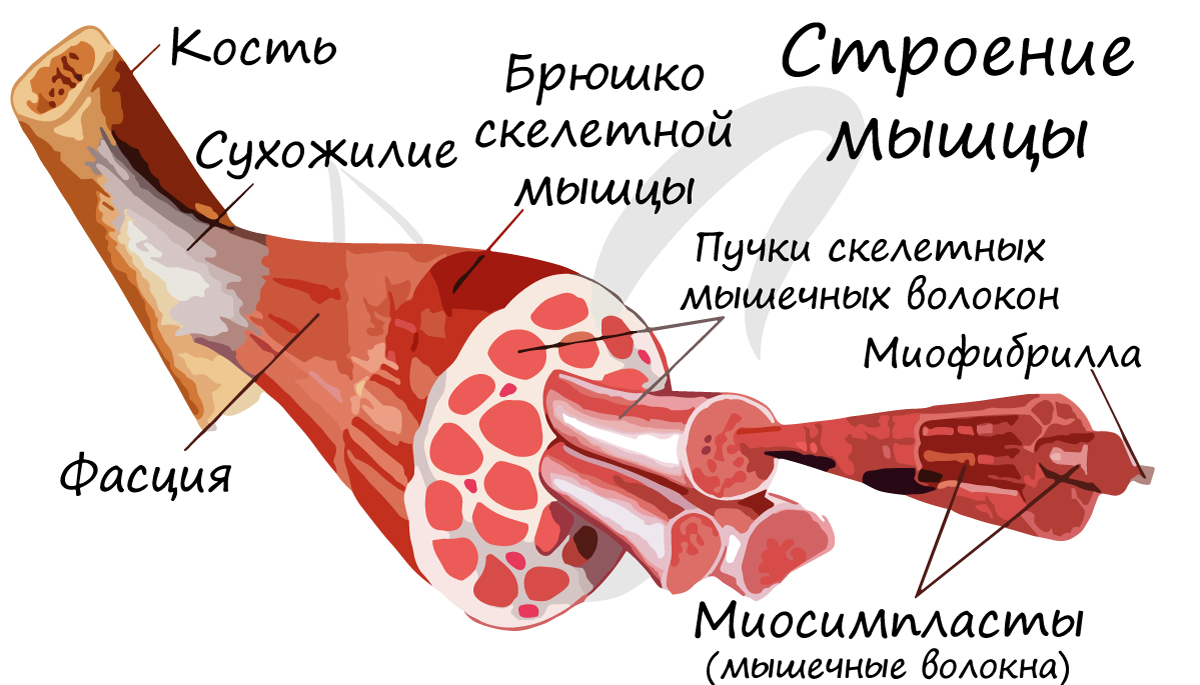
В отличие от гладкой мускулатуры, скелетная образована не отдельными одноядерными клетками, а длинными многоядерными волокнами, имеющими до 100 и более ядер - миосимпластами. Миосимпласт (греч. sim - вместе + plast - образованный) представляет совокупность слившихся клеток, имеет длину от нескольких миллиметров до нескольких сантиметров (соответствует длине мышцы).
Внутри миосимпласта находится саркоплазма, снаружи миосимпласт покрыт сарколеммой. Сократительные элементы - миофибриллы (лат. fibra - волоконце) - длинные тяжеобразные органеллы в миосимпласте (около 1400).
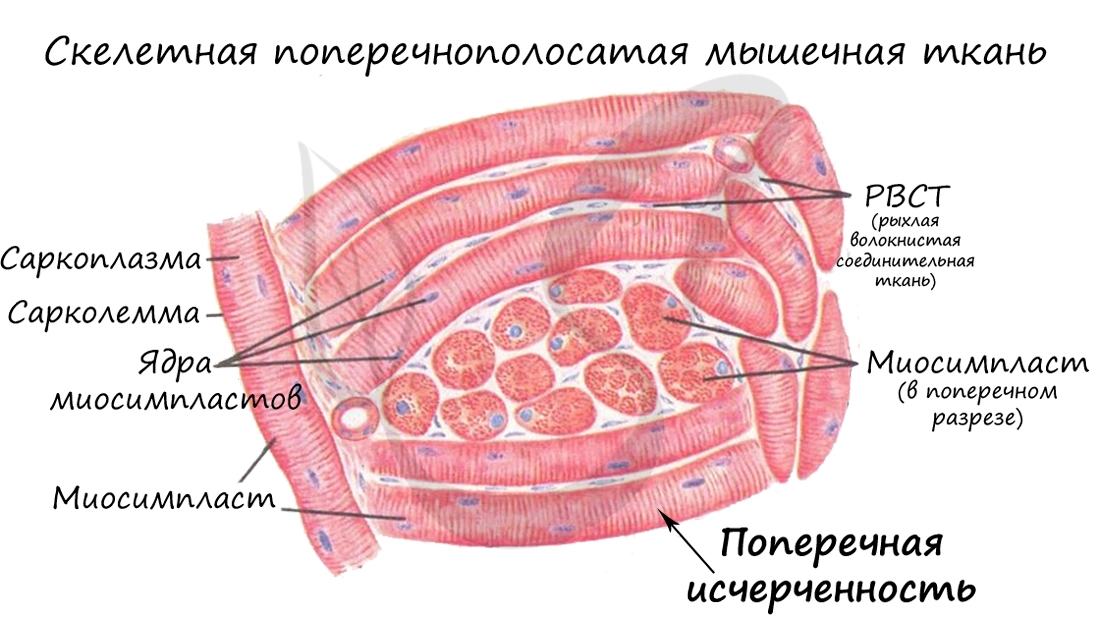
Характерная черта данной ткани - поперечная исчерченность, выражающаяся в равномерном чередовании светлых и темных полос на мышечном волокне. Это происходит потому, что границы саркомеров в соседних миофибриллах совпадают, вследствие чего все волокно приобретает поперечную исчерченность. Теперь самое время изучить микроскопическую основу мышцы - саркомер.
Саркомер (от греч. sarco - мясо (мышца) + mere - маленький)
Саркомер - элементарная сократительная единица поперечнополосатых мышц, структурная единица миофибриллы. В состав саркомера (и миофибриллы в целом) входят миофиламенты (лат. filamentum - нить) двух типов, которые обеспечивают сократимость мышечной ткани.
Саркомер состоит из актиновых (тонких) и миозиновых (толстых) филаментов, которые образованы главным образом белками актином и миозином. Сокращение происходит за счет взаимного перемещения миофиламентов: они тянутся навстречу друг другу, саркомер укорачивается (и мышца в целом).
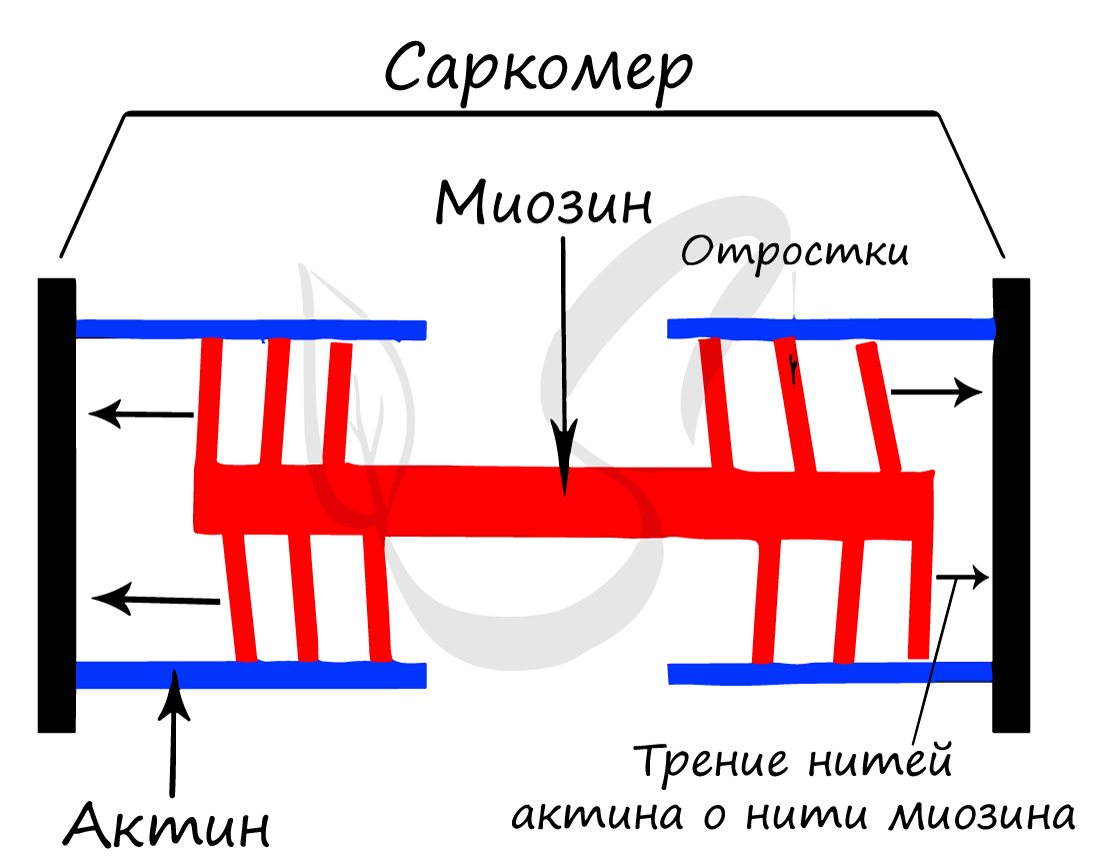
Источником энергии для сокращения служат молекулы АТФ. К тому же невозможно представить сокращение мышц без участия ионов кальция: именно они связываются с тропонином, что приводит к изменению конформации тропомиозина (тропонин и тропомиозин - регуляторные белки между нитями актина), за счет чего становится возможно соединение актина и миозина. При сокращении мышц выделяется тепло (сократительный термогенез).
Замечу, что трупное окоченение (лат. rigor mortis) - посмертное затвердевание мышц - связано именно с ионами кальция, которые устремляются в область низкой концентрации (в саркоплазму миосимпласта), способствуя связыванию актина и миозина.
После смерти в мышце перестает синтезироваться АТФ, ее уровень быстро снижается. Как следствие этого перестает функционировать Ca-АТФаза - насос, выкачивающий ионы Ca из саркоплазмы в саркоплазматический ретикулум (мембранная органелла мышечных клеток (сходная с ЭПС), в которой запасаются ионы Ca).
В саркоплазме повышается концентрация ионов Ca - замыкаются мостики между актином и миозином, однако разомкнуться они уже не могут, в связи с чем наблюдается стойкая мышечная контрактура (лат. contractura - стягивание, сужение): конечности очень сложно разогнуть или согнуть.
Вернемся к скелетным мышцам. Имеется еще ряд важных моментов, о которых нужно знать.
В процесс возбуждения вовлекается изолированно один миосимпласт, соседние миосимпласты (волокна) не возбуждают друг друга, в отличие от гладких миоцитов, где возбуждение предается между соседними клетками через нексусы. Скелетные мышцы сокращаются быстро и быстро утомляются (у гладких мышц фазы сокращения и расслабления растянуты во времени, мало утомляются) .
Скелетные мышцы сокращаются произвольно: они подконтрольны нашему сознанию. К примеру, по желанию мы можем изменить скорость движения руки, темп бега, силу прыжка. Мышцы покрыты фасцией, крепятся к костям сухожилиями, и, сокращаясь, приводят в движение суставы.
Сердечная поперечнополосатая мышечная ткань
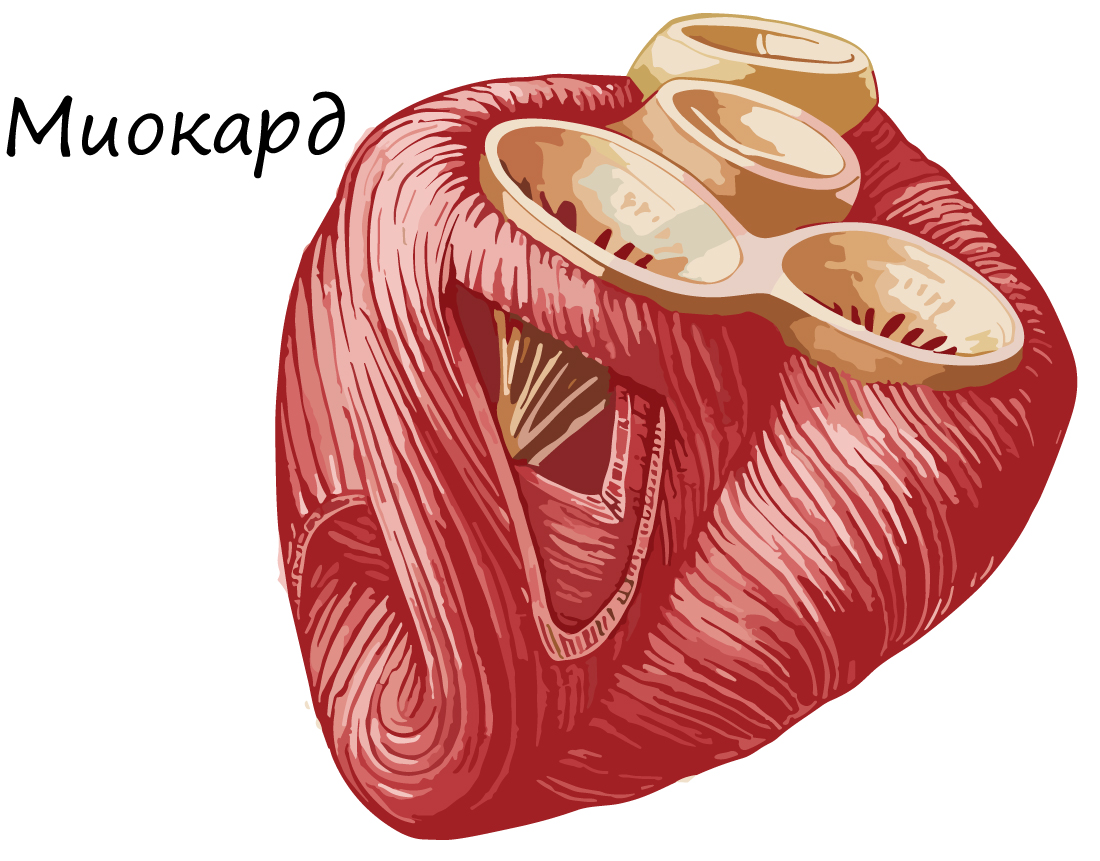
Сердечная мышечная ткань состоит из кардиомиоцитов - одиночных клеток, имеющих поперечную исчерченность. Соединяясь друг с другом, кардиомиоциты образуют функциональные волокна.
Этот тип мышечной ткани удивительным образом сочетает свойства двух предыдущих, изученных нами, тканей (возбудимость, сократимость) и имеет одно новое уникальное свойство - автоматизм.
Автоматизм - способность сердечной мышечной ткани возбуждаться и сокращаться самопроизвольно, без влияний извне. Это легко можно подтвердить, наблюдая сокращения изолированного сердца лягушки в физиологическом растворе: сокращения сердца в нем будут продолжаться несколько десятков минут после отделения сердца от организма.
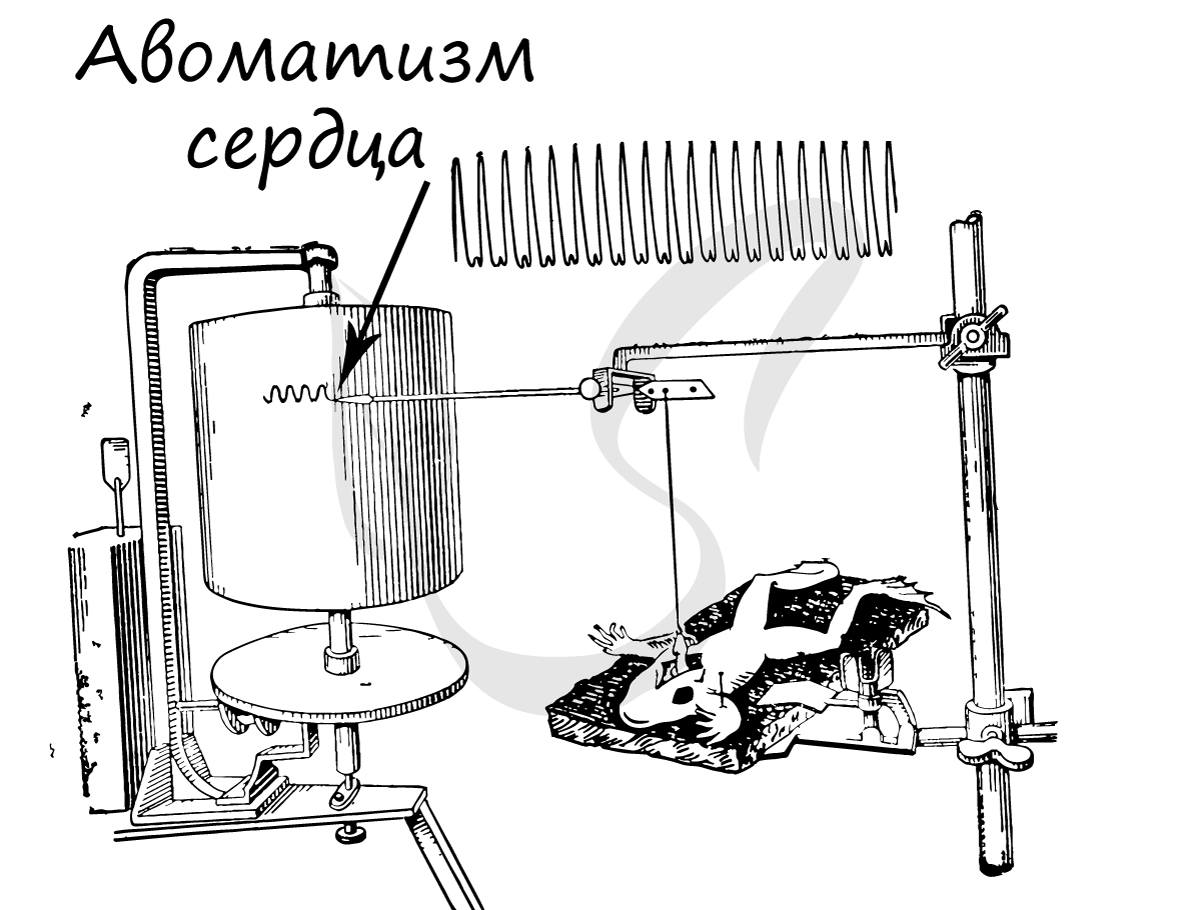
Места контактов соседних кардиомиоцитов - вставочные диски (в их составе находятся нексусы), благодаря которым возбуждение одной клетки передается на соседние, таким образом волнообразно охватываются возбуждением и сокращаются новые участки миокарда.
Большое число контактов между кардиомиоцитами обеспечивает высокую эффективность и надежность проведения возбуждения по миокарду. Сокращается эта ткань непроизвольно, не утомляется.
На рисунке или микропрепарате узнать данную ткань можно по центральному положению ядер в клетках, поперечной исчерченности, наличию вставочных дисков и анастомозов (греч. anastomosis - отверстие) - мест соединений боковых поверхностей функциональных волокон (кардиомиоцитов).

В норме возбуждение проводится по проводящей системе сердца от предсердий к желудочкам (однонаправленно). Участок сердечной мышцы, в котором генерируются импульсы, определяющие частоту сердечных сокращений - водитель сердечного ритма.
Автоматизм возможен благодаря наличию в миокарде особых пейсмекерных (англ. pacemaker - задающий ритм) клеток, которые также называют водителями ритма. Они спонтанно генерируют нервные импульсы, которые охватывают весь миокард, в результате чего осуществляется сокращение. Именно благодаря водителям ритма сердце лягушки продолжает биться, будучи полностью отделенным от тела.
Ответ мышц на физическую нагрузку
Физические нагрузки приводят к гипертрофии мышц (от др.-греч. ὑπερ- чрез, слишком + τροφή - еда, пища) - в них увеличивается количество мышечных волокон, объем мышечной массы нарастает.

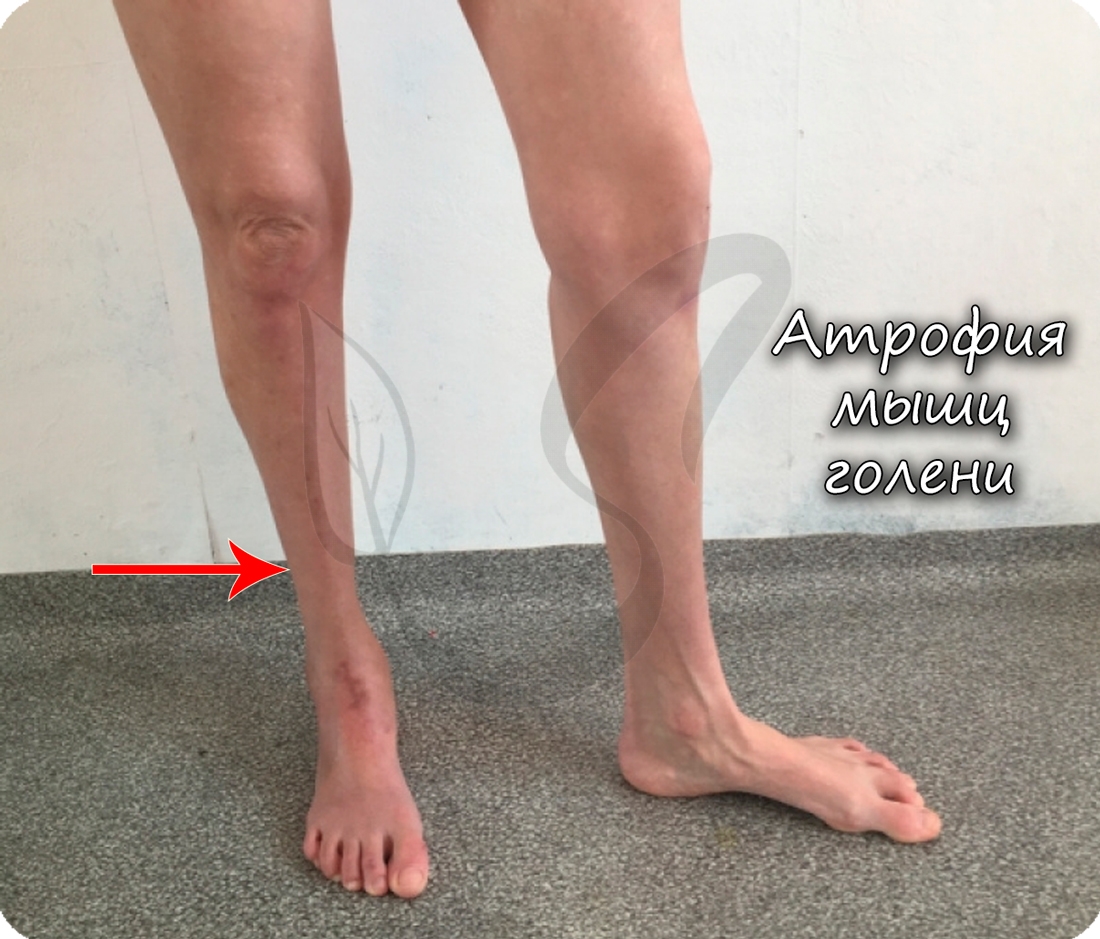
В условиях гиподинамии (от греч. ὑπό - под и δύνᾰμις - сила), то есть пониженной активности, мышцы уменьшаются вплоть до полной атрофии (греч. а – "не" + trophe – питание). В худшем случае волокна мышечной ткани перерождаются в соединительную ткань, после чего пациент становится обездвиженным.
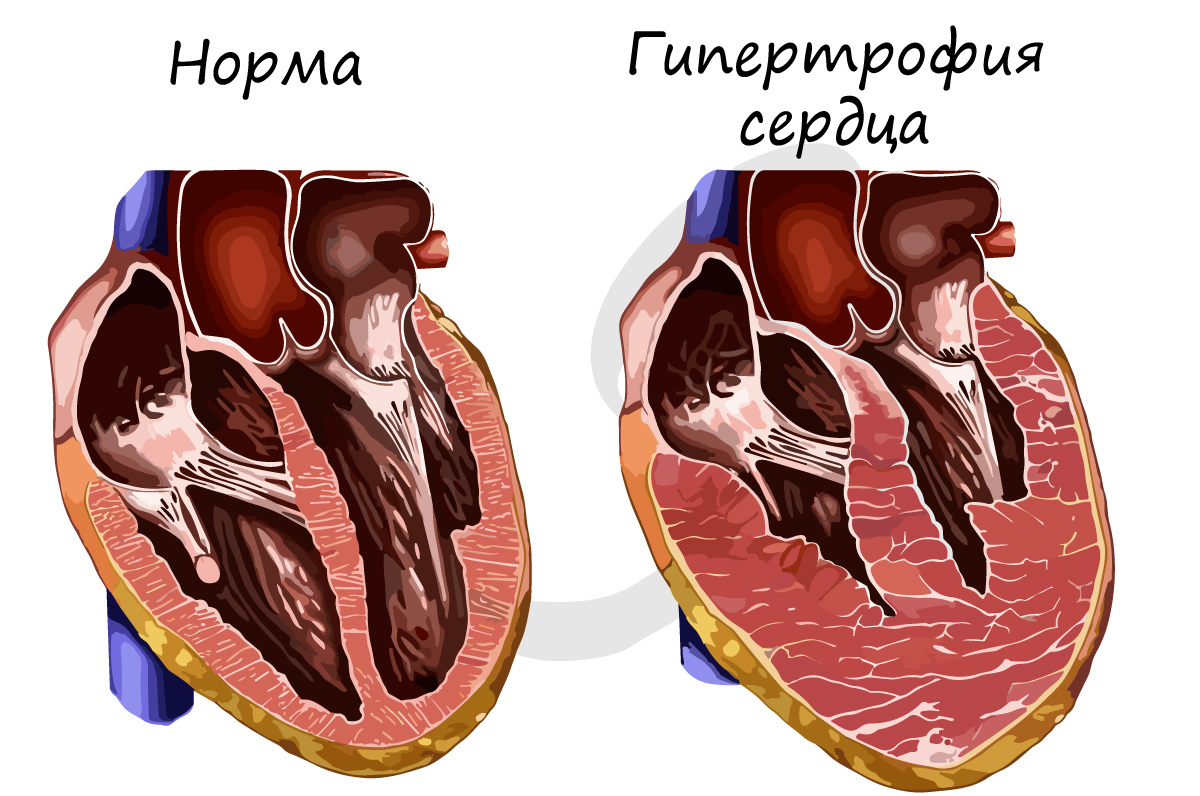
Необходимо отметить, что сердечная мышечная ткань также дает ответную реакцию на чрезмерную нагрузку: сердце увеличивается в размере, нарастает масса миокарда. Причиной могут быть генетические заболевания, повышенное артериальное давление. Гипертрофия сердца - состояние, требующее вмешательства врача и наблюдения за пациентом.
В большинстве случае гипертрофия сердца обратима, а у спортсменов наблюдается так называемая физиологическая гипертрофия (вариант нормы).
Происхождение мышц
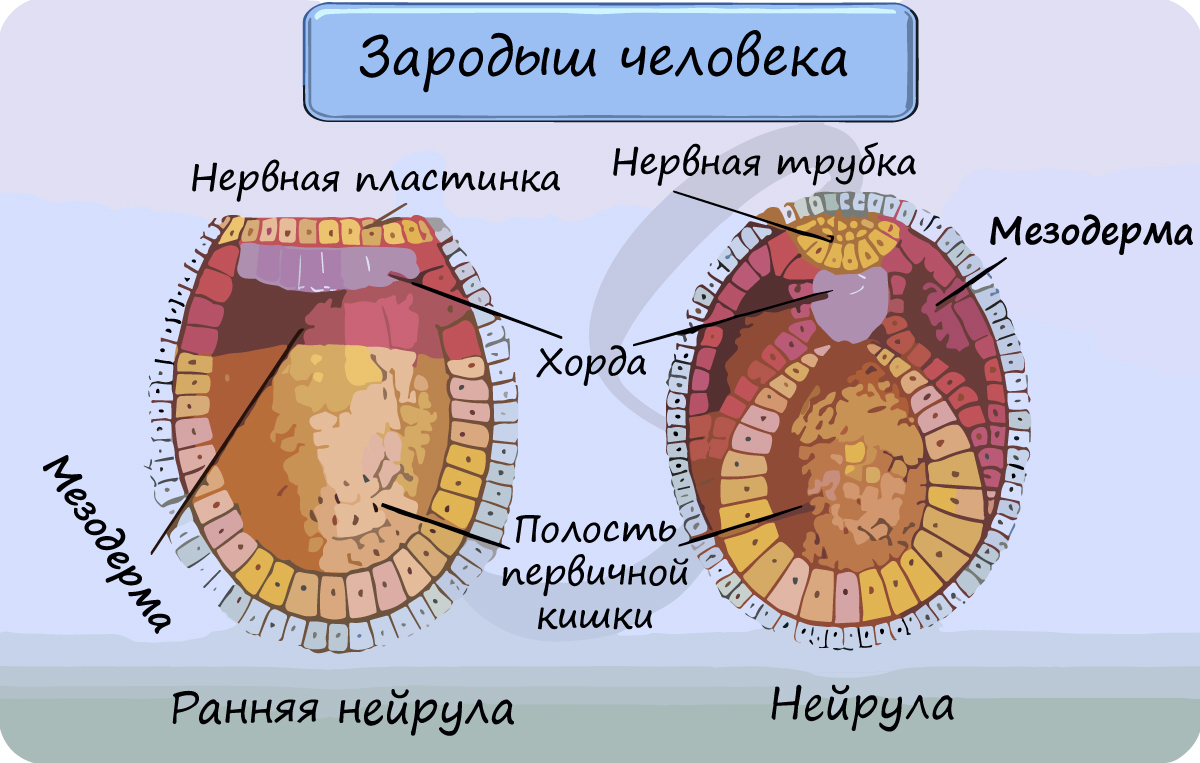
Мышцы развиваются из среднего зародышевого листка - мезодермы.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Читайте также:

