Сложные эфиры конспект урока рудзитис
Обновлено: 10.07.2024
2. Проверка подготовленности обучающихся к учебному занятию.
3. Организация внимания.
ІІ. Проверка домашнего задания. (7 мин.)
Для проверки домашнего задания (повторение химических свойств спиртов и карбоновых кислот) обучающимся выдаются карточки с заданиями (2 варианта). Работы выполняются в тетрадях для самостоятельных работ. По истечении времени ребята сдают работы учителю.
Задания 1 варианта:
1. Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ:
Этан → Этилен → Этиловый спирт → Уксусная кислота → Ацетат натрия
2. К раствору, содержащему 24,4 г карбоната натрия прибавили избыток уксусной кислоты. Определите массу образовавшейся соли.
3. В двух склянках без этикеток находятся два вещества: этилен, этанол. Как определить эти вещества химическим путем?
Задания 2 варианта:
1. Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ:
Карбид кальция → Ацетилен → Этилен → Этанол → Уксусная кислота
2. К раствору, содержащему 24,4 г карбоната натрия прибавили избыток уксусной кислоты. Определите объем (н.у) выделившегося газа.
3. В двух склянках без этикеток находятся два вещества: глицерин, уксусная кислота. Как определить эти вещества химическим путем?
III. Изучение нового материала (25 мин)
Учитель. При изучении кислот мы неоднократно встречались с их производными — сложными эфирами. Рассмотрим этот класс соединений более углубленно. Откройте, пожалуйста, § 29, страница 135. Органические вещества, которые образуются в реакциях кислот со спиртами, относят к сложным эфирам. (Дети записывают определение)
Реакции образования сложных эфиров идут с отщеплением воды:
R - C + H-O-R 1 → R - C + H 2 O
карбоновая спирт сложный
( R и R 1 – радикалы углеводородов, одинаковые или разные).
При помощи изотопа кислорода с массовым числом 18 удалось установить, что гидроксильная группа в этой реакции отщепляется от молекулы карбоновой кислоты:
R - C + H 18 8 O-R 1 → R - C + H 2 O
Физкультминутка. (1 мин.)
Упражнения для глаз.
Двигать глазами вверх – вниз, влево – вправо. Зажмурившись, снять напряжение, считая до десяти.
Представить себе большой круг. Обводить его глазами по часовой стрелке, потом против часовой стрелке.
Учитель. Молодцы! А теперь продолжим изучать сложные эфиры. Итак, номенклатура.
Названия сложных эфиров образуют от названий соответствующих спиртов и кислот, например: (дети записывают формулы и названия веществ)
или метиловый эфир или этиловый эфир
муравьиной кислоты уксусной кислоты
или изопентиловый эфир уксусной кислоты
Физкульминутка. (1 мин.)
Выполнение несколько упражнений для улучшения мозгового кровообращения и для снятия утомления с плечевого пояса и рук.
Учитель. Изучим нахождение сложных эфиров в природе и физические свойства.
ЦОР: Нахождение сложных эфиров в природе
Сложные эфиры содержатся в цветках, фруктах, ягодах. Сложные эфиры простейших одноосновных кислот и спиртов — жидкости, легче воды, летучие и в большинстве случаев обладающие приятным запахом. Например, изопентиловый эфир уксусной кислоты (изопентилацетат) имеет запах груши, бутиловый эфир масляной кислоты — ананаса (рис.37, страница 136). Синтетические сложные эфиры в виде фруктовых эссенций используются наряду с другими душистыми веществами в производстве вод, кондитерских изделий, при изготовлении духов и одеколонов. Некоторые из сложных эфиров (например, этиловый эфир уксусной кислоты) служат растворителями.
Температуры кипения и плавления сложных эфиров ниже, чем соответствующих органических кислот. В воде растворимы только сложные эфиры с небольшой относительной молекулярной массой.
Учитель: Рассмотрим получение эфиров. В лаборатории получают эти вещества путем взаимодействия карбоновых кислот со спиртами. Реакции образования сложных эфиров называют реакциями этерификации.
Реакции этерификации обратимы. Чтобы сместить равновесие такой реакции в сторону выделения сложного эфира, обычно пользуются концентрированной серной кислотой, которая связывает воду.
Сложные эфиры получают также при взаимодействии минеральных кислот со спиртами, например при нитровании глицерина.
Лабораторная работа
Тема: Получение уксусноэтилового эфира
Цель: п ровести реакцию этерификации и получить уксусноэтиловый эфир
Оборудование: прибор для получения галоидоалканов, штатив, горелка, огнезащитная прокладка, мерный цилиндр, мерная пробирка.
Техника безопасности. Соблюдать правила работы с кислотами и правила работы с горючими жидкостями.
Проведем реакцию этерификации в приборе для получения галоидоалканов. В реакционную колбу поместим этиловый спирт, уксусную кислоту и концентрированную серную кислоту. Серная кислота используется как водоотнимающее средство. Так как реакция этерификации обратима, необходимо удалять воду. В холодильник нальем насыщенный раствор поваренной соли. В этом растворе растворимость эфира минимальна. При нагревании смеси образуется летучий уксусноэтиловый эфир. Он конденсируется в холодильнике. Он легче воды и раствора соли. Поэтому он образует верхний слой жидкости. Для лучшей видимости прибавим в холодильник подкрашенную воду. Эфир растворяет краситель, и верхний слой становится хорошо заметен.
СН 3 СООН + С 2 Н 5 ОН = H 2 О + CH 3 COO С 2 Н 5
Учитель: Рассмотрим химические свойства. Характерное свойство сложных эфиров — их взаимодействие с водой — гидролиз:
этилацетат уксусная кислота этанол
Гидролиз протекает как в кислой, так и в щелочной среде. В щелочной среде гидролиз становится необратимым, поскольку щелочь связывает карбоновую кислоту в соль:
Реакцию щелочного гидролиза сложного эфира называют омылением.
Учитель: Применение сложных эфиров
ЦОР. Применение сложных эфиро в
Рассмотрим рисунок 38, страница 137. Полиметилакрилат (полимер сложного эфира CH 2 =CH-COOCH 3 ) широко используются в производстве пластмасс.
В конце XIX — начале ХХ века, когда органический синтез делал свои первые шаги, было синтезировано и испытано фармакологами множество сложных эфиров. Они стали основой таких лекарственных средств, как салол, валидол и др. Как местнораздражающее и обезболивающее средство широко использовался метилсалицилат, в настоящее время практически вытесненный более эффективными средствами.
Ребята, скажите, пожалуйста, где применяются сложные эфиры? ( Ответы: в парфюмерной, пищевой промышленностях, как растворители, для получения волокон (нитрона)).
Учитель: Рассмотрим схему 7 на странице 130. На схеме показана генетическая связь сложных эфиров с другими классами органических веществ. Из каких веществ можно получить сложные эфиры? ( Ответы: из карбоновых кислот и спиртов).
IV. Закрепление знаний. (7 мин.)
Учитель. Для закрепления знаний выполним задания №1, 2, 3, 4, 5(а) по учебнику, страница 138.
Какие вещества относят к сложным эфирам? Составьте две-три уравнения реакций их образования.
Какой вид изомерии характерен для сложных эфиров? Напишите формулы двух-трех изомеров и их названия.
Охарактеризуйте физические и химические свойства сложных эфиров. Напишите уравнения соответствующих реакций.
Где применяют сложные эфиры?
Составьте уравнения реакций, при помощи которых можно осуществить следующие превращения:
Какую массу (в г) этилацетата можно получить из 60 г уксусной кислоты и 70 г этанола, если выход сложного эфира равен 80%?
V. Домашнее задание. (1 мин.)
§ 29 , № 5 ( б), 6 с.1 38
VI. Рефлексия. (1 мин.)
1. На уроке было над чем подумать.
2. Я понял новую тему.
3. На все возникшие у меня вопросы я получил ответы.
4. По новой теме мне необходима дополнительная консультация.
5. На уроке я поработал добросовестно.
VII. Подведение итогов урока. (1 мин.)
Сложные эфиры – класс соединений на основе минеральных (неорганических) или органических карбоновых кислот, у которых атом водорода в НО-группе замещен органической группой R. Реакции образования сложных эфиров называют реакциями этерификации. Характерное свойство сложных эфиров — их взаимодействие с водой. Реакцию щелочного гидролиза сложного эфира называют омылением. Сложные эфиры содержатся в цветках, фруктах, ягодах. Применяются сложные эфиры в парфюмерной, пищевой промышленностях, как растворители, для получения волокон (нитрона).
Оборудование : раздаточный материал- на столах стоят пробирки под пробками с заранее полученными сложными эфирами; проектор, экран, ноутбук, презентация.
I. Организационный момент.
II. Подготовительный этап к усвоению новых знаний.
Вопрос классу: Что этим хотел сказать кот Алисе?
(всегда нужно знать, куда и зачем идти, т.е. предвидеть цель своей работы)
Тема нашего сегодняшнего урока зашифрована в лабиринте.
Тему урока записываем в тетрадь:
III. Введение новых знаний:
Эфир (в греческой мифологии)- верхний лучезарный слой воздуха.
Учитель: Много веков назад арабы уже знали различные способы получения душистых веществ из растений и выделений животных. Душистые вещества содержатся обычно в виде капелек в особых клетках. Они встречаются в цветах, листьях, кожуре плодов и даже в древесине. Их называют эфирными маслами . Они представляют собой сложные смеси душистых органических веществ, одним из компонентов которых являются сложные эфиры.
Нахождение в природе
Учитель: В 1759 г. Л. де Лаурагваис перегонял крепкую уксусную кислоту с винным спиртом и получил некоторое количество жидкости, запах которой отличался от запаха исходных веществ. Так ,впервые, был получен сложный эфир этилового спирта и уксусной кислоты.
Слайд №5 (портрет ученого)
Учитель: На слайде представлены формулы веществ
1) CH 3 —CH 2 —OH 4) CH 3 —O—CH 3
2) H—COOH 5) C 3 H 5 (OH) 3
3) CH 3 —COH 6) HO—NO 2
Вопрос классу: Какие из них могут быть использованы для получения сложных эфиров? Назовите их .
(1-этанол, 2- муравьиная кислота, 5- глицерин, 6- азотная кислота, 7- уксусная кислота)
Этерификация (aether - эфир) - реакция образования сложного эфира, путем совместной дегидратации спирта и кислоты.
(под запись в тетрадь)
Учитель: Методом меченых атомов было доказано, что молекула кислоты отдает гидроксогруппу, а молекула спирта – атом водорода.
Учитель: Назовите общую формулу предельных одноатомных спиртов и карбоновых кислот.
(ученики называют формулы)
; C n H 2n+1 COOH ; C n H 2n O 2
R–OH ; C m H 2m+1 –OH ; C m H 2m+2 O
Учитель: Вызывает ученика для написания общей реакции этерификации.
Какова роль серной кислоты в этом процессе?
(записывают в тетрадь)
Общая формула класса
(записывают в тетрадь)
- Название R спирта + слово эфир + тривиальное (историческое)
название кислоты – метиловый эфир уксусной кислоты.
- Название R спирта + название аниона кислоты + окончание “ ат” – метилацетат
- Название R спирта + систематическое название кислоты + окончание “ оат” – метилэтаноат
Учитель: ( з адание классу, ученик у доски). Напишите этерификацию между муравьиной кислотой и бутанолом-1, назовите этот эфир разными способами
H-COOH +CH 3 -(CH 2 ) 3 -OH H-COO-(CH 2 ) 3 -CH 3 +H 2 O
(бутиловый эфир муравьиной кислоты, бутилформиат, бутилметаноат )
Учитель: Сложные эфиры образуют и минеральные кислоты:
C 2 H 5 OH+HO–NO 2 C 2 H 5 -O-NO 2 +H 2 O
(Этилнитрат, этиловый эфир азотной кислоты)
Учитель: Давайте рассмотрим физические свойства сложных эфиров. На столах стоят в пробирках под пробками сложные эфиры, находящиеся над слоем воды. Что вы можете сказать о них? (жидкости, легче воды, летучие).Откройте пробку и, вспомнив правило по ТБ, определите запах эфиров.
№ 10 CH 3 COOC 2 H 5 – этилацетат, характерный запах растворителя
№ 11 СН 3 COO-CH 2 -CH 2 -CH(CH3)-CH 3 - изоамилацетат, запах груш
№ 12 CH 3 -(CH 2 ) 2 -COO-C 2 H 5 - этилбутаноат, запах абрикосов
№ 13 H-COO-CH 2 -CH 2 -CH(CH3)-CH 3 – изоамилформиат запах слив
№ 14 Воски – твёрдые сложные эфиры высших карбоновых кислот и высших одноатомных спиртов.
Пчелиный воск C 15 H 31 -COO-C 30 H 61 (эфир пальмитиновой кислоты и мирицилового спирта)
Учитель: Давайте рассмотрим химические свойства эфиров.
А) CH 3 –CH 2 –COO–CH 2 –CH 3 + H 2 O CH 3 –CH 2 –COOH + CH 3 –CH 2 –OH
CH 3 –COO–CH 3 + NaOH => CH 3 –COONa + CH 3 –OH
Какой реакции противоположен процесс гидролиза? Что в ходе реакции будет получиться?

Нестандартный урок. Урок путешествие в страну Эфиров.Технология использования в обучении игровых методов:ролевых, деловых.
Урок химии в 10 классе
Тема урока: Сложные эфиры. Реакции этерификации.
Учебник: Химия.10класс: базовый уровень/ Г.Е. Рудзитис Ф.Г. Фельдман
Цели урока: (Слайд №2)
Обучающие:
Способствовать формированию знаний учащихся о сложных эфирах, углублению знаний учащихся о химических свойствах карбоновых кислот и спиртов на примере реакций этерификации, показать практическое значение этой реакции, изучить условия смещения химического равновесия на примере реакций этерификации
Развивающие:
Способствовать развитию навыков составлений уравнений химических реакций, практические умения и навыки выполнения лабораторных работ, навыки работы с презентациями.
Воспитательные:
Воспитывать положительное отношение к химии, интерес к предмету химии, рассматривая распространение эфиров природе, область применения. Воспитывать творческий подход к выполнению заданий, умение находить интересное в потоке информации, используя интернет ресурсы
Оборудование и реактивы:
Образцы эфирных масел, оборудование и реактивы для получения этилацетата, презентация в Power Point
Тип урока: Урок изучения нового материала
Формы работы: Интегрированный урок, путешествие в страну эфиров.
Ход урока
Организация класса (в подготовке урока, принимали участие учащиеся, находили интересный материал по данной теме).
Актуализация опорных знаний. Мотивация учебной деятельности.
Ученик: Это страна сложных органических соединений, эфиров, с которыми мы знакомились при изучении химических свойств спиртов и карбоновых кислот.
Например, при взаимодействии метановой кислоты с метанолом образуется соединение метилформиат, или метиловый эфир муравьиной кислоты
Изучение нового материала.
Учитель: Запишите уравнение данной химической реакции
Эта реакция является обратимой и катализаторами служат минеральные кислоты (H2 SO4,H3 PO4 т.д.).
1.Сложные эфиры - это кислородсодержащие соединения, являющиеся продуктами взаимодействие карбоновых кислот со спиртами. Их можно получить в результате взаимодействия карбоновых кислот со спиртами в присутствии минеральных кислот. Такие реакции называют реакциями этерификации.(Слайд № 3)
Отправляемся в путешествие.
Экскурсовод сообщает историческую справку. (Слайд №4)
Раскопки старины показали ,что люди издавна использовали ароматические вещества для изменения запаха тела и воздуха, знали об их влиянии на психическое и физическое состояния. При раскопках Древнего Египта, Индии, Китая, Греции и Рима находили посуду с остатками ароматических масел и мазей. Это означает, что люди научились выделять душистые вещества из растительного сырья уже около 5000 лет до н. е. Около 500 лет до н. э. в Коринфе существовала фабрика по производству духов. Духи в те далекие времена были символом богатства и способом выражения эмоций, чувств. Высокого развития в Египте получило искусство бальзамирования с использованием ароматических веществ. Известно, что, когда открыли захоронение Тутанхамона (1922 г.), рядом с мумией были сосуды с ароматическими веществами (мирра, ладан), аромат и лечебные свойства которых сохранились на протяжении 3500 лет (Cлайды №4,5). Непревзойденным мастером волшебных ароматов и мастером косметики была царица Клеопатра (Слайд №6). У древних египтян без использования эфирных масел, ароматических веществ не обходился ни один священный ритуал. Еще великий Гиппократ считал, что путь к здоровью лежит через ароматические ванны, ароматический массаж, которые он рекомендовал использовать ежедневно во время болезни и регулярно для поддержания жизненных сил и здоровья (Слайд №7). В древних Афинах любая красавица знала, что руки должны пахнуть мятой, а лицо - пальмовым маслом. Изнеженные патриции гордого Рима буквально купались в духах, они окропляли ими не только свою одежду, но и улицы, которыми должен был проехать император (Слайд № 8).
2.Экскурсовод: Ароматические вещества (масла, духи) попали в Европу в XII веке вместе с крестоносцами, которые почерпнули свои знания у арабов.
В XVI веке в Германии физиолог из Страсбурга Браунцвейг опубликовал "Книгу истинного искусства дистилляции", в которой описал 25 различных эфирных масел. С конца XV до начала XVIII века было получено 120 эфирных масел. Французский химик Р. М. Хайтефос считается отцом ароматерапии. Он предложил этот термин в 1937 году и интересовался в основном косметическими и дерматологическими аспектами использования эфирных масел. Французский врач Жан Валье использовал эфирные масла для дезинфекции и обработки ран, снятия спазмов внутренних органов.
Итальянские ученные Ренато Кайоло и Джованни Гари выявили сильное влияние эфирных масел на нервную систему и предложили эффективные способы лечения депрессии и истерии эфирными маслами.
В 1903г. И. М. Сеченов исследовал влияние ароматических веществ на газообмен и общее состояние теплокровных животных (Слайд № 9)
3. Экскурсовод: Эфирные масла - это смеси химических соединений разных классов (альдегиды, кетоны, эфиры, фенолы и др.), образующихся в растениях. Наша коллекция представлена разнообразными эфирными маслами : мятное, лавандовое, розовое, можжевеловое, эвкалиптовое, шалфейное, гвоздичное, коричное. Например: в составе мятного эфирного масла более 150 химических веществ (ментол, менитен, ментиланон).
Главным компонентом лавандового масла является эфиры спирта линалона и ряда органических кислот (уксусной, масляной, валериановой, капроновой).
Физические свойства эфирных масел:
-растворяются в спиртах, эфирах, смолах;
-цвет желтоватый, темно-коричневый, красный, зеленый, но чаще бесцветные;
-легко изменяются под действием света, воздуха, t хранения не выше
15 °С (3 года гарантийный срок хранения).
Эфиры высших одноосновных кислот и высших одноатомных спиртов -основа природных восков.
Пчелиный воск - эфир пальмитиновый к-ты C 15H31COOH и мирицилового спирта
Эфиры низших карбоновых кислот и низших одноатомных спиртов имеют приятный запах цветов, ягод, фруктов.
-пентиловый эфир уксусной кислоты – для изготовления банановой эссенции (запах банана) используется в пищевой промышленности, парфюмерии;
-изопентиловый эфир уксусной кислоты - запах груши;
-метиловый эфир масляной кислоты-яблока;
- этиловый эфир масляной кислоты-ананаса;
-изопентиловый эфир масляной кислоты-сливы;
-пентиловый эфир муравьиной кислоты-вишни.
Станция: Крымский научно-исследовательский институт эфиромасличных культур ( г. Симферополь)
Крым-это благоприятное место для выращивания эфиромасличных культур. До 1990 г большая часть пахотных земель, где плохо произрастали зерновые, плодовые культуры, были засажены плантациями розы, шалфея, фенхеля, лаванды, полыни (Слайд №10,11,12).
В советское время в Крыму было несколько мощных заводов по переработке этих культур.
Так в Белогорском районе поселке Крымская Роза находился филиал КНИИЭМАК и завод по получению эфирных масел: розового, шалфейного, лавандового и т.д.
Это очень дорогостоящие вещества и наша страна продавала их в другие страны за валюту.
Из 100 кг растительного сырья выход эфирного масла составляет:
- у эвкалипта - 3 кг
- у шалфея-1,4-1,7 кг
- для получения 1 кг розового масла надо переработать 1 тонну лепестков розы (Слайд №11)
В ходе экскурсии вы узнали, что истоки лечения эфирными маслами уходит корнями в глубокую древность.
Благодаря своей высокой летучести они легко вводятся в организм процедурой ингаляции, а благодаря хорошей растворимости в жирах легко проникают через кожу и слизистые оболочки. Запах розы и жасмина - стимулирует нервную систему (ЦНС), улучшает сон. В народе с этой же целью используют подушки с шишками хмеля, можжевельника.
Работники некоторых фирм Японии, почувствовав усталость, заходят в помещение с ароматом ладана, сандалового дерева, лаванды, которые полезны при усталости и стрессовых нагрузках.
Лаванда, полынь, гвоздика, жасмин, пихта, лимон, сосна, ель, кедр, они полезны для повышения работоспособности, внимания, кратковременной памяти.
Умственное напряжение снимут базилик, гвоздика, эвкалипт, чабрец, мята, бергамот.
Повысят эмоциональное настроение – это: лимон, жасмин, китайский лимонник, кипарис, герань, мелисса, корица.
В средние века студенты носили венки из петрушки и мяты во время подготовки к экзаменам, чтобы снять усталость, активизировать память. Проведем сеанс ароматерапии, будем дышать эфирными маслами мяты, чтобы улучшить восприятие материала ( поджигают аромницу с эфирными маслами).
Получить этилэтаноат (этиловый эфир уксусной кислоты)
Реакция обратимая. Обратный процесс - гидролиз эфира.
Гидролиз в присутствии щелочи происходит необратимо. Реакцию щелочного гидролиза сложного эфира называют омылением
Номенклатура эфиров: Название эфира происходит от названия спирта и кислоты. Сначала называется спирт со словом эфир, затем кислота.
Современная международная номенклатура:
Название корень латинского
углеводородного названия кислоты
радикала + с добавлением
отвечающего суффикса ат.
4.Закрепление материала урока.
1) Записать уравнение реакций этерификации метилового спирта и бутановой кислоты, дать название продукту реакции.
2)Вывести общую формулу эфиров.
Общая формула эфиров R1-COO-R2
3)Упр. 5 стр.138 учебника, задача 6 стр.138 учебника (авторы: Г.Е.Рудзитис, Ф.Г.Фельдман)
4. Рефлексия: Что понравилось в путешествии больше всего?
Что хотелось бы узнать по данной теме или увидеть?
1) составить уравнение реакций получения пропилпропионата, этилформиата.
2) Вычислить массу метилацетата, которую можно получить в результате взаимодействия метанола массой в 16г и этановой кислоты массой в 27г.

В видеоуроке есть определение класса, общая формула, состав и строение, номенклатура и изомерия сложных эфиров, тривиальные названия, физические и химические свойства, получение и применение основных представителей сложных эфиров.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Сложные эфиры"
Сложные эфиры – это функциональные производные карбоновых кислот, в которых гидроксильная группа замещена остатком спирта или фенола.
Так, сложный эфир этилэтаноат состоит из остатка карбоновой кислоты – этановой и остатка спирта – этанола. Пропилэтаноат состоит из остатка карбоновой кислоты – этановой и остатка спирта – пропанола.
Сложные эфиры содержат сложноэфирную группу. Для сложных эфиров, как и для карбоновых кислот? можно использовать формулу CnH2nO2, которая отражает молекулярный состав.
Назовём следующие сложные эфиры. Первый эфир называется пропилэтаноат, или пропиловый эфир уксусной кислоты. Второй эфир называется этилметаноат, или этиловый эфир муравьиной кислоты.

Для сложных эфиров возможно существование структурных изомеров. Например, составим структурные изомеры состава С5Н10О2. Это метилбутаноат, припилэтаноат, метил-2-метилпропаноат.
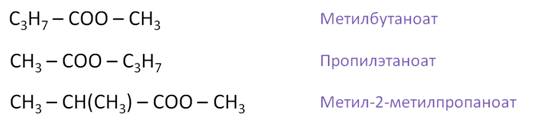
Кроме того, для сложных эфиров характерна межклассовая изомерия с карбоновыми кислотами.
Сложные эфиры, в составе которых низшие карбоновые кислоты и спирты, − летучие, малорастворимые и практически нерастворимые в воде жидкости. Они хорошо растворимы в органических растворителях.
Многие эфиры имеют приятный запах: запах ананаса имеет бутиловый эфир бутановой кислоты, запах груш – изоамиловый эфир этановой кислоты, абрикосами пахнет пентиловый эфир бутановой кислоты, запах жасмина напоминает бензиловый эфир этановой кислоты, запах хризантенм – бензиловый эфир метановой кислоты.
Получить сложные эфиры можно несколькими способами. Например, в реакции карбоновых кислот и спиртов в присутствии минеральных кислот. Так, в реакции уксусной кислоты с этанолом образуется сложный эфир – этилэтаноат, или этиловый эфир уксусной кислоты.

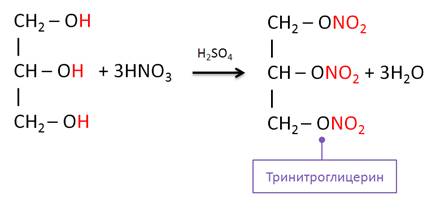
Сложный эфир можно получить и в реакции глицерина и азотной кислоты, в результате данной реакции образуется тринитроглицерин.
Для сложных эфиров характерны реакции горения. Например, составим реакцию горения метилформиата. При горении образуется углекислый газ и вода.
Важная реакция сложных эфиров – это реакция их с водой в присутствии кислоты или щёлочи. Эта реакция называется гидролизом. Гидролиз – реакция обратная реакции этерификации. Так, в результате гидролиза этилэтаноата в присутствии сильной минеральной кислоты, образуется этановая кислота и этанол. Эта реакция является обратимой.
В результате щелочного гидролиза этилэтаноата образуется этаноат натрия и этанол. Этот гидролиз необратим и называется омылением.

Сложные эфиры встречаются в виде эфирных масел, жиров, восков.
Воски – это сложные эфиры высших карбоновых кислот и высших спиртов. Пчелиный воск на 70 % состоит из сложного эфира, главным образом, из пальмитиновой кислоты и миристилового спирта. Из воска изготавливают политуры, смазки, пропиточные составы для бумаги и кожи, они входят в состав косметических кремов и мазей.
Сложные эфиры применяют в парфюмерии при производстве духов, в производстве бытовой химии, сложные эфиры составляют основу эссенций для приготовления фруктовых вод, кондитерских изделий, сложные эфиры применяют как растворители органических веществ, при производстве полимерных материалов, в частности пластификаторов, в лакокрасочной промышленности, в производстве искусственных волокон, при производстве лекарственных средств (валидола, аспирина). Сложные эфиры – основа органического стекла.
Таким образом, сложные эфиры – это функциональные производные карбоновых кислот, у которых гидроксильная группа замещена на остаток спирта. Сложные эфиры широко распространены в природе. Сложные эфиры образуются в реакциях между спиртами и кислородсодержащими кислотами. Сложные эфиры гидролизуются растворами минеральных кислот и щелочей. Сложные эфиры применяются во многих областях промышленности.

Процесс получения сложных эфиров носит название реакции этерификации. Эта реакция с использованием общих формул описывается уравнением

Именно реакцией этерификации в 1759 г. в результате взаимодействия уксусной кислоты с этиловым спиртом был получен первый сложный эфир — этиловый эфир уксусной кислоты:

Обратите внимание на то, как строится название сложного эфира. Оно состоит из четырёх слов, указывающих на название углеводородного радикала и исходной кислоты. Например, продукт взаимодействия муравьиной кислоты с метиловым спиртом — метиловый эфир муравьиной кислоты:
Катион водорода в схеме реакции указывает на то, что реакция этерификации протекает в присутствии кислоты в качестве катализатора.
Сложные эфиры с небольшой молекулярной массой представляют собой легковоспламеняющиеся жидкости с характерным, часто приятным запахом. Они нерастворимы в воде, но прекрасно растворяют различные органические вещества.
Нахождение в природе и применение сложных эфиров
Сложные эфиры широко распространены в природе. Неповторимый аромат цветов и фруктов часто обусловлен присутствием веществ именно этого класса. Сложные эфиры с большой молекулярной массой представляют собой твёрдые вещества — воски. Пчелиный воск — это смесь сложных эфиров, образованных карбоновыми кислотами и спиртами с длинными углеводородными цепями.
Синтетические сложные эфиры используют в пищевой промышленности в качестве добавок для придания фруктовых запахов напиткам и кондитерским изделиям. Благодаря хорошей растворяющей способности сложные эфиры входят в состав растворителей лаков и красок.
Жиры, их строение и свойства
Люди стали использовать жиры в повседневной жизни значительно раньше, чем задумались об их химическом строении. Животные и растительные жиры — важные компоненты пищи. Жиры необходимы для построения клеточных мембран и как источник энергии, поскольку калорийность жиров в 2 раза выше, чем других питательных веществ — углеводов и белков. У позвоночных животных жиры откладываются в жировой ткани, сосредоточенной в основном в подкожной жировой клетчатке и сальнике. В растениях жиры содержатся в сравнительно небольших количествах, за исключением семян масличных растений, в которых содержание жиров может быть более 50%.
Жиры используют не только в пищевой промышленности. Их используют в качестве смазки, косметических и лекарственных средств, для приготовления масляных красок и олифы.
В 1779 г. шведский химик К. Шееле получил из оливкового масла вязкую жидкость, сладкую на вкус, — простейший трёхатомный спирт глицерин. Вскоре выяснилось, что глицерин входит в состав молекул любых жиров. Позднее французский химик М. Шеврёль доказал, что, помимо глицерина, при нагревании жиров в присутствии кислоты образуются и карбоновые кислоты.

Общую формулу жиров можно представить в следующем виде:
В состав жиров чаще всего входят остатки карбоновых кислот, содержащих чётное число атомов углерода и неразветвлённую углеродную цепь. Наиболее часто в составе жиров встречаются остатки пальмитиновой, стеариновой и олеиновой кислот. В одной молекуле кислотные остатки могут быть различными, поэтому в общей формуле жиров углеводородные радикалы R обозначены разными цифрами.
Сравните состав стеариновой (С17Н35СООН) и олеиновой (С17Н33СООН) кислот. У стеариновой кислоты углеводородный радикал отвечает формуле СnН2n+1, т. е. является предельным. Следовательно, стеариновая кислота относится к предельным карбоновым кислотам. В углеводородном радикале олеиновой кислоты на два атома водорода меньше, поскольку в нём содержится одна двойная углерод-углеродная связь. Олеиновая кислота относится к непредельным карбоновым кислотам.
Жиры животного происхождения имеют твёрдую консистенцию (есть и исключения, например жидкий рыбий жир). В состав молекул твёрдых жиров входят остатки предельных кислот. Растительные жиры, которые часто называют растительными маслами, образованы остатками непредельных кислот, имеют жидкую консистенцию (исключение — твёрдое пальмовое масло). Кстати, название олеиновой кислоты произошло от латинского слова oleum — масло.
Жиры гидрофобны, т. е. нерастворимы в воде, но хорошо растворяются в органических растворителях: этиловом спирте, гексане, тетрахлорметане.

Жиры проявляют все характерные для сложных эфиров химические свойства. Главное из них — это гидролиз. Молекулы воды атакуют связи между кислотным остатком и фрагментом глицерина, в результате чего происходит распад молекулы жира:

Для жира, образованного стеариновой кислотой (такое вещество называют тристеаратом глицерина), уравнение реакции гидролиза выглядит следующим образом:
В качестве катализатора гидролиза жиров выступают кислоты. Такой гидролиз так и называют — кислотный гидролиз. Жирные руки трудно отмыть холодной водой, но стоит только протереть их ломтиком лимона, как они становятся заметно чище. Даже при таком непродолжительном контакте с лимонной кислотой жир частично гидролизуется.

Гидролиз жиров в присутствии щелочей называют щелочным гидролизом:
Щёлочь действует как катализатор, а также связывает образующиеся кислоты, превращая их в соли карбоновых кислот. Соли не способны вступать в реакцию этерификации с глицерином, и гидролиз становится необратимым. Неслучайно бытовые средства для удаления жира и засоров в раковинах более чем наполовину состоят из щёлочи.
Щелочной гидролиз жиров называют также омылением. Это название обусловлено тем, что образующиеся при этом натриевые и калиевые соли высших карбоновых кислот являются мылами.

Твёрдые жиры животного происхождения более ценны и дорогостоящи, чем жидкие растительные масла. Можно ли превратить жидкий жир в твёрдый химическим путём? Если вы вспомните, что растительные масла, в отличие от животных жиров, содержат остатки непредельных кислот, то нетрудно догадаться: гидрированием двойных связей С=С растительные масла превращают в аналог твёрдых жиров. Полученный продукт называют саломасом, его используют для приготовления маргарина и других продуктов питания:
Подобный процесс в больших масштабах проводят на жировых комбинатах.
Двойные связи непредельных кислот в жидких жирах сохраняют способность к реакциям полимеризации. Это свойство используют при изготовлении олифы — натуральной (на основе льняного или конопляного масла) или синтетической. При нанесении на деревянную поверхность олифа под действием кислорода воздуха полимеризуется с образованием прочной защитной плёнки. Олифу используют и при изготовлении и разбавлении масляных красок.

Читайте также:

