Скорость химических реакций химическое равновесие конспект
Обновлено: 30.06.2024
Каждая химическая реакция характеризуется кинетическим (скорость) и термодинамическим (равновесие) аспектами.
Скоростью химической реакцииназывается изменение концентрации веществ в ходе реакции в единицу времени:
Кинетическое уравнение, связывающее скорость данной реакции с концентрацией реагирующих веществ, имеет вид:
что представляет собой выражение закона действующих масс (ЗДМ), в соответствии с которым скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных соответствующим стехиометрическим коэффициентам. Постоянный множитель k в кинетическом уравнении называется константой скорости реакциии показывает скорость реакции при концентрации каждого реагента равной 1 моль/л. Константа скорости химической реакции зависит от природы реагирующих веществ и температуры в соответствие с уравнением Аррениуса:
где: А – предэкспоненциальный множитель, зависящий от числа соударений реагирующих частиц между собой;
Еа – энергия активации, Дж/моль;
R – универсальная газовая постоянная, 8,31 Дж/Kмоль;
Т – абсолютная температура, K
Значения константы скорости реакции меняется в широких пределах (от 10 -7 до 10 11 единиц), что указывает на значительное различие в скорости разных реакций. В аналитической химии применяют в основном быстрые реакции. Для ускорения медленных реакций в соответствии с уравнением Аррениуса используют повышение температуры (нагревание) и катализаторы (уменьшение энергии активации).
При протекании любой химической реакции наряду с прямой реакцией имеет место и обратная (обратимость реакции), причем при определенных условиях наступает такой момент когда скорости прямой и обратной реакций становятся одинаковыми. Этот момент называется химическим равновесием, а концентрации веществ, участвующих в этом равновесии, называют равновесными. Химическое равновесие является подвижным (динамическое равновесие) и на него можно влиять как со стороны исходных веществ, так и со стороны продуктов реакции в соответствии с принципом Ле-Шателье. Для обратимой реакции A + B ↔ C + D в соответствии с ЗДМ скорости прямой и обратной реакции могут быть записаны следующим образом:
Тогда, в момент равновесия:
Величина называется концентрационной константой химического равновесияили концентрационной константой равновесия. Концентрационная константа равновесия для данной конкретной реакции зависит от температуры, природы реагирующих веществ и растворителя, ионной силы раствора. В справочной литературе значения концентрационных констант равновесия реакций приводятся с обязательным указанием температуры и ионной силы раствора, природы растворителя.
В более общем случае, когда стехиометрические коэффициенты отличаются от единицы, т.е. для реакции
условие наступления химического равновесия определяется уравнением
Это уравнение представляет собой математическое выражение закона действующих масс (ЗДМ), который можно сформулировать следующим образом:
При установившемся равновесии отношение произведения концентраций продуктов реакции к произведению концентраций исходных веществ представляет собой для данной реакции при данной температуре величину постоянную, называемую константой равновесия. При этом концентрации каждого вещества должны быть возведены в степень, соответствующую их стехиометрическому коэффициенту.
ЗДМ строго применим к неэлектролитам и слабым электролитам в разбавленных водных растворах. Концентрированные водные растворы слабых электролитов и все сильные электролиты (кислоты, щелочи, соли) дают существенные отклонения от ЗДМ.

Значение константы равновесия позволяет оценить направление и глубину протекания химической реакции. При К = 1 скорости прямой и обратной реакции равны. Если К > 1, это благоприятствует протеканию реакции в прямом направлении, если К
Аборт - это не право женщины, аборт - это смертная казнь невинного ребенка. © Папа Римский Франциск ==> читать все изречения.
Ключевые слова конспекта: Скорость химической реакции. Факторы, влияющие на скорость реакции: природа реагирующих веществ, площадь их соприкосновения, температура, концентрация, катализатор. Катализ. Ферменты. Ингибиторы.
Скорость — это отношение изменения какой-либо величины к промежутку времени, за которое это изменение произошло. Химические реакции протекают с разными скоростями. Одни практически мгновенно, например смесь водорода с кислородом (гремучая смесь) взрывается за доли секунды. Быстро протекает реакция нейтрализации, т. е. взаимодействие растворов кислоты со щёлочью (основанием):
Другие реакции протекают значительно медленнее, например брожение глюкозы или коррозия металлов:
Что же понимается под скоростью химической реакции? Предположим, некоторое взаимодействие протекает по схеме А + В = АВ. В ходе реакции вещества А и В расходуются, превращаясь в новое вещество АВ. Изменение количества веществ, участвующих в химической реакции, характеризует такая величина, как концентрация.
В ходе реакции концентрация исходных веществ (реагентов) уменьшается, а концентрация продукта реакции увеличивается. Изменение концентраций во времени и характеризует скорость химической реакции.

Математически эту закономерность можно выразить следующей формулой:
Если в приведённой формуле С1 и С2 — это начальная и конечная концентрации одного из реагентов, то разность С2 – С1 имеет отрицательное значение, ведь С2 0.
Размерность скорости реакции легко определить: концентрация измеряется в моль/л, время — в секундах, следовательно, единицей скорости реакции является 1 моль/(л • с).
Управление скоростью химической реакции имеет большое значение. Увеличение скорости реакции позволяет получить больше продуктов реакций: стали, пластмасс, химических удобрений, лекарств, топлива и др. Замедление скорости реакции позволяет уменьшать потери металла от коррозии, дольше сохранять продукты питания и т. д.
Рассмотрим, какие факторы влияют на скорость химической реакции.
✅ 1. Природа (состав и строение) реагирующих веществ. Реакции между органическими веществами протекают медленнее подобных реакций между неорганическими веществами. По-разному взаимодействуют галогены с водородом: фтор — со взрывом, хлор — со взрывом лишь при нагревании, бром — без взрыва, а реакция водорода с йодом является эндотермической и протекает медленно. Интенсивность взаимодействия щелочных металлов с водой зависит от их восстановительных свойств, которые усиливаются с увеличением радиуса атома.
✅ 2. Температура. Зависимость скорости химической реакции от температуры была установлена в конце 1884 г. голландским учёным Якобом Хендриком Вант-Гоффом.

Математическое выражение правила Вант-Гоффа записывают следующим образом:

Например, температурный коэффициент какой–либо реакции близок к 3. Это означает, что при повышении температуры на 20 °С скорость реакции возрастёт в 9 раз:
✅ 3. Площадь соприкосновения реагирующих веществ. Этот фактор учитывается для гетерогенных реакций. Напомним, что гетерогенными (от греч. heteros — другой) называются реакции, идущие между веществами разного агрегатного состояния, т. е. имеющими поверхность раздела. Например, на поверхности соприкосновения жидкости или газа с твёрдым веществом и т. д.
✅ 4. Концентрация реагирующих веществ. Зависимость была установлена норвежскими учёными Като Максимилианом Гульдбергом и Петером Вааге в 1867 г. и получила название закона действующих масс.

Математическое выражение закона действующих масс для реакции aА + bВ = dD выглядит так:
где υ — скорость химической реакции, СА и СB — концентрации реагентов А и В, а и b — коэффициенты в уравнении реакции, k — коэффициент пропорциональности — константа скорости реакции, которая показывает скорость химической реакции при концентрации реагирующих веществ, равных 1 моль/л.
Например, для второй стадии производства азотной кислоты, которая описывается уравнением 2NO + O2 = 2NO2↑, закон действующих масс отражает формула υ = k • C 2 (NO) • С(O2)
Если в гетерогенной реакции принимает участие твёрдое вещество, его концентрация не входит в уравнение закона. Например, для реакции между раскалённым оксидом меди(II) и водородом СuО + Н2 = Сu + Н2O справедливо следующее выражение: υ = k • С(Н2)
Это означает, что внесение дополнительного количества твёрдого вещества (оксида меди(II)) не оказывает влияния на скорость реакции.
✅ 5. Катализатор. Напомним, что катализаторами (от греч. katalysis — разрушение) называются вещества, изменяющие скорость химической реакции и не входящие в состав продуктов реакции.
Современную химическую промышленность невозможно представить без использования катализаторов. С их помощью ускоряют химические процессы, чтобы быстрее получить нужные вещества и уничтожить вредные (например, химические отходы). Производство минеральных кислот, аммиака и метанола, уксусной кислоты и полимеров, нефтепереработка и производство лекарственных препаратов — около 90 % всех химических производств основано на применении катализаторов.
С помощью катализаторов удаётся повысить производительность химических процессов и уменьшить себестоимость продукции. Катализаторы также позволяют сделать производство экологически более безопасным, т. е. уменьшить загрязнение окружающей среды вредными выбросами.
Катализаторы вошли в жизнь человека, когда он стал использовать процессы брожения для получения уксуса из виноградного сока, варить сыр и выпекать хлеб. Ведь все эти процессы протекают в присутствии биологических катализаторов, или ферментов (от лат. fermentum — закваска). Их также называют энзимами.
Ферменты содержатся во всех живых клетках. Они направляют, регулируют и многократно ускоряют биологические процессы, играя тем самым важную роль в обмене веществ и энергии.
Обратное влияние на скорость химической реакции оказывают ингибиторы (от лат. inhibere — сдерживать, останавливать) — вещества, подавляющие или задерживающие течение физиологических и физико-химических (главным образом, ферментативных) процессов. Такие вещества важны, как и катализаторы: ингибиторы коррозии, например, помогают сохранить металлы от разрушения.

Химическое равновесие - состояние химической системы, при котором скорость прямой реакции равна скорости обратной.
В большом количестве заданий, которые мне довелось увидеть, я ни один раз видел, как коверкают это определение. Например, в заданиях верно-неверно предлагают похожий вариант, однако говорят о "равенстве концентраций исходных веществ и продуктов" - это грубая ошибка. Химическое равновесие - равенство скоростей.

Принцип Ле Шателье
В 1884 году французским химиком Анри Ле Шателье был предложен принцип, согласно которому, если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие (изменить температуру, давление, концентрацию), то система будет стремиться компенсировать внешнее воздействие.

Это принцип обоснован термодинамически и доказан. Однако в такой абстрактной формулировке его сложно применить для решения конкретных задач по химическому равновесию. В этой статье я покажу конкретные примеры и обозначу алгоритм действия, чтобы вы могли успешно справляться с заданиями.
Влияние изменения концентрации на химическое равновесие
При увеличении концентрации какого-либо компонента химической реакции, система будет стремиться восстановить равновесие: равновесие будет смещаться в сторону расходования добавленного компонента.
Объясню проще: если вы увеличиваете концентрацию вещества, которое находится в левой части, равновесие сместится в правую сторону. Если добавляете вещество из левой части (продуктов реакции) - смещается в сторону исходных веществ. Посмотрите на пример ниже.
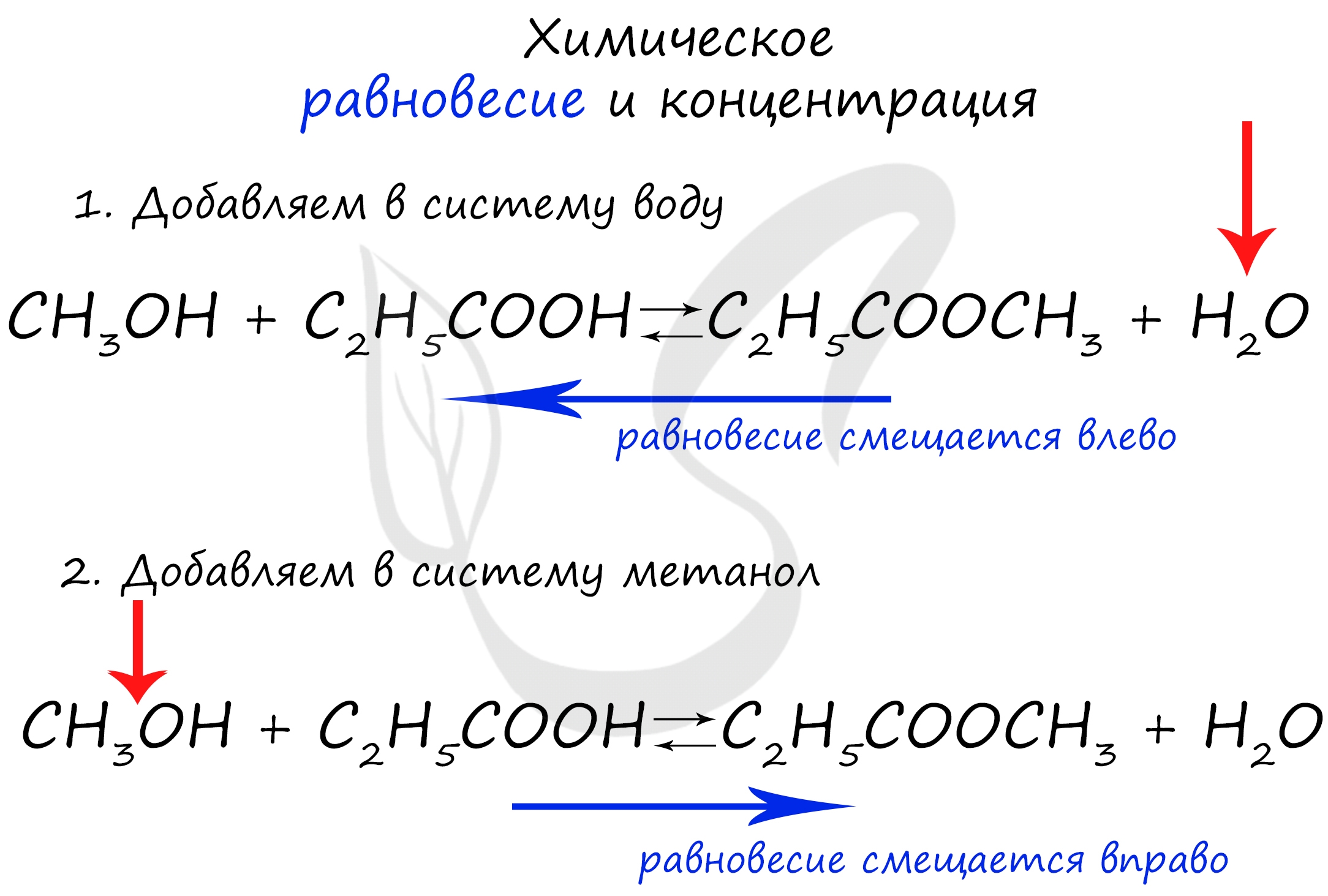
Если мы попытаемся удалить какое-либо вещество из системы (уменьшить его концентрацию), то система будет стремиться заполнить "пустое" место, которые мы создали. Наглядно демонстрирую на примере:
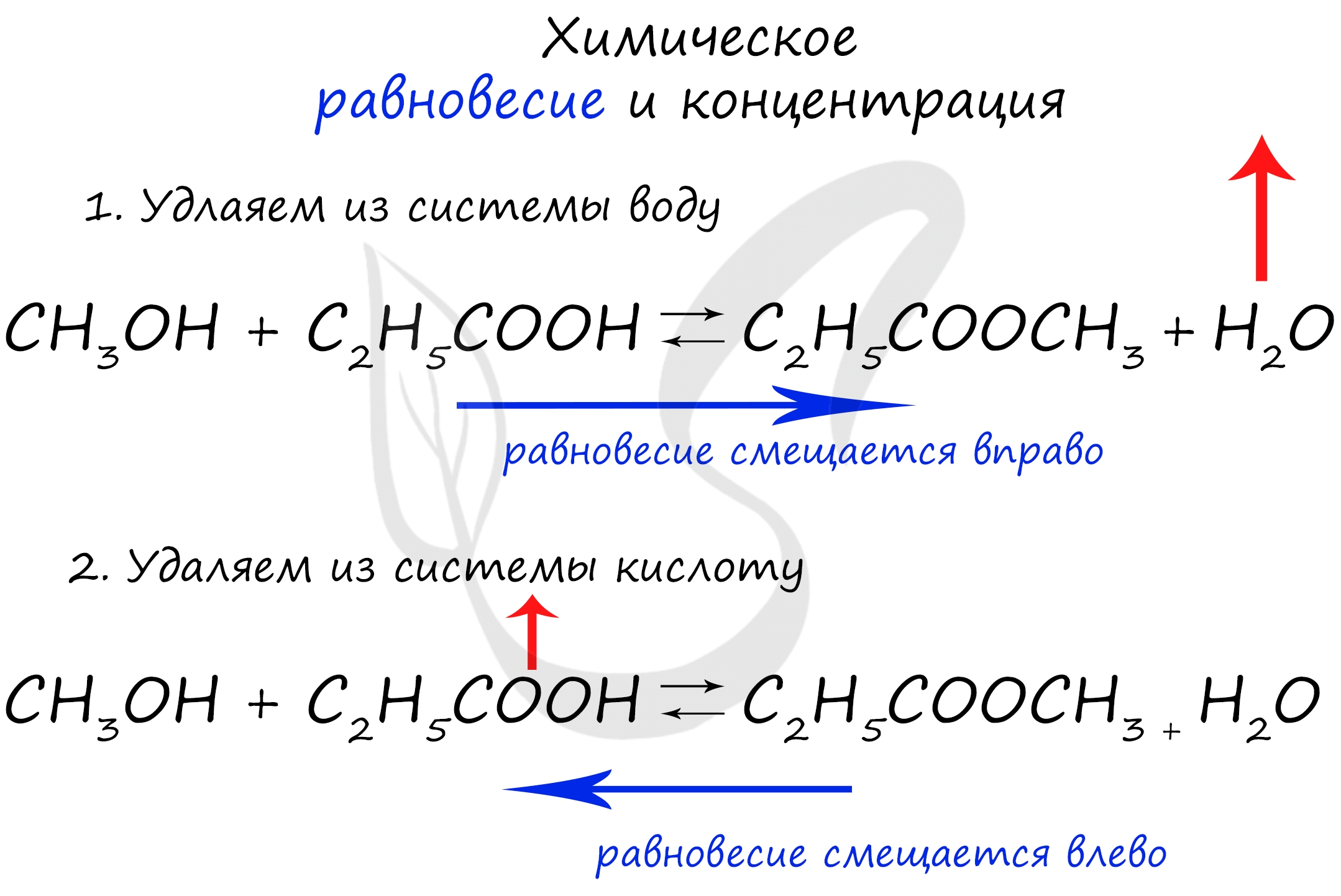
Можно подвести итог полученным знаниям таким образом: "Куда добавляем - оттуда смещается, откуда берем - туда смещается". Воспользуйтесь этой или придумайте свое правило для запоминания этой закономерности ;)
Изменения давления и химическое равновесие
Если речь в задании идет об изменении давления, то первое, что нужно сделать, это посчитать количество газов в уравнении слева и справа. Твердые вещества и жидкости считать не нужно. Например:
В приведенном уравнении количество молекул газа в левой части - 1, в правой - 2.
Запомните правило: "При увеличении давления равновесие смещается в сторону меньших газов, при уменьшении давления - в сторону больших газов". Для нашей системы правило действует таким образом:

В случае, если слева и справа количество молекул газа одинаково, например, в реакции:
Слева - 2 газа, и справа - 2. В такой реакции увеличение или уменьшение давления не повлияет на химическое равновесие.
Изменение температуры и химическое равновесие
Если в задании увеличивают или уменьшают температуру, то первое, что вы должны оценить: экзотермическая это реакция или эндотермическая.
Следуйте следующему правилу: "При увеличении температуры равновесие смещается в сторону эндотермической реакции, при уменьшении - в сторону экзотермической реакции". У любой обратимой реакции есть экзо- и эндотермические части:
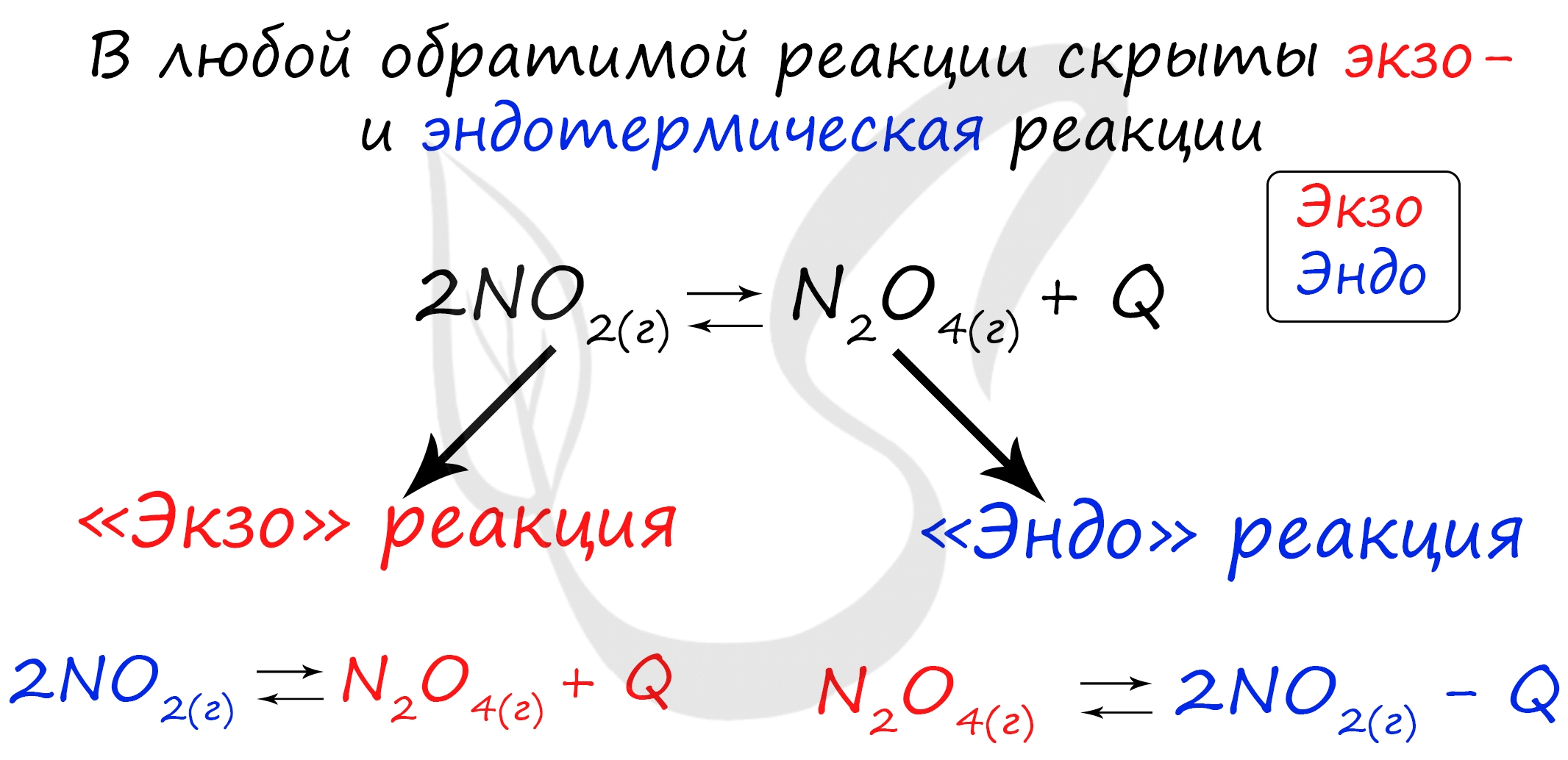
Поэтому данное правило универсально и применимо для всех реакций. Для примера разберем следующие задачи:

Чтобы не осталось белых пятен, возьмем экзотермическую реакцию и повторим с ней подобный эксперимент.

Катализатор и ингибитор
Действие катализатора и ингибитора соответственно касается только ускорения и замедления химической реакции. Они никоим образом не влияют на равновесие.
Константа равновесия
Константой равновесия называют отношения скоростей прямой и обратной реакции. Для реакции типа aA + bB = cC + dD константа равновесия будет записана следующим образом:

Решим задачу. Дана реакция: 2NO + Cl2 ⇄ 2NOCl . Вычислите константу равновесия, если равновесные концентрации веществ для данной реакции: c(NO) = 1.8 моль/л , c(Cl2) = 1.2 моль/л , c(NOCl) = 0.8 моль/л.

Константу равновесия для данной задачи можно представить в виде 1.64 * 10 -1 .
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Лекция Химия
Тема: Скорость химических реакций.
1. Понятие о скорости химических реакций.
2. Факторы, влияющие на скорость химических реакций: природа реагирующих веществ, концентрация, температура, поверхности соприкосновения и использование катализато-ров.
3. Химическое равновесие и способы его смещения.
1. Понятие о скорости химических реакций
Химические реакции протекают с различными скоростями . Одни реакции протекают быстро. Так, практически мгновенно происходят реакции ионного обмена. Другие протекают медленно, часами, как, например, разложение пищевых продуктов (белки, жиры, углеводы) при пищеварении; месяцами — коррозия (ржавление) железа. А химическое превращение горных пород (гранита в глину) протекает в течение тысячелетий.
Количественной характеристикой быстроты течения химической реакции является ее скорость, которую обозначают латинской буквой V.
Скорость химической реакции можно определять:
1. По изменению концентрации одного из исходных веществ в единицу времени. Концентрацию вещества обозначают латинской буквой С и выражают числом молей в 1 л, т. е. моль/л. Время обозначают греческой буквой т (тау) и выражают, как правило, в секундах.
Допустим, что в закрытом сосуде протекает реакция А + В = D + Е
Концентрация вещества А в первоначальный момент времени составляла С 1 , а в момент времени т 2 — С 2 . Тогда скорость реакции будет равна:
где v — скорость реакции, выраженная в моль/(л • с);
С = С 2 — С 1 — изменение концентрации вещества А за промежуток времени т;
т = т 2 – т 1 — промежуток времени, в течение которого изменяется концентрация вещества.
2. По изменению концентрации продукта реакции в единицу времени:
Таким образом, скорость реакции определяется изменением концентрации вступившего в реакцию или образовавшегося вещества в единицу времени. Скорость
реакции в течение времени меняется, поэтому рассчитывают среднее значение скорости реакции.
Задача. Вычислите среднюю скорость реакции СО + С1 2 = СОС1 2 (фосген),
если начальная концентрация хлора равнялась 1 моль/л, а через 4 сек. его концентрация стала 0,6 моль/л. Дано: С 1 = 1 моль/л, С 2 = 0,6 моль/л, т = 4сек. (Ответ: v = 0,1 моль/л * с)
2. Факторы, влияющие на скорость химических реакций.
1.Природа реагирующих веществ. Вы знаете, что скорость взаимодействия одной и той же кислоты с металлами обусловлена природой металла. В свою очередь, скорость взаимодействия одного и того же металла с кислотами обусловлена природой кислоты. Проведем опыт. Опустим в две пробирки по одной грануле цинка и прильем в первую 2 см 3 соляной кислоты, а во вторую — 2 см 3 уксусной кислоты. Мы увидим, что вытеснение водорода цинком из раствора соляной кислоты происходит значительно быстрее, чем из раствора уксусной кислоты, так как НС1 — сильная кислота, а СН 3 СООН — слабая кислота.
Реакции между сильными электролитами в растворах протекают практически мгновенно. Например:
KBr + AgN 0 3 = AgBr + KN 0 3 Ag + + Br - = AgBr
Это обусловлено тем, что вещества с ионными и полярными ковалентными связями в растворах образуют разноименно заряженные ионы, которые легко взаимодействуют друг с другом.
Скорость реакций с участием веществ с неполярными и малополярными ковалентными связями определяется их химической активностью. Так, водород с фтором реагирует очень быстро (со взрывом) уже при обычных условиях, а с бромом — медленно даже при нагревании:
Н 2 + F 2 = 2 HF (реакция протекает быстро)
Н 2 + Вг 2 = 2НВг (реакция протекает медленно)
Вывод: реакционная активность веществ определяется характером химической связи в соединениях и их строением. Наиболее активны вещества с ионными и полярными ковалентными связями.
2. Концентрация реагирующих веществ.
Гомогенные реакции. Чтобы произошло взаимодействие, частицы (атомы, молекулы, ионы) реагирующих веществ должны столкнуться друг с другом. Чем больше частиц при данной температуре в единице объема, тем чаще они сталкиваются.
Вывод: с повышением концентрации реагирующих веществ происходит увеличение скорости реакции.
Гетерогенные реакции . Если реакция гетерогенная, то взаимодействие частиц происходит лишь на поверхности твердого вещества, поэтому концентрация его не влияет на скорость реакции.
Например, скорость реакции восстановления ионов меди (II)
CuO + Н 2 = С u + Н 2 О определяется только концентрацией водорода.
3. С тепень измельчения твердого вещества является одним из факторов, который определяет скорость гетерогенной реакции, т.е. величина площади поверхности соприкосновения твердого вещества. Чем больше поверхность соприкосновения, тем больше скорость реакции. Например, куски угля горят медленно, постепенно окисляясь кислородом воздуха, а угольная пыль, взвешенная в воздухе, может давать взрыв.
Вывод: скорость гетерогенной реакции не зависит от концентрации твердого вещества.
4.Влияние температуры . С повышением температуры скорость химических реакций, как правило, возрастает, так как при нагревании реагирующие частицы становятся более активными и способными к взаимодействию. Так, в две пробирки внесем одинаковые порции оксида меди (II) (порошок черного цвета) и прильем при перемешивании по 3 см 3 серной кислоты. Одну из пробирок будем нагревать. Отметим, что в нагреваемой пробирке оксид меди (II) растворяется более интенсивно и раствор приобретает голубой цвет, обусловленный образованием гидратированных ионов меди (II):
CuO + H 2 S 0 4 = CuS 0 4 + Н 2 0 (реакция протекает медленно)
CuO + H 2 S 0 4 = CuS 0 4 + Н 2 0 (реакция протекает быстро)
СuО + 2Н + = Сu 2+ + Н 2 0
Установлено, что при повышении температуры на каждые десять градусов скорость большинства реакций увеличивается в 2—4 раза.
Например, если принять, что скорость некоторой реакции при О °С равна единице, а ее скорость при повышении температуры на каждые 10 °С увеличивается в 2 раза, то при нагревании до 100 °С ее скорость возрастает в 2 10 (1024) раза.
5.Влияние катализаторов . Большое влияние на скорость химической реакции оказывают добавки некоторых веществ к реагирующей смеси. Одни из них увеличивают скорость реакции. Например, в роли ускорителя очень часто выступает вода. Если поместить в тигель или фарфоровую чашку немного смеси порошкообразного алюминия с предварительно растертым в порошок йодом и тщательно перемешать стеклянной палочкой, видимых изменений мы не наблюдаем . Однако достаточно к этой смеси добавить одну каплю воды, происходит вспышка — результат бурного взаимодействия иода с алюминием :
Ускорителем реакции разложения пероксида водорода Н 2 0 2 является оксид марганца (IV). Нальем в пробирку немного 5%-го раствора пероксида водорода и внесем тлеющую лучинку — она не загорается, потому что реакция разложения пероксида водорода при обычных условиях протекает очень медленно. Если же в пробирку внести несколько крупинок оксида марганца (IV), то начинается бурное выделение пузырьков газа (жидкость как бы кипит), а тлеющая лучинка, внесенная в пробирку, загорается ярким пламенем:
Когда реакция разложения пероксида водорода закончится и в пробирке останется только вода, то фильтрованием отделим оксид марганца (IV) от воды и убедимся, что на фильтре остается столько же Мп0 2 , сколько его было взято. Оставшийся после реакции оксид марганца (IV) можно использовать вновь.
Вещества, которые изменяют скорость химической реакции, но сами при этом не расходуются, называют катализаторами .
Различают положительные и отрицательные катализаторы . Положительные катализаторы ускоряют химические реакции. Мы с вами рассмотрели действие положительных катализаторов (это оксид марганца (IV) и вода).
Но имеется целый ряд веществ, которые понижают скорость химической реакции ( отрицательные катализаторы ). Так, в две пробирки нальем раствор соляной кислоты, в одну из них добавим немного уротропина (его можно купить в аптеке). В каждый раствор опустим предварительно зачищенный железный гвоздь. В пробирке с чистой кислотой гвоздь растворяется, покрываясь пузырьками выделяющегося водорода. В кислоте с уротропином выделение водорода практически не наблюдается.
Вещества, которые замедляют скорость реакции, называют ингибиторами (уротропин в соляной кислоте).
Химические реакции, которые протекают в присутствии катализаторов, называют каталитическими.
Большую часть продукции, вырабатываемой химической промышленностью, получают на основе использования катализаторов. Это процессы производства серной и азотной кислот, синтетического каучука, пластмасс, лекарственных препаратов, получения из твердого угля жидкого топлива, переработки нефти, природного газа и многие другие.
Особую роль играют биологические катализаторы — ферменты. Они участвуют в сложных химических процессах, протекающих в пищеварительной системе, в крови и в клетках животных и человека. Ha п p и мер, слюна содержит фермент птиалин, который катализирует превращение крахмала в сахар (если пожевать хлеб или картофель дольше обычного, то во рту можно почувствовать сладкий вкус), желудочный сок содержит пепсин, который катализирует расщепление белков. В организме человека находится около 30 000 различных ферментов, каждый из них - катализатор соответствующей реакции.
В живом организме благодаря ферментам все биологические процессы протекают при обычных условиях.
3. Химическое равновесие.
В обратимых химических реакциях химическое равновесие является динамическим, так как сколько молекул продукта прямой реакции образуется в единицу времени, столько их и разлагается при протекании обратной реакции. Поэтому концентрации всех реагирующих веществ в системе остаются постоянными при данных условиях. Эти концентрации называют равновесными и обозначают квадратными скобками [Н 2 ], [ I 2 ], [Н1].
Химическое равновесие — это такое состояние реакционной системы, при котором концентрации реагирующих веществ и продуктов реакции не изменяются во времени, так как скорости прямой и обратной реакций равны и отличны от нуля:
Состояние химического равновесия количественно характеризуют константой равновесия К равн . В момент достижения равновесия v пр = v o 6 p , т.е.
Отношение констант скоростей прямой и обратной реакций тоже является постоянной величиной; она и называется константой равновесия:
Константа химического равновесия показывает, во сколько раз константа скорости прямой реакции k 1 больше константы скорости обратной реакции k 2 при одинаковой температуре. Она зависит от природы реагирующих веществ и температуры, но не зависит от катализатора и концентрации веществ. По значению константы равновесия можно судить о полноте протекания реакции. Чем больше значение константы равновесия, тем в большей степени равновесие смещено в сторону образования продуктов реакции.
Состояние химического равновесия обратимой реакции сохраняется при неизменных условиях (концентрация вещества, температура и давление), но стоит только изменить хотя бы одно из них, как система быстро перейдет в другое состояние, соответствующее новым условиям.
Переход системы из одного равновесного состояния в другое, отвечающее изменившимся условиям, называют смещением равновесия.
Направление смещения химического равновесия определяется принципом Ле Шателье : если изменить одно из условий, при которых система находится в состоянии химического равновесия (концентрация вещества, температура и давление), то равновесие сместится в направлении той реакции, которая противодействует этому изменению.
Факторы, влияющие на смещение химического равновесия.
Изменение концентрации . При увеличении концентрации одного из веществ (исходного или продукта) равновесие смещается в сторону уменьшения его концентрации и соответственно увеличения концентрации продуктов его взаимодействия.
В равновесной системе нельзя изменить концентрацию только одного из веществ, не вызывая этим изменение концентрации всех остальных.
В обратимых гетерогенных реакциях введение или удаление дополнительной массы твердого вещества не влияет на состояние равновесия. Например, на состояние равновесия реакции
не повлияет добавление карбоната или оксида кальция.
Изменение температуры . Изменение температуры вызывает изменение скорости как прямой, так и обратной реакции, но в разной степени. При понижении температуры из двух реакций быстрее протекает экзотермическая, при повышении – эндотермическая. Поэтому для выяснения влияния температуры на химическое равновесие необходимо знать значение теплового эффекта реакции.
Прямая реакция – экзотермическая, а обратная – эндотермическая. Повышение температуры смещает равновесие в сторону эндотермической реакции (так как она протекает с поглощением теплоты), а понижение – в направлении экзотермической реакции (так как она протекает с выделением теплоты).
Изменение давления . Известно, что сжимаемы только газообразные вещества, поэтому изменением давления можно смещать равновесие только тех реакций, в которых участвует или получается хотя бы одно вещество в газообразном состоянии и при этом изменяется число молекул газообразных веществ.
Повышение давления смещает равновесие в сторону реакции, протекающей с образованием меньшего числа молекул газообразных веществ, а понижение давления – в сторону реакции, протекающей с образованием большего числа молекул газообразных веществ.
Если реакция протекает без изменения числа молекул газообразных веществ, то изменение давления не влияет на состояние равновесия этой реакции:
две молекулы две молекулы
Введение в реакцию катализатора не влияет на состояние химического равновесия , так как катализатор снижает энергию активации прямой и обратной реакции на одну и ту же величину, следовательно, он в одинаковой степени изменяет скорость как прямой, так и обратной реакции. Катализатор только ускоряет достижение химического равновесия.
Применение принципа Ле Шателье к обратимым м необратимым химическим реакциям позволяет управлять химическими процессами, например, при производстве серной кислоты, аммиака.
Принцип Ле Шателье распространяется не только на химические, но и на различные физико-химические равновесия. Смещение равновесия при изменении условий таких процессов, как кипение, кристаллизация, растворение, также происходит в соответствии с принципом Ле Шателье.
самостоятельной работы по теме Скорость химических реакций
1. Взаимодействие железа с раствором сульфата меди (записать уравнение, определить типы реакции; расставить коэффициенты методом электронного баланса).
2. Зависимость скорости взаимодействия соляной кислоты с металлами от их природы (цинк и медь).
3. При комнатной температуре с наибольшей скоростью протекает реакция между:
а) Fe и S ; в) КВг (раствор) и AgN 0 3 (раствор);
б) Fe и HCI (раствор); г) СиО и Н 2 .
4. Определите, во сколько раз увеличится скорость реакции np и повышении температуры от 100 до 150 °С, если при повышении температуры на каждые 10 °С скорость реакции увеличивается в 3 раза.
5. При комнатной температуре с наименьшей скоростью протекает реакция между:
а) Fe и HCI (1%-й раствор); б) Fe и HCI (10%-й раствор);
в) FeCI 2 (раствор) и AgN 0 3 (раствор); г) Fe и HCI (30%-й раствор).
Задания для самостоятельной работы по теме
1. Взаимодействие серы с алюминием (записать уравнение, определить типы реакции; расставить коэффициенты методом электронного баланса).
2. Зависимость скорости взаимодействия цинка с соляной кислотой от её концентрации (10 % и 30 % соляная кислота).
3. Определите, во сколько раз уменьшится скорость реакции np и понижении температуры от 80 до 50 °С, если при понижении температуры на каждые 10 °С скорость реакции уменьшается в 2 раза.
4. С наименьшей скоростью при комнатной температуре протекает реакция между:
Читайте также:
- О чем говорит иудейский закон 4 класс конспект урока
- Конспект занятия по пожарной безопасности в группе раннего возраста
- Конспект урока по естествознанию 2 класс что такое эксперимент
- Классный час пдд 4 класс конспект и презентация
- Решение задач с величинами цена количество стоимость 3 класс презентация и конспект школа россии

