План конспект химические свойства кислот
Обновлено: 30.06.2024
Кислоты – это электролиты, в результате диссоциации которых в водных растворах образуется только один вид катионов – катионы водорода Н + (точнее – катионы гидроксония H3O + ):
НCl = Н + + Cl – (НCl + H2O = H3O + + Cl – )
HNO3 = Н + + NO3 – (HNO3 + H2O = H3O + + NO3 – )
Кислоты – вещества молекулярного строения. Атомы в молекулах кислот связаны ковалентными полярными химическими связями. Чем более поляризована связь между атомом водорода, способным отщепляться в виде катиона водорода, и атомом какого–либо другого элемента, тем легче происходит её распад с образованием ионов, тем сильнее кислота.
Классифицировать кислоты можно по разным признакам.
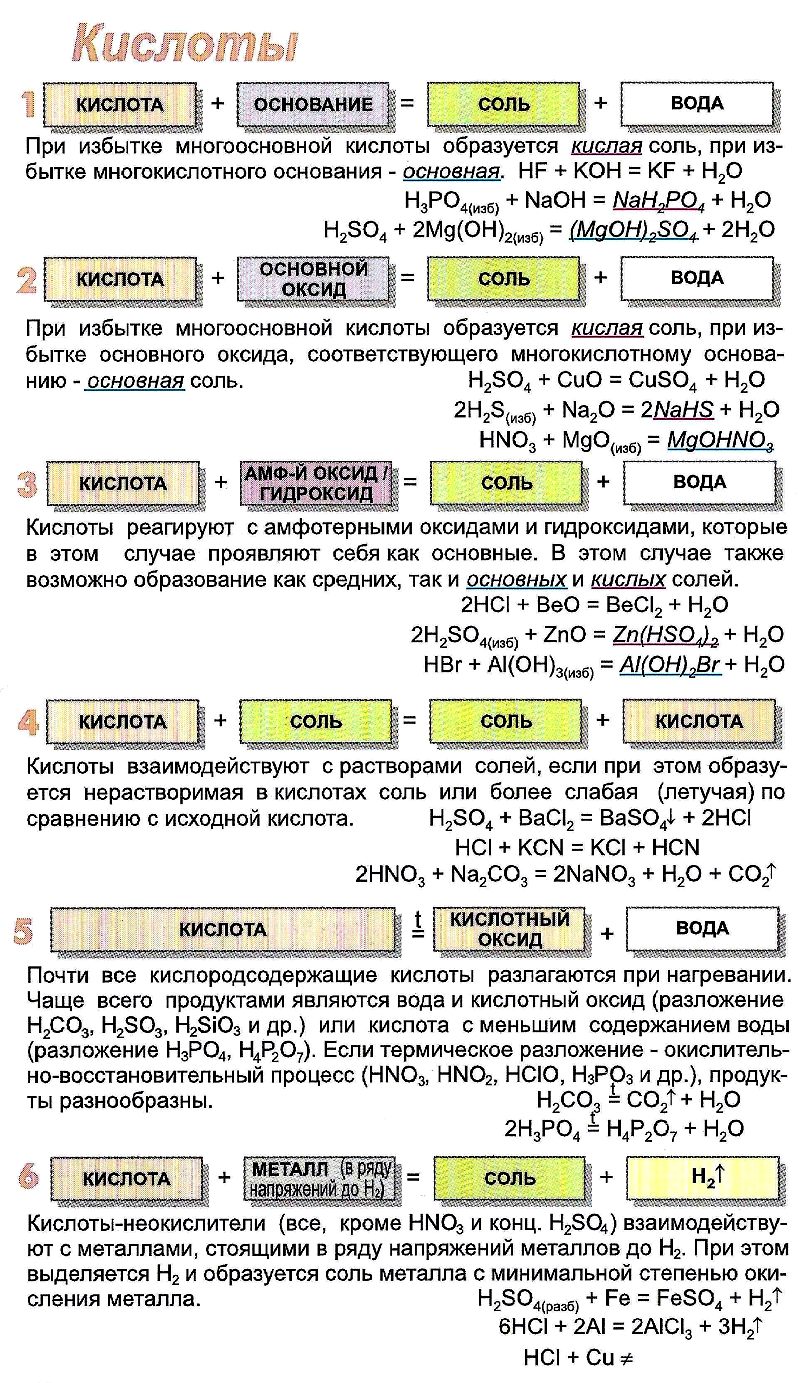
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
- Кислоты реагируют с металлами. Металлы, расположенные в электрохимическом ряду напряжений металлов до водорода H2, вытесняют водород из растворов кислот. Происходит реакция замещения, образуется соль и водород:
Металлы, расположенные в ряду напряжений после водорода, с кислотами не реагируют.
Важное примечание: с серной концентрированной кислотой и с азотной кислотой любой концентрации реакции идут за счёт аниона кислотного остатка, водород в этих случаях не выделяется:
Cu+ 4HNO3 (конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
Cu+ 2H2SO4 (конц.) = CuSO4 + SO2↑ + 2H2O
- Киcлоты реагируют с основными и амфотерными оксидами с образованием соли и воды:
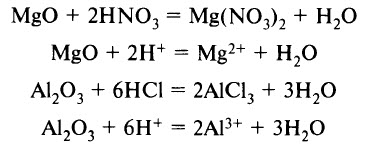
- Кислoты реагируют с основаниями и с амфотерными гидроксидами с образованием соли и воды:

(Взаимодействие сильных кислот с сильными основаниями – реакция нейтрализации.)
Al(ОН)3 + 3НCl = AlCl3 + 3H2O
Al(ОН)3 + 3Н + = Al 3+ + 3H2O
(Реакция амфотерного гидроксида с сильной кислотой.)
- Сильные кислоты реагируют с солями слабых кислот. Слабые кислоты при этом могут быть вытеснены из солей. Например, сильная соляная кислота НCl вытесняет слабую сероводородную кислоту H2S:
FeS + 2НCl = FeCl2 + H2S↑
FeS + 2Н + = H2S↑ + Fe 2+

Нелетучие кислоты могут вытеснить летучую из её соли. Например, нелетучая серная кислота H2SO4 вытесняет более летучую азотную HNO3. Обе кислоты – сильные. В растворе такая реакция не происходит. Она осуществима, если соль находится в кристаллическом виде (не в растворе), а серная кислота концентрированная:
Аналогично можно получить газообразный хлороводород, раствор которого – соляная кислота.
- Кислoты можно обнаружить индикаторами. Индикаторы реагируют на наличие в растворе ионов Н + (H3O + ). Лакмус в кислой среде приобретает красный цвет, метиловый оранжевый – красный, фенолфталеин – бесцветный. Для обнаружения кислот удобно использовать лакмус.
ПОЛУЧЕНИЕ КИСЛОТ

Бескислородные кислоты, состоящие из двух элементов, могут быть получены синтезом простых веществ:
Кислородсодержащие кислоты могут быть получены в результате взаимодействия с водой соответствующих кислотных оксидов:
Р2O5 + 3H2O = 2H3РO4
SO3 + H2O = H2SO4
Слабые или летучие киcлoты могут быть вытеснены из солей более сильными или менее летучими кислотами. Например, сильная соляная кислота НCl вытесняет слабую уксусную кислоту СH3СООН:
CH3COONa + НCl = СH3СООН + NaCl
СH3СОО – + Н + = СH3СООН

Летучие киcлoты могут быть вытеснены из солей менее летучими кислотами. Например, нелетучая серная кислота H2SO4 может вытеснить более летучую соляную НCl. Но в растворе такая реакция не пойдёт (обе киcлoты сильные). Она осуществима, если соль в кристаллическом состоянии (не в растворе) обработать серной концентрированной кислотой:
В результате этой реакции образуется газообразный хлороводород, при растворении которого в воде образуется соляная кислота.
Для получения слабых нелетучих кислот (например, ортофосфорной киcлоты или сернистой кислoты) лучше воспользоваться концентрированной серной кислотой, причём образующаяся сернистая кислота H2SO3 разлагается на сернистый газ SO2 и воду:
Са3(РO4)2 (тв.) + 3H2SO4 (конц.) = 3CaSO4 + 2H3РO4
Na2SO3 (тв.) + H2SO4 (конц.) = Na2SO4 + SO2↑ + H2O
Дополнительные материалы (схемы, таблицы)


Конспект урока с использованием ИКТ по теме "Химические свойства кислот"(8 класс). Цель урока - познакомить учащихся с классификацией кислот и изучить химические свойства кислот.
| Вложение | Размер |
|---|---|
| alferova._konspekt_uroka.zip | 167.42 КБ |
Предварительный просмотр:
Тема урока : Химические свойства кислот.
Познакомить учащихся с классификацией кислот
Изучить химические свойства кислот
Развивать практические навыки
Учить анализировать полученную информацию
Развивать логическое мышление путем сравнения, обобщения, систематизации
Учить выделять причинно-следственные связи
Развивать интерес к предмету
Развивать взаимосвязь между предметами
Развивать знания о применении химии в быту
Учить аккуратности при выполнении химических опытов
мультимедийная презентация (ПК, проектор)
штатив для пробирок, пробирки, спиртовка, спички, держатель для пробирок, химические стаканы, белый экран для демонстрации опытов
Индикаторы: лакмус, метилоранж, фенолфталеин
Кислоты: соляная и серная
Металлы: цинк, железо, медь.
Соли: сульфат меди (II), хлорид бария, карбонат натрия
1.Организационный момент (1-2 мин.)
2.Актуализация знаний учащихся (3 мин.)
3.Изучение нового материала (30 мин.)
4.Закрепление (8 мин.)
5.Домашнее задание (2 мин.)
II.Актуализация знаний учащихся:
Учитель: В этом учебном году вы приступили к изучению новой для вас науки. Как известно, химия – наука о веществах. Какие классы веществ вам известны? (металлы, неметаллы, оксиды, основания, кислоты, соли)
На экране изображен ряд неорганических веществ. Из данного перечня выберите формулы только кислот.(Слайд 1 – Соляная, серная, кремниевая кислоты)
На основании представленных формул и ранее изученного материала дайте определение этому классу веществ (Кислоты – это сложные вещества, состоящие из атомов водорода и кислотного остатка.)
Сегодня на уроке мы попробуем обобщить уже имеющиеся знания о кислотах и познакомимся с химическими свойствами кислот.(Слайд 2)
III.Изучение нового материала:
Итак, тема урока: Химические свойства кислот (запись в тетрадях и на доске).
У каждого из вас на партах имеется схема, где представлена система координат. (Приложение 1) . На одной из осей К0 отмечены основные пункты, по которым мы будем рассматривать класс кислоты. Первый пункт нашего плана Состав. Давайте на оси К1 отметим известную нам информацию.
На оси К2 отметим известные нам классификации кислот. Давайте обратимся к слайду (слайд 4): Чем различаются кислоты, записанные в правом и левом столбиках? Что лежит в основе классификации? (наличием кислорода)
(Слайд 5)Чем различаются кислоты на этом слайде? Что лежит в основе классификации? (количеством атомов водорода)
(Слайд 6)Кислоты по растворимости в воде также делятся на растворимые и нерастворимые. Назовите примеры кислот, используя таблицу растворимости.
(Слайд 7)Кислоты делятся на стабильные и нестабильные. Как вы думаете, что значит нестабильные кислоты?( кислоты, способные разлагаться)
Перейдем к оси К3 – Физические свойства кислот. Какие физические свойства кислот вам известны?(кислый вкус, агрегатное состояние, цвет)
На оси К4 будем отмечать характерные для кислот химические свойства.
Одним из общих химических свойств кислот является действие их на индикаторы. Что такое индикаторы?(вещества, изменяющие окраску в зависимости от среды – кислотной или щелочной) Какие индикаторы вам известны?(лакмус, метилоранж, фенолфталеин). (Слайд 9).Посмотрим демонстрационный опыт: в трех химических стаканах находится соляная кислота. Прильем в стаканы индикаторы? Как изменилась окраска растворов? (при добавлении лакмуса и метилоранжа растворы приобрели красную окраску, в случае фенолфталеина видимых изменений не было). Какой вывод можно сделать? (кислоты можно обнаружить только с помощью лакмуса и фенолфталеина)
Задание – на столах вам выданы 3 пронумерованные пробирки, в которых находятся вода, серная кислота и гидроксид натрия. Определите, в какой пробирке находится то или иное вещество (работа в парах).
Кислоты вступают в ряд химических реакций (Слайд 10), взаимодействуют с металлами, оксидами металлов, основаниями и солями. Обратите внимание, что во всех случаях основным продуктом реакции будет соль.
1.Взаимодействие кислот с металлами. В три пробирки поместите соответственно цинк, железо, медь. Прилейте одинаковое количество соляной кислоты. Что наблюдаете? (в случае цинка - быстрое выделение пузырьков газа, в случае железа – менее интенсивное выделение газа, в случае меди признаки реакции отсутствуют). Какой вывод можно сделать?(не все металлы реагируют с кислотами). Практическим путем учеными было выяснено, какие металлы вытесняют водород из растворов кислот. Таким образом был составлен ряд Н. Н. Бекетова, который сейчас называют электрохимический ряд напряжения металлов. Если металл находится до водорода, то он реагирует с кислотами, если после, то – нет. Запишите соответствующие уравнения реакций:
Zn + 2HCl = ZnCl 2 + H 2 ↑ (реакция замещения)
Fe + 2HCl = FeCl 2 + H 2 ↑ (реакция замещения)
2.Взаимодействие кислот с оксидами металлов. В сухую пробирку поместите небольшое количество оксида меди (II), прилейте 2 мл серной кислоты. Осторожно нагрейте пробирку, соблюдая правила техники безопасности. Что наблюдаете? (после реакции раствор стал голубого цвета). Составьте уравнение реакции. Какие вещества образуются в результате реакции?
CuO + H 2 SO 4 = CuSO 4 + H 2 O (реакция обмена)
3.Взаимодействие кислот с основаниями. На каждом столе в штативе для пробирок имеется свежеприготовленный гидроксид меди(II) синего цвета. Прилейте раствор кислоты до полного растворения осадка. Напишите уравнение химической реакции.
Cu(OH) 2 + 2HCl = CuCl 2 + 2H 2 O (реакция обмена)
4.Взаимодействие кислот с солями. В две пробирки прилейте соответственно растворы хлорида бария и карбоната натрия. Прилейте в обе пробирки серную кислоту. Что наблюдаете? (выпадения осадка белого цвета; выделение пузырьков газа). Напишите уравнение химической реакции.
BaCl 2 + H 2 SO 4 = BaSO 4 + 2HCl (реакция обмена)
Na 2 CO 3 + H 2 SO 4 = Na 2 SO 4 + H 2 O + CO 2 ↑ (реакция обмена) Для написания уравнений реакций кислот с солями следует пользоваться рядом вытеснения кислот, в котором каждая предыдущая может вытеснить из соли последующую. (Приложение 2)
На схеме найдем ось К5. Давайте подумаем, где в жизни мы встречаемся с кислотами?
В желудочном соке животных организмов присутствует соляная кислота.
Действие кислот на наш организм:
1.Кислоты уничтожают болезнетворные и гнилостные микробы, поэтому влияют на наш иммунитет (особенно аскорбиновая кислота). Кроме того, именно это свойство позволяет их использовать как консерванты (при мариновании продуктов). Вы все прекрасно знаете, что кислые ягоды не портятся значительно дольше, чем сладкие.
2.Кислоты способствуют расщеплению жиров, тем самым улучшают переваривание пищи.
3. Возбуждают аппетит, обостряют осязание.
Немало кислот в нашей пище. Фрукты, молочные продукты, соусы, приправы, лекарства поставляют целый букет кислот: яблочную, щавелевую, лимонную, молочную и др.
Уксусная и лимонная кислота применяется для удаления пятен от ржавчины на хлопчатобумажных, льняных и шерстяных белых тканях. 1 чайная ложка на 1 стакан воды, подогреть до кипения и ткань с пятном несколько раз окунуть в раствор или пятно протереть раствором, а затем кислоту тщательно смыть водой, лучше с добавлением несколько капель нашатырного спирта – для нейтрализации кислоты. (Приложение 3)
Задание: составьте возможные уравнения реакций взаимодействия перечисленных веществ с раствором серной кислоты. Из букв, соответствующих правильным ответам, вы составите название одного из элементов четвертого периода таблицы Д.И. Менделеева.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
План – конспект урока 8 класс
Тема. Химические свойства кислот.
Образовательные:
Развивающие:
-Развивать практические навыки и умения составлять уравнения химических реакций.
Продолжить формирование умений работать с лабораторным оборудованием и реактивами.
-Развивать логическое мышление путем сравнения, обобщения, систематизации.
-Учить выделять причинно-следственные связи.
Воспитательные:
-Развивать интерес к предмету.
-Развивать взаимосвязь между предметами.
Тип урока: изучение нового материала.
Метод обучения: словесный, практический и наглядный.
Оборудование: микролаборатория, пробирки, штативы для пробирок, спиртовки, стеклянные палочки, спички, держатели, химические стаканы.
Реактивы: HCl ( раствор и концентрированная), H2SO4, лимонная кислота, щавель, яблоко, лимон, салициловая кислота, лакмус, метиловый оранжевый, фенолфталеин, H 2 O , Zn, Mg , Cu, CuO, NaOH, Cu(OH)2 .
І. Организационный этап
ІІ. Актуализация знаний
Учитель.
Прежде чем исследовать химические свойства кислот, давайте дадим ответы на такие вопросы: (фронтальный опрос)
Какие вещества называются кислотами?
Какой состав имеют кислоты?
Назовите двухосновные кислоты?
Задание. Какое вещество лишнее, назовите его, ответ объясните.
H2SO4; H3PO4; H2CO3
HBr ; HCl ; H 2 CO 3
Какие физические свойства имеют кислоты?
III. Изучение нового материала
Учитель.
Сначала ознакомимся с правилами ТБ при работе с кислотами.
(Изучаются основные правила ТБ при работе с кислотами)
1. Концентрированные кислоты вызывают обезвоживание кожи и других тканей.
По быстроте действия и по скорости разрушения тканей тела, кислоты располагаются в следующем порядке, начиная с наиболее сильных: царская водка (смесь азотной и соляной кислот). Азотная кислота, уксусная кислота (90 – 100%), молочная кислота, щавелевая кислота и т.д. очень опасны ожоги хромой смесью. Сильное раздражающее действие на слизистые оболочки дыхательных путей и глаз оказывают концентрированные соляная и азотная кислоты.
2.Кислоты вызывают локальный химический ожог.
3. Концентрированные кислоты опасны еще и тем, что могут выделять едкие пары. Например, азотная кислота с концентрацией выше 63% выделяет физиологически активные оксиды азота. От концентрированной серной кислоты воздух загрязняет оксидами серы. Ледяная уксусная и муравьиная кислоты сильно раздражают дыхательные пути и слизистые оболочки глаз, являются легковоспламеняющимися жидкостями.
4. Концентрированные кислоты хранят под тягой. Переливают их также под тягой, пользуясь индивидуальными средствами защиты (очки или защитная маска, резиновые перчатки, халат, резиновый фартук).
5. При пользовании склянкой с кислотой необходимо следить, чтобы на каждой склянке было четкое название кислоты. Наливать кислоту надо так, чтобы при наклоне склянки этикетка, во избежание ее порчи оказывалась наверху.
! При разбавлении или укреплении растворов кислот льют кислоту большей концентрации; при изготовлении смеси кислот необходимо вливать жидкость большей плотности в жидкость с меньшей плотностью.
6. В случае пролива кислоты ее необходимо убрать. Лучший способ уборки – засыпать лужу сухим кварцевым песком. Его перемешивают на месте разлива, а затем, собрав в совок, выбрасывают или зарывают в землю. После уборки песка место разлива обрабатывают 10 – 15 %-ым раствором соды, а затем моют водой.
Учитель. Спасибо. Теперь мы можем начать эксперименты.
1 свойство. Кислоты дружат с индикаторами.
Демонстрируется опыт: действие кислот на индикаторы. Учащиеся формулируют вывод и записывают в тетради.
Индикаторы – это вещества, которые изменяют окраску в различных средах.(учащиеся записывают в тетради). Метиловый оранжевый и лакмус дрожат перед кислотами. Метиловый оранжевый изменяет цвет на розовый, лакмус – на красный. Не боится кислот только фенолфталеин, он не изменяет цвет в кислой среде.
2 свойство. Кислоты реагируют с металлами.
Учитель. Давайте проверим, как кислоты относятся к металлам.
Опыт. Взаимодействие кислот с металлами.
1. Магний. Очень активный металл и быстро взаимодействует с кислотами. Вот, посмотрите. ( учитель проводит опыт, записывает уравнение реакции)
Mg + 2HCl= MgCl2 + H2↑
2. Цинк – менее активный металл. Так как стоит в ряде активности металлов правее магния, он также взаимодействую с металлами. ( учитель проводит опыт, записывает уравнение реакции).
Zn + 2HCl= ZnCl2 + H2↑
3.Медь – малоактивный, так как стоит в ряде активности металлов правее водорода. И, следовательно, с растворов кислот его не вытесняет, реакция между ними не происходит. Cu + HCl ≠
Учитель вводит понятие о ряде активности металлов, демонстрирует его.
Ряд активности металлов Н.Н. Бекетова
Учитель: Этот ряд называют еще вытеснительным рядом металлов или рядом Н.Н. Бекетова – по имени нашего русского ученого, в XX веке изучавшего взаимодействие металлов со сложными веществами.
Запомните, что металлы стоящие до водорода вытесняют его из растворов кислот. Чем левее стоит металл, тем активнее он вытесняет водород.
Задание для учащихся : (работаем по таблице):
1.Может ли выделить водород из раствора соляной кислоты алюминий и почему?
2.Может ли выделить водород из раствора соляной кислоты серебро и почему?
3 свойство. Взаимодействие с оксидами металлов
Например: оксид меди (ІІ) – взаимодействует с кислотами и сейчас я вам это докажу.(учитель проводит опыт)
CuО+2HCl = CuCl2 + H2О
Учитель: Почему реакция идёт?
Вводится понятие о реакции обмена.
4 свойство.
Учитель: я хочу показать вам фокус (демонстрирует реакцию нейтрализации)
К 2-3 мл. раствора гидроксида натрия добавляем 2-3 мл. раствора фенолфталеина. Как изменилась окраска?
По каплям добавляем раствор соляной кислоты и следим за исчезновением окраски . Что происходит при постепенном приливании раствора кислоты?
- Происходит нейтрализация раствора – малиновый цвет исчезает.
Записывает уравнение реакции:
Учитель . Такие реакции в результате которых происходит обменное взаимодействие кислоты и щелочи с нейтрализацией называют реакциями нейтрализации.
Лабораторный опыт:
Учитель . Теперь предлагаю вам самим поэкспериментировать (работа в группах).
На ваших столах есть пробирка с гидроксидом меди(II) голубого цвета. Прилейте к ней небольшое количество серной кислоты.
Что произошло с осадком гидроксида меди(II)?
- Он растворился, значит кислоты взаимодействуют с нерастворимыми основаниями.
Учитель: Какие выводы мы можем сделать по итогам нашего урока?
Учащиеся формулируют выводы.
V. Обобщение и систематизация знаний учащихся
Учитель. А сейчас прослушайте стихотворение:
Кислота, кроме азотной,
И металл до водорода
Образуют соль охотно
И, конечно, водород.
Кислота и синий лакмус,
Лакмус сразу станет красным,
Обнаружим так кислоты
В день хороший и ненастный.
Кислота и основание
Образуют соль и воду.
Именно вот это свойство
Взяли все кислоты в моду!
В кислоту внесёшь оксид ты
Без сомненья, соль и воду
Ты получишь, если надо!
А к последнему их свойству
Рифму я не смог придумать.
Вы меня за то простите,
Я над ней продолжу думать.
Учитель. О каком последнем хим. свойстве автор не смог придумать рифму?
Ученики: (разложение некоторых кислот при нагревании – на кислотный оксид и воду)
Учитель: верно, это нам с вами известно из способов получения кислотных оксидов.
V. Домашнее задание
1. Изучить химические свойства характерные для класса кислоты.
2. Познакомить учащихся с электрохимическим рядом напряжения металлов, показать принцип работы с ним.
1. Закрепить и обобщить знания учащихся об особенностях класса неорганических веществ – кислот.
2. Познакомить учащихся с химическими свойствами кислот.
3. Показать использование на уроках химии электрохимического ряда напряжения металлов и таблицы растворимости.
4. Продолжить формирование умений работать с лабораторным оборудованием и реактивами, делать обобщения, использовать учебную литературу.
5. Продолжить формирование умений работать в группах.
6. Продолжить формирование научного мировоззрения.
Метод обучения: словесный и сопутствующие ему практический и наглядный.
Тип урока: изучение нового материала.
Оборудование: ящички для проведения лабораторных опытов, пробирки, штативы для пробирок, спиртовки, стеклянные палочки, спички, держатели, химические стаканы, предметные стекла, древесина, ткань.
Реактивы: H2SO4( раствор и концентрированная), сахароза, лакмус, метиловый оранжевый, фенолфталеин, H2O, Zn, Al, Cu, CuO, NaOH, CuSO4, BaCl2.
- Организационный момент.
- Актуализация пройденного материала
- Изучение нового материала.
- Физические свойства кислот.
- Химические свойства кислот.
2.1. Демонстрационные опыты.
2.2. Практическая работа. - Обобщение и выводы.
А на прошлом уроке вы узнали о строении и составе молекул кислот.
- Дайте определение классу кислот.
- Исходя из определения выведите общую формулу кислот. (показать формулу на опорном сигнале).
- Кислот достаточно много, а можно ли их классифицировать.
- Какие вы знаете классификации.
- На какие группы делятся кислоты по составу ( приведите примеры).
- На какие группы делятся кислоты по оснoвности (приведите примеры).
- Существует ли общий принцип составления названий кислот или у каждой кислоты свое индивидуальное название.
- Я вижу, что состав и строение кислот вы усвоили достаточно хорошо, но наука химия изучает свойства веществ, а точнее химические свойства. Изучением химических свойств кислот мы и займемся сегодня на уроке.
1. Но прежде чем говорить о химических свойствах кислот, нам необходимо несколько слов сказать и о физических свойствах.
На демонстрационном столе представлены примеры кислот, вы видите, что по агрегатному состоянию все они жидкости. Однако есть одно исключение, кремниевая кислота по агрегатному состоянию напоминает желе. Цвет кислот – все кислоты бесцветные вещества.
Запах – большинство кислот не обладают запахом однако у некоторых представителей, запах резкий неприятный.
а) жидкости (кроме кремниевой кислоты),
б) без цвета,
в) без запаха,
г) кислые на вкус.Ну а теперь, наше внимание направлено на химические свойства.
2.1. Демонстрационные опыты:
С сахарной пудрой.
Надпись на деревянной дощечке.
Я думаю, мы убедились, что кислоты действительно разрушают органические вещества.
Запись в тетради:
Кислоты разрушают органические вещества.
2.2. А как ведут себя кислоты с неорганическими веществами? Чтобы ответить на этот вопрос, вам всем предстоит на некоторое время стать исследователями. Вы все поделены на группы, каждой группе определена своя область исследования и инструкция, как его провести. В каждой группе есть инструктор, который знает по своей теме практически все и будет руководить работой каждой группы. В сложных ситуациях вы можете обратиться за помощью ко мне..
Необходимо точно по инструкции провести эксперимент, записать в тетради уравнения реакций, ответить на предложенные вопросы.
После окончания исследования один человек из группы рассказывает, что и как проводили, показывает результаты исследования, другой человек из группы записывает уравнение реакции на доске под цифрой, которая соответствует номеру вашего опыта.
К концу урока мы составим подробное описание химических свойств кислот, у каждого ученика оно должно быть в тетради.
Работу каждого члена группы оценивает инструктор на оценочном листе, затем с учетом этих оценок и работы на уроке каждый получит итоговую оценку в журнал
1 группа: Изменение окраски индикаторов при действии растворов кислот.
2 группа: Взаимодействие кислот с металлами.
3 группа: Взаимодействие кислот с основными оксидами.
4 группа: Взаимодействие кислот с растворимыми основаниями (щелочами).
5 группа: Взаимодействие кислот с нерастворимыми основаниями.
6 группа: Взаимодействие кислот с солями.
Самостоятельная работа учащихся в группах по инструкциям
Запись на доске ив тетради:
2. Действие индикаторов.
![]()
3. Взаимодействие с металлами ( до Н !)
Кроме4. Взаимодействие с основными оксидами.
![]()
5. Взаимодействие с растворимыми основаниями (щелочами).
![]()
6. Взаимодействие с нерастворимыми основаниями.
![]()
7. Взаимодействие с солями.
![]()
Таким образом, сегодня на уроке мы узнали, что кислоты взаимодействуют с металлами (до водорода), с основными оксидами, с основаниями, с солями, кроме того кислоты изменяют окраску индикаторов и разрушают органические вещества.
V. Закрепление (тест).
VI. Домашнее задание.
Действие кислот на растворы индикаторов.
- 1-ю пробирку добавить 2 – 3 капли лакмуса;
- 2 –ю пробирку добавить 2 – 3 капли метилового оранжевого;
- 3-ю пробирку добавить 2 – 3 капли фенолфталеина.
Какой индикатор не изменяет своей окраски в присутствии раствора кислоты?
Взаимодействие кислот с металлами.
В 1-ю пробирку поместите несколько гранул цинка - Zn;
Во 2-ю пробирку поместите несколько гранул алюминия - Al;
В 3-ю пробирку поместите несколько гранул меди - Cu.
В каждую пробирку прилейте по 2 – 3 мл серной кислоты - H2SO4Во всех ли пробирках происходят химические реакции?
Напишите уравнения тех химических реакций, которые происходят.
Назовите полученные вещества.
Определите тип химических реакций.
Взаимодействие кислот с основными оксидами.
В пробирку поместите несколько гранул оксида меди - CuO.
Затем прилейте 2 – 3 мл серной кислоты - H2SO4Закрепите пробирку в держателе и нагрейте. Нагревание ведите очень осторожно.
По какому признаку определили, что происходит химическая реакция?
Напишите уравнение химической реакции.
Назовите полученные вещества.
Определите тип химической реакции.
Взаимодействие кислот с растворимыми основаниями – щелочами.
В пробирку налейте 1 мл раствора гидроксида натрия - NaOH, добавьте 2 – 3 капли фенолфталеина.
Постепенно по каплям добавьте серную кислоту - H2SO4.
Пробирку слегка встряхните.
Напишите уравнение химической реакции.
Назовите полученные вещества.
Определите тип химической реакции.
Взаимодействие кислот с нерастворимыми основаниями.
В пробирку налейте 1 – 2 мл гидроксида натрия - NaOH , добавьте 1 – 2 мл сульфата меди – CuSO4 .
К полученному осадку прилейте 2 – 3 мл серной кислоты - - H2SO4.
Все содержимое пробирки перемешайте стеклянной палочкой.
Напишите уравнения химических реакций.
Назовите полученные вещества.
Определите тип химической реакции.
Взаимодействие кислот с растворами солей.
В пробирку налейте 1 – 2 мл хлорида бария – BaCl2, затем добавьте 1 – 2 мл серной кислоты - H2SO4.
7. Напишите уравнение химической реакции.
8. Назовите полученные вещества.
9. Определите тип химической реакции.![Нажмите, чтобы узнать подробности]()
Цель: создать условия для освоения новых знаний по теме химические свойства кислот.
Задачи: организовать деятельность учащихся по
- закреплению знаний по классу кислот;
- определению особенностей химических свойств кислот;
- формированию компетентности решения проблемных ситуаций;
- развитию логического мышления учащихся посредством проведения опытов и формулирования выводов по результатам наблюдений;
- развитию познавательного интереса к химии.
Продолжительность занятия: 45 мин.
Материально-техническое обеспечение занятия: лоток с реактивами (цинк (гранулы), медь (кусочки), оксид меди (II) (порошок), окрашенный раствор гидроксида натрия, раствор карбоната натрия, раствор соляной кислоты) и оборудованием (пробирки).
Методическое и дидактическое обеспечение занятия: таблица Д.И. Менделеева, таблица растворимости, электрохимический ряд напряжений металлов; Кузнецова Н.Е. Химия. 8 класс. – М.: Вентана-Граф, 2008, 320 с.: ил., задачник по химии: 8 класс [для учащихся общеобразовательных учреждений] / Н.Е.Кузнецова, А.Н.Лёвкин. – М.: Вентана-Граф, 2010, 128 с.: ил.
Методические приёмы: беседа по вопросам, в т.ч. проблемный вопрос, классификации; установления аналогии, обобщения, систематизации, конкретизации, обсуждения результатов наблюдений.
Читайте также:







