Модели строения атома конспект
Обновлено: 03.07.2024
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Строение атома
Долгое время атом считался мельчайшей частицей вещества, но в 1897 году Томсон открыл электроны, и оказалось, что они вылетают из атомов. Следовательно, атом имеет сложное строение.
Таким образом, к началу XX века учёные сделали вывод о том, что атомы материи имеют сложную внутреннюю структуру. Они являются электрически нейтральными системами, а носителями отрицательного заряда атомов являются лёгкие электроны, масса которых составляет лишь малую долю массы атомов. Однако модель атома Томсона находилась в полном противоречии с экспериментами по изучению распределения положительных зарядов.
Для экспериментального изучения распределения положительного заряда, а значит, и массы внутри атома Эрнест Резерфорд в 1906 г. предложил применить зондирование атома α-частицами, скорость которых составляет 1/15 скорости света.

Весь прибор размещался в сосуде, из которого был откачан воздух. Радиоактивный препарат, помещался внутри свинцового цилиндра, вдоль которого был высверлен узкий канал. Пучок α-частиц из канала падал на тонкую фольгу из тяжёлого металла. После рассеяния α-частицы попадали на полупрозрачный экран, покрытый сульфидом цинка. Столкновение каждой частицы с экраном сопровождалось сцинтилляцией (вспышкой света), которую можно было наблюдать в микроскоп.
Чтобы обнаружить отклонение α-частиц на большие углы Резерфорд окружил фольгу экранами.

Резерфорд, изучая рассеяние быстрых α-частиц при прохождении их через тонкую золотую фольгу, обнаружил, что все α-частицы рассеиваются на всевозможные углы, вплоть до углов, близких к 180°.

Планетарная модель атома Резерфорда: в целом атом нейтрален, в центре атома расположено положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Число внутриатомных электронов, как и заряд ядра, равны порядковому номеру элемента в периодической системе Д. И. Менделеева.
Электроны движутся вокруг ядра, подобно тому, как планеты обращаются вокруг Солнца.
Противоречия модели атома (по Резерфорду)
1. Обращающиеся вокруг ядра электроны обладают центростремительным ускорением, а значит, должны излучать. За счет кулоновских сил расстояние между электроном и ядром непрерывно уменьшается, а частота непрерывно растет и в рамках классической физики спектр излучения атома — непрерывный , что противоречит эксперименту.
Оставаясь в рамках классической механики, Резерфорд не смог разрешить данные противоречия.
На смену планетарной теории пришли постулаты Бора. В 1913 году выдающийся датский физик Нильс Бор на основе своих наблюдений и фактов, полученных опытным путем, установил, что большая часть представлений о строении атома не соответствовала действительности. Он же стал основоположником новой теории о строении атома.
Постулаты Бора
1. Атомная система может находиться только в особых стационарных, или квантовых, состояниях, каждому из которых соответствует определённая энергия. В стационарном состоянии атом не излучает.
2. Излучение света происходит при переходе атома из стационарного состояния с большей энергией E k в стационарное состояние с меньшей энергией E n . Энергия излученного фотона равна разности энергий стационарных состояний:
Если E k > E n , то происходит излучение фотона , если E k n , то происходит поглощение фотона , при котором атом переходит из одного стационарного состояния в другое.
Ключевые слова конспекта: строение атома, элементарные частицы, протоны и электроны в атомах, атомный номер, массовой число, число нейтронов, нуклид, изотопы, ионы, катионы, заряд иона.
Согласно модели Резерфорда каждый атом состоит из находящегося в его центре ядра и электронной оболочки. Весь положительный заряд и почти вся масса атома сосредоточены в его ядре. Электроны движутся вокруг ядра. Число электронов атома равно положительному заряду ядра.
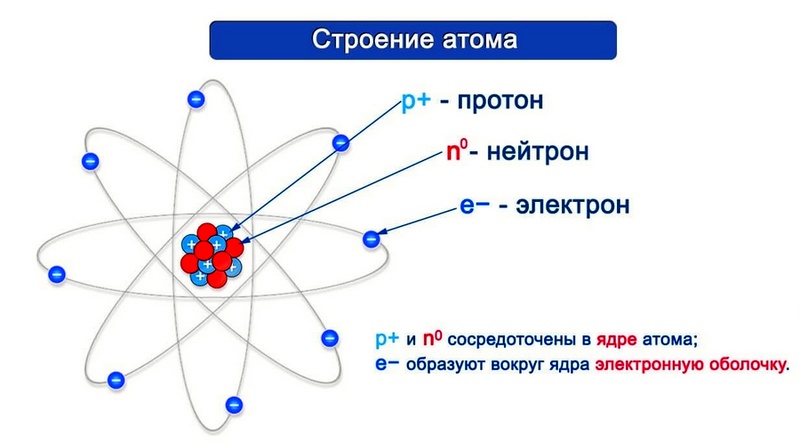
Диаметр атома 10 -10 м, диаметр ядра 10 -14 – 10 -15 м. Масса атома водорода равна 1,67 • 10 -24 г, атома углерода — 1,99 • 10 -23 г, атома железа — 9,29 • 10 -23 г.
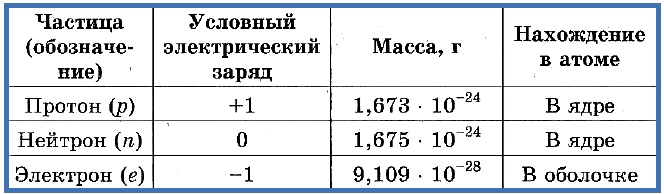
Элементарные частицы — это протоны, электроны и нейтроны, из них состоят все атомы.
Число протонов разное у атомов различных видов, оно определяет заряд ядра атома и равно атомному номеру элемента в таблице Менделеева. Поскольку атом — электро-нейтральная частица, число электронов в нем равно числу протонов.
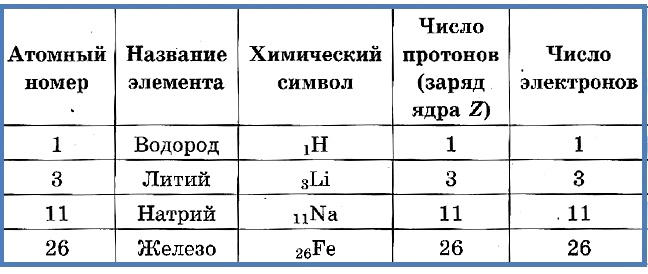
Атомный номер указывают слева внизу от символа элемента, например: 1Н, 26Fe. Обозначение атомного номера — прописная латинская буква Z.
Массовое число атома А — это сумма чисел его протонов и нейтронов в ядре. Массовое число указывают слева вверху от символа элемента или добавляют к названию элемента через дефис, например: 23 Na или натрий-23.
Массовое число кислорода, А( 16 О) = 16 = (8р + 8n).
Число нейтронов N в ядре атома определяют по формуле: N = A — Z. Например, для атома натрия с массовым числом 23, 23 Na: А = 23, Z = 11, N = А – Z = 23 — 11 = 12.
Нуклид — это вид атомов с определенным числом протонов и нейтронов в ядре. Например, в природе встречается три вида нуклидов кислорода: 16 О, 17 О и 18 О.
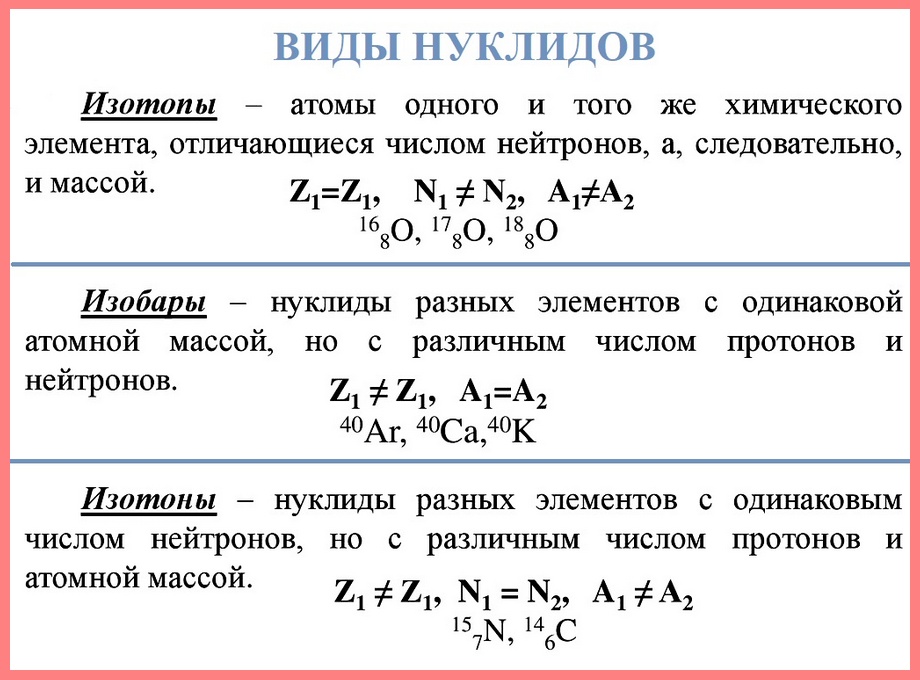
Изотопы — это атомы одного вида с одинаковым числом протонов, но разным числом нейтронов. Так, атомы 16 О, 17 О и 18 О — это изотопы. Природные изотопы урана — 234 U, 235 U и 238 U.
Ионы — заряженные частицы, образующиеся при отщеплении от нейтральных атомов или присоединении к ним электронов. Ионы образуются также из молекул в результате присоединения протона Н + (NH3 → NH4 + ) или отщепления Н + (HNO3 -> NO3 – ).

Катионы — это положительно заряженные ионы (Na + , Аl 3+ ), анионы — отрицательно заряженные ионы (Cl – , NO3 – ).
Заряд иона указывают в виде индекса справа вверху от символа химического элемента: Li + , Са 2+ . На первом месте пишут цифру, на втором — знак заряда. Цифру 1 не пишут.
Атомы каждого химического элемента имеют строго индивидуальный линейчатый спектр, присущий только данному элементу и не меняющийся от опыта к опыту. Как это можно объяснить? Как вывести формулу, дающую весь набор частот атомного спектра? Чтобы сделать это, нужно узнать, как устроен атом.
Модель Томсона
Согласно Томсону атом представляет собой шар размером порядка см. По этому шару некоторым образом распределён положительный заряд, а внутри шара, подобно изюминкам, находятся электроны (рис. 1 ).

Рис. 1. Модель атома Томсона
Суммарный заряд электронов в точности равен положительному заряду шара, поэтому атом в целом электрически нейтрален.
Излучение атомов объясняется колебаниями электронов около положений равновесия (как вы помните, любой ускоренно движущийся заряд излучает электромагнитные волны). Однако вся совокупность экспериментальных данных по атомным спектрам не укладывалась в модель Томсона. Например, для некоторых химических элементов были подобраны формулы, хорошо описывающие их спектры, но эти формулы из модели Томсона никак не следовали.
Опыты Резерфорда
Резерфорд говорил об -частицах как об ионах гелия; сейчас мы знаем, что это ядра гелия.
Но в те времена об атомных ядрах ещё ничего не знали — о них Резерфорду лишь предстояло догадаться, глядя на результаты своих знаменитых опытов!
Каково же было всеобщее удивление, когда такие частицы обнаружились! Да, как и следовало ожидать, подавляющая доля -частиц отклонялась несущественно. Но совсем небольшая их часть (примерно одна частица из нескольких тысяч) отклонялась на угол, больший (рис. 2 ).

Рис. 2. Рассеяние -частиц на атомах
Эти отклонения казались совершенно невероятными. По словам Резерфорда, дело выглядело так, словно артиллерийский снаряд налетел на кусок бумаги и от удара повернул назад.
Расчёты, однако, показывают, что такое поле оказывается слишком слабым — его тормозящего действия никак не хватит для того, чтобы остановить -частицу и отбросить её назад!
Таким образом, наличие -частиц, отброшенных фольгой, опровергло модель Томсона. Что же было предложено взамен?
Планетарная модель атома
Чтобы отбросить -частицу, положительный заряд атома должен создавать куда более сильное электрическое поле, чем то, которое получается в модели Томсона. А чтобы создать такое поле, положительный заряд должен быть сосредоточен в области, гораздо меньшей размера атома.
Размер этой области можно вычислить. Если положительный заряд занимает область размером , то вблизи заряда создаётся электрическое поле с потенциалом
Зная кинетическую энергию -частицы, можно найти величину тормозящего потенциала , а затем и размер положительно заряженной области. Вычисления, проведённые Резерфордом, дали следующий результат:
Эта величина на пять порядков (в сто тысяч раз!) меньше размера атома. Так на смену модели Томсона пришла планетарная модель атома (рис. 3 ).

Рис. 3. Планетарная модель атома
В центре атома находится крошечное положительно заряженное ядро, вокруг которого, словно планеты вокруг Солнца, движутся электроны. Между ядром и электронами действуют силы кулоновского притяжения, но упасть на ядро электроны не могут за счёт своего движения — точно так же, как и планеты не падают на Солнце, хоть и притягиваются к нему.
Заряд ядра по модулю равен суммарному заряду электронов, так что атом в целом электрически нейтрален. Однако электроны могут быть выбиты из своих орбит и покинуть атом — тогда атом превращается в положительно заряженный ион.
Масса электронов составляет очень малую часть общей массы атома. Например, в атоме водорода всего один электрон, и его масса в раз меньше массы ядра. Следовательно, почти вся масса атома сосредоточена в ядре — и это при том, что ядро в сто тысяч раз меньше самого атома.
Чтобы лучше почувствовать соотношение масштабов атома и ядра, представьте себе, что атом стал размером с Останкинскую телебашню ( м). Тогда ядро окажется горошиной размером мм, лежащей у вас на ладони. И тем не менее, почти вся масса атома заключена в этой горошине!
Вот таким удивительным объектом оказался атом. Однако планетарная модель атома, объяснив результаты опытов Резерфорда по рассеянию -частиц, оказалась лишь первым шагом на пути к пониманию внутриатомных процессов. А именно, планетарная модель приводила к одному серьёзному противоречию, и преодоление этого противоречия Нильсом Бором положило начало физике атома. Читаем следующий листок!

Атом – наименьшая частица вещества. Его изучение началось еще в Древней Греции, когда к строению атома было приковано внимание не только ученых, но и философов. Каково же электронное строение атома, и какие основные сведения известны об этой частице?
Строение атома
Уже древнегреческие ученые догадывались о существовании мельчайших химически частиц, из которых состоит любой предмет и организм. И если в XVII-XVIII вв. химики были уверены, что атом неделимая элементарная частица, то на рубеже XIX-XX вв., опытным путем удалось доказать, что атом не является неделимым.
Атом, будучи микроскопической частицей вещества, состоит из ядра и электронов. Ядро в 10000 раз меньше атома, однако практически вся его масса сосредоточена именно в ядре. Главной характеристикой атомного ядра, является то, что он имеет положительный заряд и состоит из протонов и нейтронов. Протоны заряжены положительно, а нейтроны не имеют заряда (они нейтральны).
Связаны они друг с другом с помощью сильного ядерного взаимодействия. Масса протона примерно равна массе нейтрона, но при этом в 1840 раз больше массы электрона. Протоны и нейтроны имеют в химии общее название – нуклоны. Сам атом является электронейтральным.
Атом любого элемента можно обозначить электронной формулой и электронно графической формулой:
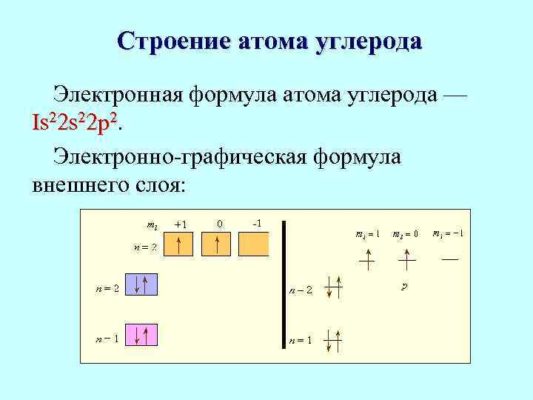
Рис. 1. Электронно-графическая формула атома.
Единственным химическим элементом из периодической системы, в ядре которого не содержатся нейтроны, является легкий водород (протий).
Электрон является отрицательно заряженной частицей. Электронная оболочка состоит из движущихся вокруг ядра электронов. Электроны имеют свойства притягиваться к ядру, а между друг друг на них оказывает влияние кулоновское взаимодействие. Чтобы преодолеть притяжения ядра, электроны должны получать энергию от внешнего источника. Чем дальше электрон находится от ядра, тем меньше энергии для этого необходимо.
Модели атомов
На протяжении долго времени ученые стремились познать природу атома. На раннем этапе большой вклад внес древнегреческий философ Демокрит. Хотя сейчас его теория и кажется нам банальной и слишком простой, в тот период, когда представления об элементарных частицах только начинало зарождаться, его теория о кусочках материи воспринималась совершенно серьезно. Демокрит считал, что свойства любого вещества зависят от формы, массы и других характеристик атомов. Так, например, у огня, полагал он, острые атомы – поэтому огонь обжигает; у воды атомы гладкие, поэтому она способна течь; у твердых предметов, по его представлению, атомы были шереховатые.
Демокрит считал, что из атомов состоит абсолютно все, даже душа человека.
В 1904 году Дж. Дж. Томсон предложил свою модель атома. Основные положения теории сводились к тому, что атом представлялся положительно заряженным телом, внутри которого находились электроны с отрицательным зарядом. Позже эта теория была опровергнута Э. Резерфордом.

Рис. 2. Модель атома Томсона.
Также в 1904 году японским физиком Х. Нагаока была предложена ранняя планетарная модель атома по аналогии с планетой Сатурн. Электроны по этой теории объединены в кольца и вращаются вокруг положительно заряженного ядра. Эта теория оказалась ошибочной.
В 1911 году Э. Резерфорд, проделав ряд опытов, сделал выводы, что атом по своему строению похож на планетную систему. Ведь электроны, словно планеты, движутся по орбитам вокруг тяжелого положительно заряженного ядра. Однако это описание противоречило классической электродинамике. Тогда датский физик Нильс Бор в 1913 году ввел постулаты, суть которых заключалась в том, что электрон, находясь в некоторых специальных состояниях, не излучает энергию. Таким образом, постулаты бора показали, что для атомов классическая механика неприменима. Планетарная модель, описанная Резерфордом и дополненная Бором, получила название – планетарная модель Бора-Резерфорда.

Рис. 3. Планетарная модель Бора-Резерфорда.
Дальнейшее изучение атома привело к созданию такого раздела, как квантовая механика, с помощью которого объяснялись многие научные факты. Современные представления об атоме развились из планетарной модели Бора-Резерфорда.
Что мы узнали?
В данной статье по химии (8 класс) рассказывается кратко и понятно о строении атома. На протяжении многих веков ученые разных стран изучали мельчайшие частицы вещества. Появлялись разные теории, модели и разные формулы строения атома. Современные представления об атоме основываются на модели Бора-Резерфорда, по которой атом состоит из ядра и электронного облака, в котором электроны движутся вокруг ядра.
Читайте также:

