Конспект урока получение и применение алкенов
Обновлено: 03.07.2024
Тема урока: Алкены: строение, изомерия, свойства, применение.
Цель урока: создать условия для формирования знаний об алкенах как классе непредельных углеводородов, об особенностях их электронного строения, изомерии, химических свойствах, способах получения и их применения.
Задачи урока
Обучающие: изучить алкены, развивая знания о кратной двойной связи между атомами углерода; рассмотреть изомерию и номенклатуру алкенов; изучить химические свойства алкенов, качественные реакции на П-связь, правило Марковникова, правило Зайцева познакомить учащихся с основными промышленными и лабораторными способами получения.
Развивающие: способствовать развитию логического мышления и интеллектуальных умений (анализировать, сравнивать, устанавливать причинно-следственные связи).
Воспитательные: продолжить формирование культуры умственного труда; коммуникационных навыков.
Тип урока: изучение нового материала.
Организационная форма: фронтальный опрос, беседа по проблемным вопросам, рефлексия.
Средства обучения: таблицы, химическое оборудование и реактивы, медиапроектор.
Программное обеспечение: компьютерная презентация к уроку.
Оборудование и реактивы:
Для демонстрации: штатив ученический с лапкой, пробирка, пробка с газоотводной трубкой, этиловый спирт, концентрированная серная кислота, спички, спиртовка, пробирка с раствором йода (имитация бромной воды) и пробирка с раствором перманганата калия КМnО 4 .
коллекции полимерных образцов полиэтилена с разной степенью полимеризации; портрет В.В.Марковникова.
I. Организационный момент. (1 мин)
II. Постановка темы и учебной цели. (3 мин.)
(Стадия вызова ) СЛАЙД 2.
1) Выберите одно лишнее. Объясните свой выбор
1) пропан 2) пропен 3) циклопропан 4) бутан
2) Выберите одно лишнее. Объясните свой выбор.
Учащиеся должны прийти к выводу, что изучать на уроке более подробно будем класс алкены. Так как это не первый класс углеводородов, который мы изучаем, то план изучения учащимся знаком. Исходя из строения, предполагаем, какие виды изомерии характерны для них. Прогнозируем, какими свойствами должны обладать данные углеводороды. Учащиеся работают в группах, изучая материал учебника , каждая группа работает над своей темой.
III. Изучение нового материала (стадия осмысления)
Работа в группах.(5 мин)
Изучить строение алкенов: выяснить тип гибридизации, геометрию молекулы, угол связи, длину двойной связи, схему образования двойной связи
Выяснить возможные виды изомерии алкенов. Изомеры для С 4 Н 8
Изучить химические свойства: реакции присоединения, реакции окисления, качественные реакции на п-связь.
Рассмотреть способы получения алкенов: в лаборатории и промышленности.
Выступление в группах корректируется с помощью презентации.
Комментарии к презентации , запись уравнений реакций в тетрадях. (15мин.)
Строение СЛАЙД 4
Виды изомерии
Изомерия углеродного скелета СЛАЙД 5
Изомерия положения двойной связи СЛАЙД 6
С 4 Н 8 СН 2 = СН - СН 2 – СН 3 и СН 3 - СН = СН – СН 3
-
ежклассовая изомерия (циклоалканы) СЛАЙД 7
Химические свойства
Реакции присоединения: СЛАЙД 8
А) Гидрирование (присоединение водорода)
СН 2 =СН 2 +Н 2 → СН 3 -СН 3
Б) Бромирование (присоединение брома).
Качественная реакция на П-связь.
СН 2 =СН 2 + Br 2 → СН 2 Br - СН 2 Br
В) Гидратация (присоединение воды) СЛАЙД 9
СН 2 = СН – СН 3 + H 2 O → СН 3 - СН 2 OH – СН 3
Г) Гидрохлорирование (присоединение хлороводорода)
СН 2 = СН – СН 3 + НС l → СН 3 – СНС l – СН 3
Д ) Реакция полимеризации
(соединение множества одинаковых молекул) СЛАЙД 10
СН 2 =СН 2 + СН 2 =СН 2 + СН 2 =СН 2 +…→ -СН 2 - СН 2 - СН 2 - СН 2 - СН 2 -СН 2 - … Этилен полиэтилен
Реакции окисления СЛАЙД 11
А) Горение С 2 Н 4 +3О 2 → 2СО 2 +2Н 2 О
Б) Окисление перманганатом калия. Качественная реакция на П -связь.
СН 2 =СН 2 + Н-ОН+[О] → CH 2 – CH 2
Этиленгликоль (двухатомный спирт)
Получение .
В лаборатории. Демонстрационный эксперимент (получение этилена и взаимодействие с иодной водой (имитация бромной воды) и раствором перманганата калия.) Горение этилена.
СЛАЙД 12 CH 3 – CH 2 – OH Н 2SO4 CH 2 = CH 2 + H 2 O

Видеоурок посвящён изучению физических и химических свойств алкенов, способам их получения, а также применению некоторых алкенов.
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Алкены: свойства, получение и применение"
По своим свойствам алкены значительно отличаются от алканов. Например, для них характерны реакции присоединения и окисления. Все реакции присоединения происходят за счёт разрыва π-связи, большинство реакций окисления идут по этому же механизму.
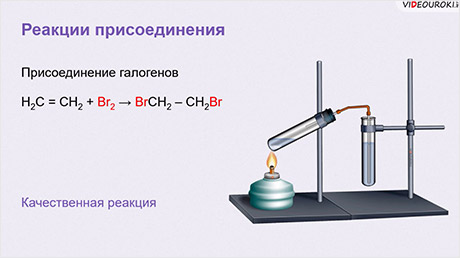
Так, алкены присоединяют при комнатной температуре галогены: хлор, бром, менее эффективно – йод. В реакции бутена-2 с хлором образуется 2,3-дихлобутан.
В процессе реакции происходит разрыв π-связи в молекуле пропена и σ-связи в молекуле хлора с образованием двух новых σ-связей.
Кроме этого, алкены, в частности этилен, обесцвечивают раствор брома в воде. Поэтому данная реакция является качественной на присутствие двойных связей.
1, 2-дибромэтан (растворитель)
Но еще в 1884 году русский ученый Львов М. Д. провёл реакцию хлорирования пропена в более жёстких условиях, при t = 400 0 C. В результате получился продукт не присоединения хлора, а замещения.
Алкены вступают в реакции гидрирования – присоединения водорода. Данные реакции идут при обычной или повышенной температуре под действием катализаторов: платины, палладия, никеля и других.
Алкены вступают в реакции присоединения воды – гидратации. Присоединение воды к алкенам идёт по правилу Марковникова, согласно которому атом водорода при присоединении воды или галогеноводородов присоединяется к наиболее гидрогенизированному атому углерода.
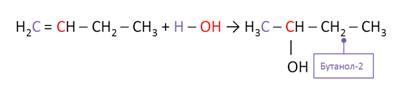
Присоединение воды происходит только в присутствии кислоты и при нагревании. (H3PO4, t, 0 С) В результате присоединения воды к бутену образуется бутанол-2. Атом водорода от воды присоединился к наиболее гидрогенизированному атому углерода, то есть к тому атому, где больше атомов водорода при двойной связи, а ОН-группа присоединилась к другому атому углерода при двойной связи.
По такому же принципу идёт присоединение и галогеноводородов. Так, в реакции пропена с хлороводородом образуется 2-хлопропан.

Особым случаем реакции присоединения является реакция полимеризации.
Полимеризацией называется последовательное соединение молекул ненасыщенных соединений за счёт разрыва π-связей с образованием высокомолекулярных соединений.
Исходный алкен при этом называется мономером, а образующийся в результате продукт – полимер.
Полимеризацию проводят в присутствии веществ – инициаторов. Буква n обозначает степень полимеризации, которая показывает число молекул мономера, которое соединяется в процессе полимеризации. Реакция полимеризации протекает при повышенной температуре, давлении, в присутствии катализаторов.
Например, при полимеризации этилена образуется полиэтилен, при полимеризации винилхлорида – поливинилхлорид, при полимеризации тетрафторэтилена – тефлон, при полимеризации пропена – полипропилен, при полимеризации стирола – полистирол.

В реакциях окисления разрывается π-связь или С = С -связи. Алкены легко реагируют с окислителя. Если пропустить этилен через разбавленный раствор перманганата калия при низкой температуре, то фиолетовая окраска раствора исчезает. При окислении этилена перманганатом калия образуется этиленгликоль, эта реакция служит качественной реакцией на алкены. Эта реакция называется реакцией Вагнера.
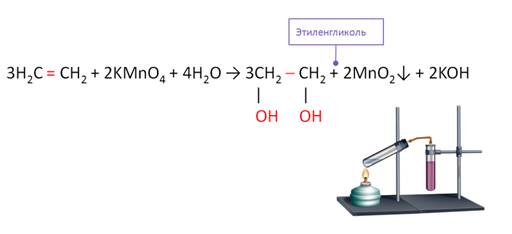
Этиленгликоль используют в качестве антифриза.
При каталитическом окислении этилена – в присутствии солей палладия и меди (PdCl2, CuCl2) – происходит образование уксусного альдегида.
При окислении алкенов надкислотами или пероксидами водорода в щелочной среде образуются эпоксиды. Эта реакцию называют реакцией Прилежаева.

Николай Александрович Прилежаев – русский химик. Разработал синтез эпоксидов при действии на алкены органических надкислот.
При полном окислении алкенов – горении в избытке кислорода образуется углекислый газ и вода. Этилен, например, горит светящимся жёлтым пламенем.
Из алкенов самым распространенным продуктом, который получают, является этилен. В промышленных масштабах его получают высокотемпературным разложением углеводородов нефти. Наибольший выход получается при пиролизе этана.


В лаборатории этилен получают дегидратацией этанола. Реакция идёт при температуре более >140 С, в присутствии серной кислоты.

Алкены можно получить отщеплением галогеноводорода от галогеналканов. В зависимости от структуры исходного галогеналкана получается смесь алкенов. Так, при действии на 2-бромбутан спиртовым раствором щёлочи при нагревании получается бутен-1 и в качестве основного продута бутен-2.

Алкены можно получить и при дегидратации спиртов – отщеплении воды при нагревании с концентрированными растворами минеральных кислот. Отщепление воды и галогеналканов идёт по правилу Зайцева: при отщеплении галогеноводородов или воды от галогеналканов или спиртов атом водорода отщепляется от наименее гидрогенизированного атома углерода.
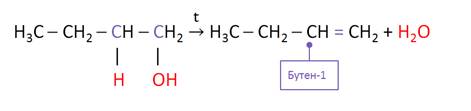
Алкены можно получить и при гидрировании алкинов. Так, при присоединении водорода к бутину-1 образуется бутен-1.

Алкены используют для получения спиртов, антифризов, лекарственных средств, полимерных материалов.
Из этилена получают полиэтилен, поливинилхлорид, этанол, уксусную кислоту, антифриз, ацетальдегид, каучуки, взрывчатые вещества, пестициды, растворители, этилен применяют для ускорения созревания плодов. Большое количество этилена перерабатывается в полиэтилентерефталат, необходимый для производства волокна лавсан.
Один из синтезируемых растениями фитогормонов, газ этилен, способствует созреванию плодов, причём он образуется, даже если плод уже сорван с ветки.
Таким образом, этилен и его гомологи могут присоединять галогены, водород, галогеноводороды, воду. Качественной реакцией на двойную связь является реакция с бромной водой и раствором перманганата калия. Для алкенов свойственны реакции полимеризации – получения высокомолекулярных соединения из низкомолекулярных. В лаборатории этилен получают дегидратацией этанола. Другие алкены в лаборатории получают отщеплением воды от спиртов, галогеноводорода от галогеналканов и гидрированием алкинов.
Цель урока: рассмотреть различные способы получения алкенов, их физические и химические свойства и применение через работу с различными источниками информации.
- разобрать промышленные и лабораторные способы получения алкенов;
- изучить физические и химические свойства алкенов;
- определить личную значимость полученных знаний, рассмотрев области практического применения алкенов на примере этилена и пропилена;
- продолжить формирование умения работать с учебными текстами.
I. Организационный момент.
II. Д/з: параграф 10, стр. 43 (?) 10, 11, 14, 15 (у), 12, 16 (п); и как вариант, предлагаю для желающих расширить свои знания (?) 13 (п).
III. Актуализация знаний.
- Какой класс соединений мы начали изучать на прошлом уроке? (алкены).
- Что такое алкены? Дайте определение (алкены – это углеводороды с общей формулой CnH2n, в молекулах которых между атомами углерода имеется одна двойная связь).
- Простейший представитель алкенов? (этилен C2H4).
- Итак, чтобы определить тему сегодняшнего урока и поставить перед собой цели, необходимо выяснить и повторить, что нам уже известно об алкенах.
- Что мы уже знаем об этих органических соединениях? (строение, гомологию, изомерию, номенклатуру).
Задание на повторение.
Чтобы освежить в памяти основные моменты, предлагаю выполнить следующее задание (Приложение 1, слайд 1).
Даны формулы веществ и их названия:
I ряд – проверьте, правильно ли названы вещества;
II ряд – определите изомеры;
III ряд – найдите гомологи.
I ряд – неправильно названо вещество б), так как нумерация атомов углерода должна начинаться с того конца, где ближе двойная связь. Вещество называется 3–метилпентен-2.
- Какие вещества называют изомерами? (вещества, имеющие один и тот же состав и одну и ту же молекулярную массу, но разное строение).
- Какие еще виды изомерии характерны для алкенов? (углеродного скелета, межклассовая, цис-, транс-изомерия).
- Какие вещества называют гомологами? (вещества, сходные по своему строению и свойствам, но отличающиеся друг от друга по составу на одну или несколько групп – CH2).
- Как называется группа – CH2? (гомологическая разность).
- Почему вещество г) не прозвучало в ваших ответах? (это алкан).
IV. Изучение нового материала.
- Что еще мы рассматриваем при изучении классов органических соединений, кроме строения, гомологии, изомерии и номенклатуры? (получение, свойства и применение).
Итак, тема урока: “Получение, свойства и применение алкенов” (Приложение 1, слайд 2).
- Как мы рассматриваем получение? (в лаборатории и промышленности).
- Какие свойства изучаем? (физические и химические).
- Для чего знакомимся с применением? (чтобы знать, где вещества используются и какую личную значимость для нас они представляют) (Приложение 1, слайд 3).
Чтобы достигнуть поставленной цели, мы будем работать с текстовыми источниками информации – это наш учебник (авторы Г.Е. Рудзитис, Ф.Г. Фельдман) и в дополнении еще один учебник по химии (авторы О.С. Габриелян, Ф.Н. Маскаев, С.Ю. Пономарев, В.И. Теренин).
- I ряд - рассматривает химические свойства алкенов;
- II ряд – знакомиться с получением;
- III ряд – изучает физические свойства (перевод текстовой информации в таблицу) и применение (перевод информации в текстовую форму).
Когда отвечают ученики одного ряда, другие заполняют рабочий лист.
Учитель дополняет ответы учеников и предлагает одно задание на закрепление изученного материала (Приложение 1, слайды 4, 5, 6, 7, 8, 9, 10, 11).
VI. Подведение итогов.
Что мы сегодня узнали об алкенах? Достигнули ли поставленной цели? (Приложение 1, слайд 12).
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Муниципальное бюджетное общеобразовательное учреждение
Конспект урока в 10 классе



Разработала: учитель химии, ВК,
Виноградова К. А.
Тема: Получение и применение алкенов.
1. Образовательные цели. Ознакомить учащихся основными способами промышленного и лабораторного получения алкенов; применением УВ ряда этилена.
2. Развивающие цели:
- развитие мышления, на основе установления причинно-следственных связей (свойства-применение);
- развитие умения составлять уравнения химических реакций;
-развитие навыков устной и письменной речи.
3. Воспитательные цели:
-воспитание в учениках средствами урока уверенность в своих силах;
-воспитание убеждённости в позитивной роли химии в жизни современного общества;
-применение полученных знаний для безопасного использования веществ и материалов в быту и повседневной жизни;
- воспитание умения работать в группе и выступать на публике.
Тип урока: изучения нового материала с использованием кейс-технологии.
Методы организации и осуществления учебно-познавательной деятельности : словесный, наглядный, метод самостоятельной работы (работа в группах), поисковый, здоровьесберегающий, ИКТ.
Оборудование:
Организационный момент.
Какое вещество получено в опыте?
Какие углеводороды называются алкенами?
Какова общая формула алкенов?
Какое химическое свойство продемонстрировано и какими еще обладает?
Какие способы получения алкенов вы знаете? Каким лабораторным способом можно получить алкены?
Для чего используют алкены?
Скажите, пожалуйста, при ответе на какие вопросы у вас возникли затруднения?
Работа с кейсами.
Сегодня на уроке вы будете работать с информационными кейсами. На подготовку ответа вам отводится 10 мин, а затем мы с вами проверяем.
Начнем проверять ваши ответы на предложенные кейсы. Прослушав выступление групп с кейсами № 1 и № 2, вам в тетради необходимо будет заполнить следующую схему:
Промышленные способы получения алкенов.
Природных источников с большим содержанием алкенов не существует, поэтому химики разработали удобные методы их синтеза. В промышленности эти углеводороды получают высокотемпературным разложением высших алканов, которое называется крекингом.
1 способ: дегидрирование алканов. Составить уравнение реакции, пояснить условия.
Дать определение понятию: крекинг.
2 способ: термический крекинг алканов. Составить уравнение реакции, пояснить условия.
Составить 3 вопроса по данной теме.
Лабораторные способы получения алкенов.
В лаборатории алкены можно синтезировать из органических соединений других классов, например, из спиртов.
2 способ: дегидрогалогенирование моногалогенпроизводных. Составить уравнение реакции, пояснить условия.
3 способ: дегалогенирование дигалогенпроизводных.Составить уравнение реакции, пояснить условия.
Составить 3 вопроса по данной теме.
Физкультминутка
В целях профилактики улучшения зрения на каждом уроке используются упражнения, укрепляющие мышцы глаз. Упражнения выполняются сидя на стуле, спина прямая, руки лежат на коленях. Каждый раз по мере выполнения отдельных упражнений взгляд фокусируется на каком-нибудь предмете. Это способствует концентрации зрения.
Упражнения для глаз:
Несколько раз посмотреть вверх, вниз, вверх, вниз.
Глаза вверх, прямо перед собой, вниз, прямо, вверх и т. д. Закрыть глаза.
Несколько раз поочередно посмотреть направо, налево. Закрыть глаза.
Посмотреть прямо, направо, прямо, налево и т.д. Закрыть глаза.
Посмотреть вверх, в правый угол, вниз, в левый угол. Затем сменить направление.
Медленно вращать глазами по кругу вправо, закрыть глаза; влево, закрыть глаза.
Попеременно посмотреть на кончик своего носа, затем на предмет вдали.
Попеременно посмотреть на кончик своего пальца, расположенного на расстоянии 30 – 35 см, затем на предмет вдали.
Попеременно сосредоточить взгляд на каком-нибудь предмете (видеть его четкое изображение)
Крепко зажмурить глаза, а затем несколько раз быстро поморгать
Прослушав выступление группы с кейсом № 3, вам в тетради необходимо будет заполнить следующую схему:
6. Особое свойство
Применение алкенов.
Благодаря высокой химической активности алкены являются ценным сырьем для синтеза многих органических веществ. Особенно широко с этой целью используют этилен.
Составить уравнение реакции получения этилового спирта из этилена.
Составить уравнение реакции получения полиэтилена из этилена.
Составить 3 вопроса по данной теме.
А теперь приступаем к закреплению знаний. Группа № 4 подготовила для вас тестирование в формате ЕГЭ по сегодняшней теме. Приготовьтесь к выполнению теста.
Закрепление знаний и подготовка к ЕГЭ.
Из заданий ЕГЭ составить вопросы по изучаемой теме.
Провести тестирование учащихся.
Закрепление знаний.
Вы дома при подготовке к сегодняшнему уроку подготовили вопросы по темам своих кейсов. Обменяйтесь группы своими вопросами и ответьте на вопросы другой группы и оцените друг друга.
Домашнее задание.
Готовимся к ЕГЭ. Органическая химия. Пособие для учащихся. И. Н. Новошинский, Н. Н. Новошинская.
Химия. Подготовка к ЕГЭ. Тематические тесты. Базовый и повышенный уровни. 10-11 класс. В. Н. Доронькин.
- подготовка к ЕГЭ/ОГЭ и ВПР
- по всем предметам 1-11 классов
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 933 человека из 80 регионов

Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 24 человека из 17 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- ЗП до 91 000 руб.
- Гибкий график
- Удаленная работа
Дистанционные курсы для педагогов
Свидетельство и скидка на обучение каждому участнику
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 610 950 материалов в базе
Материал подходит для УМК
§ 4. Алкены. Этилен
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
Свидетельство и скидка на обучение каждому участнику
Другие материалы
Вам будут интересны эти курсы:
Оставьте свой комментарий
- 18.11.2018 2038
- DOCX 143 кбайт
- 84 скачивания
- Оцените материал:
Настоящий материал опубликован пользователем Виноградова Ксения Алексеевна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
40%
- Подготовка к ЕГЭ/ОГЭ и ВПР
- Для учеников 1-11 классов
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Минобрнауки и Минпросвещения запустили горячие линии по оказанию психологической помощи
Время чтения: 1 минута
Время чтения: 2 минуты
Минпросвещения России подготовит учителей для обучения детей из Донбасса
Время чтения: 1 минута
Курские власти перевели на дистант школьников в районах на границе с Украиной
Время чтения: 1 минута
Отчисленные за рубежом студенты смогут бесплатно учиться в России
Время чтения: 1 минута
Рособрнадзор предложил дать возможность детям из ДНР и ЛНР поступать в вузы без сдачи ЕГЭ
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Читайте также:

