Конспект на тему основания в свете тэд
Обновлено: 04.07.2024
1. Распределить основания по группам и привести примеры их диссоциации: KOH, Zn(OH)2, Cu(OH)2, Al(OH)3, NaOH, Mg(OH)2. Какие из этих оснований будут электролитами?
| Расворимые/щелочи/ | Амфотерные | Нерастворимые |
| Однокислотные | ||
| Двухкислотные | ||
| Трехкислотные |
2. Закончить уравнения реакций в молекулярном и ионном виде:
2ой этап. /для класса/ тест
3-й этап. /проверка тестов карандашом и выставление оценок/, проверка работ у доски. /5 мин./
4-й этап. Химический эксперимент.
/работа в группах по 2 человека/ Провести опыты, записать УР в молекулярном и ионном виде, сделать выводы./ Карточки 2 варианта, работа в группе по 2 человека/.

Данный видеофрагмент направлен на повторение классификации оснований, а также изучение химических свойств оснований. В уроке приведены соответствующие уравнения реакций, сопровождающиеся иллюстрациями, объяснением, он включает в себя лабораторные опыты, предусмотренные программой.
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Свойства оснований в свете ТЭД"
Прежде, чем изучать свойства оснований, давайте с вами вспомним классификацию оснований по нескольким признакам.
Классификация оснований
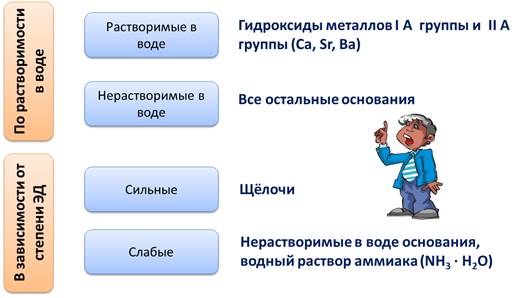
По растворимости в воде основания делятся на растворимые в воде, или щёлочи, к ним относятся гидроксиды металлов I A группы главной подгруппы и гидроксиды металлов II A группы главной подгруппы, таких как Ca, Sr, Ba. Все остальные основания являются нерастворимыми в воде.
В зависимости от степени электролитической диссоциации различают сильные основания, к ним относятся щёлочи, степень диссоциации этих оснований стремиться к единице. К слабым основаниям относятся основания, степень диссоциации которых стремиться к нулю, к таким основаниям относятся нерастворимые в воде основания, водный раствор аммиака (NH3 · H2O).
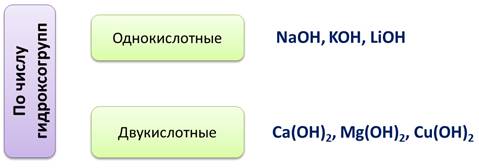
По числу гидроксогрупп основания делятся на однокислотные, у которых одна группа ОН - , например, NaOH, KOH, LiOH. Двукислотные, у которых две группы ОН - , например, Ca(OH)2, Mg(OH)2, Cu(OH)2.
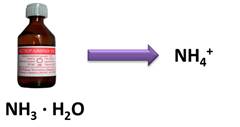
Все основания по агрегатному состоянию являются твёрдыми веществами, имеющими различную окраску. Исключение составляет только раствор аммиака в воде, представляющий собой всем известный нашатырный спирт. Это основание, в отличие от других, содержит не катион металла, а катион аммония (NH4 + ) и существует только в растворе. Он легко разлагается на аммиак и воду.
NH3 · H2O ↔ NH3↑ + H2O
Такое основание, как гидроксид кальция (Са(ОН)2) имеет белую окраску, Cu(OH)2 – голубую окраску, Ni(OH)2 – зелёную окраску, а Fe(OH)3 – красно-бурую окраску.

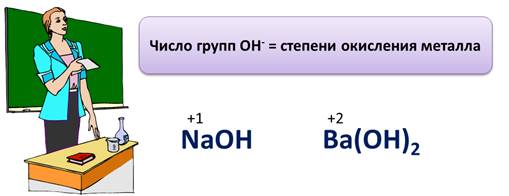
Основания – это электролиты, при диссоциации которых в качестве катионов выступают катионы металла (или аммония), а в качестве анионов – гидроксид-ионы. Число групп ОН равно степени окисления металла. Если степень окисления металла +1, значит, в составе основания будет 1 группа ОН, например NaOH, 1 группа ОН, т.к. степень окисления металла натрия +1, или Ba(OH)2, в составе данного основания 2 группы ОН, т.к. у металла бария степень окисления +2.
Наличие группы ОН обуславливает ряд общих свойств оснований: мыльность на ощупь, изменение окраски индикаторов и др.
Основания, в частности щёлочи, изменяют окраску индикаторов, т.к. при диссоциации образуют гидроксид-ионы. В присутствии щелочей лакмус изменяет свою окраску на синюю, метиловый оранжевый – на желтую, фенолфталеин – на малиновую.

Диссоциация оснований
NaOH = Na + + OH -
Основания вступают в реакцию с кислотами. Эти реакции относятся к реакциям обмена. В результате чего образуется соль и вода. Вспомните, если мы в стакан с гидроксидом натрия добавим несколько капель фенолфталеина, то раствор щёлочи окрасится в малиновый цвет, а затем сюда же добавим раствор соляной кислоты, то малиновая окраска исчезает. Окраска исчезает, т.к. в результате этой реакции образуется соль и вода. Образование соли можно легко подтвердить: если мы на предметное стекло капнем несколько капель раствора и выпарим, то на стекле появятся кристаллы соли.

NaOH + HCl = NaCl + H2O
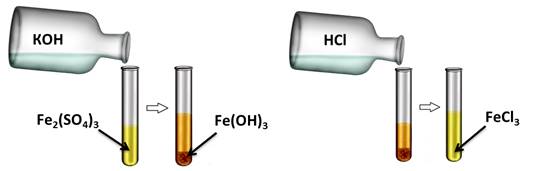
Аналогично, и нерастворимые основания реагируют с кислотами. Получим, например, нерастворимое основание – гидроксид железа (III). Для этого, в раствор сульфата железа (III) добавим несколько капель гидроксида калия, при этом образуется осадок бурого цвета – это гидроксид железа (III). К этому нерастворимому основанию добавим соляной кислоты, осадок растворяется, т.к. образуется соль и вода. Если мы этот раствор соли поместим на предметное стекло и выпарим, то на стекле появятся кристаллы жёлтого цвета – это кристаллы соли хлорида железа (III).
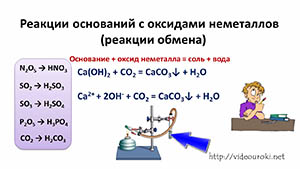
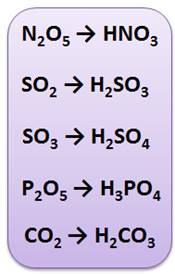
Щёлочи реагируют и с оксидами неметаллов. Каждому оксиду неметалла соответствует своя кислота, так оксиду азота (V) соответствует азотная кислота (N2O5 → HNO3), оксиду серы (IV) – сернистая кислота (SO2 → H2SO3), оксиду серы (VI) соответствует серная кислота (SO3 → H2SO4), оксиду фосфора (V) – фосфорная кислота (P2O5 → H3PO4), оксиду углерода (IV) – угольная кислота (CO2 → H2CO3) и т.д.
Поэтому в реакциях щелочей с оксидами неметаллов образуются соли соответствующих кислот и вода. Вспомните качественную реакцию на углекислый газ: известковая вода реагирует с углекислым газом, в результате чего происходит помутнение известковой воды, вследствие образования карбоната кальция.

Эта реакция относится к реакциям обмена.
Щёлочи вступают в реакцию обмена с солями, при этом образуется новая соль и новое основание, но при этом, должны выполняться определённые условия, т.е. должен образоваться осадок или слабый электролит.
Проведём эксперимент, для этого нальём в первую пробирку гидроксида натрия и хлорида аммония, во вторую – гидроксида калия и сульфата железа (III), а в третью – гидроксида натрия и хлорида бария. Содержимое первой пробирки нагреем. В результате появляется резкий запах аммиака. Во второй пробирке образуется осадок бурого цвета, а в третьей пробирке изменений не произошло. Т.о. в двух пробирках реакция прошла, т.к. выполнялись условия: образуется осадок или слабый электролит.

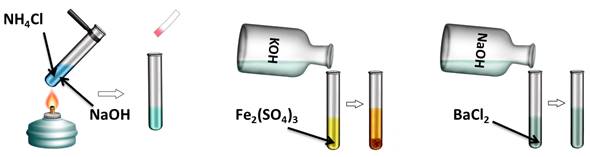
OH - + NH4 + = NH3↑ + H2O
6OH - + 2Fe 3+ = 2Fe(OH)3↓
Все нерастворимые основания при нагревании разлагаются на оксид металла и воду. Щёлочи этой способностью не обладают. Например, гидроксид железа (II) разлагается на оксид железа (II) и воду.
Fe(OH)2 = FeO + H2O
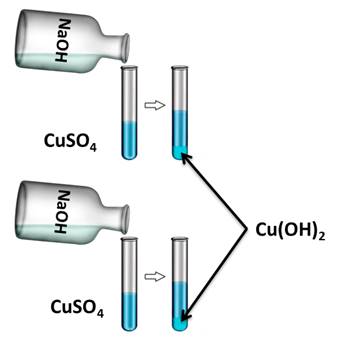
Для подтверждения этого свойства получим нерастворимое основание гидроксида меди (II), а затем нагреем его. Для этого, в две пробирки нальём раствора сульфата меди (II), затем сюда же добавим несколько капель гидроксида натрия. У нас образуется осадок голубого цвета. Это гидроксид меди (II).
Если в одну из пробирок с осадком гидроксида меди (II) добавить раствора соляной кислоты, то осадок растворяется. В результате образуется соль и вода. В этом можно убедиться, если несколько капель раствора капнуть на предметное стекло и выпарить, то на стекле появляются кристаллы соли.
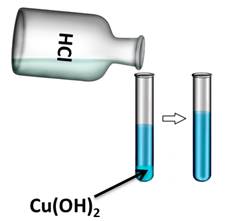
Нагреем пробирку с гидроксидом меди (II). В результате образуется вещество черного цвета – это оксид меди (II). Образуется оксид меди (II), т.к. нерастворимые основания при нагревании разлагаются на оксид металла и воду.

Cu(OH)2 = CuO + H2O
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Конспект урока по химии 8 класс
Учитель биологии и химии Бузюрова О.В.
Тип урока: урок изучение нового материала
Дидактическая задача: формирование новых знаний
Сформировать понятия об основаниях как электролитах
Рассмотреть классификацию оснований по различным признакам
Охарактеризовать химические свойства оснований в свете ТЭД
Совершенствовать умения и навыки в написании формул веществ и уравнений химических реакций в молекулярном и ионном виде.
Развивать умения и навыки классифицировать и распознавать вещества; прогнозировать химические свойства веществ, исходя из их строения
Развивать наблюдательность, умение анализировать данные наблюдений и делать выводы.
Формирование навыков по работе с малым количеством реактивов и соблюдения ПТБ
Работа с учебником
Оборудование и материалы: персональный компьютер, презентация по теме урока, соляная кислота, гидроксид натрия, сульфат меди (II), держатель, спиртовка, пробирки, спички.
Оборудование: Таблица растворимости, презентация.
I Актуализация опорных знаний.
Урок начинается с проверки домашнего задания (устный опрос и работа у доски).
(слайд 2,3) Закончите молекулярные уравнения возможных реакций и запишите соответствующие им ионные уравнения:
а ) ZnO + HNO3 →
б ) Al + H2SO4( разб ) →
в ) HNO3 + CuSO4 →
г ) HCl + FeS →
д ) H2SO4 + Fe(OH)3 →
Если реакция не может быть осуществлена, объясните почему
Выполняют 5 человек у доски, остальные в тетради.
ZnO + 2H + + 2NO 3 − = Zn 2+ + 2NO 3 − + H 2 O
ZnO + 2H + = Zn 2+ + H 2 O
2Al 0 + 6H + + 3SO 4 2 − = 2Al 3+ + 3SO 4 2 − + 3H 2 0 ↑
2 Al 0 + 6 H + = 2 Al 3+ + 3 H 2 0 ↑
2H + + 2NO 3 − + Cu 2 − + SO 4 2− = Cu 2 − + 2NO 3 − + 2H + + SO 4 2−
Реакция не идет так как в результате: 1) не образуется вода, 2)не выделяется газ, и 3) не выпадает осадок.
г ) 2HCl + FeS = FeCl 2 + H 2 S↑
2H + + 2Cl − + FeS = Fe 2+ + 2Cl − + H 2 S↑
6H + + 3SO 4 2− + 2Fe(OH) 3 = 2Fe 3+ + 3SO 4 2+ + 6H 2 O
6 H + + 2 Fe ( OH )3 = 2 Fe 3+ + 6 H 2 O
II Введение новых знаний.
Какие классы неорганических соединений вы знаете?
Существуют сложные вещества, которые состоят из 3-х элементов: Ме, О и Н.
Ион металла – простой : Ме + , Ме +2 , Ме +3
Ион ОН – сложный. Чему равна величина его заряда? Совпадает ли он со степенью окисления каждого элемента? А с суммой степеней окисления элементов?
Степень окисления О -2 и Н + ; сумма ст. ок. - (О -2 Н +1 ) -1 ; название - гидроксид ион.
Основания – вещества, в растворах которых содержатся гидроксильные ионы
Сегодня мы разберем основания с точки зрения ТЭД.
Химические свойства оснований с точки зрения теории электролитической диссоциации обусловлены наличием в их растворах избытка свободных гидроксид – ионов ОН — .Но прежде, чем изучать свойства оснований, давайте с вами вспомним классификацию оснований по нескольким признакам.

При обычных условиях основания (гидроксиды металлов) являются твёрдыми кристаллическими веществами. Они нелетучи и не имеют запаха. Большинство оснований — вещества белого цвета. Но существуют гидроксиды металлов, которые имеют отличающуюся окраску.
Цвет основания
LiOH — гидроксид лития,
Mg(OH) 2 — гидроксид магния,
Ca(OH) 2 — гидроксид кальция
CuOH — гидроксид меди(I)
(при соприкосновении с кислородом
воздуха окраска становится коричневой)
Mn(OH) 2 — гидроксид марганца(II)
Fe(OH) 3 — гидроксид железа(III)
Белый с зеленоватым оттенком
(при соприкосновении с кислородом
воздуха окраска становится темнее)
Fe(OH) 2 — гидроксид железа(II)
Ni(OH) 2 — гидроксид никеля(II)
Cu(OH) 2 — гидроксид меди(II)
Записать в тетрадь физические свойства оснований используя текст параграфа 40 и ранее услышанную информацию.
Для оснований характерны не только различные физические свойства, но и целый ряд химических свойств.
Первое свойство – это изменение цвета индикаторов, при действии растворов щелочей. Обратите внимание на цвета индикаторов в нейтральной среде.
Индикатор - это определитель или указатель среды любого раствора.
В водном растворе любой щёлочи сильной или слабой и даже щелочи с осадком содержатся гидроксид-ионы, и именно они, фактически взаимодействуют с индикаторами. При этом протекает химическая реакция с образованием нового продукта, признаком протекания которой является изменение окраски веществ.

ПРАВИЛА ТЕХНИКИ БЕЗОПАСНОСТИ ПРИ РАБОТЕ СО ЩЕЛОЧАМИ.
При попадании раствора щелочи и кожу или одежду необходимо смыть ее большим количеством проточной воды до исчезновения чувства мылкости, а затем нейтрализовать слабой кислотой — борной или уксусной.

Выбор способа получения основания зависит от того, к какой группе данное соединение относится, является щёлочью или нерастворимым основанием.

Сильными основаниями являются гидроксиды металлов I и II групп, но только главных подгрупп этих двух групп, и за исключением бериллия и магния.
Таким образом, к сильным основаниям относятся: LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2, Ra(OH)2.
Гидроксиды прочих металлов принято считать слабыми основаниями. Например, Mg(OH)2, Al(OH)3, Fe(OH)3, Cu(OH)2 — это слабые основания.
Также слабым основаниям относится гидроксид аммония NH4OH (правильнее записывать его в виде NH3.H2O).
Зависит сила основания от степени диссоциации, которая, в свою очередь, сильно зависит от активности металла.
III Закрепление
Выполнение самостоятельной работы на закрепление изученного материала.
1. В реакцию с раствором гидроксида калия вступает
2. Гидроксид меди(II) реагирует с
1) оксидом бария
2) соляной кислотой
3) хлоридом калия
4) гидроксидом нат
3 .Гидроксид железа(III) в отличие от гидроксида натрия
1) легко растворяется в
2) разлагается при небольшом нагревании
3) взаимодействует с фосфорной кислотой
4) реагирует с алюминием
Поменяться тетрадями с соседом по парте, проверить работу, поставить оценку.
3. Воспитывать бережное, осторожное отношение с реактивами и веществами .
Методы : наглядные, словесные, частично - поисковые.
Оборудование: компьютер, мультимедийный проектор, экран, таблица растворимости, конспект урока, учебник, рабочая тетрадь.
- Мотивация, целеполагание
- Актуализация знаний
- Изучение нового материала
- Закрепление (рефлексия содержания)
- Домашнее задание
Организационный момент, настрой на урок.
Учитель: Здравствуйте, ребята! Девизом нашего урока являются слова Дмитрия Ивановича Менделеева:
Желаю удачи, вам на сегодняшнем уроке.
Если формулы начало
Начинается с металла,
ОН – красуется затем,
Вещества знакомы всем.
Не надо придумывать им название
Ведь эти вещества…
- дать понятие об основаниях как классе электролитов;
- рассмотреть их классификацию по разным признакам;
- охарактеризовать химические свойства оснований в свете теории
электролитической диссоциации.
Формулируют тему и цели урока и записывают в тетрадь.
1.Какие вещества называют электролитами?
2. Какие классы веществ являются электролитами?
3. Что такое диссоциация?
4. Что такое ионы, какие ионы бывают?
5. Какие вещества называют основаниями?
Общая формула оснований Ме(ОН)n, где n – заряд иона металла, численно равный его степени окисления.
Выберите из предложенных веществ основания:
CaO Al(OH) 3 HCl KOH Na 2 SO 4 MgO Ba(OH) 2 H 2 SO 4 N 2 O 5 NaOH HNO 3 Cu(OH) 2 MgCO 3 Fe(OH) 3
Составьте формулы оснований, образованных следующими металлами, назовите их:
- Электролиты – это вещества, растворы которых проводят электрический ток.
- К электролитам относятся все растворимые:
- основания, т.е. щелочи,
3. Диссоциация – это распад электролита на ионы.
4. Ионы – это заряженные частицы.
5. Основания – это сложные вещества, которые состоят из ионов металла и одной или нескольких гидроксогрупп.
Al(OH) 3, KOH , Ba(OH) 2, NaOH,
2) NaОН – гидроксид натрия
3) Ca(ОН) 2 – гидроксид кальция
4) Cu(ОН) 2 – гидроксид меди (II)
5) Al(OH) 3 – гидроксид алюминия
Посмотрите пожалуйста на слайд. В каком агрегатном состоянии находятся основания?
На основании этого познакомимся с классификацией оснований:
1 признак классификации основан на растворимости. Рассмотрим следующий слайд. На какие 2 группы можно разделить основания по растворимости в воде?
2 признак классификации по кислотности, смотрим на слайд, объясните пожалуйста на чем основана эта классификация?
3 признак: по степени ЭД:
По какому признаку основания разделены на группы?
Основаниями называют электролиты,
которые при диссоциации образуют
катионы металла и анионы гидроксогрупп ОН -
Запишите уравнения диссоциации веществ:
Качественная реакция на основания:
БОЙЛЬ РОБЕРТ – английский химик и физик, положил начало применению индикаторов. Это вещества с помощью, которых можно определить среду раствора.
Я растворчик изучал.
Лакмус в нем синее стал.
Поглощал раствор тотчас
Кислый углекислый газ!
Про такой раствор я знаю,
Что среда в нем …
Правила техники безопасности.
Химические свойства оснований
Давайте, ребята, познакомимся с химическими свойствами оснований. Я буду проводить реакции, а вы делать выводы: протекает реакция или нет, если да, то указываете признак.
- Взаимодействие с кислотами (реакция нейтрализации) провожу я:
NaOH + HCl = NaCl + H 2 O
Na + + OH - + H + + Cl - = Na + + Cl - + H 2 O
2. Взаимодействие щелочей с кислотными оксидами (для написания реакций необходимо знать какая кислота соответствует кислотному оксиду):
2NaOH + SO 3 = Na 2 SO 4 + H 2 O
2Na + + 2OH - + SO 3 = 2Na + + SO 4 2- + H 2 O
2OH - + SO 3 = SO 4 2- + H 2 O
3. Взаимодействие с солями (условия протекания – исходные вещества должны быть растворимы и образовываться осадок или газ):
2 NaOH + СuCl 2 = Cu(OH) 2 ↓ + 2NaCl
2 Na + + 2OH - + Сu 2+ + 2Cl - = Cu(OH) 2 ↓ + 2Na + + 2Cl -
2OH - + Сu 2+ = Cu(OH) 2 ↓
KOH + NH 4 Cl = KCl + NH 3 ↑ + H 2 O
K + + OH - + NH 4 + + Cl - = K + + Cl - + NH 3 ↑ + H 2 O
OH - + NH 4 + = NH 3 ↑ + H 2 O
Химические свойства нерастворимых оснований:
Cu(OH) 2 + 2HCl = CuCl 2 + 2H 2 O
Cu(OH) 2 + 2H + + 2Cl - = Cu 2+ + 2Cl - + 2H 2 O
Cu(OH) 2 + 2H + = Cu 2+ + 2H 2 O
2. Нерастворимое основание при нагревании
Cu(OH) 2 = CuO + H 2 O
Обучающиеся записывают в тетрадь:
- нерастворимые в воде.
Ca(OH) 2 → Ca 2+ + 2OH -
Ba(OH) 2 → Ba 2+ + 2OH -
Обучающиеся записывают в тетрадь:
Бесцветный фенолфталеин – малиновый, метилоранжевый – желтый, фиолетовый лакмус – синеет.
Запись в тетради.
Ученики записывают реакции, 1 ученика вызвать к доске.
Выполняют опыты и самостоятельно записывают в тетрадках реакции в молекулярном и ионном видах.
1 ученик записывает на доске.
1. Выберите формулы оснований:
а) SO 3 б) Mg(OH) 2
в) H 2 SO 4 г) СаО
2. К каждому из ниже указанных веществ прибавили воду и фенолфталеин. В каких случаях появится малиновое окрашивание?
3. Какой тип химической реакции не характерен для оснований?
а) реакция разложения
б) реакция замещения
в) реакция обмена.
4.Окраска индикаторов под действием раствора гидроксида калия меняется следующим образом:
а) лакмус краснеет
б) лакмус синеет
в) метилоранж краснеет
г) метилоранж желтеет
д) фенолфталеин становится малиновым
е) фенолфталеин остается бесцветным
5. Раствор гидроксида калия вступает в химические реакции с веществами, формулы которых
а) СО 2 б) H 2 S в) Са(ОН) 2 г) Cu д) NaNO 3 e) Mg
Выполняют в маршрутных листках по группам.
Записывают в дневник.
Предварительный просмотр:
Подписи к слайдам:
Если формулы начало Начинается с металла, ОН – красуется затем, Вещества знакомы всем. Не надо придумывать им название Ведь эти вещества…
Цели : дать понятие об основаниях как классе электролитов; рассмотреть их классификацию по разным признакам; охарактеризовать химические свойства оснований в свете теории электролитической диссоциации.
Проверка д / з : 1.Какие вещества называют электролитами? 2. Какие классы веществ являются электролитами? 3. Что такое диссоциация? 4. Что такое ионы, какие ионы бывают? 5. Какие вещества называют основаниями?
Основания - это сложные вещества, состоящие из иона металла и одной или нескольких гидроксогрупп – ОН. Общая формула оснований Ме (ОН) n , где n – заряд иона металла, численно равный его степени окисления.
Выберите из предложенных веществ основания CaO Al(OH) 3 HCl KOH Na 2 SO 4 MgO Ba (OH) 2 H 2 SO 4 N 2 O 5 NaOH HNO 3 Cu(OH) 2 MgCO 3 Fe(OH) 3
Проверь себя Al(OH) 3 , KOH , Ba (OH) 2 , NaOH , Cu(OH) 2 , Fe(OH) 3
Составьте формулы оснований, образованных следующими металлами, назовите их: 1) К 2) Na 3) Ca 4) Cu (II) 5) Al
Составьте формулы оснований, образованных следующими металлами, назовите их: КОН – гидроксид калия 2) Na ОН – гидроксид натрия 3) Ca (ОН) 2 – гидроксид кальция 4) Cu (ОН) 2 – гидроксид меди (II) 5) Al(OH) 3 – гидроксид алюминия
Классификация оснований по растворимости: .
по кислотности: - однокислотные – КОН, - двухкислотные – Ca (ОН) 2, - трехкислотные – Al(OH) 3 .
по степени ЭД: - сильные, - слабые. + + + + + + + + +
Основания Основаниями называют электролиты, которые при диссоциации образуют катионы металла и анионы гидроксогрупп ОН - . Запишите уравнения диссоциации веществ: NaOH → Ca(OH) 2 → LiOH → Ba (OH) 2 →
Качественная реакция индикатор Нейтральная среда Щелочная среда фенолфталеин бесцветный малиновый Метил- оранжевый оранжевый желтый Лакмус фиолетовый фиолетовый синий
Правила техники безопасности
Химические свойства оснований
Взаимодействие с кислотами (реакция нейтрализации): NaOH + HCl = NaCl + H 2 O Na + + OH - + H + + Cl - = Na + + Cl - + H 2 O OH - + H + = H 2 O 2. Взаимодействие щелочей с кислотными оксидами (для написания реакций необходимо знать какая кислота соответствует кислотному оксиду): 2NaOH + SO 3 = Na 2 SO 4 + H 2 O ( H 2 SO 4 ) 2Na + + 2OH - + SO 3 = 2Na + + SO 4 2- + H 2 O 2OH - + SO 3 = SO 4 2- + H 2 O
Практическая работа 3. Взаимодействие с солями (условия протекания – исходные вещества должны быть растворимы и образовываться осадок или газ) 2 NaOH + С uCl 2 = Cu(OH) 2 ↓ + 2NaCl 2 Na + + 2OH - + С u 2+ + 2Cl - = Cu(OH) 2 ↓ + 2Na + + 2Cl - 2OH - + С u 2+ = Cu(OH) 2 ↓ 3KOH + FeCl 3 = 3KCl + Fe(OH) 3 ↓ 3K + + 3OH - + Fe 3+ + 3Cl - =3K + + 3Cl - + Fe(OH) 3 ↓ 3OH - + Fe 3 = Fe(OH) 3 ↓
Нерастворимое основание + кислота Cu(OH) 2 + 2HCl = CuCl 2 + 2H 2 O Cu(OH) 2 + 2H + + 2Cl - = Cu 2+ + 2Cl - + 2H 2 O Cu(OH) 2 + 2H + = Cu 2+ + 2H 2 O 2 . Нерастворимое основание при нагревании Cu(OH) 2 = CuO + H 2 O
4. Окраска индикаторов под действием раствора гидроксида калия меняется следующим образом: а) лакмус краснеет б) лакмус синеет в) метилоранж краснеет г) метилоранж желтеет д ) фенолфталеин становится малиновым е) фенолфталеин остается бесцветным 5. Раствор гидроксида калия вступает в химические реакции с веществами, формулы которых а) СО 2 б) H 2 S в) Са (ОН) 2 г) Cu д ) NaNO 3 e) Mg

сформировать понятия об основаниях как классе электролитов;
рассмотреть их классификацию по различным признакам;
познакомить практически с химическими свойствами оснований в свете теории электролитической диссоциации;
развивать умения и навыки работы с химическими реактивами и химическим оборудованием;
учить сравнивать, анализировать, делать выводы;
совершенствовать умения и навыки в написании формул веществ и уравнений химических реакций;
развивать познавательный интерес к предмету и окружающим явлениям;
способности к сотрудничеству, общению, работе в коллективе.
1этап. Целеполагание.
Учитель: В этом году вы начали изучать новый предмет – химию. Что изучает химия?
Ученик: Химия – это наука о веществах, их свойствах и превращениях. (Слайд 1).
Учитель: С веществами мы сталкиваемся ежедневно в повседневной жизни.
Веществ очень много: неорганических – более 500 тысяч, органических 1,5 миллиона и ежедневно синтезируются сотни новых веществ. Чтобы разобраться в их многообразии, существует классификация веществ. Давайте вспомним основные классы неорганических веществ. (Слайд 2)

Учитель: Один класс сложных веществ вы уже изучили. Какой?
Ученик: Кислоты.
Учитель: Сегодня нам предстоит познакомиться еще с одним классом неорганических веществ. С каким? Попробуйте догадаться сами. (Слайд 3)
На слайде изображены предметы, с которыми вы уже встречались либо в быту, либо в тексте вашего учебника. Все они связаны с темой нашего урока. Кто догадался, какой класс мы будем изучать сегодня?
Ученик: Основания.
Учитель: Действительно, основания.
Учитель: Как вы считаете, какие вопросы мы должны рассмотреть сегодня на уроке?
Что мы узнаем?
Как отличить основания от других веществ?
Как классифицируются основания?
Какими свойствами обладают основания?
Чему мы научимся?
Определять раствор щелочи среди выданных веществ.
Осуществлять химические реакции с участием оснований.
Составлять уравнения этих реакций в молекулярной и ионной форме.
2 этап. Актуализация знаний.
Давайте вспомним, что нам уже известно об основаниях. (Слайд 6).
1.Что такое основания?
2.Как дают названия основаниям?
3.Составьте формулы оснований, образованных следующими металлами и назовите их: Си (II), Nа, Сr(III), Са, Ва, Аl.
Двое учащихся выполняют задание на доске, а все остальные - в тетрадях. Затем ученики сверяют свои решения с записями на доске.
3 этап. Изучение нового материала.
1.Классификация оснований.

Учитель: Рассмотрим еще 2 признака классификации оснований.
Работа в парах по заданию. (Слайд 8)
Задание. Дайте характеристику гидроксидам калия и алюминия по всем признакам классификации.
2. Химические свойства.
Учитель: Рассмотрите схему, отражающую химические свойства оснований. (Слайд 9).
Какие из этих реакций вам знакомы?
Ученик: Действие на индикаторы, взаимодействие с кислотой.
Давайте проверим это на практике. На столах у вас инструктивные карты, проведем лабораторную работу. Будем работать в парах.
Прежде чем приступить к выполнению лабораторных опытов, давайте вспомним правила безопасности, которые мы должны соблюдать?
Учащиеся повторяют правила по таблице с правилами ТБ.
По мере выполнения работы учитель приглашает одного из учащихся для написания уравнения реакции на доске.
Инструктивная карта
Возьмите пробирку. Налейте в нее 1 мл раствора гидроксида натрия. Добавьте в нее каплю фенолфталеина. Что наблюдаете? Какой ион обусловил окраску индикатора? Затем в нее прилейте 2мл соляной кислоты. Что наблюдаете? Запишите уравнение реакции в молекулярной, полной и сокращенной ионной форме.
В чистую пробирку налейте 1 мл гидроксида натрия. Прилейте в нее 2 мл сульфата меди (II). Что наблюдаете? Запишите уравнение этой реакции в молекулярной, полной и сокращенной ионной форме.
В пробирку наливаем 1-2 мл раствора гидроксида кальция. Через стеклянную трубку продуваем углекислый газ. Какие изменения произошли? Записать уравнение реакции.
Полученный в опыте № 2 осадок Си(ОН)2 разделить на две части. В первую часть осадка гидроксида меди (II) прилейте 2-3 мл соляной кислоты (НС1). Что наблюдаете? Напишите уравнения этой химической реакции в молекулярном и ионном виде.
Вторую часть осадка Си(ОН)2 поместите в пробиркодержатель и нагрейте над спиртовкой. Что наблюдаете? Напишите уравнения этой химической реакции в молекулярном виде.
Учитель: Подведем итоги. Как щелочи изменяют цвета индикаторов? (Слайд 10). С какими классами веществ реагируют основания? (Слайд 11).
1)NaOH + HCl → NaCl +HOH;
2)2NaOH + CuSO4 → Cu(OH)2 ↓ + Nа 2SO4;
3)Са(ОН)2 + CO2→ СаCO3 + H2 O ;
1.Сu(OH)2 + 2HCl → Cu Cl 2+ 2H2 O;
2.Cu(OH)2 → CuO +H 2O
На экране вы видите ключевые положения, усвоенные на сегодняшнем уроке (Слайд 12).
4 этап. Закрепление.
Для закрепления знаний и проверки уровня усвоения материала учащимся предлагается решить тест (Слайд 13).
Вариант 1 Вариант 2
Даны вещества: СаО, Аl (ОН)3, НСl, КОН, Nа2SО4, MgO.
Читайте также:

