Конспект моносахариды на примере глюкозы строение свойства применение
Обновлено: 02.07.2024
Для установления структурной формулы глюкозы на уроке проводится исследование: установление структурной формулы неизвестного органического вещества и прогнозирование его химических свойств (используя уже знакомую информацию о свойствах спиртов и альдегидов учащиеся решают проблему: какое строение может иметь молекула глюкозы и можно ли подтвердить её строение экспериментально?). Учащиеся в ходе урока выполняют эксперимент по обнаружению функциональных групп в молекуле глюкозы: реакцию глюкозы с индикатором лакмусом и гидроксидом меди (II) без нагревания и при нагревании, доказывая наличие в её молекуле гидроксильных групп и альдегидной группы. Результат реакций с гидроксидом меди (II) позволяет сделать учащимся вывод, что глюкоза — многоатомный альдегидоспирт.
Дальнейшее знакомство со строением глюкозы происходит с опорой на рисунки и схемы учебника, анимационные фрагменты.
Химические свойства глюкозы рассматриваются по аналогии с альдегидами и многоатомными спиртами. В заключении рассматриваются процессы брожения глюкозы (спиртовое, молочнокислое, маслянокислое), окисление глюкозы.
Закрепление нового знания предусматривает решение заданий №15 ЕГЭ по химии и контекстных заданий.
1. Организационный этап.(0,5 мин)
2. Актуализация знаний. Вывод молекулярной формулы глюкозы. (5 мин) (слайд №1)
- Какой природный процесс приводит к образованию углеводов из неорганических соединений? В каких живых организмах он происходит?
- Какой признак положен в основу классификации углеводов? (Ответ: способность к гидролизу)
- Какие углеводы называются моносахаридами? (Ответ: Углеводы, которые не подвергаются гидролизу, называются моносахаридами).
- Какие признаки положены в основу классификации моносахаридов? (Ответ: Если моносахарид содержит альдегидную группу и представляет собой альдегидоспирт, его называют Альдозой. Если карбонильная группа находится не у первого углеродного атома, углевод является кетоспиртом и называется Кетозой. По числу углеродных атомов в молекуле моносахариды делятся на: Тетрозы (4 атома), Пентозы(5 атомов), Гексозы(6 атомов).
- Какие углеводы относятся к олигосахаридам? (Ответ: Если углевод содержит несколько (2до10) остатков моносахаридов и образует их при гидролизе, его называют олигосахаридами)
- Какие углеводы называют полисахарида ми? (Ответ: полисахариды представляют собой природные полимеры, состоящие из нескольких сотен и даже тысяч остатков моносахаридов).
Сегодня нам нужно провести исследование: установить структурную формулу неизвестного для нас органического вещества и предложить его химические свойства. Его физические свойства: вещество представляет собой белый кристаллический порошок, сладкий на вкус, хорошо растворимый в воде, плохо растворимый в спирте и других органических растворителях (учащиеся записывают эти данные).
Образец этого вещества находится на столе в пробирке. Нам предстоит сначала установить формулу этого вещества. Для этого вы должны решить следующую задачу:
Задача: На основании элементного анализа исследуемого нами вещества установлено: массовая доля углерода составляет 40%, водорода - 6,67% и кислорода 53,33%. Относительная плотность паров этого вещества по воздуху составляет 6,207. Установите молекулярную формулу этого вещества (слайд №2,3)
Задание: сформулировать цель урока, используя требования к цели.
Цель: На уроке изучить строение и свойства глюкозы.
(слайд 7) - Ребята, задачи – это шаги для достижения цели.
Сформулировать задачи урока:
Задачи:
1. Выяснить строение глюкозы.
2. Спрогнозировать свойства глюкозы, исходя из ее строения.
3. Узнать физические и химические свойства глюкозы.
4. Провести химический эксперимент по свойствам глюкозы.
5. Узнать области применения глюкозы.

5. Открытие новых знаний (20 мин).
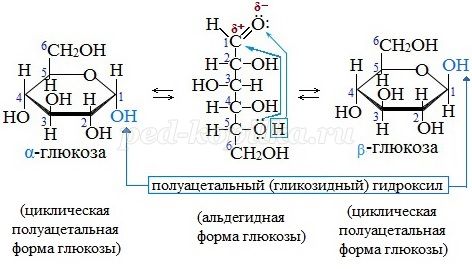
1. Понятие о линейной и циклической форме глюкозы.
Глюкоза – альдегидоспирт. Глюкоза может существовать в двух формах: открытой цепной (слайд №10) и циклической. В результате взаимодействия первого и пятого атомов углерода появляется новая ОН-группа (полуацетальный гидроксил) у первого атома, которая может занять два положения: над и под плоскостью цикла. Поэтому возможны две циклические формы глюкозы –альфа-форма (ОН-группы при 1-м и 2-м атомах углерода расположены по одну сторону кольца молекулы) и бетта-форма (группы ОН находятся по разные стороны) (слайд №11-12, видео)
2. Окисление гидроксидом меди (II) при нагревании:(слайд №15)
- Допишите уравнение реакции
3. Восстановление в спирты:(слайд №16)
СH2OH(CHOH)4-COH + H2 = СH2OH(CHOH)4-CH2OH
Сорбит - кристаллическое вещество, вдвое слаще сахара, впервые был выделен из листьев рябины (sorbus-рябина). Нетоксичен, используется как заменитель сахара, особенно больным сахарным диабетом).
II. Свойства многоатомных спиртов
1. Взаимодействие с гидроксидом меди (II) без нагревания: (слайд №17)
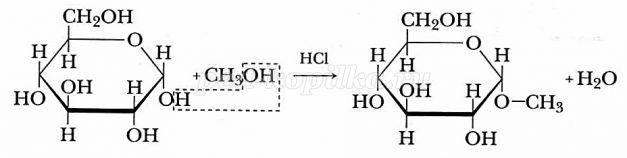
III. Специфические свойства
Важнейшим свойством моносахаридов является их ферментативное брожение, т.е. распад молекул на осколки под действием различных ферментов. Брожение происходит в присутствии ферментов, выделяемых дрожжевыми грибками, бактериями или плесневыми грибками. В зависимости от природы действующего фермента различают реакции следующих видов:
а) Спиртовое брожение (под действием дрожжей): (слайд №19)
С6Н12О6 = 2С2Н5ОН + 2СО2
б) Молочнокислое брожение (под действием молочнокислых бактерий): (слайд №20)
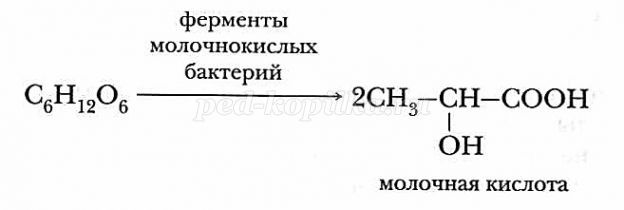
- изготовление кисло-молочных продуктов;
- при консервировании, квашении, силосовании кормов;
- в условиях недостатка кислорода глюкоза превращается в молочную кислоту, которая обуславливает боли в мышцах в момент физической нагрузки и после нее.
в) Маслянокислое брожение: (слайд №21)
С6Н12О6= С3Н7СООН + 2Н2 +2СО2
г) Окисление: (слайд №21)
C6H12O6 + 6O2 = 6H2O + 6CO2 + 2800 кДж
7. Рефлексия (3 мин) (Слайд №29)
- Что узнали на уроке?
- Чему научились на уроке?
- Испытывали ли трудности? Какие?
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
_____________________ 11 класс (химия)
Урок № 48. Моносахариды. Состав, строение молекулы и свойства глюкозы.
Цели урока: дать общее понятие об углеводах, как о полифункциональных органических соединениях; рассмотреть классификацию, строение, свойства, значение и применение этих соединений.
Задачи: познакомить учащихся с особенностями строения углеводов на примере моносахаридов, их свойствами и значениями; продолжить развивать умение выявлять связь между составом, строением молекул углеводов и их свойствами и функциями; умение использовать полученные знания для доказательства материального единства живой и неживой природы; формирование научного мировоззрения.
Орг. момент – 2-3 мин.
Работа над ошибками – 10-12 мин.
Изучение нового материала – 15-20 мин.
Историческая справка:
тростниковый сахар был известен людям достаточно давно. Родиной сахарного тростника считается Индия. В соке этого растения содержится углеводород сахароза , который мы называем сахаром ;
из сладких плодов и ягод был выделен виноградный сахар, названный в последствии глюкозой;
из молока млекопитающих еще в XVII в. Был получен молочный сахар (лактоза);
в прорастающих зернах ячменя (солод) содержится мальтоза…
В 1811 году Константин Готлиб Сигизмунд получил глюкозу гидролизом крахмала.
В 1953 году французский химик Лемье синтезировал сахарозу.
Какое значение для живых организмов имеют полифункциональные соединения – углеводы? (Углеводы широко распространены в живой природе, особенно в растительном мире, и составляют его основную массу органических веществ нашей планеты).
На долю углеводов приходится до 80% сухой массы растений.
В зависимости от строения углеводы подразделяют на:
МОНОСАХАРИДЫ – углеводы, которые не гидролизуются с образованием более простых веществ.
Наиболее распространены глюкоза и фруктоза.
Состав и строение молекулы глюкозы.
Глюкоза (сладкий) – бесцветное кристаллическое вещество, хорошо растворимое в воде, сладкое на вкус.
СН 2 ОН – СНОН – СНОН – СНОН – СНОН – С
Глюкоза одновременно является многоатомным спиртом и альдегидом, то есть является альдегидоспиртом.
Нахождение в природе.
В свободном виде глюкоза содержится почти во всех органах зеленых растений. Особенно ее много содержится в соке винограда, поэтому иногда ее называют – виноградным сахаром. Мед состоит из смеси глюкозы и фруктозы. В организме человека глюкоза содержится в мышцах, в крови и в небольших количествах во всех клетках.
Химические свойства глюкозы.
Реакции с учетом альдегидной группы.
Р-ция окисления: О t , NH 3 * H 2 O О
СН 2 ОН – (СНОН) 4 – С + Ag 2 О СН 2 ОН – (СНОН) 4 – С + 2 Ag
Окисление глюкозы свежеприготовленным раствором гидроксида меди ( II ) при нагревании:
Лекарственный препарат глюконат кальция – соль глюконовой кислоты.
Реакция восстановления, глюкоза восстанавливается, образуя шестиатомный спирт – сорбит:
Сорбит – исходное вещество для промышленного синтеза витамина С, он служит заменителем сахара для больных сахарным диабетом.
РЕАКЦИИ с участием ГИДРОКСИЛЬНЫХ ГРУПП
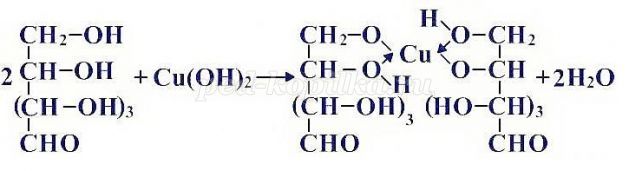
Глюкоза, как многоатомный спирт реагирует со свежеприготовленным гидроксидом меди ( II ) без нагревания, образуя соединение ярко-синего цвета.
Специфические свойства глюкозы.
Молекулы глюкозы подвергаются расщеплению, эту реакцию называют – брожением.
Молочнокислое брожение протекает под действием ферментов, вырабатываемых молочнокислыми бактериями:
ОН молочная кислота
Биологическая роль и применение глюкозы учащиеся изучают в группах в классе.
Выполнение упражнения на стр. 131.
Домашнее задание: § 28, упр. 3-4. Вопросы.
- подготовка к ЕГЭ/ОГЭ и ВПР
- по всем предметам 1-11 классов
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания

Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 24 человека из 17 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- ЗП до 91 000 руб.
- Гибкий график
- Удаленная работа
Дистанционные курсы для педагогов
Свидетельство и скидка на обучение каждому участнику
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 608 101 материал в базе
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
Свидетельство и скидка на обучение каждому участнику
Другие материалы
Вам будут интересны эти курсы:
Оставьте свой комментарий
- 11.01.2016 2695
- DOCX 50.1 кбайт
- 8 скачиваний
- Оцените материал:
Настоящий материал опубликован пользователем Дымова Наталья Сергеевна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
40%
- Подготовка к ЕГЭ/ОГЭ и ВПР
- Для учеников 1-11 классов
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Минтруд предложил упростить направление маткапитала на образование
Время чтения: 1 минута
Минобрнауки и Минпросвещения запустили горячие линии по оказанию психологической помощи
Время чтения: 1 минута
Отчисленные за рубежом студенты смогут бесплатно учиться в России
Время чтения: 1 минута
Новые курсы: функциональная грамотность, ФГОС НОО, инклюзивное обучение и другие
Время чтения: 15 минут
В приграничных пунктах Брянской области на день приостановили занятия в школах
Время чтения: 0 минут
В Россию приехали 10 тысяч детей из Луганской и Донецкой Народных республик
Время чтения: 2 минуты
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Урок проводится по технологии деятельностного обучения с использованием эвристического, объяснительно-иллюстративного и экспериментального методов обучения.
Системно- деятельностная технология обучения в химии является одной из актуальных методик развития учащихся. Поэтому на уроках очень важны способы организации самостоятельной, поисково-исследовательской деятельности учащихся. Но результативна она лишь тогда, когда обучающиеся обладают достаточными знаниями, необходимыми для построения научных предположений, а также умением выдвигать гипотезы, объясняющие противоречие, причины явлений.
Правильно поставленная система деятельностного обучения позволяет рациональными педагогическими средствами целенаправленно развивать познавательную самостоятельность и творческие способности учащихся, т. к. в процессе обучения активно приобретаются не только конкретные знания по предмету, но и знания о средствах их наиболее эффективного усвоения и применения.
Давно известно, что знания, добытые собственным трудом, намного прочнее и ценнее, чем знания, предложенные учителем в готовом виде.
| Вложение | Размер |
|---|---|
| moy_urok-samaya_poslednyaya_versiya-2.doc | 117 КБ |
Предварительный просмотр:
Углеводы. Моносахариды. Глюкоза.
Урок по органической химии.
Автор – составитель: Т.Л.Гвоздева, учитель химии МБОУ СОШ № 6 г.Озеры Московской области
Урок химии в 10 классе
Урок проводится по технологии деятельностного обучения с использованием эвристического, объяснительно-иллюстративного и экспериментального методов обучения.
Системно- деятельностная технология обучения в химии является одной из актуальных методик развития учащихся. Поэтому на уроках очень важны способы организации самостоятельной, поисково-исследовательской деятельности учащихся. Но результативна она лишь тогда, когда обучающиеся обладают достаточными знаниями, необходимыми для построения научных предположений, а также умением выдвигать гипотезы, объясняющие противоречие, причины явлений.
Правильно поставленная система деятельностного обучения позволяет рациональными педагогическими средствами целенаправленно развивать познавательную самостоятельность и творческие способности учащихся, т. к. в процессе обучения активно приобретаются не только конкретные знания по предмету, но и знания о средствах их наиболее эффективного усвоения и применения.
Давно известно, что знания, добытые собственным трудом, намного прочнее и ценнее, чем знания, предложенные учителем в готовом виде.
Урок построен так, чтобы обеспечить формирование познавательного интереса учащихся, продемонстрировать красоту процесса познания, почувствовать радость от результатов проведенных опытов, создать положительное эмоциональное отношение к учебе.
Роль учителя при этом в том, что он - организатор этого взаимодействия, он управляет процессом познания.
На уроке активно используется компьютерная среда (презентация темы, иллюстрации, задания для самообучения). Назначение этих материалов в обеспечении большей наглядности и доказательности.
При составлении урока уделено внимание здоровью учащихся. В урок включены эмоциональные разрядки, игровые моменты, смена видов деятельности. Снять утомление позволяет двигательная активность, организация работы в группах.
Нравственная атмосфера урока предполагает психологический комфорт, педагогическое сотрудничество.
Тип урока: Изучение нового материала.
Вид урока: проблемно-исследовательский.
Цель урока: закрепить знания о кислородсодержащих органических соединениях и их взаимосвязи. Сформировать умение предсказывать строение молекулы вещества исходя из его химических свойств (второе положение теории химического строения органических соединений А.М. Бутлерова).
О. Закрепить методику решения задач на вывод молекулярной формулы вещества, умение различать и доказывать класс органических соединений по их функциональным группам. Спрогнозировать и опытным путем выявить химические свойства глюкозы как альдегидоспирта. Вывести ее структурные формулы. Записать химические уравнения реакций.
В. Воспитать потребность в знаниях о тех веществах, с которыми мы соприкасаемся в жизни. Посредством химического эксперимента прививать навыки трудолюбия, бережного отношения к реактивам, аккуратность, эстетические качества при оформлении конспекта.
Р. Развивать умение формировать проблему, определять цель, выдвигать и проверять гипотезу. Умение наблюдать, сравнивать изучаемые явления, выявлять причинно-следственные связи, выделять внутрипредметные и межпредметные связи. Делать выводы, развивать доказательную речь, используя химическую терминологию. Развивать коммуникативные компетентности учащихся.
Методы обучения: проблемно-исследовательский, объяснительно-иллюстративный.
Формы обучения: фронтальная беседа, практическая работа, обобщение.
Принципы обучения: систематичность и последовательность формирования знаний, умений и навыков, самостоятельность.
Оборудование урока: 1)Лабораторное оборудование: спиртовка , штатив с пробирками, пробиркодержатель, спички, стеклянные палочки;
2) Реактивы: глюкоза (тв.), раствор 40%, лакмус, раствор нашатырного спирта, нитрата серебра, сульфата меди (II), гидроксида калия или натрия, вода, уксусная кислота, карбонат натрия, фуксинсернистая кислота.
3) Технологическая карта учащегося; конспект-урок (печатная основа для самостоятельной работы учащихся на уроке); тест; презентация; мультимедийный проектор; видеоопыты.
Мы продолжаем изучение класса кислородсодержащих органических соединений, который называется - углеводы.
Расширяя знания об углеводах, начнем знакомство с моносахаридами, в молекулах которых может содержаться от четырех до десяти атомов углерода. Сегодня мы на 45 минут станем исследователями. У нас работает три экспертные исследовательские группы. Цель – в ходе экспериментальной работы исследовать строение и свойства одного из важнейших углеводов.
Оценка работы учащихся на уроке – самооценка – работа с оценочной таблицей.
II.Актуализация знаний учащихся.
1. Расположите вещества в порядке возрастания числа атомов углерода в составе молекулы:
2. Тетрозы, пентозы, гексозы – это:
В. Полисахариды ( Б )
3. Самый сладкий моносахарид:
4. Какой из моносахаридов содержится в крови человека?
5. Углевод, который предотвращает свертывание крови:
III. Определение темы, постановка задач урока.
Учитель: Химия—наука, изучающая вещества. На каждом уроке мы наблюдаем, описываем различные вещества, изучаем их свойства. Поэтому и сегодня главным участником нашего занятия будет химическое вещество. Но не любое, а то, формулу которого вы вывели, решая домашнюю задачу к этому уроку:
Определите формулу органического соединения, состоящего из углерода (массовая доля 40%), кислорода (массовая доля 53,33%) и водорода (массовая доля 6,67%), если относительная плотность паров этого вещества по воздуху составляет 6,207. Может ли это соединение относиться к классу углеводов?
Назовите ответ домашней задачи. С 6 Н 12 О 6 .
Сахароза, рибоза, фруктоза, лактоза-
Углеводов всех не счесть.
Главная средь них – глюкоза,
И о ней пойдет здесь речь.
Задание группам : вспомните, чем же глюкоза вам знакома?
Работа проходит в форме мозгового штурма (кто больше вспомнит!).
Какова тема нашего урока?
Что мы с вами должны сегодня сделать на уроке ? Каковы задачи урока?
- Выяснить строение глюкозы;
- Предсказать свойства глюкозы, исходя из ее строения;
- Узнать физические и химические свойства глюкозы;
- Расширить и систематизировать свои знания об углеводах;
- Совершенствовать навыки химического эксперимента.
Учитель записывает на доске тему урока:
Какими источниками информации и вспомогательными средствами мы можем воспользоваться на уроке?
С чего мы должны начать свою работу?
IV. Постановка проблемы:
Если глюкоза - кислородосодержащее соединение, то какие функциональные группы могут содержаться в ее молекуле?
Сегодня в ходе нашей исследовательской работы мы и попробуем разгадать все ее тайны.
V. Построение проекта выхода из затруднения.
Учащиеся выдвигают гипотезу:
А) молекула глюкозы может содержать функциональные группы атомов – ОН, одну или несколько.
Б) альдегидную группу -СНО
В) карбоксильную группу -СООН
Учащиеся с помощью учителя согласовывают тему урока, выбирают способ , строят план достижения цели и определяют средства её достижения.
Принимается решение проверить гипотезу экспериментально.
Учитель напоминает учащимся о соблюдении правил техники безопасности.
VI. Решение проблемы.
Задание для учащихся всех групп . Исследуйте физические свойства глюкозы.
Внимательно рассмотрите выданный вам образец глюкозы. Определите цвет, запах, вкус глюкозы. Исследуйте растворимость ее в воде. Проверьте среду раствора. Для этого опустите индикаторную бумагу в раствор глюкозы.
Данные исследования занесите в опорный конспект (печатную основу для самостоятельной работы учащихся) и кратко доложите.
Задание 2 для группы №1 . Исследуйте принадлежность глюкозы к многоатомным спиртам.
В пробирку прилейте 0,5 мл раствора глюкозы и 2 мл раствора гидроксида натрия. К полученной смеси добавьте 1 мл раствора сульфата меди (II). Что наблюдаете? Почему образовавшийся вначале осадок гидроксида меди (II) растворяется с образованием прозрачного синего раствора? Наличием каких функциональных групп в глюкозе обусловлена эта реакция?
Напишите уравнения реакций : CuSO+ NaOH →
Глюкоза (раствор) + Cu(OH) →
Соблюдайте правила предосторожности при работе с едкими веществами – щелочами.
Данные исследования занесите в опорный конспект и кратко доложите.
В пробирку, содержащую 1-2 мл глюкозы, прилейте 1-2 мл аммиачного раствора оксида серебра и осторожно нагрейте пробирку. Что наблюдаете? Наличием какой функциональной группы обусловлена эта реакция? Напишите уравнение реакции: глюкоза (раствор) + AgO
Нагревая пробирку с жидкостью, держите ее так, чтобы открытый конец ее был направлен в сторону и от самого себя и от соседей.
Данные исследования занесите в опорный конспект и кратко доложите.
Задание 2 для группы №3 . Проведите исследование на наличие в глюкозе альдегидной группы с помощью Cu(OH).
В пробирку прилейте 0,5 мл раствора глюкозы и 2 мл раствора гидроксида натрия. К полученной смеси добавьте 1 мл раствора сульфата меди (II). Что наблюдаете? К полученному раствору аккуратно добавьте 1 мл воды и нагрейте на пламени спиртовки пробирку, укрепив ее наклонно так, чтобы нагревалась только верхняя часть раствора ( см. рисунок на стр.304 учебника). Прекратите нагревание, как только начнется изменение цвета. Почему при нагревании происходит изменение цвета реакционной смеси с синего на оранжево- желтый ? Что представляет собой желто-красный осадок? Наличие какой функциональной группы в глюкозе является причиной данной реакции? Напишите уравнение реакции:
Глюкоза (раствор) + Cu(OH)
Данные исследования занесите в опорный конспект и кратко доложите.
Делаем общий вывод: Глюкоза – это альдегид и одновременно многоатомный спирт, т.е. альдегидоспирт ( запись в опорном конспекте ).
Запишите структурную формулу глюкозы:
А) соедините все шесть атомов углерода последовательно друг с другом;
Б) один из крайних атомов углерода образует альдегидную группу;
В) к остальным пяти атомам углерода присоедините по одной гидроксогруппе;
Г) добавьте к каждому атому углерода недостающие атомы водорода.
Изучить новый материал предлагаем учащимся самостоятельно. В связи с этим группы учащихся получают следующие задания:
Задание 3 для группы №1 . Работа с учебником ( стр. 207 – 208 ). Изучите динамическое равновесие в водном растворе глюкозы, а также циклические формы глюкозы. Запишите циклические формы альфа- и бета-глюкозы в опорный конспект.
Представитель каждой группы докладывает о выполнении задания.
Время выполнения 5 минут.
Отчет о результатах выполнения задания. Выступление представителей.
VII. Закрепление, контроль знаний.
- При взаимодействии раствора глюкозы с гидроксидом меди (II):
А.Образуется ярко-синий раствор
В.Выпадает красно-бурый осадок
Г.На стенках пробирки образуется серебряный налет.
2. Продукт каталитического гидрирования глюкозы:
3. Какой тип брожения углеводов существует?
Г.Все предыдущие ответы верны.
4. При спиртовом брожении образуется
Б.Спирт, углекислый газ
Г.Спирт, углекислый газ, водород.
5. При нагревании раствора глюкозы с аммиачным раствором оксида серебра:
А.Образуется ярко-синий раствор
В.Выпадает красно-бурый осадок
Г.На стенках пробирки образуется серебряный налет.
6. Чем различаются альфа- и бетта- формы глюкозы?
В.Расположением гидроксогруппы при первом атоме углерода
Г.Числом атомов кислорода в цикле.
7. Качественной реакцией на глюкозу является реакция с:
VIII. Домашнее задание:
Параграф 23; вопросы 1,2,3,5,6,8
Дополнительно: задачи 9 и 10
IX. Подведение итогов.
Оцените свой вклад в работу группы, класса, свои достижения.
Учащиеся выставляют баллы в оценочные листы и сдают их учителю.
Работа в группе
Итог ( оценивать работу на уроке по пятибалльной системе )
-- Какая задача стояла перед вами на уроке?
-- Что было сегодня необычного на уроке?
-- Есть ли те, кто сделал сегодня маленькое открытие?
--Что вы взяли для себя с данного урока?
-- Каков результат нашего урока?
Учитель комментирует работу групп на уроке, выставляет оценки и заносит их в журнал.
Список используемой литературы:
«Единственный путь, ведущий
Задание 1 для группы №1 . Исследуйте физические свойства глюкозы.
Внимательно рассмотрите выданный вам образец глюкозы. Определите цвет, запах, вкус глюкозы. Исследуйте растворимость ее в воде. Проверьте среду раствора. Для этого опустите индикаторную бумагу в раствор глюкозы.
Данные исследования занесите в печатную основу для самостоятельной работы учащихся и кратко доложите.
Задание 2 для группы №1 . Исследуйте принадлежность глюкозы к многоатомным спиртам.
В пробирку прилейте 0,5 мл раствора глюкозы и 2 мл раствора гидроксида натрия. К полученной смеси добавьте 1 мл раствора сульфата меди (II). Что наблюдаете? Почему образовавшийся вначале осадок гидроксида меди (II) растворяется с образованием прозрачного синего раствора? Наличием каких функциональных групп в глюкозе обусловлена эта реакция?
Напишите уравнения реакций : CuSO+ NaOH →
Глюкоза (раствор) + Cu(OH) →
Соблюдайте правила предосторожности при работе с едкими веществами – щелочами.
Данные исследования занесите в опорный конспект и кратко доложите.
Задание 3 для группы №1 . Работа с учебником ( стр. 207 – 208 ). Изучите динамическое равновесие в водном растворе глюкозы, а также циклические формы глюкозы. Запишите циклические формы альфа- и бета-глюкозы в опорный конспект.
4. Домашнее задание: Параграф 23; вопросы 1,2,3,5,6,8
Дополнительно: задачи 9,10
«Единственный путь, ведущий
Задание 1 для группы №2 . Исследуйте физические свойства глюкозы.
Внимательно рассмотрите выданный вам образец глюкозы. Определите цвет, запах, вкус глюкозы. Исследуйте растворимость ее в воде. Проверьте среду раствора. Для этого опустите индикаторную бумагу в раствор глюкозы.
Данные исследования занесите в печатную основу для самостоятельной работы учащихся и кратко доложите.
В пробирку, содержащую 1-2 мл глюкозы, прилейте 1-2 мл аммиачного раствора оксида серебра и осторожно нагрейте пробирку. Что наблюдаете? Наличием какой функциональной группы обусловлена эта реакция? Напишите уравнение реакции: глюкоза (раствор) + AgO
Нагревая пробирку с жидкостью, держите ее так, чтобы открытый конец ее был направлен в сторону и от самого себя и от соседей.
Данные исследования занесите в опорный конспект и кратко доложите.
4. Домашнее задание: Параграф 23; вопросы 1,2,3,5,6,8
Дополнительно: задачи 9,10
«Единственный путь, ведущий
Задание 1 для группы №3. Исследуйте физические свойства глюкозы.
Внимательно рассмотрите выданный вам образец глюкозы. Определите цвет, запах, вкус глюкозы. Исследуйте растворимость ее в воде. Проверьте среду раствора. Для этого опустите индикаторную бумагу в раствор глюкозы.
Данные исследования занесите в печатную основу для самостоятельной работы учащихся и кратко доложите.
Задание 2 для группы №3 . Проведите исследование на наличие в глюкозе альдегидной группы с помощью Cu(OH).
В пробирку прилейте 0,5 мл раствора глюкозы и 2 мл раствора гидроксида натрия. К полученной смеси добавьте 1 мл раствора сульфата меди (II). Что наблюдаете? К полученному раствору аккуратно добавьте 1 мл воды и нагрейте на пламени спиртовки пробирку, укрепив ее наклонно так , чтобы нагревалась только верхняя часть раствора ( см. рисунок на стр.304 учебника). Прекратите нагревание, как только начнется изменение цвета . Почему при нагревании происходит изменение цвета реакционной смеси с синего на оранжево- желтый? Что представляет собой желто-красный осадок? Наличие какой функциональной группы в глюкозе является причиной данной реакции? Напишите уравнение реакции:
Глюкоза (раствор) + Cu(OH)
Данные исследования занесите в опорный конспект и кратко доложите.
Теория по теме Углеводы. Краткие конспект по углеводам. Классификация углеводов, химические свойства углеводов, способы получения углеводов. Свойства и получение моносахаридов (глюкоза, фруктоза), олигосахаридов (сахароза и др.), полисахаридов.
| Углеводы (сахара) – органические соединения, имеющие сходное строение, состав большинства которых отражает формула Cx(H2O)y, где x, y ≥ 3. |
Исключение составляет дезоксирибоза, которая имеют формулу С5Н10O4 (на один атом кислорода меньше, чем рибоза).
По числу структурных звеньев
- Моносахариды — содержат одно структурное звено.
- Олигосахариды — содержат от 2 до 10 структурных звеньев (дисахариды, трисахариды и др.).
- Полисахариды — содержат n структурных звеньев.
Некоторые важнейшие углеводы:
По числу атомов углерода в молекуле
- Пентозы — содержат 5 атомов углерода.
- Гексозы — содержат 6 атомов углерода.
- И т.д.
По размеру кольца в циклической форме молекулы
- Пиранозы — образуют шестичленное кольцо.
- Фуранозы — содержат пятичленное кольцо.
1. Горение
Все углеводы горят до углекислого газа и воды.
| Например, при горении глюкозы образуются вода и углекислый газ |
2. Взаимодействие с концентрированной серной кислотой
| Например, при действии концентрированной серной кислоты на глюкозу образуются углерод и вода |
| Моносахариды – гетерофункциональные соединения, в состав их молекул входит одна карбонильная группа (группа альдегида или кетона) и несколько гидроксильных. |
Моносахариды являются структурными звеньями олигосахаридов и полисахаридов.
Важнейшие моносахариды
Глюкоза – это альдегидоспирт (альдоза).
Она содержит шесть атомов углерода, одну альдегидную и пять гидроксогрупп.

Глюкоза существует в растворах не только в виде линейной, но и циклических формах (альфа и бета), которые являются пиранозными (содержат шесть звеньев):
| α-глюкоза | β-глюкоза |
 |  |
Химические свойства глюкозы
Водный раствор глюкозы
В водном растворе глюкозы существует динамическое равновесие между двумя циклическими формами — α и β и линейной формой:

Качественная реакция на многоатомные спирты: реакция со свежеосажденным гидроксидом меди (II)
При взаимодействии свежеосажденного гидроксида меди (II) с глюкозой (и другими моносахаридами происходит растворение гидроксида с образованием комплекса синего цвета.
Реакции на карбонильную группу — CH=O
Глюкоза проявляет свойства, характерные для альдегидов.

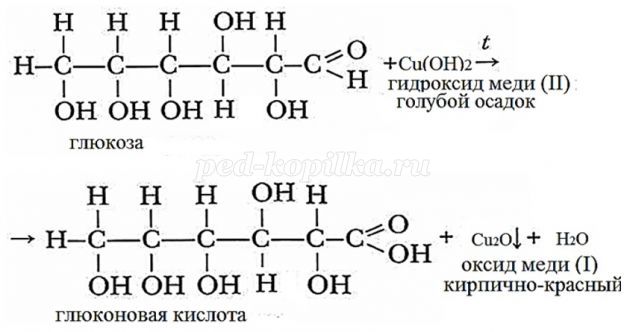
- Реакция с гидроксидом меди (II) при нагревании. При взаимодействии глюкозы с гидроксидом меди (II) выпадает красно-кирпичный осадок оксида меди (I):

- Окисление бромной водой. При окислении глюкозы бромной водой образуется глюконовая кислота:

- Также глюкозу можно окислить хлором, бертолетовой солью, азотной кислотой.
- Каталитическое гидрирование. При взаимодействии глюкозы с водородом происходит восстановление карбонильной группы до спиртового гидроксила, образуется шестиатомный спирт – сорбит:

- Брожение глюкозы. Брожение — это биохимический процесс, основанный на окислительно-восстановительных превращениях органических соединений в анаэробных условиях.
Спиртовое брожение. При спиртовом брожении глюкозы образуются спирт и углекислый газ:
Молочнокислое брожение. При молочнокислом брожении глюкозы образуется молочная кислота:

Маслянокислое брожение. При маслянокислом брожении глюкозы образуется масляная кислота (внезапно):

- Образование эфиров глюкозы (характерно для циклической формы глюкозы).
Глюкоза способна образовывать простые и сложные эфиры.
Наиболее легко происходит замещение полуацетального (гликозидного) гидроксила.
Например, α-D-глюкоза взаимодействует с метанолом.
При этом образуется монометиловый эфир глюкозы (α-O-метил-D-глюкозид):

| Простые эфиры глюкозы получили название гликозидов. |
В более жестких условиях (например, с CH3-I) возможно алкилирование и по другим оставшимся гидроксильным группам.
Моносахариды способны образовывать сложные эфиры как с минеральными, так и с карбоновыми кислотами.
| Например, β-D-глюкоза реагирует с уксусным ангидридом в соотношении 1:5 с образованием пентаацетата глюкозы (β-пентаацетил-D-глюкозы): |

Получение глюкозы
Гидролиз крахмала
В присутствии кислот крахмал гидролизуется:
Синтез из формальдегида
Реакция была впервые изучена А.М. Бутлеровым. Синтез проходит в присутствии гидроксида кальция:
Фотосинтез
В растениях углеводы образуются в результате реакции фотосинтеза из CO2 и Н2О:
| Фруктоза — структурный изомер глюкозы. Это кетоноспирт (кетоза): она тоже может существовать в циклических формах (фуранозы). |
Она содержит шесть атомов углерода, одну кетоновую группу и пять гидроксогрупп.
| Фруктоза | α-D-фруктоза | β-D-фруктоза |
 |  |  |
Фруктоза – кристаллическое вещество, хорошо растворимое в воде, более сладкое, чем глюкоза.
В свободном виде содержится в мёде и фруктах.
Химические свойства фруктозы связаны с наличием кетонной и пяти гидроксильных групп.
При гидрировании фруктозы также получается сорбит.
| Дисахариды – это углеводы, молекулы которых состоят из двух остатков моносахаридов, соединенных друг с другом за счет взаимодействия гидроксильных групп (двух полуацетальных или одной полуацетальной и одной спиртовой). |
Сахароза (свекловичный или тростниковый сахар) С12Н22О11
Молекула сахарозы состоит из остатков α-глюкозы и β-фруктозы, соединенных друг с другом:

В молекуле сахарозы гликозидный атом углерода глюкозы связан из-за образования кислородного мостика с фруктозой, поэтому сахароза не образует открытую (альдегидную) форму.
Сахароза подвергается гидролизу подкисленной водой. При этом образуются глюкоза и фруктоза:
Мальтоза С12Н22О11
Это дисахарид, состоящий из двух остатков α-глюкозы, она является промежуточным веществом при гидролизе крахмала.

| Мальтоза является восстанавливающим дисахаридом (одно из циклических звеньев может раскрываться в альдегидную группу) и вступает в реакции, характерные для альдегидов. |
При гидролизе мальтозы образуется глюкоза.
| Полисахариды — это природные высокомолекулярные углеводы, макромолекулы которых состоят из остатков моносахаридов. |
Основные представители — крахмал и целлюлоза — построены из остатков одного моносахарида — глюкозы.
Крахмал и целлюлоза имеют одинаковую молекулярную формулу: (C6H10O5)n, но совершенно различные свойства.
Это объясняется особенностями их пространственного строения.
Крахмал состоит из остатков α-глюкозы, а целлюлоза – из β-глюкозы, которые являются пространственными изомерами и отличаются лишь положением одной гидроксильной группы:

Крахмал
Крахмалом называется полисахарид, построенный из остатков циклической α-глюкозы.

В его состав входят:
- амилоза (внутренняя часть крахмального зерна) – 10-20%
- амилопектин (оболочка крахмального зерна) – 80-90%
Цепь амилозы включает 200 — 1000 остатков α-глюкозы (средняя молекулярная масса 160 000) и имеет неразветвленное строение.
Амилопектин имеет разветвленное строение и гораздо большую молекулярную массу, чем амилоза.
Свойства крахмала
- Гидролиз крахмала: при кипячении в кислой среде крахмал последовательно гидролизуется:

- Крахмал не дает реакцию “серебряного зеркала” и не восстанавливает гидроксид меди (II).
- Качественная реакция на крахмал: синее окрашивание с раствором йода.
Целлюлоза
Целлюлоза (клетчатка) – наиболее распространенный растительный полисахарид. Цепи целлюлозы построены из остатков β-глюкозы и имеют линейное строение.

Свойства целлюлозы
- Образование сложных эфиров с азотной и уксусной кислотами.
Нитрование целлюлозы.
Так как в звене целлюлозы содержится 3 гидроксильные группы, то при нитровании целлюлозы избытком азотной кислоты возможно образование тринитрата целлюлозы, взрывчатого вещества пироксилина:

Ацилирование целлюлозы.
При действии на целлюлозу уксусного ангидрида (упрощённо-уксусной кислоты) происходит реакция этерификации, при этом возможно участие в реакции 1, 2 и 3 групп ОН.
Получается ацетат целлюлозы – ацетатное волокно.

Целлюлоза, подобно крахмалу, в кислой среде может гидролизоваться, в результате тоже получается глюкоза. Но процесс идёт гораздо труднее.
Читайте также:

