Электропроводность электролитов кратко конспект
Обновлено: 05.07.2024
ЭЛЕКТРОПРОВОДНОСТЬ ЭЛЕКТРОЛИТОВ
ЭЛЕКТРОПРОВОДНОСТЬ ЭЛЕКТРОЛИТОВ, способность электролитов проводить электрич. ток при приложении электрич. напряжения. Носителями тока являются положительно и отрицательно заряженные ионы - катионы и анионы, к-рые существуют в р-ре вследствие электролитич. диссоциации. Ионная электропроводность электролитов, в отличие от электронной, характерной для металлов, сопровождается переносом в-ва к электродам с образованием вблизи них новых хим. соед. (см. Электролиз). Общая (суммарная) проводимость состоит из проводимости катионов и анионов, к-рые под действием внешнего электрич. поля движутся в противоположных направлениях. Доля общего кол-ва электричества, переносимого отд. ионами, наз. числами переноса, суммак-рых для всех видов ионов, участвующих в переносе, равна единице.
Количественно электропроводность электролитов характеризуют эквивалентной электропроводностью - проводящей способностью всех ионов, образующихся в 1 грамм-эквиваленте электролита. Величина связана с уд. электропроводностью соотношением:
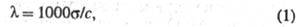
где с - концентрация р-ра в г-экв/л. Эквивалентная электропроводность зависит от природы растворенного в-ва и р-рителя, структуры р-ра, а также от концентрации, т-ры, давления. Предельно разбавленному р-ру, в к-ром все молекулы диссоциированы на ионы, соответствует предельное значение В соответствии с Кольрауша закономравна сумме эквивалентных электропроводностей катионов и анионов. Эквивалентная электропроводность отд. иона пропорциональна скорости его движения в р-ре и характеризует подвижность иона в р-ре.
Описание концентрац. зависимостикак и других св-в р-ров электролитов (см. Растворы электролитов), обычно базируется на ионном подходе, в рамках к-рого р-ритель рассматривается как бесструктурная диэлектрич. среда, в к-рой ионы движутся в соответствии с законами гидродинамики и характером межионного взаимодействия. Простейшей моделью является модель заряженных твердых сфер, движущихся в вязком р-рителе под влиянием силы, обусловленной градиентом потенциала. При этом сила сопротивления движению иона в р-ре определяется ур-нием Стокса (см. Вискозиметрия). В рамках применимости этого ур-ния выполняется правило Вальдена-Писаржевского, в соответствии с к-рым для одного и того же электролита в любых р-рителях произведение предельного значения эквивалентной электропроводности на вязкость р-рителя является постоянной величиной, к-рая не зависит от природы р-рителя, но является ф-цией т-ры. Сравнительно хорошо это правило выполняется только для слабо сольватир. ионов, в частности ионов, имеющих большие размеры в кристаллич. фазе. С увеличением концентрации значение уменьшается в осн. в р-рах слабых электролитов и в области малых концентраций удовлетворительно описывается законом разведения Оствальда (см. Электролитическая диссоциация).
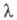
В р-рах сильных электролитов концентрац. зависимость определяется межионным взаимодействием. В области применимости Дебая-Хюккеля теории имеются две причины для торможения ионов вследствие межионного взаимодействия. Первая из них связана с тем, что движение иона тормозится ионной атмосферой, к-рая имеет заряд, противоположный центральному иону, и под влиянием поля движется в направлении, противоположном перемещению иона (электрофоретич. эффект). Вторая причина связана с тем, что при движении иона под действием электрич. поля его ионная атмосфера деформируется и теряет сферич. симметрию, причем большая часть заряда ионной атмосферы концентрируется позади центрального иона (релаксац. эффект). Учет обоих эффектов приводит кур-нию Онсагера:
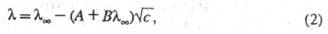
где А и В - эмпирич. постоянные, являющиеся ф-циями т-ры, вязкости и диэлектрич. проницаемости р-рителя.
Как и теория Дебая-Хюккеля, ур-ние Онсагера ограничено областью умеренно разбавленных р-ров. Для описания концентрир. р-ров возникает необходимость в учете некулоновской части межионного взаимод., в частности в учете ионных размеров. Для этой цели применяют методы кинетич. теории ионных систем. К дополнит. уменьшению приводит образование ионных ассоциатов - пар, тройников и т. п., к-рое, как и эффект неполной диссоциации, сокращает общее число своб. ионов в р-ре. Для учета этого эффекта в ур-нии Онсагера заменяют общую концентрацию ионов концентрацией своб. ионов (- степень электролитич. диссоциации), что приводит к ур-нию Фуосса-Онсагера:
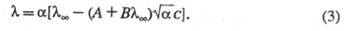
В переменных электрич. полях при достаточно высокой частоте ион не уходит далеко от центра ионной атмосферы, вследствие чего она не деформируется. Обусловленный деформацией релаксац. эффект не возникает, что приводит к увеличению-т.наз. эффект Дебая-Фалькенхагена. Величина возрастает также в постоянных электрич. полях достаточно высокой напряженности (10 4 -10 5 В/см). В этих условиях ионы движутся настолько быстро, что ионная атмосфера не успевает образоваться, вследствие чего практически отсутствуют и релаксац. и электрофоретич. эффекты. В результате стремится к предельному значению (т. наз. эффект Вина). В слабых электролитах эффект Вина вызывается также смещением диссоциативного равновесия в сильном электрич. поле в сторону образования ионов.
Влияние т-ры и давления на электропроводность электролитов обусловлено изменением предельного значения вследствие изменения структуры р-рителя и характера ион-молекулярного взаимод., изменения влияния межионного взаимод. и смещения диссоциативного равновесия. Более детальное описание механизма электропроводности электролитов в широкой области концентраций, т-р и давлений возможно в рамках ион-молекулярного подхода. При этом уд. электропроводность рассчитывают через электрич. поток j(t)= и автокорреляц. ф-цию с помощью соотношения:

где- кол-во ионов электролита в единице объема р-ра, е -элементарный электрич. заряд, - приведенная масса катиона и аниона, za - степень окисления иона сорта a, vа(t) - его скорость в момент времени t.
Специфич. механизм электропроводности характерен для к-т и оснований, содержащих соотв. ионы Н + и ОН - , к-рые в водных р-рах (или других протонных р-рителях) имеют подвижность на порядок больше остальных ионов. Для объяснения аномально высокой проводимости ионов Н + и ОН - предполагается, что под влиянием электрич. поля протоны перемещаются не только путем миграции, но и по механизму протонного обмена, включающему перенос протона в кислой среде от ионов гидроксония Н3О + к молекуле воды, а в щелочной - от молекулы воды к иону ОН - .
Эксперим. изучение электропроводности электролитов- важное направление физико-химического анализа, поскольку зависимость электропроводности электролитов от состава р-ра позволяет судить о концентрации солей, качественный, состав к-рых известен (см. также Кондуктометрия). Измерения l используют для определения подвижностей ионов.
Лит.: Скорчеллетти В. В., Теоретическая электрохимия, 4 изд., Л., 1974; Измайлов Н. А., Электрохимия растворов, 3 изд., М., 1976; Эрдеи-Груз Т., Явления переноса в водных растворах, пер. с англ., М., 1976. См. также лит. к ст. Растворы электролитов.
Электролитическая диссоциация представляет собой разложение молекул на ионы под действием электрического поля полярных молекул воды.
Степень диссоциации представляет собой долю распавшихся молекул в растворенном веществе.
Ионная проводимость - это проводимость водных растворов или расплавов электролитов, которая осуществляется ионами.
Электролиз - процесс выделения на электроде вещества, связанного с окислительно-восстановительными реакциями.
Основная и дополнительная литература по теме урока:
Мякишев Г.Я., Буховцев Б.Б., Сотский Н. Н. Физика. 10 класс. Учебник для образовательных организаций М.: Просвещение, 2017. С. 376-380.
Рымкевич А.П. Сборник проблем физики. 10-11 класс М.: Дрофа, 2009.
Теоретический материал для самостоятельного изучения
Жидкости в степени электропроводности делятся на диэлектрики (дистиллированная вода), проводники (электролиты), полупроводники (расплавленный селен).
Электролит представляет собой проводящую жидкость (растворы кислот, щелочей, солей и расплавленных солей). Электролитическая диссоциация представляет собой разложение молекул электролита на ионы при растворении в воде или плавлении. Степень диссоциации - это доля молекул, которые распадаются на ионы. Электропроводность электролитов является ионной. Проход электрического тока связан с переносом вещества.
Электролиз - процесс выделения на электроде вещества, связанного с окислительно-восстановительными реакциями.
Закон электролиза открыт в 1833 году Майклом Фарадеем.

Закон Фарадея: m = kI∆t
Закон электролиза определяет массу вещества, выделяемого на электроде при электролизе при прохождении электрического тока.

k - электрохимический эквивалент вещества, численно равного массе вещества, выделяемого на электроде, когда он проходит через зарядный электролит в 1 Кл.
Применение электролиза: получение чистых металлов (очистка от примесей); гальваностегия (никелирование, хромирование и т. д.); гальванопластика, то есть получение отслаивающихся покрытий (рельефные копии).
Примеры и разбор решения заданий:
1. Источник тока присоединили к двум пластинам, опущенным в раствор поваренной соли. Сила тока в цепи равна 0,3 А. Какой заряд проходит между пластинами в ванне за 7 минут?
Решение: Сила тока равна отношению заряда ко времени, в течение которого этот электрический заряд прошёл по цепи:

Подставив числовые значения, переведя время в СИ, получим q = 126 Кл.
Правильный ответ: q = 126 Кл.
- В процессе электролиза из водного раствора хлорида железа-2 выделилось 840 мг железа. Какой заряд прошёл через электролитическую ванну?


q = 840 · 10 -6 · 1,6 · 10 -19 · 2 · 6,02 · 10 23 / 0,056 = 2880 Кл.
Электропроводность электролитов, способность электролитов проводить электрический ток при приложении электрического напряжения. Носителями тока являются положительно и отрицательно заряженные ионы - катионы и анионы, которые существуют в растворе вследствие электролитич. диссоциации. Ионная электропроводность электролитов, в отличие от электронной, характерной для металлов, сопровождается переносом вещества к электродам с образованием вблизи них новых химических соединений. Общая (суммарная) проводимость состоит из проводимости катионов и анионов, которые под действием внешнего электрического поля движутся в противоположных направлениях. Доля общего кол-ва электричества, переносимого отдельными ионами, называется числами переноса, сумма которых для всех видов ионов, участвующих в переносе, равна единице.
Количественно электропроводность электролитов характеризуют эквивалентной электропроводностью - проводящей способностью всех ионов, образующихся в 1 грамм-эквиваленте электролита. Величина связана с удельной электропроводностью соотношением:
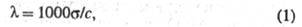
где с - 4 -10 5 В/см). В этих условиях ионы движутся настолько быстро, что ионная атмосфера не успевает образоваться, вследствие чего практически отсутствуют и релаксационные и электрофоретические эффекты. В результате стремится к предельному значению (так называемый эффект Вина). В слабых электролитах эффект Вина вызывается также смещением диссоциативного равновесия в сильном электрического поле в сторону образования ионов.
Влияние температуры и давления на электропроводность электролитов обусловлено изменением предельного значения вследствие изменения структуры растворителя и характера ион-молекулярного взаимодействия, изменения влияния межионного взаимодействия и смещения диссоциативного равновесия. Более детальное описание механизма электропроводности электролитов в широкой области концентраций, температур и давлений возможно в рамках ион-молекулярного подхода. При этом удельная электропроводность рассчитывают через электрический поток j(t)= и автокорреляционную функцию с помощью соотношения:

где - кол-во ионов электролита в единице объема раствора, е -элементарный электрический заряд, - приведенная масса катиона и аниона, za - степень окисления иона сорта a, vа(t) - его скорость в момент времени t.
Специфический механизм электропроводности характерен для кислот и оснований, содержащих соотв. ионы Н + и ОН - , которые в водных растворах (или других протонных растворителях) имеют подвижность на порядок больше остальных ионов. Для объяснения аномально высокой проводимости ионов Н + и ОН - предполагается, что под влиянием электрического поля протоны перемещаются не только путем миграции, но и по механизму протонного обмена, включающему перенос протона в кислой среде от ионов гидроксония Н3О + к молекуле воды, а в щелочной - от молекулы воды к иону ОН - .
Экспериментальное изучение электропроводность электролитов - важное направление физико-химического анализа, поскольку зависимость электропроводности электролитов от состава раствора позволяет судить о концентрации солей, качественный, состав которых известен (см. также Кондуктометрия) Измерения l используют для определения подвижностей ионов.

Материал раскрывает физическую природу прохождения электрического тока в растворе электролита, понятие "электродный потенциал".
Это фактически основы электрохимии - науки на стыке физики и химии
Ток в электролитах
Электролиты, как и металлы, относятся к проводникам. Иногда металлы называют проводни-ками 1 рода, а электролиты – 2го рода. Рассмотрим жидкие электролиты..
Электролиз -окислительно-восстановительные реакции, протекающие на электродах при пропускании электрического тока через растворы или расплавы электролитов. На катоде протекает реакция восстановления за счет отдачи катодом электронов катионам; на аноде – реакция окисления в результате принятия электронов анодом от анионов электролита.На процесс электролиза существенное влияние оказывают свойства растворителя (в случаях электролиза растворов), свойства материала, из которого выполнены электроды, и величина стандартного электродного потенциала ионов электролита.


Здесь происходит разложение воды на молекулярные кислород и водород, а количество H2SO4 остается неизменным.
Считается, что для электролита закон Ома выполняется. но для всей цепи закон Ома не выполняется из-за скачков потенциала на электродах.

1закон электролиза: Масса вещества, выделившегося на электроде пропорциональна заряду, прошедшему через электролит. где k – электрохимический эквивалент.


2 закон электролиза: Электрохимический эквивалент вещества пропорционален его химическому эквиваленту. F – постоянная Фарадея.
Химическим эквивалентом вещества называется отношение его молярной массы к его валентности
Часто 1 и 2 законы объединяют в один, который называют обобщенным законом электролиза.
или (если ток постоянный)
Фарадей эти законы установил экспериментально. Однако их можно получить и теоретически.
(доказательство 1-го закона электролиза)



По смыслу F – это заряд моля одновалентного вещества.
Электрод– это проводник 1 рода. С ростом температуры электрическое сопротивление этих проводников растет (тепловые колебания кристаллической решетки).
Растворы электролитов – проводники 2рода. Электрическое сопротивление этих проводни-ков с ростом температуры падает (уменьшается вязкость среды).
Электролитическая диссоциация – это образование положительных и отрицательных ионов вследстствие самопроизвольного распада молекулы, распадения полярных молекул электроли-тов на ионы под действием полярных молекул растворителя. В кристаллах с ионной связью ионы расположены в узлах кристаллической решётки.


Отрыв ионов полярн молекулами растворителя от ионного кристалла при его растворении
диссоциация полярных молекул электролита под действ полярных молекул растворителя
На первый взгляд кажется, что заряженные ионы появляются в электролите под действием электрического поля. но закон Джоуля – Ленца опровергает это, так как вся работа электрического тока полностью переходит в тепло, не оставляя энергии необходимой для ионизации молекул. То есть нужно предположить, что распад молекулы на ионы происходит под действием растворителя. Эта гипотеза лежит в основе теории электролитической диссоциации Клаузиуса – Аррениуса.
Основные положения теории Аррениуса:
1.Диссоциация электролита на ионы в растворе идет самопроизвольно, независимо от того протекает или нет электрический ток через раствор.
2.Для слабых электролитов диссоциация имеет динамический характер.
«Электронная проводимость воды зависит в основном от концентрации раствора минеральных солей и температуры. Минеральную часть воды составляют ионы Na + , K + , Ca 2+ ,Mg 2+ , Cl - , SO4 2- , HCO3 - . Этими ионами и обусловлена электропроводность природных вод. Присутст-ствие других ионов, например, Fe3+, Fe2+, Mn 2+ ,Al 3+ , NO3 - , HPO4 2- , H2 PO4 - , не сильно влияет на электропроводимость, если эти ионы не содержатся в воде в значит колич
Бинарные или симметричные электролиты, распадаются на 2 иона. \
Тернарные электролиты, распадаются на 3 иона. К ним относят 1,2-заря (Na2SO4 и др.) и 2,1-зарядн (CaCl2 и др.) электролиты.
Сильные электролиты диссоциируют практически полностью (α = 1). К ним относятся:1) кислоты (H2SO4, HCl, HNO3, HBr, HI, HClO4, HМnO4);
Слабые электролиты диссоциируют на ионы в очень малой степени, в растворах они находятся, в основном в недиссоциированном состоянии (в молекулярной форме)
Электролиты при растворении распадаются на ионы не полностью. Только опред часть раствор молекул присутст в виде ионов. Доля молекул, распавшихся в состоянии равновесия на ионы, отвечает степени электролитич диссоциацииa, которая равна отношению числа молекул n, распавшихся на ионы, к общему числу растворенных молекул N (ионизир n и неионизир n0):
Степень диссоциации:


Степень электролитической диссоциации зависит от природы растворителя, концентрации электролита, температуры и присутствия других электролитов в растворе. Чем выше диэлект-рическая проницаемость растворителя, тем больше степень диссоциации электролита.
Движение ионов обусловлено напряжением, поданным на электроды, опущенные в раствор. Достигнув электродов, ионы забирают или отдают электроны, образуя соответственно молекулы Cl и Na. Подобное явление наблюдается и в растворах многих других веществ. Молекулы этих веществ, подобно молекулам поваренной соли, составлены из противополож-но заряженных ионов, на которые они и распадаются в растворах. Количество распавшихся молекул, точнее, число ионов, характеризует электрическое сопротивление раствора.происх эл тока по цепи, элем кот явл раствор, выз перемещ вещества этого эл эл цепи, и, след, изм его химич свойств, в то вр, как при про эл тока по метал проводн никаких изм в проводн не происходит.
Что же такое электродный потенциал? Как он возникает?
к электрохимическим относятся только такие окислительно–восстановительные реакции, кот вызывают электрический ток или же сами происходят под действием тока. 1й тип реакций - в гальваническом элементе —батарее в которой энергия химической реакции превращается в электроэнергию), 2й тип — в электролизерах (электроэнергия превращается в химическую).
Если погрузить пластинку металла в воду, то под действием полярных молекул воды часть катионов перейдет в жидкость Me z+ +mH2O↔ [Me(H2O)m] z а электроны останавливаются на пластинке металла, в результате чего металл зарядится отрицательно. Катионы, перешедшие в жидкость, располагаются вблизи поверхности отрицательно заряженной пластинки металла, в результате образуется двойной электрический слой, схему можно представить так


Таким образом, на границе соприкосновения жидкости с металлом электрически потенциал φ резко изменяется и наблюдается скачок (или разность) потенциала ∆φ, который принято называть электродным потенциалом.
чем активнее металл, тем легче будут диссоциировать его атомы, тем большее количество катионов перейдет в жидкость и тем, след, бόльшим будет отрицательный заряд металла, что, в свою очередь, обусловит бόльшую разность потенциалов на границе металл—жидкость Процесс перехода ионов металла в жидкость является обратимым. Поэтому, если погрузить пластину металла не воду, а в раствор соли этого металла, то равновесие будет смещённым: из металла в раствор будет переходить меньше ионов и разность потенциалов на границе металл—раствор будет несколько иной, чем в первом случае.
величина электродного потенциала определяется прежде всего природой металла. Кроме того она зависит от температур, концентрации раствора и других факторов 1 .Поэтому для сравне-ния электродных потенциалов н выбрать некоторые стандартные условия. Обычно сравнивают произв при 25°С, давл 101,3 кПа и в р=ре с концентр одноим иона= (1 моль/л)
стандартным электродным потенциалом называют электродный потенциал при концентрации иона металла 1 моль/л.
Абс зн электрод потенц изм невозм (поск введ любых измер зондов неизб прив к появл новой контак разности потенц). Вместе с тем не предст труда измер вел отн электродн потенциала.
Относит электрод потенциалы металлов измер отн станд водородного электрода,потенциал кот произв принят за 0
Гальванические элементы
это устройство, где происходит превращение химической энергии в электрическую. Состоят из 2 электродов, имеющих разный электродный потенциал, электролита, дающего возможность перемещаться ионам от 1 электрода к другому и металлич проводн эл-нов
на одном из кот всегда идёт процесс окисления, на др—процесс восстановления.
Необратимые Г.Э. – химическая реакция идет когда внешний ток не протекает
Обратимые Г.Э. - химическая реакция не идет когда внешний ток не протекает
На поверхности контакта 2 проводящих фаз электрохимической системы наблюдаются скачки потенциала. Сумма скачков потенциалов на всех границах раздела фаз равновесной эл с-мы называется электродвижущей силой (ЭДС) элемента Она может быть непосредствено измерена как разность потенциалов фаз, нахожящихся на концах цепи. Для электрохимических систем характерны три основных типа скачков потенциала металл — раствор, раствор—раствор и метал—металл.
1. Скачок потенциала на границе металл — металл (контактный потенциал).
Контактные потенциалы появляются на границе сопротивления 2тел. Они возникают в результате перехода свободных электродов из одного тела в другое.


Энергия связи элнов в конденсир телах опр раб выхода- кол энергии, необх для вывода эл-на e из вещества, в т ч и из металла М:где Е – работа выхода.
Если работа выхода одного металла Е1меньше раб выхода др Е2(Е1 Е2), электроны б перех из одного металла (М1) в другой (М2). Металл М1кот покидают электроны, заряж положит, а металл М2ко принимает электрон,- отрицательно.

Величина и характеризует контактный потенциал.
2 .Скачок потенциала на границе металл- раствор электролита.

Рассм эл сост из цинковой платины, опущ в раствор электролита —сульфата цинка ().
Сульфат цинка в водном растворе диссоциирует на ионе:
В св оч в растворе сущ молекулы воды, кот сильно поляризованы Н2О
Пластина цинка сост из ионов в узлах крист решётки и элнов (поэтому металлы легко пров эл ток).Ионы в металлах удерживаются за счёт энергии кристаллической решётки (). Ион в растворе удерживается за счёт сольватной (гидратной) оболочки, образуемой растворителем ().
При погружении металла в раствор электролита ионы на поверхности кристаллической решётки металла взаимодействуют с полярными молекулами растворителя (чаще воды), и образуется сольватная (гидратн) оболочка. Связь гидратиров иона с остальными ионами крис-таллической решётки ослабляется, и он, если обладает достаточной кинетической энергией, переходит в раствор. При этом цинк пластина заряжается отрицательно , т.к. остальные электроны. Таким образом, в раствор уходит много ионов . Но каждому последующему иону уйти труднее, чем предыдущему, т.к. растет отрицательный заряд на пластин. И при каком-то отрицательном заряде на пластине наступит состояние равновесия, когда число уходящ ионов в растворе будет равно числу ионов , приходящих из р-ра.При этом отрицательный заряд на пластине меняться не будет.
Сравнить вел отриц заряда при равновесии м по табл станд потенциалов.
2) Энергия кристаллизации решетки больше эн сольватации .
Ион раствор вещества подходит к поверхности металла, восстанавливается и переходит в кристаллическую решетку металла. При этом металл заряжается положительно. К такому типу взаимодействия относят восстановление меди из раствора.
Электропроводимость электролитов
Формула связи между плотностью потока вещества, молярной концентрацией и скоростью направленного движения частиц имеет вид Если ее умножить а заряд q носителя тока, то произведение qJ будет заряду, проходящему через единицу площади сечения за 1 сек, т. е. будет являться плотностью тока:
Плотность тока для электролитов представляем в виде суммы выражений для положительных и отрицательных ионов ( 52)
Если предположить, что каждая молекула диссоциирует на 2 иона, то концентрации положительных и отрицательных ионов одинаковы: п+ = п- = an,
где a — коэффициент диссоциации, п — концентрация молекул электролита.
Направление движения ионов в электрическом поле можно приближенно считать равном, при этом сила qE, действующая на ион со стороны электрического поля, уравновешена силой трения ru: qE = ru, откуда, заменив q/r = b, получим u = bE. (54)
Коэффициент пропорциональности b называют подвижностью носителей заряда (ионов). Он равен отнощению скорости направленного движения ионов, вызванного электрическим полем, к напряженности этого поля.
Для ионов разных знаков из (54) соотв имеем
u+ = b+E и u- = b-E (55) Подст (53) и (55) в (52), находим
j = nq a(b+ + b-)E (56)
Представим электролит в виде прямоугольного параллелепипеда с гранями-электродами площади S, расположенными на расстоянии l (рис. 12.28). Считая поле однородным, учитывая выр (12.14), преоб (12.56)
Т к I = jS, то это соответствует закону Ома для участка цепи без источника тока:
где сопротивление электролита. Сравнивая его с соотн (57) получим
Отсюда следует, что уд проводимость g электролита тем больше, чем больше концентрация ионов, их заряд и подвижность При повышении темпе-ратуры возрастает подвижность ионов и увеличивается электропроводимость.
Вопросы и ответы
Что такое гальванический элемент? Почему происходит разделение зарядов в гальваническом элементе Вольта?
гальванический элемент - источник тока, разделение зарядов в котором происходит за счет преобразования химической энергии в электрическую. Отрицательные ионы в растворе серной кислоты притягиваются положительными ионыиз кристаллической решетки. При достаточной энергии притяжения, эти ионы переходят из электродов в раствор.
Когда прекращается растворение электродов в растворе электролита?
В какой-то момент кинетической энергии ионов не хватит для преодоления разности потенциала дв эл слоя, образлванного положит ионами в растворе и отрицательным зарядом на электродах, тогда растворение электродов прекратится.
Что такое нормальный электродный потенциал? Чему равна разность потенциалов на зажимах гальвического элемента?
Потенц на электродах, кот отсчитывается отн водородного электрода. Разность потенц равна, как видно из названия, разности нормальных потенциалов. Для обыкновенной пальчиковой батарейки U = 1,5 В.
Почему гальванический элемент допускают лишь однократное использование?
поск один из элд-ов (Zn в эл Даниэля – Якоби) необрат расход;
Течет ли ток в не подключенной батарее,если электродыды (Zn и Cu ) находятся в проводящ растворе электролите
Внутри батарейки за счёт хим реакций разделяются заряды, на одном электроде получается положительный заряд, на другом отрицательный. При этом между электродами появляется элек-трическое поле, которое препятствует дальнейшему их разделению. Чем больше зарядов на электродах - тем больше напряжение между электродами и тем сильнее электрическое поле, препятствует дальнейшему разделению зарядов. В равновесии сила этого препятствующего разделению поля полностью уравновешивает силу разделения за счёт химической реакции и ток не течёт (т е заряд на электродах не меняется) . Когда замыкают внешнюю цепь - заряды с электродов утекают в эту внешнюю цепь, внутри элемента поле ослабевает и силы химической реакции опять хватает на то, чтобы разделить заряды
Читайте также:
- Зимние олимпийские виды спорта конспект
- Конспект характеристика элементов рыночного регулирования зп
- М х валеев воробышек конспект урока
- Образ захара и его роль в характеристике обломовщины 10 класс конспект и презентация
- Конспект дидактической игры для ii младшей группы доу на тему один много ни одного

