Бериллий магний и щелочноземельные металлы конспект урока 9 класс
Обновлено: 01.07.2024
- Как меняются восстановительные свойства ЩМ в группе?
- Почему ЩМ хранят под слоем керосина?
- Перечислить физические свойства ЩМ.
- Как получают ЩМ?
- Перечислить основные химические свойства ЩМ.
- Какой характер имеют оксиды ЩМ?
- В какой цвет окрашиваю пламя соли лития, натрия, калия?
3. Изучение нового материала
Общая характеристика элементов главной подгруппы II группы
Количество электронов на последнем уровне
Атомный радиус
Металлические свойства
Восстановительные свойства
К щелочноземельным металлам относят : Ca , Sr , Ba , Ra
Ве - амфотерный металл, Mg – металл, С a , Sr , Ba - щёлочноземельные металлы Ra –радиоактивный элемент
- Общим является одинаковое строение внешнего электронного слоя
- Элементы проявляют СО +2
- Атомы элементов являются сильными восстановителями, т.к содержат 2 электрона на внешнем энергетическом уровне, которые отдают при взаимодействиями с другими элементами.
- С увеличением № элементов увеличивается атомный радиус, увеличивается число электронных слоев, следовательно возрастает легкость отдачи электронов. Восстановительные свойства увеличиваются в группе сверху вниз.
- Mg хранится на воздухе, ЩЗМ под слоем керосина.
Be – светло-серый, твердый, хрупкий металл
Mg – относительно мягкий, пластичный, ковкий
Ca – твердый, пластичный
Ba - пластичный, ковкий
Химические свойства элементов II группы главной подгруппы
Химические свойства оксидов и гидроксидов
BeO – амфотерный оксид
SrO Основные оксиды
По таблице растворимости определить растворимость гидроксидов:
Ве(ОН) 2 – амфотерный гидроксид
Mg ( OH ) 2 – нерастворимое основание
Sr ( OH ) 2 - растворимые основания (щелочи)

Слайд 1
Слайд 2
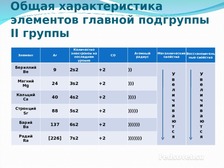
Общая характеристика элементов главной подгруппы II группы Количество электронов на последнем уровне Атомный радиус Элемент Ar СО Бериллий Be 9 2s2 +2 )) Магний Mg 24 3s2 +2 ))) Кальций Ca 40 4s2 +2 )))) Стронций Sr 88 5s2 +2 ))))) Барий Ba 137 6s2 +2 )))))) Радий Ra [226] 7s2 +2 ))))))) Металлические Восстановитель свойства ные свойства У в е л и ч и в а ю т с я У в е л и ч и в а ю т с я

Слайд 3
Ве - амфотерный металл, Mg – металл, Сa, Sr,Ba - щёлочноземельные металлы Ra –радиоактивный элемент

Слайд 4
Общая характеристика элементов главной подгруппы II группы Одинаковое строение внешнего электронного слоя Элементы проявляют СО +2 Атомы элементов являются сильными восстановителями, т.к содержат 2 электрона на внешнем энергетическом уровне, которые отдают при взаимодействиями с другими элементами. С увеличением № элементов увеличивается атомный радиус, увеличивается число электронных слоев, следовательно возрастает легкость отдачи электронов. Восстановительные свойства увеличиваются в группе сверху вниз.

Слайд 5
Ca – твердый, пластичный Be – светло-серый, твердый, хрупкий Mg – относительно мягкий, пластичный, Sr – ковкий

Слайд 6

Слайд 7
Химические свойства элементов II группы главной подгруппы 1.С кислородом 2M+O2=2MO (оксид) 2.С галогенами M+Cl2=MCl2 (хлорид) 3.С серой M+S=MS (сульфид) 4.С азотом 3M+N2=M3N2 (нитрид) 5.С водородом M+H2=MH2 (гидрид) 6.С водой M+2H2O=M(OH)2+H2

Слайд 8
Химические свойства оксидов BeO – амфотерный оксид MgO CaO SrO BaO Основные оксиды Оксид кальция СаО (негашеная известь)

Слайд 9

Слайд 10
Химические свойства гидроксидов Ве(ОН)2 – амфотерный гидроксид Mg(OH)2 – нерастворимое основание Ca(OH)2 Sr(OH)2 Ba(OH)2 Растворимые основания (щелочи) Гидроксид кальция Са(ОН)2 – гашеная известь

Слайд 11

Слайд 12

Слайд 13
Напишите уравнения реакций с помощью которых можно осуществить превращения: Са(ОН)2 ←Са→СаО→Са(ОН)2→Са(NO3)2→CaSO4 Be→BeO→BeCl2→Be(OH)2→Na2BeO2 ↓ BeSO4

Слайд 14
Полный текст материала Урок химии по теме "Бериллий, магний и щелочноземельные металлы",9 класс смотрите в скачиваемом файле.
На странице приведен фрагмент.
Спасибо за Вашу оценку. Если хотите, чтобы Ваше имя
стало известно автору, войдите на сайт как пользователь
и нажмите Спасибо еще раз. Ваше имя появится на этой стрнице.

Есть мнение?
Оставьте комментарий
Упражнения на технику чтения и понимания прочитанного
Тонкости и секреты работы в Яндекс.Почте
Как работать с детьми с СДВГ в обычном классе?
0 Спам
0 Спам
0 Спам
0 Спам
0 Спам
0 Спам
Мне очень понравилась презентация! Удачный дизайн презентации, читаемый шрифт, интересное представление материала. Но немного подводит техническая сторона оформления слайда №9 Это можно доработать.
0 Спам
Удалила слайд с видео (наверное), сжала все рисунки. Презентация стала "весить" не 4,19 Мб, а хотя бы 2,37 Мб.
Отправляя материал на сайт, автор безвозмездно, без требования авторского вознаграждения, передает редакции права на использование материалов в коммерческих или некоммерческих целях, в частности, право на воспроизведение, публичный показ, перевод и переработку произведения, доведение до всеобщего сведения — в соотв. с ГК РФ. (ст. 1270 и др.). См. также Правила публикации конкретного типа материала. Мнение редакции может не совпадать с точкой зрения авторов.
Для подтверждения подлинности выданных сайтом документов сделайте запрос в редакцию.
О работе с сайтом
Мы используем cookie.
Публикуя материалы на сайте (комментарии, статьи, разработки и др.), пользователи берут на себя всю ответственность за содержание материалов и разрешение любых спорных вопросов с третьми лицами.
При этом редакция сайта готова оказывать всяческую поддержку как в публикации, так и других вопросах.
Если вы обнаружили, что на нашем сайте незаконно используются материалы, сообщите администратору — материалы будут удалены.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Цель урока: дать общую характеристику металлов главной подгруппы II группы; рассмотреть основные физические и химические свойства, важнейшие соединения и области их применения.
Обучающие: Сформировать знания учащихся о металлах главной подгруппы II группы, свойствах и значением важнейших из них.
Развивающие : развитие у учащихся познавательных способностей, умения логически рассуждать, обобщать и делать выводы из полученных знаний
Воспитывающие : формирование навыков коллективной работы в сочетании с индивидуальной, повышение творческой активности учащихся
Тип урока: комбинированный
Фронтальный опрос
Запись темы урока
Рассказ учителя
Запись в тетрадь
Запись в тетрадь
Запись в тетрадь
Самостоятельное выполнение задания учениками
Рассказ учителя
I. Орг. момент.
II. Проверка д/з.
Ученикам раздаются карточки
Фамилия и Имя______________________________________
1.Назовите особенности химических свойств лития. Чем он отличается от других ЩМ?
Только литий при сгорании на воздухе образует оксид, все остальные ЩМ образуют пероксиды
2.Что общего в строении атомов ЩМ?
Общим является одинаковое строение внешнего электронного слоя, у всех ЩМ на последнем уровне находится один электрон. ЩМ проявляют постоянную с. о. +1
3. Каковы физические свойства щелочных металлов ?
Все щелочные металлы обладают металлическим блеском, тепло- и электропроводностью, плавятся при низких температурах, легки и пластичны. Щелочные металлы легко режутся ножом. Все они (за исключением желтоватого цезия) серебристо-белые. Хранят их под слоем керосина или парафина.
4.Опишите основные химические свойства ЩМ.
реагируют с неметаллами, водой, с кислотами — со взрывом), с водой образуют щелочи. От лития к калию в озрастают радиусы атомов, повышается химическая активность:
2 Na + O 2 —> Na 2 O 2 (пероксид)
K + O 2 -> К O 2 (надпероксид)
Увеличиваются атомная масса, плотность; уменьшаются температура плавления, твердость
Рассмотрим химические свойства ЩМ на примере натрия:
2Na + С l 2 = 2Na С l
2Na + S = 2Na 2 S
2 Na + H 2 O = 2 Na OH + H 2
5. Назовите важнейшие природные соединения ЩМ.
NaCl — каменная соль, NaCl • КС1 — сильвинит, Na 2 S О4 • 10Н2О - глауберова соль, NaN О3 - селитра, КС1 • MgCl 2 • 6Н2О — карналлит.
III. Содержание урока.
1.Строение и физические свойства атомов . Бериллий Ве, магний М g и щелочноземельные металлы кальций Са, стронций Sr, барий Ва и радий Ra — элементы главной подгруппы II группы Периодической системы. Атомы этих элементов содержат на внешнем энергетическом уровне два электрона, которые они отдают при химических взаимодействиях, и поэтому являются сильнейшими восстановителями. Во всех соединениях они имеют степень окисления +2. С ростом порядкового номера сверху вниз в подгруппе восстановительные свойства элементов усиливаются, что связано с увеличением радиусов их атомов.
Радий — радиоактивный элемент, содержание его в природе невелико.
Бериллий, магний и щелочноземельные металлы — простые вещества. Легкие серебристо-белые металлы, стронций имеет золотистый оттенок. Он значительно тверже щелочных металлов, барий же по мягкости напоминает свинец.
2. Химические свойства . На воздухе при обычной температуре поверхность бериллия и магния покрывается защитной оксидной пленкой. Щелочноземельные металлы взаимодействуют с кислородом воздуха более активно, поэтому их хранят под слоем керосина или в запаянных сосудах, как и щелочные металлы.
а) При нагревании на воздухе все рассматриваемые металлы энергично сгорают с образованием оксидов:
2 Ca + O 2 = 2 CaO
Реакция сжигания магния сопровождается ослепительной вспышкой, раньше она применялась при фотографировании объектов в темных помещениях. В настоящее время используют электрическую вспышку.
б ) Реакция с неметаллами. Бериллий, магний и все щелочноземельные металлы взаимодействуют при нагревании с неметаллами — хлором, серой, азотом и т. д., образуя соответственно хлориды, сульфиды, нитриды:
Са + S = CaS сульфид
в) Реакция с водой . Из всех металлов главной подгруппы II группы только бериллий практически не взаимодействует с водой (препятствует защитная пленка на его поверхности), магний реагирует с ней медленно, остальные металлы бурно взаимодействуют с водой при обычных условиях:
Подобно алюминию магний и кальций способны восстанавливать редкие металлы — ниобий, тантал, молибден, вольфрам, титан и др. — из их оксидов
Mg + TiO = Ti + MgO
Магний и кальций применяют для производства редких металлов и легких сплавов. Например, магний входит в состав дюралюминия, а кальций — один из компонентов свинцовых сплавов, необходимых для изготовления подшипников и оболочек кабелей.
Внимание. Выполните задание. Сейчас вы составите опорный конспект по химическим свойствам ЩЗМ. Задание выполняется в паре.
Металлы II гр А подгруппы
гидроксиды(основания, кроме ВеО)
3.Соединения металлов II группы
Me ( O Н)2
Ме(кислотный остаток)
MeO Основные оксиды
Ве(ОН)3 амфотерный гидроксид
Соединения бериллия, магния и щелочноземельных металлов. В природе щелочноземельные металлы, как и щелочные металлы, находятся только в форме соединений вследствие своей высокой химической активности.
Оксиды МО — твердые белые тугоплавкие вещества, устойчивые к воздействию высоких температур.
Проявляют основные свойства, кроме оксида бериллия, имеющего амфотерный характер.
Оксид магния малоактивен в реакции с водой, все остальные оксиды очень бурно взаимодействуют с ней:
Оксиды получают обжигом карбонатов: МСО3 = МО + СО2
В технике оксид кальция СаО называют негашеной известью, а МgО — жженой магнезией. Оба этих оксида используют в производстве строительных материалов.
Гидроксиды щелочноземельных металлов относятся к щелочам. Их растворимость в воде растет от Са(ОН)2 к Ва(ОН)2. Эти гидроксиды получают взаимодействием соответствующего оксида с водой.
Реакция оксида кальция с водой сопровождается выделением большого количества теплоты и называется гашением извести, а образующийся Са(ОН)2 — гашеной известью:
Прозрачный раствор гидроксида кальция называется известковой водой, а белая взвесь Са(ОН)2 в воде — известковым молоком. Гашеная известь широко используется в строительстве. Известковое молоко применяют в сахарной промышленности для очистки свекловичного сока.
Соли бериллия, магния и щелочноземельных металлов получают взаимодействием их с кислотами. Галогениды (фториды, хлориды, бромиды и иодиды) этих металлов — белые кристаллические вещества, большинство из них растворимо в воде.
Из сульфатов хорошо растворимы в воде только сульфаты бериллия и магния. Растворимость сульфатов уменьшается от ВеSO4 к ВaSO4. Карбонаты этих металлов малорастворимы или совсем нерастворимы в воде.
Сульфиды щелочноземельных металлов, содержащие в малых количествах примеси тяжелых металлов, после предварительного освещения начинают светиться различным цветом — красным, оранжевым, голубым, зеленым. Они входят в состав специальных светящихся красок, которые называют фосфорами. Их используют для изготовления светящихся дорожных знаков, циферблатов и т. п.
Рассмотрим наиболее важные соединения элементов главной подгруппы II группы периодической системы.
СаСО3 — карбонат кальция — одно из самых распространенных на Земле соединений. Вам хорошо известны такие содержащие его минералы, как мел, мрамор, известняк.
Самый важный из этих минералов — известняк, без которого не обходится ни одно строительство. Во-первых, он сам является прекрасным строительным камнем (вспомните знаменитые одесские катакомбы — бывшие каменоломни, в которых добывали камень для строительства города), во-вторых, это сырье для получения других материалов: цемента, гашеной и негашеной извести, стекла и др.
Известковой щебенкой укрепляют дороги, а порошком — уменьшают кислотность почв.
Природный мел представляет собой остатки раковин древних животных .Один из примеров его использования вы хорошо знаете — это школьные мелки, зубные пасты. Мел применяют в производстве бумаги и резины, а также для побелки.
Мрамор — это минерал скульпторов, архитекторов и облицовщиков. Из него создавал свои прекрасные творения Микеланджело ), стены всемирно известного индийского мавзолея-Тадж-Махал выложены из мрамора, им же облицованы многие станции московского метро.
МgС O 3 — карбонат магния, необходим в производстве стекла, цемента, кирпича, а также в металлургии для перевода пустой породы, т. е. не содержащей соединения металла, в шлак.
СаSО4 — сульфат кальция, встречается в природе в виде минерала гипса СаSO4 • 2Н2О, представляющего собой кристаллогидрат. Используется в строительстве, в медицине для наложения неподвижных гипсовых повязок, для получения слепков.
Для этого применяют полуводный гипс 2СаSО4 • Н2О — алебастр, который при взаимодействии с водой образует двуводный гипс:
Эта реакция идет с выделением теплоты.
Сульфат магния, известный под названием горькая, или английская, соль, используемый в медицине в качестве слабительного средства. Содержится в морской воде и придает ей горький вкус.
Кальций имеет важное значение для живых организмов, это материал для постройки костных скелетов. Он играет существенную роль и в самих процессах жизнедеятельности: ионы кальция регулируют работу сердца, участвуют в процессах свертывания крови.
На долю кальция приходится более 1,5% от массы тела человека, 98% кальция содержится в костях скелета. Однако кальций не только делает наши кости крепче, но и способствует работе нервной системы. При недостатке кальция руки теряют способность удерживать предметы, мышцы начинают судорожно сокращаться, кровь перестает свертываться, нервная система приходит в негодность, а сердечная мышца отказывается нормально работать.
Открытие магния и кальция . Магний был впервые получен Г. Дэви в 1808 г. из белой магнезии — минерала, найденного близ греческого города Магнезия. По названию минерала и дали название простому веществу и химическому элементу.
Полученный Г. Дэви металл был загрязнен примесями, а чистый магний получил француз А. Бюсси в 1829 г.
Генетический ряд кальция
Ca – 1 CaO – 2 Ca ( OH )2 – CaCO 3
Домашнее задание
П рочитайте § 15 о значении соединений щелочноземельных металлов и выпишите сведения в виде таблицы:

В ходе урока рассматривается общая характеристика ЩЗМ.
Бериллий, магний и щелочноземельные металлы.
Цель. Дать общую характеристику металлов главной подгруппы II группы.
Образовательные: дать общую характеристику металлов главной подгруппы II группы; рассмотреть основные физические и химические свойства этих элементов.
Развивающие: продолжить формирование устойчивого интереса к химической науке и практике, положительных мотивов учения, развивать логическое мышление и интеллектуальные умения (анализировать, сравнивать, устанавливать причинно-следственные связи, делать выводы), внимательность, самостоятельность при выполнении заданий; совершенствовать умения составления уравнений химических реакций.
Воспитательные: воспитывать интерес к химии как науке, сознательное отношение к химическим знаниям
Повторение изученного материала
Проверить домашнее задание упр. 1 стр. 58
Группу каких элементов вы изучали на предыдущем уроке?
Какие химические элементы относят к семейству щелочных металлов.
Литий, натрий, калий, рубидий, цезий, франций
Где встречаются щелочные металлы в природе?
В виде оксидов, оснований или в составе минералов
Почему щелочные металлы не встречаются в природе в чистом виде?
У них очень высокая химическая активность
С чем связана высокая химическая активность щелочных металлов? (Свяжите строение их атомов с их положением в ПСЭ)
У них 1 электрон на внешнем уровне (они находятся в 1 группе главной подгруппе), который они могут очень легко отдавать, проявляя при этом восстановительные свойства.
Как тогда нужно хранить щелочные металлы?
Под слоем керосина, чтобы они не взаимодействовали с кислородом воздуха и другими веществами
Какие физические свойства щелочных металлов вам известны?
Очень мягкие, легко режутся ножом, металлический блеск на свежем срезе.
Перечислить основные химические свойства ЩМ
Взаимодействуют с неметаллами, образуя бинарные соединения (с кислородом, водородом, мерой, хлором, азотом и др.), с водой (образуют основания), с кислотами (образуют соли), с солями менее активных металлов
Внимание Скидка 50% на курсы! Спешите подать
заявку
Профессиональной переподготовки 30 курсов от 6900 руб.
Курсы для всех от 3000 руб. от 1500 руб.
Повышение квалификации 36 курсов от 1500 руб.
Лицензия №037267 от 17.03.2016 г.
выдана департаментом образования г. Москвы

Конспект урока "Бериллий, магний, щелочноземельные металлы" 9 Класс
Автор-составитель Ильичева Т.В., учитель химии МОУ-СОШ №21г.Альметьевск, РТ
Познакомить со свойствами элементов II группы, главной подгруппы, их соединениями и основными областями применения.
Развивать умения анализировать, сравнивать, предугадывать свойства металлов, опираясь на знания об особенностях строения атомов химических элементов. Расширять кругозор, обогащать словарный запас.
Воспитывать интерес к химии как науке, сознательное отношение к химическим знаниям.
карточки со словами;
образцы металлов (магний);
задания к кроссворду на каждую парту по одному экземпляру.
Х О Д У Р О К А :
I Организационный момент.
II Актуализация знаний.
Проверка домашнего задания (два ученика у доски):
№ 1 а, с.58 – решает 1 ученик;
№ 1 б, с.58 – решает 2 ученик.
Соотнести технические названия веществ с их формулами.
Формулы выписаны в столбик на доске, а названия вразброс на карточках, прикрепляемых к доске магнитами с обратной стороны.
На доске формулы (записаны в столбик): NaOH NaCl Na 2 SO 4 *10 H 2 O KOH NaHCO 3 Na 2 CO 3 *10 H 2 O K 2 CO 3 .
На карточках: едкий натр, едкий кали, поваренная соль, кристаллическая сода, пищевая сода, глауберова соль, поташ.
Попутно, по мере соотнесения формул и названий, необходимо называть область применения данных веществ.
С солями и гидроксидами каких металлов мы работали?
Что общего в строении щелочных металлов?
Почему их хранят под слоем керосина?
Перечислите их физические свойства.
Как они изменяются с увеличением порядкового номера?
Перечислите основные химические свойства щелочных металлов.
III Изучение нового материала.
1. Самостоятельная работа учащихся в рабочих тетрадях:
С какими химическими элементами вы работали?
Где они все располагаются?
3. Физические свойства металлов II группы, главной подгруппы, нахождение в природе; строение ЩЗМ, бериллия, магния.
Объяснение учителя: казалось, все эти элементы находятся в одной группе, в главной подгруппе, но по какой-то причине магний и бериллий к группе щелочноземельных металлов (ЩЗМ) не относят?! Оказывается, если магний по свойства во многом тяготеет к ЩЗМ, то бериллий стоит как бы особняком. По свойствам он ближе к алюминию, расположенному по диаганали от него в III группе. По какой причине не относят к ЩЗМ магний мы узнаем сегодня чуть позже.
Далее заслушиваются выступления учащихся (заранее заготовленное домашнее задание) о физических свойствах данных металлов их применении, истории открытия, нахождении в природе, учитель может добавить:
Бериллий – встречается в природе в виде минералов: берилла, хризоберилла и их разновидностей: изумруда, аквамарина, александрита – известных как драгоценные камни.
Бериллий и его растворимые в воде соединения высокотоксичны (ядовиты). Даже ничтожно малая примесь его в воздухе приводит к тяжёлым заболеваниям. Он находит широкое применение в технике. Добавляя к меди он сильно повышает её твёрдость, прочность, химическую стойкость, делает похожей на сталь. Основной потребитель бериллия – атомная энергетика. Потребность в нём с каждым годом растёт.
Как вы думаете почему остальные металлы этой группы, главной подгруппы названы ЩЗМ?
Так они именуются по той причине, что их гидроксиды, подобно гидроксидам ЩМ растворимы в воде, то есть являются щелочами.
Кальцит образует залежи мела, мрамора, известняка.
Подумайте из чего кальцит формируется?
Поэтому неудивительно, что иногда в известняках находят ракушки или отпечатки животных.
Где он применяется? (гипсовые слепки, карнизы, лепнина, штукатурка потолков, в хирургии, бумажная промышленность).
Вспомните внешний вид, агрегатное состояние металлов: бериллия, магния, кальция; обратите внимание на зависимость температуры плавления, плотности простых веществ и сделайте соответствующие выводы, используя таблицу (таблица может быть на экране компьютера, либо на доске):
Читайте также:
- Конспект утренней гимнастики в средней группе тема в лесу
- Линейные программы на питоне конспект
- Мои первые книжки 1 класс конспект урока
- Конспект урока рабочие специальности озеленитель и цветовод значение обязанности условия труда
- В мире кожаных изделий подготовительная группа конспект и презентация окружающий мир

