Закон гейлюсака определение простыми словами кратко и понятно
Обновлено: 07.07.2024
Открытие газового закона Р. Бойлем и Э. Мариоттом для изотермических процессов побудило ученых искать другие функциональные зависимости макропараметров газов. В 1802 году французский ученый Ж. Л. Гей-Люссак, исследуя зависимость объема газа от температуры при постоянном давлении, установил закон, названный со временем в его честь.
Жозеф Луи Гей-Люссак (1778—1850) — французский физик и химик, установил, что коэффициент расширения всех газов одинаковый; исследовал температуру и влажность воздуха на высоте до 7 км, дважды поднимаясь в 1804 г. на воздушном шаре. Изобрел спиртометр, барометр и ряд других приборов.
| Рис. 1.8. Опыт Ж. Л. Гей-Люссака |
Обобщив экспериментальные данные, Гей-Люссак установил, что с изменением температуры при постоянном давлении относительный объем данной массы газа изменяется линейно.
На основании наблюдений он сформулировал утверждение, названное в его честь законом Гей-Люссака.
Закон Гей-Люссака. При постоянном давлении относительное изменение объема газа данной массы прямо пропорционально изменению температуры:
где Δt — изменение температуры; V — объем газа при определенной температуре t.
После некоторых математических преобразований, закон Гей-Люссака можно записать также в виде:
Открытие газового закона Р. Бойлем и Э. Мариоттом для изотермических процессов побудило ученых искать другие функциональные зависимости макропараметров газов. В 1802 году французский ученый Ж. Л. Гей-Люссак, исследуя зависимость объема газа от температуры при постоянном давлении, установил закон, названный со временем в его честь.
Закон Гей-Люссака Для данной массы газа отношение объема газа к его температуре постоянно, если давление газа не меняется.
Эту зависимость математически записывают так:
\[ \frac = const \qquad \text \quad \begin m=const \\ p=const \end \]
Данный закон приближенно можно наблюдать, когда происходит расширение газа при его нагревании в цилиндре с подвижным поршнем. Постоянство давления в цилиндре обеспечивается атмосферным давлением на внешнюю поверхность поршня.
Другим проявлением закона Гей-Люссака в действии является аэростат. Закон Гей-Люссака не соблюдается в области низких температур, близких к температуре сжижения (конденсации) газов.
Закон справедлив для идеального газа. Он неплохо выполняется для разреженных газов, которые по своим свойствам близки к идеальному. Температура газа должна быть достаточно велика.
Обобщив экспериментальные данные, Гей-Люссак установил, что с изменением температуры при постоянном давлении относительный объем данной массы газа изменяется линейно.
На основании наблюдений он сформулировал утверждение, названное в его честь законом Гей-Люссака.
Закон Гей-Люссака При постоянном давлении относительное изменение объема газа данной массы прямо пропорционально изменению температуры:
где:
Δt — изменение температуры;
V — объем газа при определенной температуре t.
После некоторых математических преобразований, закон Гей-Люссака можно записать также в виде:
\[ V=V_0\left( 1+\alpha \Delta t \right) \]
где:
V0 — объем газа при температуре t0 .
Коэффициент пропорциональности α называется температурным коэффициентом объемного расширения. Расчета показали, что все разреженные газы при нагревании на 1°C или 1 K изменяют свой объем приблизительно на \( \frac < 273>\) частицу от начального объема:
Гей-Люссак доказал, что у всех газов температурный коэффициент объемного расширения одинаковый и равен 1 / 273 K -1 .
Термодинамический процесс, который происходит при постоянном давлении, называется изобарным, а линии, изображающие его, — изобарами. На координатной плоскости зависимости объема V от температуры t изобары будут иметь вид прямых, которые сходятся в одной точке. Их наклон зависит от значения давления — изобара, которая отвечает большему давлению, проходит ниже изобары меньшего давления (p1 .
Закон Гей-Люссака приобретет более простую форму, если его выразить через абсолютную температуру. Поскольку 1 + αt = 1 + (1 / 273) • (T — 273) = αТ , то
Таким образом, при постоянном давлении объем данной массы газа прямо пропорциональный абсолютной температуре.
Закон Гей-Люссака утверждает, что в изобарном процессе отношение объемов данной массы газа в разных состояниях равно отношению абсолютных температур газа в этих состояниях:
Очевидно, что на координатных плоскостях pT и pV изобарами являются прямые, перпендикулярные оси давления.

Закон Гей-Люссака — закон пропорциональной зависимости объёма газа от абсолютной температуры при постоянном давлении, названный в честь французского физика и химика Жозефа Луи Гей-Люссака, впервые опубликовавшего его в 1802 году.
Следует отметить, что в англоязычной литературе закон Гей-Люссака обычно называют законом Шарля и наоборот. Кроме того, законом Гей-Люссака называют также химический закон объёмных отношений.
Содержание
Неоднозначность терминологии
В русско- и англоязычной научной литературе существуют некоторые различия в наименовании законов, связанных с именем Гей-Люссака. Эти различия представлены в следующей таблице.
| Русскоязычное название | Англоязычное название | Формула |
|---|---|---|
| Закон Гей-Люссака | Закон Шарля (en:Charles's law) Закон Гей-Люссака Закон объёмов (Volumes Law) |  |
| Закон Шарля | Закон Гей-Люссака (en:Gay Lussac's law) Второй закон Гей-Люссака |  |
| Закон объёмных отношений | Закон Гей-Люссака (en:Gay Lussac's law) |
История открытия
Неоднозначность терминологии связана с историей открытия газовых законов. Закон объёмов (называемый в русскоязычной литературе законом Гей-Люссака) впервые был опубликован в открытой печати в 1802 году Гей-Люссаком [1] , однако сам Гей-Люссак считал, что открытие было сделано Жаком Шарлем в неопубликованной работе, относящейся к 1787 году. Независимо от них закон был открыт в 1801 году английским физиком Джоном Дальтоном. Кроме того, качественно закон был описан французом Гийомом Амонтоном в конце XVII века.
За кем бы ни оставался приоритет этого открытия, Гей-Люссак первым продемонстрировал, что закон применим ко всем газам, а также к парам летучих жидкостей при температуре выше точки кипения. Математически он выразил своё открытие так:

где " width="" height="" />
— объём данного количества газа при температуре 100 °C; — объём того же газа при 0 °C; — константа, одинаковая для всех газов при одинаковом давлении.

Гей-Люссак дал для константы значение 1 ⁄2 6 666 , что достаточно близко к современному значению, равному 1 ⁄2 7 315 .
Формулировка закона
Изобарический закон, открытый Гей-Люссаком в 1802 году утверждает, что при постоянном давлении объём постоянной массы газа пропорционален абсолютной температуре. Математически закон выражается следующим образом:


где — объём газа, — температура.
Если известно состояние газа при неизменном давлении и двух разных температурах, закон может быть записан в следующей форме:


.


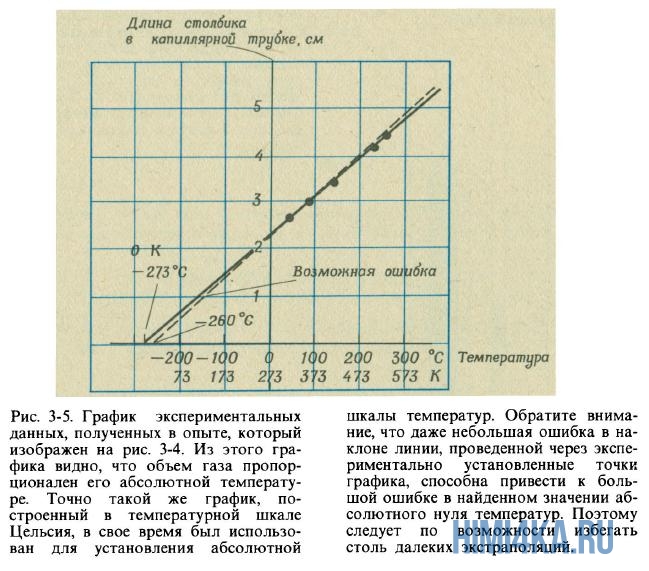
Подобные измерения нетрудно выполнить при помощи устройства, схематически изображенного на рис. 3-4. При этом получаются данные, аналогичные Показанным на рис. 3-5, из которого видно, что график зависимости объема V газа от его температуры Т при постоянном давлении представляет собой прямую линию. Прямолинейная экстраполяция этой линии в область низких температур показывает, что график пересекает температурную ось в точке, соответствующей -273°С. Закон Гей-Люссака можно записать в виде математического соотношения:
где V — объем образца газа, t — его температура по шкале Цельсия, а с — коэффициент пропорциональности.

Впоследствии У. Томсон (1824-1907), который с 1892 г. стал лордом Кельвином, выдвинул предположение, что температура -273°С представляет собой абсолютный минимум температур, ниже которого невозможно опуститься. В настоящее время ученые пользуются абсолютной шкалой температур Кельвина, в которой 0 К = -273,15°С, а 0°С = 273,15 К. В этой шкале закон Гей-Люссака принимает вид:
где Т — температура в абсолютной шкале Кельвина (т.е. Т = t + 273,15); n — число молей газа в данном образце. Уравнение (3-6) означает, что при
постоянном давлении объем заданного числа молей газа прямо пропорционален его абсолютной температуре.
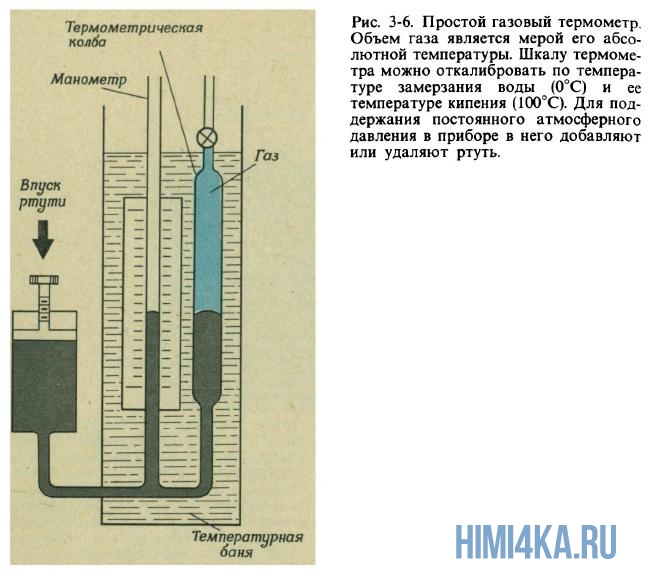
Газовый термометр
Легкие газы типа водорода и гелия настолько точно подчиняются закону Гей-Люссака, что для сверхточных измерений температуры вместо ртутных термометров используют термометры, наполненные одним из этих газов (рис. 3-6). Ртутный термометр, откалиброванный таким образом, что он показывает 0°С в смеси воды со льдом и 100°С в кипящей воде, в промежуточных точках шкалы имеет точность, не превышающую 0,1 градуса (град), а водородный термометр позволяет производить измерения температуры в этом диапазоне с намного большей точностью.
Формулы из закона Гей-Люссака
Для сопоставления объемов и температур одного и того же образца газа при различных температуре и объеме (но при постоянном давлении) закон Гей-Люссака удобно представить в формул:
Такой способ записи закона Гей-Люссака показывает, что если давление и число молей газа остаются постоянными, то отношение его объемов при двух различных температурах должно быть равно отношению соответствующих абсолютных температур.
Пример 5. Если пластмассовый мешочек, описанный в примере 4 (см. урок 25), положить на подоконник, где его нагревает солнце, температура мешочка повышается от 20 до 30°С. Исходный объем мешочка равнялся 100,0 см 3 , какой объем он приобретает в результате нагревания?
Решение
V1 = 100,0 см 3 , Т1 = 20°С, т.е. 293,15 К, а Т2 = 30°С, т.е. 303,15 К. Для вычисления V2 воспользуемся соотношением (3-7):
Подставляя в него исходные данные, найдем:
Подчеркнем, что при использовании соотношения (3-7) следует подставлять в него абсолютные значения температуры в шкале Кельвина, а не в шкале Цельсия.
Читайте также:

