Основные положения теории бутлерова кратко
Обновлено: 02.07.2024

Химическая структура молекулы представляет собой наиболее характерную и уникальную ее сторону, поскольку она определяет ее общие свойства (механические, физические, химические и биохимические). Любое изменение в химической структуре молекулы влечет за собой изменение ее свойств. В случае незначительных структурных изменений, внесенных в одну молекулу, следуют небольшие изменения ее свойств (обычно затрагивает физические свойства), если же молекула испытала глубокие структурные изменения, то и ее свойства (особенно химические) будут глубоко изменены.
Например, Альфа-аминопропионовая кислота (Альфа-аланин) имеет следующую структуру:
Альфа-аланин
- Наличие определенных атомов (С, Н, О, N),
- определенное количество атомов, принадлежащих каждому классу, которые связаны в определенном порядке;
Все эти конструктивные особенности определяют целый ряд свойств Альфа-аланина, таких как: твердое агрегатное состояние, температура кипения 295° С, растворимость в воде, оптическая активность, химические свойства аминокислот и т. д.
При наличии связи аминогруппы с другим атомом углерода (т.е. произошло незначительное структурное изменение), что соответствует бета-аланину:
Бета-аланин
Общие химические свойства по-прежнему остаются характерными для аминокислот, но температура кипения составляет уже 200° C и отсутствует оптическая активность.
Если же, например, два атомы в этой молекуле соединены атомом N в следующем порядке (глубокое структурное изменение):
1- нитропропан
тогда образованное вещество — 1-нитропропан по своим физическим и химическим свойствам совершенно не похож на аминокислоты: 1-нитро-пропан — это желтая жидкость, с температурой кипения 131°С, нерастворим в воде.
Общие принципы теории строения органических соединений
В сущности определения структуры органического соединения, лежат следующие принципы, которые вытекают из связи между их структурой и свойствами:
а) органические вещества, в аналитически чистом состоянии, имеют один и тот же состав, независимо от способа их получения;
б) органические вещества, в аналитически чистом состоянии, обладает постоянными физико-химическими свойствами;
в) органические вещества с постоянным составом и свойствами, имеет только одну уникальную структуру.
Основные положения теории А. М. Бутлерова
кратко могут быть изложены следующим образом:
- В молекуле органического соединения атомы связаны в определенной последовательности, что и определяет его строение.
- Атом углерода в составе органических соединений имеет валентность равную четырем.
- При одинаковом составе молекулы возможно несколько вариантов соединения атомов этой молекулы между собой. Такие соединения, имеющие один состав, но различное строение были названы изомерами, а подобное явление – изомерией.
- Зная строение органического соединения можно предсказать его свойства; зная свойства органического соединения можно предсказать его строение.
- Атомы, образующие молекулу подвержены взаимному влиянию, что определяет их реакционную способность. Непосредственно связанные атомы оказывают большее влияние друг на друга, влияние не связанных непосредственно атомов значительно слабее.
Заслуга А.М. Бутлерова и значение теории химического строения исключительно велико ля химического синтеза. Открылась возможность предсказать основные свойства органических соединений, предвидеть пути их синтеза. Благодаря теории химического строения химики впервые оценили молекулу как упорядоченную систему со строгим порядком связи между атомами. И в настоящее время основные положения теории Бутлерова, несмотря на изменения и уточнения, лежат в основе современных теоретических представлений органической химии.
Другим значимым аспектом теории А. М. Бутлерова стало утверждение, что химическое строение веществ можно установить опытным путём химическими методами и отразить в формуле.
отражены в следующем:
1. Атомы в молекулах соединены друг с другом в определённой последовательности согласно их валентности.
2. Свойства веществ зависят от вида и количества атомов, входящих в состав молекулы, а также от химического строения. Химическое строение определяет взаимное влияние атомов в молекуле.
3. Химическое строение молекулы может быть установлено в результате изучения свойств вещества.
Структуры органических соединений отображаются химическими формулами, в которых показан порядок соединения атомов в молекулах. Такие формулы называют формулами химического строения или структурными формулами.
Структурные формулы отображают только последовательность соединения атомов, но не расположение их в пространстве.
Каждая структурная формула отображает строение одной и той же молекулы пропана, т. к. последовательность соединения атомов в данном случае не изменяется.
Структурные формулы веществ обычно изображают в сокращённом виде `"CH"_3-"CH"_2-"CH"_3`. В сокращённых формулах чёрточки показывают связь атомов углерода друг с другом, но не показывают связи между атомами углерода и водорода. Начиная с бутана возможен различный порядок соединения атомов при одном и том же составе молекулы, т. е. в бутане атомы углерода могут располагаться в виде линейной и разветвлённой цепей.
`"C"-"C"-"C"-"C"`
В первом случае каждый атом углерода соединён с одним (если он концевой) или с двумя (если он находится внутри цепи) соседними атомами углерода; во втором случае – появляется атом углерода, соединённый с тремя соседними атомами углерода. Различному порядку связывания атомов при одном и том же качественном и количественном составе молекулы должны соответствовать разные вещества.
Бутан линейного строения и изобутан различаются температурами кипения.
| `"CH"_3-"CH"_2-"CH"_2-"CH"_3` | |
| бутан (т. кип. `-0,5^@"C"`) | изобутан (т. кип. `-11,7^@"C"`) |
называют вещества, которые имеют одинаковый состав молекулы, но различное химическое строение.
С увеличением числа атомов углерода в молекуле число возможных изомеров резко возрастает. Различия в химическом строении являются причиной проявления изомерами различных физико-химических свойств.
Теория А. М. Бутлерова завоевала признание. Значение теории химического строения А. М. Бутлерова можно сравнить с Периодическим законом и Периодической системой химических элементов Д. И. Менделеева.
Для изображения электронного строения молекул используются электронные формулы (структуры Льюиса, октетные формулы). При написании электронной формулы должно выполняться правило октета, согласно которому атом, участвуя в образовании химической связи (отдавая или принимая электроны), стремится приобрести электронную конфигурацию инертного газа - октет (восемь) валентных электронов. Исключение составляет атом водорода, для которого устойчивой является конфигурация гелия, т. е. два валентных электрона.
Общую пару электронов иногда обозначают чёрточкой, которая и символизирует внутримолекулярную химическую связь:

Поведение частиц в соединениях зависит от множества факторов. Теория строений органических соединений как раз изучает поведение молекулы в соединениях, природу атомов, валентность, порядок и характер химических связей. В данной статье сформулированы кратко основные положения этой теории.
Строение органических соединений
Многообразие органических соединений объясняются особенностью их химического строения. Атомы в молекуле расположены в определенном порядке в соответствии с их валентностью. Эта последовательность и является химическим строением.
Вещества, имеющие один и тот же качественный и количественный состав (молекулярную формулу), но разное строение, называются изомерами, а само их существование – изомерией. Известный русский химик А. М. Бутлеров доказал, что с помощью управляемых реакций можно получить новые вещества.
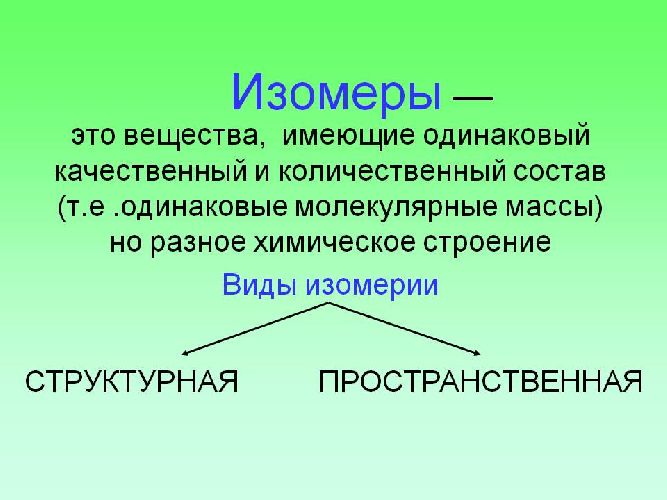
Рис. 1. Изомерия определение.
Также важным является положение о том, что атомы и группы атомов в молекуле взаимно влияют друг на друга.
Теория строений органических веществ
Теория строения органических соединений была сформулирована русским химиком А. М. Бутлеровым в 1861 году. Главным выводом этой научной работы стало утверждение, что каждом веществу соответствует только одна формула. Этот труд показывает поведение атомов внутри молекул.

Рис. 2. А. М. Бутлеров.
Основные положения и следствия теории строения Бутлерова могут быть сформулированы следующим образом:
- В молекулах атомы расположены не хаотично, а имеют определенную структуру.
Схематическое изображение строения молекулы называется структурной формулой

Рис. 3. Структурная формула молекулы.
Основываясь на положении о валентности атома углерода, равной четырем, и его способности образовывать цепи и циклы, строят структурные формулы органических веществ.
- Химические свойства вещества зависят от состава и порядка расположения атомов и молекул.
- Различное строение при одном и том же составе и молекулярной массе вещества обуславливает явление изомерии. Абсолютные разные химические элементы могут иметь одинаковый состав и молекулярную массу, все зависит от расположения мельчайших частиц и связей между ними.
- По свойствам вещества можно определить строение молекулы, а по ее строению можно предсказать свойства
- Так как при отдельных реакциях изменяются не все, а только некоторые части молекул, то, изучая продукты химических превращений соединения, можно установить его строение.
- Реакционная способность атомов, входящих в молекулу, меняется в зависимости от того, с какими атомами они связаны в данной молекуле. Связанные между собой атомы влияют друг на друга с большей силой, чем несвязанные.
Что мы узнали?
Значение теории химических строений органических соединений Бутлерова велико. Его теория не только объясняет строение молекул всех известных органических веществ и их свойства, но и дает возможность теоретически предвидеть существование неизвестных и новых веществ, а также найти способ их получения и синтеза.

Основные положения
теории химического строения
Ключевые слова конспекта: Теория химического строения органических соединений. Валентность. Структурная формула. Простые (одинарные) связи. Кратные (двойные и тройные) связи. Изомеры. Изомерия. Взаимное влияние атомов в молекуле.
Предпосылки создания теории химического строения
По мере накопления химических знаний учёные овладели умением не только выделять органические вещества из природных объектов, но и проводить реакции с участием таких соединений. Так накапливались знания о свойствах органических веществ, расширялись области их практического применения.
К середине XIX в. возникла необходимость осмысления, объяснения и обобщения накопившихся данных в области органической химии, т. е. создания научной теории, которая позволила бы систематизировать и объяснять строение и свойства органических веществ.
В первой половине XIX в. учёными разных стран были предприняты попытки создания подобной теории. Одни основывались на сходстве качественного и количественного состава родственных органических веществ, другие — на общности химических свойств. Однако подобно тому, как первые попытки классификации химических элементов не превратились в научную теорию, а стали лишь предтечей открытия Д. И. Менделеевым периодического закона, так и ранние попытки систематизации знаний об органических веществах явились предпосылками создания теории химического строения органических соединений.
Первое положение теории химического строения.
Структурные формулы
Основой теории Бутлерова является положение о химическом строении как определённой последовательности химических связей между атомами в молекулах в строгом соответствии с их валентностью. Рассмотрим основные положения теории химического строения.
Напомним, что валентность — это способность атомов химических элементов образовывать определённое число связей с другими атомами. Для соединений с ковалентными связями валентность равна числу общих электронных пар данного атома с соседними атомами.
Наглядно продемонстрировать валентность атомов в молекуле можно с помощью структурных формул. Структурная формула — это такое изображение молекулы, в котором каждая ковалентная химическая связь показана чёрточкой — валентным штрихом.

В органических соединениях углерод проявляет постоянную валентность, равную четырём. Например, структурная формула простейшего углеводорода метана СН4 имеет вид

Атомы углерода обладают уникальной способностью образовывать связи не только с атомами других элементов, но и друг с другом; при этом возникают различные цепи — линейные, разветвлённые, замкнутые:
Атомы углерода во всех приведённых примерах четырёхвалентны и образуют между собой и с атомами водорода простые, или одинарные, связи.

Но этим уникальные особенности атомов углерода как химического элемента не исчерпываются. Два атома могут быть связаны между собой и с другими атомами не только простыми, но и кратными, т. е. двойными или даже тройными, связями, например:
Теперь вам становится понятна одна из причин многообразия органических соединений. Она заключается в том, что атомы углерода способны образовывать между собой ковалентные химические связи (простые и кратные), соединяясь в цепи (неразветвлённые, разветвлённые, циклические).
Второе положение теории
химического строения. Изомерия
Первое вещество — этиловый спирт и второе — диметиловый эфир имеют одинаковый состав, но их физические и химические свойства различны. Вы впервые встретились с очень распространённым в органической химии явлением — изомерией.
Вещества, имеющие одинаковый качественный и количественный элементный состав, но различное химическое строение, а следовательно, и различные свойства, называют изомерами. Явление существования изомеров называют изомерией.
А. М. Бутлеров не только впервые объяснил существование изомеров различием в химическом строении молекул, но и сумел предсказать существование изомеров для уже известных веществ, а затем и синтезировать их. В этом заключается выдающаяся предсказательная роль теории строения.
Таким образом, молекулярная формула отражает только качественный и количественный состав вещества. Информацию о химическом строении соединения несёт структурная формула, указывающая на порядок связи атомов в молекулах. Помимо полной структурной формулы наподобие тех, которые изображены выше, на практике чаще используют сокращённые структурные формулы, сворачивая близлежащие группы атомов, не записывая ненужные при этом валентные штрихи. Например, особенности строения этилового спирта и диметилового эфира вполне однозначно передают формулы:

Более детальную информацию о химическом строении вещества, в частности о взаимном расположении атомов в пространстве, дают объёмные модели молекул — модели Стюарта—Бриглеба.
Явление изомерии — ещё одна причина многообразия органических соединений.
Третье положение теории химического строения
В молекуле диметилового эфира все атомы водорода связаны только с атомами углерода. Становится понятно, почему, в отличие от этилового спирта, диметиловый эфир не способен реагировать с металлическим натрием.
Теория химического строения, предложенная А. М. Бутлеровым, сыграла в органической химии такую же огромную роль, как периодический закон и периодическая система элементов Д. И. Менделеева в неорганической химии. Она позволила систематизировать все накопленные сведения об органических веществах и объяснить причины их многообразия. Но самое главное — теория строения сделала осмысленным и целенаправленным синтез новых органических веществ и изучение их химических свойств. Она настолько многогранна и динамична, что и сегодня является основополагающим учением не только органической, но и всей современной химии.
Основные выводы по теме конспекта:
- Научной основой органической химии является современная теория химического строения органических соединений. Некоторые положения этой теории:
- атомы в молекулах соединены друг с другом согласно их валентности, причём углерод в органических веществах всегда четырёхвалентен;
- свойства веществ зависят не только от их качественного и количественного состава, но и от их строения (химического, электронного и пространственного);
- атомы в молекулах влияют друг на друга.
- Химическим строением называют порядок расположения атомов в молекуле согласно их валентности.
- Химическое строение отображают с помощью химических формул: молекулярных и структурных (полных или сокращённых).
- Материальные модели, отражающие состав и пространственное строение молекул органических соединений, бывают двух видов: шаростержневые и объёмные.
- Причины многообразия органических веществ — это: способность атомов углерода соединяться друг с другом, образуя различные цепи (линейные, разветвлённые, циклические); способность атомов углерода образовывать связи различной кратности (одинарные, двойные, тройные); явление изомерии.
Читайте также:

