Механизм реакции присоединения на примере непредельных углеводородов ряда этилена кратко
Обновлено: 05.07.2024
Многочисленные экспериментальные данные свидетельствуют о том, что в отличие от реакций гидрирования электрофильное присоединение осуществляется по асинхронному типу.
Механизм реакции электрофильного присоединения к алкенам
Рассмотрим типичную реакцию электрофильного присоединения к алкенам — реакцию бромирования этилена:
Поскольку изменение энтропии в этой реакции не очень значительно, очевидно, что бромирование этилена согласно эмпирическому правилу (см. раздел 9.5) принципиально возможно, а константа равновесия данной реакции заведомо больше единицы: К ≥1 .
Бромирование алкенов удается легко осуществить при комнатной температуре как в инертных, так и в полярных растворителях (например, в бензоле, ССl4 , этиловом спирте) и в других условиях, исключающих участие в реакции свободных радикалов.
Механизм реакции электрофильного присоединения к алкенам, в частности бромирования, в настоящее время представляется следующим
Доказательства механизма электрофильного присоединения к алкенам основаны на следующих фактах.
Направление электрофильного присоединения к алкенам. Правило Марковникова
Примеры реакций электрофильного присоединения
Среди типичных реагентов отметим:
Галогенирование.
Расчеты тепловых эффектов реакций галогенирования алкенов дают следующие результаты:
Все реакции галогенирования принципиально возможны и практически осуществимы, за исключением фторирования. Эта реакция вследствие очень высокой экзотермичности не поддается контролю. Легкость осуществления реакций галогенирования, например бромирования, в обычных органических растворителях, таких, как хлороформ, четыреххлористый углерод, широко используют в аналитических целях для качественного определения наличия двойной связи в органических соединениях.
Присоединение кислот к алкенам.
Реакция может идти дальше с образованием ди-(трет -бутил)сульфата.
Гипогалогенирование.
Гидратация алкенов (присоединение воды).
Вода является слабым электрофилом, и по этой причине ее прямое присоединение к алкенам осуществить не удается. Однако в присутствии сильных минеральных кислот в результате гидратации образуются спирты. Так получают синтетический этиловый спирт, техническую потребность в котором промышленность удовлетворяет гидратацией этилена, выделяемого из газов крекинга или продуктов пиролиза легких алканов (этана, пропана, бутана).
С фосфорной кислотой гидратация осуществляется под давлением. Спирт в данном случае образуется сразу при взаимодействии карбокатиона с водой.
Реакцию гидратации можно осуществить и в газовой фазе — при высоких температуре и давлении. В качестве катализаторов обычно применяют оксид алюминия ( Аl2O3 ), хлористый цинк ( ZnCl2 ) и др. Гомологи этилена образуют вторичные и третичные спирты.
Образование простых эфиров.
Образование сложных эфиров.
Взаимодействие с галогенангидридами и ангидридами карбоновых кислот (реакция Дарзана) .
Непредельный кетон может образоваться и в результате отщепления протона от карбокатиона [46, т. 3].
Комплексы с переходными металлами.
В качестве электрофильных реагентов наряду с обычными электрофилами могут быть использованы ионы переходных металлов, которые известны как хорошие комплексообразователи. Особо прочные π-комплексы образуют ионы Сu + , Ag + , Ru 2+ , Pd 2+ , Pt 2+ .
Сорбция осуществляется при повышенном давлении, десорбция — при пониженном.
Алкилирование.
Одной из важнейших в практическом плане реакций алкенов является алкилирование — введение алкильной группы, которое приводит к алканам и может быть осуществлено различными методами.
Синтез изоалканов — высокооктанового бензина — реализован в промышленности в нескольких модификациях.
Трет-Бутилкатион реагирует с алкеном смеси (на схеме представлен один из вариантов). Стабилизация карбокатиона А отщеплением протона (вода прерывает процесс полимеризации) приводит к смеси алкенов, гидрирование которой дает изооктан.

Непредельные углеводороды
Ключевые слова конспекта: Непредельные углеводороды. Алкены. Пространственная (геометрическая) изомерия. Реакции дегидратации. Реакции присоединения (гидратация, гидрогалогенирование, галогенирование). Правило Марковникова. Реакции полимеризации. Мономер. Полимер. Структурное звено. Степень полимеризации. Качественные реакции на непредельные углеводороды.
Гомологический ряд алкенов
Полиэтилен получают из углеводорода этилена С2Н4. В молекуле этилена два атома углерода связаны не одинарной, а двойной связью, что отражает структурная формула СН2=СН2. Этилен — первый представитель гомологического ряда этиленовых углеводородов, или алкенов.

Наличие в молекуле одной двойной связи С=С показывает, что валентности углеродных атомов не полностью насыщены атомами водорода, поэтому такие углеводороды называют непредельными углеводородами.
Этиленовые углеводороды образуют свой гомологический ряд. Как и в случае алканов, состав двух гомологов отличается на одну или несколько групп СН2. Приведём молекулярные и структурные формулы ближайших гомологов этилена.

Номенклатура и изомерия алкенов

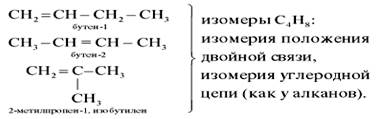
Два последних углеводорода в таблице 2 имеют одинаковый состав, но различное химическое строение, т. е. это изомеры. Однако у бутена изомерия проявляется не только в строении углеродной цепи (линейная или разветвлённая), но и в положении двойной связи в молекуле. В конце названия алкена арабской цифрой указывают атом углерода, за которым следует двойная связь:
Изомерия положения двойной связи — тоже один из видов структурной изомерии.
Особенности пространственного строения этиленовых углеводородов приводят к появлению в гомологическом ряду алкенов ещё одного вида изомерии — пространственной изомерии.

Для бутена-2 возможно написание двух различных структурных формул. В первом случае углеродная цепь алкена расположена по одну сторону от линии двойной связи, а во втором — по разные стороны:
Эти два углеводорода имеют разные физические свойства (температуры кипения, плавления и др.). Каждое вещество имеет состав С4Н8, неразветвлённую цепь углеродных атомов, одинаковое положение кратной связи в цепи, но различаются они взаимным расположением атомов в пространстве. Следовательно, эти углеводороды являются изомерами. Первый называют цис-бутен-2, второй — транс-бутен-2. Такой вид пространственной изомерии носит название геометрической или цис-транс-изомерии (от лат. cis — на одной стороне и trans — напротив).

Способы получения алкенов
В отличие от предельных углеводородов, алкены встречаются в природе нечасто. Промышленные способы их получения основаны на превращении алканов в алкены. В качестве природных источников алкенов используют главным образом нефть и природный газ.
Один из способов получения алкенов — уже знакомая вам реакция дегидрирования соответствующих предельных углеводородов.
К лабораторным способам получения алкенов относят реакции отщепления. Для образования в молекуле двойной связи от соседних атомов углерода нужно отнять по одному связанному с ними атому или группе. Тогда освободившиеся валентности превращаются во вторую углерод-углеродную связь.

или
Химические свойства алкенов
Химические свойства этилена и его гомологов обусловлены особенностями их строения, а именно наличием в их молекулах двойной углерод-углерод ной связи.
Для непредельных соединений характерны реакции присоединения.

Одна из наиболее важных реакций присоединения для этилена — его взаимодействие с водой в присутствии катализатора (кислоты):

Обычно эту реакцию записывают так:
В результате реакции гидратации этилена получают технический этиловый спирт. Его используют только в качестве растворителя, горючего, сырья для химических производств — словом, везде, кроме пищевой промышленности.
Присоединение воды к гомологу этилена — пропилену происходит по правилу, сформулированному выдающимся русским химиком, учеником Бутлерова В. В. Марковниковым.


Этиленовые углеводороды вступают в реакции присоединения галогеноводородов — реакции гидрогалогенирования:

И в этих реакциях, как и в реакциях гидратации, соблюдается правило Марковникова:

К реакциям присоединения относят также взаимодействие этиленовых углеводородов с галогенами — реакции галогенирования. В отличие от алканов, которые с галогенами вступают в реакцию замещения, алкены присоединяют молекулу галогена за счёт разрыва связи С=С:

или
В качестве реагента для реакции бромирования этилена можно использовать раствор брома в воде — так называемую бромную воду. При этом жёлтая окраска бромной воды исчезает. Поскольку реакция сопровождается характерными видимыми изменениями, обесцвечивание бромной воды можно использовать как качественную реакцию на этилен и другие непредельные соединения.

Вещества, содержащие двойную углерод-углеродную связь, можно обнаружить с помощью ещё одной качественной реакции. При пропускании этилена через водный раствор перманганата калия происходит обесцвечивание этого раствора. В упрощённом виде, обозначив окислитель ( КМ nO 4 ) как [О], уравнение реакции записывают так:
Разновидностью реакции присоединения можно считать процесс полимеризации.
Под действием высокой температуры и давления двойные углерод-углеродные связи в этилене разрываются, и за счёт освободившихся валентностей атомы углерода соединяются друг с другом:

Исходное вещество (в данном случае — этилен) называют мономером, а продукт реакции (в нашем примере — полиэтилен) — полимером. В результате реакции полимеризации образуются длинные цепи, состоящие из фрагментов этилена —СН2—СН2—. Многократно повторяющуюся в полимерной цепи группу атомов называют структурным звеном полимера. Число структурных звеньев в макромолекуле обозначают буквой п и называют степенью полимеризации. Относительная молекулярная масса таких гигантских молекул может составлять от нескольких тысяч до нескольких миллионов. Поскольку эта величина не является постоянной, говорят о средней молекулярной массе полимера. Уравнение реакции полимеризации этилена записывают так:
Этилен — важное химическое сырьё для производства полиэтилена, галогенпроизводных (используются, например, в качестве растворителей), этилового спирта, этиленгликоля и других продуктов химической промышленности.
Алкены — не единственные представители углеводородов, содержащих в молекуле двойную связь. О других углеводородах с двойными связями вы узнаете из материала следующего конспекта.

Непредельные углеводороды ряда этилена, или алкены, – это углеводороды с общей формулой CnH2n, молекулы которых содержат одну двойную связь. Атомы C, связанные двойной связью, находятся в состоянии sp 2 -гибридизации, двойная связь является сочетанием - и - связей. По своей природе - связь резко отличается от -связи; - связь менее прочная вследствие перекрывания электронных облаков вне плоскости молекулы.
Простейшим алкеном является этилен. Структурная и электронная формулы этилена имеют вид:
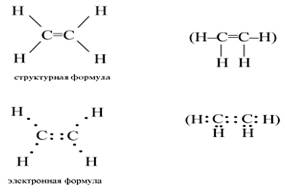
В молекуле этилена подвергаются гибридизации одна s- и две p-орбитали атомов C (sp 2 -гибридизация). Таким образом, каждый атом C имеет по три гибридных орбитали и по одной негибридной p-орбитали. Две из гибридных орбиталей атомов C взаимно перекрываются и образуют между атомами C -связь. Остальные четыре гибридных орбитали атомов C перекрываются в той же плоскости с четырьмя s-орбиталями атомов H и также образуют четыре -связи.
Две негибридные p-орбитали атомов C взаимно перекрываются в плоскости, которая расположена перпендикулярно плоскости -связей, т.е. образуется одна -связь. Под действием реагентов -связь легко разрывается.
Этилен – первый член гомологического ряда алкенов.
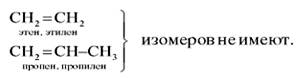
Но молекула бутена-2 может находиться в виде двух пространственных форм – цис- и транс-:
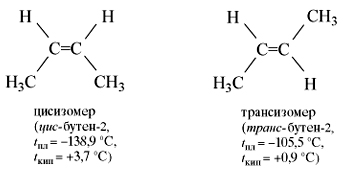
Цис- и трансизомеры, имея различное расположение атомов в пространстве, отличаются многими физическими и химическими свойствами. Таким образом, для алкенов возможны два вида структурной изомерии: изомерия углеродной цепи и изомерия положения двойной связи. Возможна также геометрическая изомерия. Этилен (этен) – бесцветный газ с очень слабым сладковатым запахом, немного легче воздуха, малорастворим в воде.
По химическим свойствам этилен резко отличается от этана, что обусловлено электронным строением его молекулы. Имея в молекуле двойную связь, состоящую из - и -связей, этилен способен присоединять два одновалентных атома или радикала за счет разрыва -связи.
Способность к реакциям присоединения характерна для всех алкенов.
1. Присоединение водорода (реакция гидрирования):
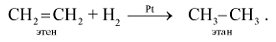
2. Присоединение галогенов (реакция галогенирования):
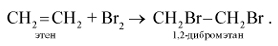
При добавлении к алкену брома (в виде бромной воды) бурая окраска брома быстро исчезает. Эта реакция является качественной на двойную связь.
3. Присоединение галогеноводородов (реакция гидрогалогенирования):

Если исходный алкен несимметричен, то реакция протекает по правилу Марковникова.
Присоединение галогеноводородов к непредельным соединениям идет по ионному механизму.
4. Присоединение воды (реакция гидратации):

Этой реакцией пользуются для получения этилового спирта в промышленности.
Для алканов характерны реакции окисления:
1. Этилен легко окисляется уже при обычной температуре, например при действии перманганата калия. Если этилен пропускать через водный раствор перманганата калия KMnO4, то характерная фиолетовая окраска последнего исчезает, происходит окисление этилена перманганатом калия (качественная реакция на двойную связь):
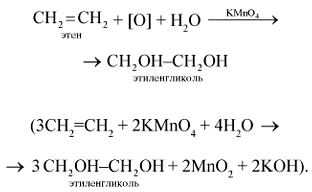
2. Этилен горит светящимся пламенем с образованием оксида углерода (IV) и воды:
3. Большое промышленное значение имеет частичное окисление этилена кислородом воздуха:

Для этилена, как и для всех непредельных углеводородов, характерны реакции полимеризации. Они протекают при повышенной температуре, давлении и в присутствии катализаторов:
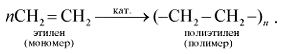
Полимеризация – это последовательное соединение одинаковых молекул в более крупные.
Таким образом, для этилена и его гомологов характерны реакции присоединения, окисления и полимеризации.
Непредельные углеводороды ряда этилена, или алкены, – это углеводороды с общей формулой CnH2n, молекулы которых содержат одну двойную связь. Атомы C, связанные двойной связью, находятся в состоянии sp 2 -гибридизации, двойная связь является сочетанием - и - связей. По своей природе - связь резко отличается от -связи; - связь менее прочная вследствие перекрывания электронных облаков вне плоскости молекулы.
Простейшим алкеном является этилен. Структурная и электронная формулы этилена имеют вид:

В молекуле этилена подвергаются гибридизации одна s- и две p-орбитали атомов C (sp 2 -гибридизация). Таким образом, каждый атом C имеет по три гибридных орбитали и по одной негибридной p-орбитали. Две из гибридных орбиталей атомов C взаимно перекрываются и образуют между атомами C -связь. Остальные четыре гибридных орбитали атомов C перекрываются в той же плоскости с четырьмя s-орбиталями атомов H и также образуют четыре -связи.

Две негибридные p-орбитали атомов C взаимно перекрываются в плоскости, которая расположена перпендикулярно плоскости -связей, т.е. образуется одна -связь. Под действием реагентов -связь легко разрывается.
Этилен – первый член гомологического ряда алкенов.
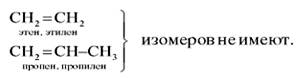

Но молекула бутена-2 может находиться в виде двух пространственных форм – цис- и транс-:

Цис- и трансизомеры, имея различное расположение атомов в пространстве, отличаются многими физическими и химическими свойствами. Таким образом, для алкенов возможны два вида структурной изомерии: изомерия углеродной цепи и изомерия положения двойной связи. Возможна также геометрическая изомерия. Этилен (этен) – бесцветный газ с очень слабым сладковатым запахом, немного легче воздуха, малорастворим в воде.
По химическим свойствам этилен резко отличается от этана, что обусловлено электронным строением его молекулы. Имея в молекуле двойную связь, состоящую из - и -связей, этилен способен присоединять два одновалентных атома или радикала за счет разрыва -связи.
Способность к реакциям присоединения характерна для всех алкенов.
1. Присоединение водорода (реакция гидрирования):

2. Присоединение галогенов (реакция галогенирования):
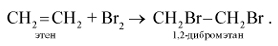
При добавлении к алкену брома (в виде бромной воды) бурая окраска брома быстро исчезает. Эта реакция является качественной на двойную связь.
3. Присоединение галогеноводородов (реакция гидрогалогенирования):

Если исходный алкен несимметричен, то реакция протекает по правилу Марковникова.
Присоединение галогеноводородов к непредельным соединениям идет по ионному механизму.
4. Присоединение воды (реакция гидратации):

Этой реакцией пользуются для получения этилового спирта в промышленности.
Для алканов характерны реакции окисления:
1. Этилен легко окисляется уже при обычной температуре, например при действии перманганата калия. Если этилен пропускать через водный раствор перманганата калия KMnO4, то характерная фиолетовая окраска последнего исчезает, происходит окисление этилена перманганатом калия (качественная реакция на двойную связь):

2. Этилен горит светящимся пламенем с образованием оксида углерода (IV) и воды:
3. Большое промышленное значение имеет частичное окисление этилена кислородом воздуха:

Для этилена, как и для всех непредельных углеводородов, характерны реакции полимеризации. Они протекают при повышенной температуре, давлении и в присутствии катализаторов:

Полимеризация – это последовательное соединение одинаковых молекул в более крупные.
Таким образом, для этилена и его гомологов характерны реакции присоединения, окисления и полимеризации.
Рассмотрим этот механизм на примере реакции присоединения бромоводорода к молекуле этилена.

Несмотря на то, что реакция гидробромирования описывается очень простым равнением, ее механизм включает несколько стадий.

Стадия 2. Связь водород-галоген разрывается с образованием электрофильной частицы Н+, и нуклеофильной частицы Br-. Освободившийся электрофил Н+ присоединяется к алкену за счет электронной пары двойной связи, образуя σ-комплекс – карбокатион.

Стадия 3. На этой стадии к положительно заряженному карбокатиону присоединяется отрицательно заряженный нуклеофил с образованием конечного продукта реакции.

Правило Марковникова — в органической химии правило, используемое для предсказания региоселективности реакции присоединения протонных кислот и воды к несимметричным алкенам и алкинам. Наиболее часто данное правило формулируют следующим образом: при присоединении протонных кислот и воды к несимметричным алкенам и алкинам атом водорода присоединяется к наиболее гидрогенизированному атому углерода. Впервые правило было предложено русским химиком В. В. Марковниковым в 1869 году

.
Реакция протекает в две стадии. На первой, медленной стадии происходит присоединение протона H+ к двойной связи: при этом протон может связываться с одним из двух атомов углерода, образующих двойную связь. Образующиеся карбокатионы И1 и И2 имеют различную энергию (устойчивость), поскольку положительный заряд в них делокализуется с разной эффективностью. По этой причине вторичный карбокатион И2 является более устойчивым, и соответствующий ему бромид П2 образуется в большем количестве.

При более строгом рассмотрении необходимо сравнивать устойчивости не интермедиатов, а двух альтернативных переходных состояний на стадии образования карбокатионов, то есть энергии активации двух параллельных процессов. Для некоторых реакций различие этих величин достигает 25—30 кДж/моль.
Благодаря высокой химической активности углеводороды ряда этилена являются ценным сырьем для синтеза многих органических веществ.
Вопрос 41
Алкадиены — класс углеводородов, содержащих две двойных связи углерод-углерод
В зависимости от взаимного расположения двойных связей, диены подразделяются на три группы:
сопряженные диены, в которых двойные связи разделены одинарной (1,3-диены)
аллены с кумулированными двойными связями (1,2-диены)
диены с изолированными двойными связями, в которых двойные связи разделены несколькими одинарными.
Обычно к диенам относят ациклические и циклические образующие гомологические ряды общих формул и соответственно, ациклические диены являются структурными изомерами алкинов.
Формально эту реакцию можно представить как дегидратацию двух молекул этилового спирта с одновременным межмолекулярным дегидрированием.
Элиминирование галогенопроизводных алканов спиртовым раствором щёлочи:
Для синтеза каучуков. В результате реакции полимеризации соответствующих мономеров.
Тут вы можете оставить комментарий к выбранному абзацу или сообщить об ошибке.
Этилен (этен) – первый представитель ряда алкенов – непредельных углеводородов с одной двойной связью.
Формула – С2Н4 (СН2 = СН2). Молекулярная масса (масса одного моль) – 28 г/моль.
Углеводородный радикал, образованный от этилена называется винил (-CH = CH2). Атомы углерода в молекуле этилена находятся в sp 2 -гибридизации.
Химические свойства этилена
Для этилена характерны реакции, протекающщие по механизму электрофильного, присоединения, реакции радикального замещения, окисления, восстановления, полимеризации.
Галогенирование (электрофильное присоединение) — взаимодействие этилена с галогенами, например, с бромом, при котором происходит обесцвечивание бромной воды:
![]()
С), в этом случае разрыва двойной связи не происходит – реакция протекает по механизму радикального замещения:
Гидрогалогенирование — взаимодействие этилена с галогенводородами (HCl, HBr) с образование галогенпроизводных алканов:
Гидратация — взаимодействие этилена с водой в присутствии минеральных кислот (серной, фосфорной) с образованием предельного одноатомного спирта – этанола:
Среди реакций электрофильного присоединения выделяют присоединение хлорноватистой кислоты (1), реакции гидрокси- и алкоксимеркурирования (2, 3) (получение ртутьорганических соединений) и гидроборирование (4):
Реакции нуклеофильного присоединения характерны для производных этилена, содержащих электроноакцепторные заместители. Среди реакций нуклеофильного присоединения особое место занимают реакции присоединения циановодородной кислоты, аммиака, этанола. Например,
В ходе реакций окисления этилена возможно образование различных продуктов, причем состав определяется условиями проведения окисления. Так, при окислении этилена в мягких условиях (окислитель – перманганат калия) происходит разрыв π-связи и образование двухатомного спирта — этиленгликоля:
При жестком окислении этилена кипящим раствором перманганата калия в кислой среде происходит полный разрыв связи (σ-связи) с образованием муравьиной кислоты и углекислого газа:
![]()
С в присутствии CuCl2 и PdCl2 приводит к образованию ацетальдегида:
При восстановлении этилена происходит образование этана, представителя класса алканов. Реакция восстановления (реакция гидрирования) этилена протекает по радикальному механизму. Условием протекания реакции является наличие катализаторов (Ni, Pd, Pt), а также нагревание реакционной смеси:
Этилен вступает в реакцию полимеризации. Полимеризация — процесс образования высокомолекулярного соединения – полимера-путем соединения друг с другом с помощью главных валентностей молекул исходного низкомолекулярного вещества – мономера. Полимеризация этилена происходит под действием кислот (катионный механизм) или радикалов (радикальный механизм):
Физические свойства этилена
Этилен – бесцветный газ со слабым запахом, малорастворимый в воде, растворим в спирте, хорошо растворим в диэтиловом эфире. При смешении с воздухом образует взрывоопасную смесь
Получение этилена
Основные способы получения этилена:
— дегидрогалогенирование галогенпроизводных алканов под действием спиртовых растворов щелочей
— дегалогенирование дигалогенпроизводных алканов под действием активных металлов
![]()
C) или пропускании его паров над катализатором
![]()
С) в присутствии катализатора (Ni, Pt, Pd)
Применение этилена
Этилен является одним из важнейших соединений, производимых в огромных промышленных масштабах. Его используют в качестве сырья для производства целого спектра различных органических соединений (этанол, этиленгликоль, уксусная кислота и т.д.). Этилен служит исходным сырьем для производства полимеров (полиэтилен и др.). Его применяют в качестве вещества, ускоряющего рост и созревание овощей и фруктов.
Примеры решения задач
| Задание | Осуществите ряд превращений этан → этен (этилен) → этанол → этен → хлорэтан → бутан. |
| Решение | Для получения этена (этилена) из этана необходимо использовать реакцию дегидрирования этана, которая протекает в присутствии катализатора (Ni, Pd, Pt) и при нагревании: |
Получение этанола из этена осуществляют по реакции гидратации, протекающей водой в присутствии минеральных кислот (серной, фосфорной):
Для получения этена из этанола используют реакцию дегидротации:
Получение хлорэтана из этена осуществляют по реакции гидрогалогенирования:
Для получения бутана из хлорэтана используют реакцию Вюрца:
| Задание | Вычислите сколько литров и граммов этилена можно получить из 160 мл этанола, плотность которого равна 0,8 г/мл. |
| Решение | Этилен из этанола можно получить по реакции дегидратации, условием протекания которой является присутствие минеральных кислот (серной, фосфорной). Запишем уравнение реакции получения этилена из этанола: |
Найдем массу этанола:
Молярная масса (молекулярная масса одного моль) этанола, вычисленная с помощью таблицы химических элементов Д.И. Менделеева – 46 г/моль. Найдем количество вещества этанола:
Могласно уравнению реакции v(C2H5OH) : v(C2H4) = 1:1, следовательно, v(C2H4) = v(C2H5OH) = 2,78 моль. Молярная масса (молекулярная масса одного моль) этилена, вычисленная с помощью таблицы химических элементов Д.И. Менделеева – 28 г/моль. Найдем массу и объем этилена:
Читайте также:

