Строение и свойства молекулы азота и аммиака план урока
Обновлено: 05.07.2024
На уроке мы сможем: Узнать: строение молекулы аммиака и иона аммония; механизм образования связи по донорно-акцепторному механизму; физические свойства аммиака; особенности химических реакций, протекающие с аммиаком; Научиться: составлять электронную, структурную формулы аммиака и иона аммония; составлять уравнения химических реакций, характеризующие химические свойства и способы получения; объяснять физиологическое воздействие аммиака на организм человека. NH 3 Проверка знаний
NH 3 Эта история произошла во время I мировой войны.
Состав вещества 4 + 7 N ) ) 2 5 2s 2 1 s 2 2p 3 + 1 H ) 1 s 1 NH 3 H H 1 N H КПС
Образование иона аммония 5 H N H H •• Есть возможность образовать донорно – акцепторную связь У атома азота есть неподеленная электронная пара N H H H •• + H + N H H H •• H + АКЦЕПТОР ДОНОР NH 4 +
Между молекулами аммиака образуются водородные связи: Водородная связь – это связь между атомами очень электроотрицательного элемента ( F, O, N) одной молекулы и атомами водорода другой молекулы. δ -
Химические свойства Взаимодействие с кислотами N Н 3 +НС I N Н 4 С I N Н 3 +Н 2 S О 4 N Н 4 Н S О 4 Взаимодействие с водой N Н 3 +НОН N Н 4 ОН Аммиак горит в кислороде 4 N Н 3 +3О 2 2 N 2 + 6Н 2 О NH 3
Применение NH 3 Производство азотной кислоты. Производство азотных удобрений Производство взрывчатых веществ В холодильных установках. В медицине, в быту. Для паяния
Проверка знаний. Решите задачи: При синтезе аммиака промышленным способом, азот объёмом 50 л. (н.у.) прореагировал с водородом, взятом в избытке. Выход продукта составил 50%. Рассчитайте объём и массу полученного аммиака. Какая масса хлорида аммония получится при взаимодействии 3 моль аммиака с соляной кислотой? Какой объём кислорода потребуется для сжигания 34 г. аммиака?
Проверка знаний. Осуществите цепочку превращений Азот аммиак оксид азота ( II ) нитрат аммония аммиак азот Составьте уравнения следующих реакций и назовите продукты: 2 NH 3 + H 2 SO 4 → NH 3 + H 2 SO 4 → NH 3 + H 3 PO 4 → 2 NH 3 + H 3 PO 4 → 3 NH 3 + H 3 PO 4 →
Домашнее задание: §25,упр. 1-5. Получение аммиака выучить самостоятельно.
Ответьте на следующие вопросы: Характеристика азота по положению в Периодической системе элементов Д. И. Менделеева Модель атома азота Простое вещество азот Почему молекулярный азот химически инертен, а атомарный – химически активен? Азот в природе. Какова схема круговорота азота в природе? Расскажите о двойственном названии элемента №7. Кто и в каком году открыл азот? NH 3 Проверка знаний
Предварительный просмотр:
ПЛАН-КОНСПЕКТ УРОКА ПО ХИМИИ
Цель урока: изучение строения молекулы аммиака, его физических и химических свойств, роли аммиака в жизни человека и его применение
- обучающие: изучить состав и строение молекулы аммиака, его физические и химические свойства, способы получения в лаборатории и промышленности, применение; познакомить с водородной связью и донорно-акцепторным механизмом образования ковалентной связи.
- развивающие: развитие логического и аналитического мышления, развитие критического мышления, самостоятельности и способности к рефлексии, обеспечение системности учения, а так же развитие терминологического мышления; умения ставить и разрешать проблемы, анализировать, сравнивать, обобщать и систематизировать, бережного отношения к здоровью человека
- воспитательные: воспитание положительной мотивации учения, правильной самооценки, чувства ответственности, уверенности и требовательности к себе, продолжить воспитание толерантности при работе в группе.
Тип урока: Изучение нового материала с элементами повторения и закрепления ранее изученного.
Методы работы: Диалогические, экспериментально – исследовательские.
Организационный момент (2 мин)
Опрос-повторение (5 мин.)
Мотивационно-ориентировочный этап (5 мин.)
Операционно – исполнительский этап.(23 мин.) по плану (записывается на доске по мере объяснения).
Проверка усвоения знаний (7 мин.).
Подведение итогов урока. Рефлексия. Домашнее задание.(3 мин.)
- Таблица растворимости веществ.
- Периодическая система Д.И.Менделеева.
- Раствор аммиака.
- Соляная кислота.
- Индикатор фенолфталеин.
- Серная кислота.
- Лабораторная посуда.
I. Организационный момент (2 мин.)
Учитель проверяет готовность учащихся к уроку, организует начало урока. Отмечает отсутствующих. Объявление темы урока, задач, беседа с целью выявления знаний учащихся об аммиаке (Что они уже знают об аммиаке) (слайд 1-2)
II. Опрос-повторение (5 мин.)
Проведение проверки знаний: 3 ученика идут к доске; 5 учеников получают письменные задания на месте по карточкам. Остальные учащиеся отвечают на вопросы устно, со своих рабочих мест.
Вопросы - и задания для фронтальной проверки.
1. Характеристика азота по положению в Периодической системе элементов Д. И. Менделеева
2. Модель атома азота
3. Простое вещество азот
4. Почему молекулярный азот химически инертен, а атомарный – химически активен?
5. Азот в природе.
6. Какова схема круговорота азота в природе?
7. Расскажите о двойственном названии элемента №7.
8. Кто и в каком году открыл азот?
III. Мотивационно - ориентировочный этап (5 мин.)
Создание проблемной ситуации
Вводное слово учителя
Эта история произошла во время I мировой войны. Английский крейсер вел преследование поврежденного в бою немецкого эсминца. Цель была почти достигнута, как вдруг между кораблями появилось плотное белое облако дыма. Экипаж крейсера почувствовал удушливый запах, раздражающий горло и легкие. Крейсер был вынужден дать задний ход и выйти из дымового облака. Уже после обнаружили, что пострадали не только люди, но и металлические части корабля.
Сегодня я хочу познакомить вас с этим удивительным веществом, имеющим необыкновенные свойства. Запах этого газа знаком каждому - даже тем, кто совсем далёк от химии. Кое – что о его свойствах тоже всем известно.
Итак, вещество, о котором пойдёт речь на нашем уроке – аммиак.
Давайте попробуем частично воспроизвести картину давних лет.
Давайте, ребята, проведем небольшое исследование и решим, откуда у этого газа столь необычные свойства и названия.
IV. Операционно – исполнительский этап(23 мин.)
Формула аммиака – NH 3 , т.е. это водородное соединение азота.
Атом азота образует с атомами водорода 3 ковалентные полярные связи (т.к. электроотрицательность азота больше, чем у водорода) за счет своих трех неспареных электронов; Неподеленная электронная пара атома азота способна участвовать в образовании четвертой ковалентной связи по донорно-акцепторному механизму с атомами, имеющими вакантную орбиталь;
Механизм донорно-акцепторной связи:
H 3 N: + H+ = [NH 4 ] + образуется ион аммония
Для молекул аммиака характерно связывание их между собой в ассоциации за счет водородных связей
Л.о № 1. Моделирование молекулы аммиака (из стержневых шариков)
Ответьте на вопрос:
- Какую пространственную форму имеет молекула аммиака? (Молекула аммиака имеет форму правильной пирамиды: в углах треугольника находятся атомы водорода, а в вершине пирамиды – атом азота. Угол между связями Н-N-Н равен 107.)
Изучите запах аммиака в склянке.
- Имеет ли раствор специфический запах? (Характерный резкий запах)
- Какого цвета исследуемый раствор? (Аммиак бесцветный газ)
Температура кипения аммиака - -33.4 0 С, он сжижается, а при-77.8 0 С превращается в твёрдое белое вещество
Аммиак хорошо растворим в воде: при 20 С в 1 объёме воды растворяется до 700 объёмов аммиака.
Постановка проблемы. Почему аммиак очень хорошо растворяется в воде?
Учащиеся выписывают из учебника определение водородной связи
и примеры веществ
Проводят опыт, потирая друг о друга стеклянные палочки, одна смочена раствором аммиака, а другая – раствором соляной кислотой. Что вы наблюдаете?( Дым.)
(записываем в опорный конспект и оформляем на доске химическое уравнение между соляной кислотой и аммиаком)
NН 3 +НСI NН 4 СI (образование солей аммония, удобрения)
- Взаимодействие с оксидами ( Н 2 О) Оформление в опорном конспекте и оформление на доске.
NН 3 +НОН NН 4 ОН Нашатырный спирт
- Взаимодействие с серной кислотой (оформление опорного конспекта и оформление на доске)
NН 3 + Н 2 SО 4 N Н 4 НSО 4 Недостаток гидросульфат аммония
- Аммиак горит в кислороде (оформление опорного конспекта и оформление на доске)
4 NН 3 + 3О 2 2N 2 + 6Н 2 О
- Производство азотной кислоты.
- Для получения аммиачной воды.
- Производство азотных удобрений.
- В медицине, в быту.
- В холодильных установках.
- Для паяния.
- Взрывчатых веществ.
- Проверка усвоения знаний (7 мин.)
- При синтезе аммиака промышленным способом, азот объёмом 50 л. (н.у.) прореагировал с водородом, взятом в избытке. Выход продукта составил 50%. Рассчитайте объём и массу полученного аммиака.
- Какая масса хлорида аммония получится при взаимодействии 3 моль аммиака с соляной кислотой?
- Какой объём кислорода потребуется для сжигания 34 г. аммиака?
4.Азот аммиак оксид азота (II ) нитрат аммония аммиак азот
5.Напишите четыре уравнения химических реакций, в результате которых образуется аммиак.

Урок позволит актуализировать знания учащихся о строении атома азота на основании положения в периодической системе химических элементов Д.И. Менделеева, рассмотреть физические и химические свойства азота в свете ОВР.
Ли Марина Николаевна специализированная гимназия № 8 с обучением на трех языках имени М. Х. Дулати, г. Шымкент, ЮКО, Республика Казахстан
Описание разработки
Цели и задачи урока:
Актуализировать знания учащихся о строении атома азота на основании положения в ПС ХЭ Д.И. Менделеева.
Рассмотреть физические и химические свойства азота в свете ОВР.
Рассмотреть вопросы связывания атмосферного азота, круговорота азота в природе
Развивать химический язык, понятие в отличии понятий “элемент” и “простое вещество”.
Развивать критическое мышление через работу с учебным материалом.
Развивать информационную компетентность учащихся
Формирование коммуникативных навыков и навыков самоконтроля, правильной самооценки и чувства ответственности; повышение положительной мотивации учащихся путём постановки проблемных вопросов и их решения в ходе работы с заданиями различной формы.
В ходе урока продолжить экологическое воспитание.
1. История открытия и изучения азота (работа в группах)
История открытия и изучения азота.
Группа № 1. История и факты. Азот – элемент необыкновенный. Порою кажется, что чем больше мы о нем узнаем, тем непонятнее он становится. Противоречивость свойств элемента №7 отразилась даже в его названии, ибо ввела в заблуждение даже такого блистательного химика, как Антуан Лоран Лавуазье.
Современник и соотечественник Лавуазье Ж. Шапталь, не мудрствуя лукаво, предложил назвать элемент №7 гибридным латино-греческим именем “нитрогениум”, что значит “селитру рождающий”. Селитры – азотнокислые соли, вещества, известные с древнейших времен. Надо сказать, что термин “азот” укоренился только в русском и французском языках. По-английски элемент №7 – “Nitrogen”, по-немецки – “Stockton” (удушающее вещество). Химический же символ N – дань шапталевскому нитрогениуму.
Группа № 2. История и факты. Азот – самая большая (по массе и объему) часть атмосферного воздуха (76% и 78%). Соединения азота – участники обмена веществ в живой природе. Азот входит в состав белков, выводится из организма человека и животных в основном в виде карбамида или мочевины.
Ход урока.
Группа № 4. История и факты. Знакомство человека с этим элементом состоялось несколько тысячелетий назад. Упоминания о сочащейся из горных пород коричневой либо чёрно-бурой маслянистой жидкости со специфическим запахом встречаются в трудах древних историков и географов – Геродота, Пиутарха, Страбона, Плиния старшего.
- в литосфере – 1, 9*10-3 по массе.
- в живых организмах- 0, 3% по массе
- в белке животных и человека -16-17% азота. В организмах человека и плотоядных животных белок образуется за счёт потребляемых белковых веществ травоядных животных и в растениях. Вот, что сказано об азоте:
Весь материал - в документе.
Содержимое разработки
Учитель химии и биологии: Ли М. Н.
9 класс.
Тема урока: Элементы VА группы. Азот, аммиак, оксиды азота
Цели и задачи урока:
Образовательные
Актуализировать знания учащихся о строении атома азота на основании положения в ПС ХЭ Д.И.Менделеева.
Рассмотреть физические и химические свойства азота в свете ОВР.
Рассмотреть вопросы связывания атмосферного азота, круговорота азота в природе
Развивающие
Развивать химический язык, понятие в отличии понятий “элемент” и “простое
Развивать критическое мышление через работу с учебным материалом.
Развивать информационную компетентность учащихся
Воспитывающие
Формирование коммуникативных навыков и навыков самоконтроля, правильной самооценки и чувства ответственности; повышение положительной мотивации учащихся путём постановки проблемных вопросов и их решения в ходе работы с заданиями различной формы.
В ходе урока продолжить экологическое воспитание.
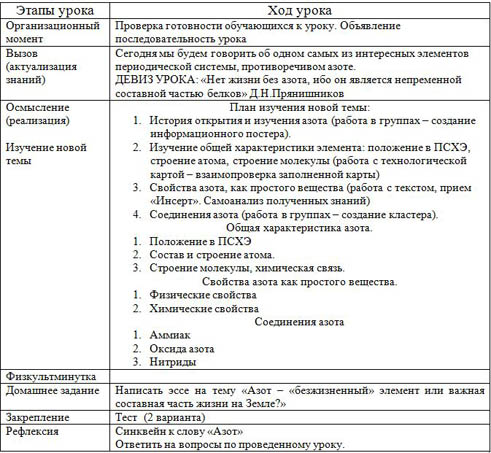
Этапы урока
Организационный момент
Проверка готовности обучающихся к уроку. Объявление последовательность урока
Вызов (актуализация знаний)
Изучение новой темы
План изучения новой темы:
История открытия и изучения азота (работа в группах – создание информационного постера).
Изучение общей характеристики элемента: положение в ПСХЭ, строение атома, строение молекулы (работа с технологической картой – взаимопроверка заполненной карты)
Соединения азота (работа в группах – создание кластера).
Общая характеристика азота.
Положение в ПСХЭ
Состав и строение атома.
Строение молекулы, химическая связь.
Свойства азота как простого вещества.
Соединения азота
Физкультминутка
Домашнее задание
Закрепление
Тест (2 варианта)
Ответить на вопросы по проведенному уроку.
Приложение к уроку.
История открытия и изучения азота (работа в группах)
История открытия и изучения азота
Современник и соотечественник Лавуазье Ж. Шапталь, не мудрствуя лукаво, предложил назвать элемент №7 гибридным латино-греческим именем “нитрогениум”, что значит “селитру рождающий”. Селитры – азотнокислые соли, вещества, известные с древнейших времен. Надо сказать, что термин “азот” укоренился только в русском и французском языках. По-английски элемент №7 – “Nitrogen”, по-немецки – “Stockton” (удушающее вещество). Химический же символ N – дань шапталевскому нитрогениуму.
- в живых организмах- 0,3% по массе
- в белке животных и человека -16-17% азота. В организмах человека и плотоядных животных белок образуется за счёт потребляемых белковых веществ травоядных животных
Технологическая карта (работа с ПСХЭ, заполнение карты, взаимопроверка)
Общая характеристика азота
Положение в ПСХЭ ____________________________________________________
Состав атома азота _____________________________________________________

На уроке учащиеся будут изучать строение и свойства аммиака. А также химические свойства.
Урок №28. Аммиак. Физические и химические свойства аммиака, получение, применение.
Аммиак – NH3

1. Строение молекулы


Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине. Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать донорно-акцепторную связь с ионом водорода, образуя ион аммония NH4 + .
Вид химической связи: ковалентная полярная, три одинарные σ - сигма связи N-H
2. Физические свойства аммиака
При нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта), почти вдвое легче воздуха, ядовит. По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это мы и воспринимаем как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи. Растворимость NH3 в воде чрезвычайно велика — около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды.
3. Получение аммиака
В лаборатории
В промышленности
Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония:
Внимание! Гидроксид аммония неустойчивое основание, разлагается: NH4OH ↔ NH3↑ + H2O
При получении аммиака держите пробирку - приёмник дном кверху, так как аммиак легче воздуха:

Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота:
катализатор – пористое железо
температура – 450 – 500 ˚С
давление – 25 – 30 МПа
Это так называемый процесс Габера (немецкий физик, разработал физико-химические основы метода).
4. Химические свойства аммиака
Для аммиака характерны реакции:
с изменением степени окисления атома азота (реакции окисления)
без изменения степени окисления атома азота (присоединение)
Реакции с изменением степени окисления атома азота (реакции окисления)
N -3 → N 0 → N +2
NH3 – сильный восстановитель.
с кислородом
1. Горение аммиака (при нагревании)
2. Каталитическое окисление амииака (катализатор Pt – Rh, температура)
Видео - Эксперимент " Окисление аммиака в присутствии оксида хрома"
с оксидами металлов
с сильными окислителями
аммиак – непрочное соединение, при нагревании разлагается
Реакции без изменения степени окисления атома азота (присоединение -Образование иона аммония NH4 + по донорно-акцепторному механизму)

Видео - Эксперимент "Качественная реакция на аммиак"
Видео - Эксперимент "Дым без огня"
Видео - Эксперимент "Взаимодействие аммиака с концентрированными кислотами"
Видео - Эксперимент "Фонтан"
Видео - Эксперимент "Растворение аммиака в воде"
5. Применение аммиака
По объемам производства аммиак занимает одно из первых мест; ежегодно во всем мире получают около 100 миллионов тонн этого соединения. Аммиак выпускается в жидком виде или в виде водного раствора – аммиачной воды, которая обычно содержит 25% NH3. Огромные количества аммиака далее используются для получения азотной кислоты, которая идет на производство удобрений и множества других продуктов. Аммиачную воду применяют также непосредственно в виде удобрения, а иногда поля поливают из цистерн непосредственно жидким аммиаком. Из аммиака получают различные соли аммония, мочевину, уротропин. Его применяют также в качестве дешевого хладагента в промышленных холодильных установках.
Аммиак используется также для получения синтетических волокон, например, найлона и капрона. В легкой промышленности он используется при очистке и крашении хлопка, шерсти и шелка. В нефтехимической промышленности аммиак используют для нейтрализации кислотных отходов, а в производстве природного каучука аммиак помогает сохранить латекс в процессе его перевозки от плантации до завода. Аммиак используется также при производстве соды по методу Сольве. В сталелитейной промышленности аммиак используют для азотирования – насыщения поверхностных слоев стали азотом, что значительно увеличивает ее твердость.
Медики используют водные растворы аммиака (нашатырный спирт) в повседневной практике: ватка, смоченная в нашатырном спирте, выводит человека из обморочного состояния. Для человека аммиак в такой дозе не опасен.
Тренажёр №1 "Горение аммиака"
Тренажёр №2 "Химические свойства аммиака"
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Осуществить превращения по схеме:
а) Азот→ Аммиак → Оксид азота (II)
б) Нитрат аммония → Аммиак → Азот
в) Аммиак → Хлорид аммония → Аммиак → Сульфат аммония
Для ОВР составить е-баланс, для РИО полные, ионные уравнения.
№2. Напишите четыре уравнения химических реакций, в результате которых образуется аммиак.
Урок проходит в форме обсуждения и исследования с использованием проблемного подхода на основе личностно-ориентированного обучения. Форма организации познавательной деятельности обучающихся парная и индивидуальная.
Методы работы. Диалогические, экспериментально-исследовательские.
- любознательность и интерес к химической науке, наблюдательность, логическое мышление, умение анализировать свою деятельность, делать выводы из наблюдаемых явлений, познавательные способности;
- навыки проведения химического эксперимента, исследовательские навыки,
- умения прогнозирования;
- развить умения работать с дополнительными источниками, ПК для получения и обработки информации, работать в паре.
Формирование навыков поведения обучающихся в коллективном и индивидуальном учебном труде, воспитание экологической культуры; бережного отношения к здоровью как ценности для человека, привычки соблюдать правила безопасности при проведении исследовательских работ, умение слушать сверстников.
- Правила обращения с аммиачной водой;
- правила оказания первой помощи при отравлении аммиаком;
- владеть информацией об экологических проблемах, связанных с авариями при производстве и транспортировке аммиака, и на производствах, использующих аммиак;
- уметь экспериментально распознавать аммиак;
- писать химические формулы и уравнения реакций с участием аммиака и аммиачной воды;
Оборудование: Таблица растворимости веществ, периодическая система химических элементов Д.И.Менделеева, ПК, проектор, экран, телевизор с DVD, использование мультимедиа презентаций Power Point учителя и обучающихся заранее подготовленных к уроку, набор реактивов: раствор аммиака, 25% раствор соляной кислоты, индикаторы фенолфталеин и универсальный индикатор, раствор сульфата меди (II ), раствор гидроксида натрия, раствор серной кислоты, лабораторная посуда.
ХОД УРОКА
1. Организационный момент урока. Цели и задачи урока.
2. Психологический настрой. Слово учителя.
Начиная изучение новой темы, обратимся к истории.
История произошла во время I мировой войны. Английский крейсер вел преследование поврежденного в бою немецкого эсминца. Цель была почти достигнута, как вдруг между кораблями появилось плотное белое облако дыма. Экипаж крейсера почувствовал удушливый запах, раздражающий горло и легкие. Крейсер был вынужден дать задний ход и выйти из дымового облака. Уже после обнаружили, что пострадали не только люди, но и металлические части корабля. Как вы думаете, что это был за газ? Почему были от его действия такие последствия? Идёт обсуждение. Сегодня на уроке мы докажем, что газ аммиак не только опасный, но и необходимый.
3.1. Ученик 1. Из истории химических имён. (Приложение. Презентация слайд №3)
3.2. Учитель. Рассмотрим строение молекулы этого соединения.
Аммиак среди соединений азота является летучим водородным соединением. В свободном состоянии он нигде не встречается. Образует соли, в которых выступает в роли щелочного металла. У всех в домашних аптечках обязательно есть его водный раствор – нашатырный спирт. Его химическая формула NH3 В молекуле содержится один атом азота и три атом водорода. Рассмотрим строение атома азота. На последней оболочке у него пять валентных электронов. Схема строения атома азота выглядит так:
Электронная формула атома водорода 1S 1 .
Электронная формула атома азота имеет вид: 1S 2 2S 2 2P 3 .
У атома водорода один не спаренный электрон. Так как каждый атом стремится завершить свою последнюю оболочку для этого атому азоту необходимо принять три электрона, а атому водорода необходим ещё один электрон, поэтому между атомом азота и водорода образуется в молекуле аммиака три одинаковые ковалентные полярные связи с помощью общих электронных пар. Связи будут полярные потому, что соединяются разные атомы неметаллов, и так как атом азота более электроотрицателен, он будет сильнее к себе притягивать общие электронные пары. Будет происходить смещение электронов в сторону азота. Образование в молекуле аммиака трёх ковалентных полярных связей N - H можно посмотреть на схеме. У азота валентность – III, степень окисления равна –3. В пространстве молекула аммиака будет иметь форму пирамиды.
На атоме азота появится отрицательный заряд, а на атомах водорода положительный. Поэтому молекулы аммиака будут притягиваться друг к другу, и между ними будет устанавливаться ещё и водородная связь. Она обозначается тремя точками. (Приложение слайд №9). Присутствие водородной связи в молекуле аммиака объясняет его растворение в воде, и лёгкое сжижение этого газа. (Приложение. Презентация слайд №4-10)
Учитель: Давайте спрогнозируем свойства аммиака на основании строения его молекулы. В какие химические реакции может вступать аммиак благодаря наличию не поделённой электронной пары на атоме азота и трём КПС? В ходе обсуждения обучающиеся приходят к выводу.
Наличие не поделённой электронной пары на атоме азота и присутствие трёх полярных ковалентных связей в молекуле аммиака будет способствовать тому, что он будет вступать в реакции присоединения протона водорода Н+, то есть реагировать с водой и с растворами кислот, веществами, имеющие протоны водорода.
Исходя из низшей степени окисления атома азота (-3) аммиак будет проявлять только восстановительные свойства в окислительно-восстановительных реакциях.
3.3. Физические свойства аммиака. Определение запаха нашатырного спирта.
(Приложение №2). Ученик 2. Демонстрирует и рассказывает заранее подготовленный ученик.
(Приложение презентация слайд 12,13).
Действие аммиака на организм. Ученик №3
3.4. Учитель: Рассмотрим химические свойства аммиака по плану:
*Взаимодействие с водой. Действие водного раствора аммиака на индикаторы.
*Взаимодействие с кислотами
*Взаимодействие с нерастворимым основанием с образованием комплексной соли.
(Приложение. Презентация на слайде №14)
Ученик 3. Нашатырный спирт. Это спирт?
Нашатырный спирт назван спиртом неправильно. Его так называют в быту. Он не относится к классу спиртов, так как спирты – это органические вещества, а нашатырный спирт относится к неорганическим соединениям. Химики называют это соединение гидроксид аммония – это водный раствор газа аммиака NH3. Спирты не изменяют окраску индикаторов и не обладают щелочными свойствами.
Исследуем, как действует нашатырный спирт, то есть водный раствор аммиака на индикатор фенолфталеин и на универсальный индикатор.
Опыт №1. Делают все обучающиеся в парах. (Инструкция. Приложение №4)
О чём свидетельствует окраска индикатора? Ответ обучающихся.
Это говорит о том, что раствор нашатырного спирта обладает щелочной реакцией. На основании изученных свойств спрогнозируем применение аммиачной воды.
Применение нашатырного спирта. Ученик 4.
Нагревание раствора нашатырного спирта. Ученик 5. Демонстрация опыта(ученик заранее подготовлен).
А как будет вести себя раствор аммиака при нагревании?
При нагревании нашатырного спирта газ аммиак очень быстро улетучится и раствор обесцветится а влажная бумага фенолфталеина, поднесённая к отверстию пробирки станет малиновой.
Налить в пробирку раствор аммиака, добавить каплю фенолфталеина и нагревать на спиртовке, до появления обесцвечивания.
Разобрать, используя слайд №17 Презентации донорно-акцепторный механизм образования иона аммония.
Вывод: раствор аммиака обладает основными свойствами, которые будут проявляться в том, что в химических реакциях, аммиак будет присоединять протон водорода, а значит будет вступать в реакцию с водой и кислотами.
Посмотрим процесс растворения аммиака в воде (диск DVD Электронные уроки. “Соединения азота”. Опыт “Фонтан”).
(Приложение. Презентация. Слайд № 15-18)
Реакция аммиака с кислотами. “ Дым без огня” Химические свойства аммиака.
Ученик 6. (Ученик заранее подготовлен).
Аммиак реагирует с кислотами. Например, рассмотрим реакцию взаимодействия аммиака с соляной кислотой. При этом образуются соль, которая называется хлорид аммония, а ещё её называют нашатырь. Её формула NH4Cl. Этот опыт называется дым без огня. Как известно дыма без огня не бывает, но только не в химии. Если смочить две стеклянные палочки, одну раствором аммиака, а другую концентрированной соляной кислотой НCl, то появится белый дым, образованный солью хлоридом аммония, или нашатырём.
Нашатырь представляет из себя твёрдое белое кристаллическое вещество, которое применяется при паянии для очистки поверхности металлов от оксидной плёнки и хорошо пристаёт припой.
Запишем уравнение этой реакции: (Приложение. Презентация. Слайд19)
Взаимодействие аммиака с кислотами. Ученик 7. (Приложение. Презентация. Слайд19)
Аммиак легко реагирует не только с соляной кислотой (ученик подготовлен заранее).
Давайте проверим, а будет ли реагировать аммиак с разбавленной серной кислотой. Проделаем вместе такой опыт. Налить в пробирку 1 мл нашатырного спирта, который является водным раствором аммиака и добавим фенолфталеин. Произойдет окрашивание раствора в малиновый цвет, который говорит о том, что аммиак обладает щелочными свойствами, а теперь прильём раствор серной кислоты, формула которой H2SO4.
Раствор обесцвечивается. Это говорит о том, что произошла химическая реакция, образовалась соль аммиака, которая называется сульфат аммония. Запишем уравнение реакции:
Итак можно сделать вывод, что раствор аммиака, называемый аммиачной водой, проявляет свойства неорганических оснований, реагируя с кислотами с образованием солей, образуя ион аммония NH4 + . Этот ион ведет себя подобно иону металлов и стоит в таблице растворимости вместе с ионами металлов.
Вывод: Растворение аммиака в воде и в кислотах – процесс химический, в основе которого лежит способность молекул аммиака связывать ионы водорода. Причина этого – наличие у атома азота свободной электронной пары, которая “перетягивает” протон водорода из молекул воды и кислоты.
Рассмотрим окислительно-восстановительные реакции аммиака.
Реакции окисления аммиака могут протекать двумя способами:
1. В отсутствии катализатора.
2. В присутствии катализатора
Вывод: Аммиак не горит на воздухе, но в чистом кислороде или в присутствии катализатора аммиак хорошо окисляется.
Как хороший восстановитель взаимодействует с оксидом меди. (Составить дома уравнение).
Учитель. (Приложение №4, презентация слайд №22). Будет ли реагировать водный раствор аммиака с нерастворимым основанием. Выполняем задание №4 с Инструкции. Водный раствор аммиака может образовать окрашенное соединение, которое является комплексной солью.
Запишем уравнение химической реакции. Смотрим слайд №22.
В эту реакцию аммиак вступает за счёт того, что у атома азота есть не поделённая электронная пара. Эта реакция является особенной, так как основание с основанием не должно реагировать.
Способы получения аммиака в лаборатории и в промышленности . (см Презентацию слайд №23,24).
3.5. Просмотр диска DVD запись, выполнения эксперимента получения аммиака в лаборатории обучающимися старших классов на занятиях химического кружка “Химик-теоретик и практик”. Получение аммиака в промышленности обучающиеся изучают самостоятельно дома.
На основании изученных свойств спрогнозируем применение аммиака и его водного раствора.
3.6. Применение аммиака. Ученик 8. (Приложение к уроку№5. Презентация. Слайд №25-27).
Аммиак в медицине. Ученик 9. (Приложение к уроку №6)
4. Закрепление знаний. Что узнали? (На столах карточки с двумя уровнями заданий.)
Обучающиеся отвечают сразу на карточках, выбирая свой уровень.
1) Аммиак ____________ растворяется в воде.
2) Раствор аммиака в воде называют ___________ водой или ___________ спиртом.
3) Под действием аммиака влажная фенолфталеиновая бумажка меняет свою окраску на ________________.
4) При взаимодействии аммиака с концентрированной соляной кислотой образуется вещество в виде клубов белого дыма, называемого _______________.
5) Аммиак в реакциях проявляет ______________ свойства.
6) На каких свойствах аммиака основаны методы борьбы с его утечкой?
7) На каких свойствах аммиака основано его применение в медицине, в холодильных установках?
1)Молекула аммиака имеет неподелённую электронную пару:
А. Одну. Б. Две. В. Три. Г. Пять.
2) Какое вещество является восстановителем в реакции
А. Аммиак Б. Кислород В. Азот Г. Вода
3) Аммиак не взаимодействует с:
А. Серной кислотой Б. Соляной кислотой В. Гидроксидом натрия Г. Водой
4) Установите соответствие:
| Свойства азота | Химические уравнения реакций |
| 1. Реакции, связанные с изменением степени окисления азота. | А. NH3 + H2O NH4OH Б. 2NH3 N2 + 3H2 В. 4NH3 + 3O2 = 2N2 +6H2O Г. NH3 + HCl = NH4Cl |
| 2. Реакции, связанные с образованием ковалентной связи по донорно-акцепторному механизму. |
5) Составить уравнение химической реакции аммиака с азотной кислотой HNO3.
6) Почему окрашенная в аммиаке фенолфталеиновая бумажка со временем обесцвечивается? Составьте соответствующие уравнения реакций.
Карточки сдаются учителю.
5. Рефлексия.
Составление синквейна. Обучающиеся зачитывают несколько синквейнов про аммиак.
Аммиак какой из каждого пункта плана изучения темы 5 слов или определений.
Читайте также:
- Анализ олимпиады по математике 4 класс школьный этап
- Экологический проект в детском саду маленькие огородники
- По снегу шаламов анализ кратко
- Древнейшие гоминиды питекантроп синантроп и их трудовая деятельность кратко
- Какие факторы говорят что при разрушении динамического стереотипа происходит распад общей кратко

