Почему водород легче воздуха кратко
Обновлено: 28.06.2024
Водород является первым элементом периодической системы элементов. Широко распространён в природе. Катион (и ядро) самого распространённого изотопа водорода 1 H— протон. Свойства ядра 1 H позволяют широко использовать ЯМР-спектроскопию в анализе органических веществ.
Трое из пяти изотопов водорода имеют собственные названия: 1 H— протий (Н), 2 H— дейтерий (D) и 3 H— тритий (радиоактивен) (T).
Простое вещество водород— H2— лёгкий бесцветный газ. В смеси с воздухом или кислородом горюч и взрывоопасен. Нетоксичен. Растворим в этаноле и ряде металлов: железе, никеле, палладии, платине.
История водорода
Происхождение названия водород
Распространённость водорода
Во Вселенной
Водород — самый распространённый элемент во Вселенной. На его долю приходится около 92% всех атомов (8% составляют атомы гелия, доля всех остальных вместе взятых элементов — менее 0,1%). Таким образом, водород — основная составная часть звёзд и межзвёздного газа. В условиях звёздных температур (например, температура поверхности Солнца ~6000 °C) водород существует в виде плазмы, в межзвёздном пространстве этот элемент существует в виде отдельных молекул, атомов и ионов и может образовывать молекулярные облака, значительно различающиеся по размерам, плотности и температуре.
Земная кора и живые организмы
Массовая доля водорода в земной коре составляет 1%— это десятый по распространённости элемент. Однако его роль в природе определяется не массой, а числом атомов, доля которых среди остальных элементов составляет 17% (второе место после кислорода, доля атомов которого равна ~52%). Поэтому значение водорода в химических процессах, происходящих на Земле, почти так же велико, как и кислорода. В отличие от кислорода, существующего на Земле и в связанном, и в свободном состояниях, практически весь водород на Земле находится в виде соединений; лишь в очень незначительном количестве водород в виде простого вещества содержится в атмосфере (0,00005% по объёму).
Водород входит в состав практически всех органических веществ и присутствует во всех живых клетках. В живых клетках по числу атомов на водород приходится почти 50%.
Получение Водорода
Промышленные способы получения простых веществ зависят от того, в каком виде соответствующий элемент находится в природе, то есть что может быть сырьём для его получения. Так, кислород, имеющийся в свободном состоянии, получают физическим способом— выделением из жидкого воздуха. Водород же практически весь находится в виде соединений, поэтому для его получения применяют химические методы. В частности, могут быть использованы реакции разложения. Одним из способов получения водорода служит реакция разложения воды электрическим током.
Основной промышленный способ получения водорода— реакция с водой метана, который входит в состав природного газа. Она проводится при высокой температуре (легко убедиться, что при пропускании метана даже через кипящую воду никакой реакции не происходит):
В лаборатории для получения простых веществ используют не обязательно природное сырьё, а выбирают те исходные вещества, из которых легче выделить необходимое вещество. Например, в лаборатории кислород не получают из воздуха. Это же относится и к получению водорода. Один из лабораторных способов получения водорода, который иногда применяется и в промышленности,— разложение воды электротоком.
Обычно в лаборатории водород получают взаимодействием цинка с соляной кислотой.
Получение водорода в промышленности
1.Электролиз водных растворов солей:
2NaCl +2H2O → H2↑ +2NaOH +Cl2
2.Пропускание паров воды над раскаленным коксом при температуре около 1000°C:
H2O +C ⇄ H2↑ +CO↑
3.Из природного газа.
Конверсия с водяным паром:
CH4 +H2O ⇄ CO↑ +3H2↑ (1000°C)
Каталитическое окисление кислородом:
2CH4 +O2 ⇄ 2CO↑ +4H2↑
4. Крекинг и риформинг углеводородов в процессе переработки нефти.
Получение водорода в лаборатории
1.Действие разбавленных кислот на металлы. Для проведения такой реакции чаще всего используют цинк и разбавленную соляную кислоту:
Zn +2HCl → ZnCl2 +H2↑
3.Гидролиз гидридов:
NaH +H2O → NaOH +H2↑
5.С помощью электролиза. При электролизе водных растворов щелочей или кислот на катоде происходит выделение водорода, например:
2H3O + +2e - → H2↑ +2H2O
Дополнительная информация про Водород
Биореактор для производства водорода
Физические свойства Водорода

Спектр излучения водорода

Эмиссионный спектр водорода
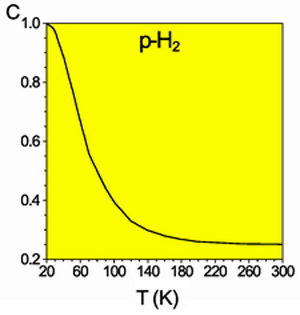
Равновесная мольная концентрация пара-водорода
Разделить модификации водорода можно адсорбцией на активном угле при температуре жидкого азота. При очень низких температурах равновесие между ортоводородом и параводородом почти нацело сдвинуто в сторону последнего. При 80 К соотношение форм приблизительно 1:1. Десорбированный параводород при нагревании превращается в ортоводород вплоть до образования равновесной при комнатной температуре смеси (орто-пара: 75:25). Без катализатора превращение происходит медленно (в условиях межзвездной среды— с характерными временами вплоть до космологических), что даёт возможность изучить свойства отдельных модификаций.
Водород — самый лёгкий газ, он легче воздуха в 14,5 раз. Очевидно, что чем меньше масса молекул, тем выше их скорость при одной и той же температуре. Как самые лёгкие, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому. Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в семь раз выше теплопроводности воздуха.
Молекула водорода двухатомна — Н2. При нормальных условиях — это газ без цвета, запаха и вкуса. Плотность 0,08987 г/л (н.у.), температура кипения −252,76 °C, удельная теплота сгорания 120.9·10 6 Дж/кг, малорастворим в воде — 18,8 мл/л. Водород хорошо растворим во многих металлах (Ni, Pt, Pd и др.), особенно в палладии (850 объёмов на 1объём Pd). С растворимостью водорода в металлах связана его способность диффундировать через них; диффузия через углеродистый сплав (например, сталь) иногда сопровождается разрушением сплава вследствие взаимодействия водорода с углеродом (так называемая декарбонизация). Практически не растворим в серебре.
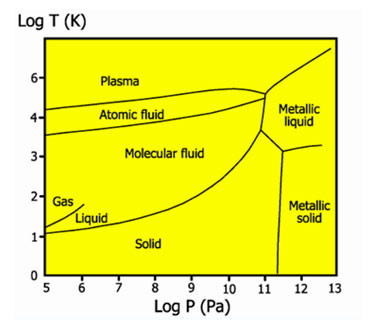
Фазовая диаграмма водорода
Жидкий водород существует в очень узком интервале температур от −252,76 до −259,2 °C. Это бесцветная жидкость, очень лёгкая (плотность при −253 °C 0,0708 г/см3) и текучая (вязкость при −253 °C 13,8 спуаз). Критические параметры водорода очень низкие: температура −240,2 °C и давление 12,8 атм. Этим объясняются трудности при ожижении водорода. В жидком состоянии равновесный водород состоит из 99,79% пара-Н2, 0,21% орто-Н2.
Твердый водород, температура плавления −259,2 °C, плотность 0,0807 г/см3 (при −262 °C) — снегоподобная масса, кристаллы гексогональной сингонии, пространственная группа P6/mmc, параметры ячейки a=3,75 c=6,12. При высоком давлении водород переходит в металлическое состояние.
Изотопы
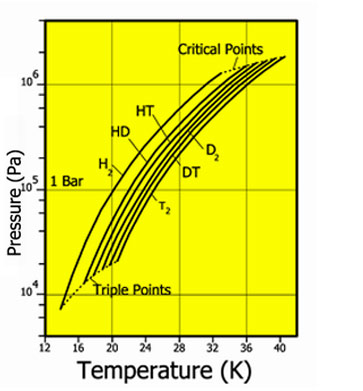
Давление пара для различных изотопов водорода
Водород встречается в виде трёх изотопов, которые имеют индивидуальные названия: 1 H— протий (Н), 2 Н— дейтерий (D), 3 Н— тритий (радиоактивный) (T).
Протий и дейтерий являются стабильными изотопами с массовыми числами 1и 2. Содержание их в природе соответственно составляет 99,9885±0,0070% и 0,0115 ± 0,0070%. Это соотношение может незначительно меняться в зависимости от источника и способа получения водорода.
Изотоп водорода 3 Н (тритий) нестабилен. Его период полураспада составляет 12,32 лет. Тритий содержится в природе в очень малых количествах.
В литературе также приводятся данные об изотопах водорода с массовыми числами 4— 7и периодами полураспада 10 −22 — 10 −23 с.
Природный водород состоит из молекул H2 и HD (дейтероводород) в соотношении 3200:1. Содержание чистого дейтерийного водорода D2 ещё меньше. Отношение концентраций HD и D2, примерно, 6400:1.
Из всех изотопов химических элементов физические и химические свойства изотопов водорода отличаются друг от друга наиболее сильно. Это связано с наибольшим относительным изменением масс атомов.
| Температура плавления, K | Температура кипения, K | Тройная точка, K /kPa | Критическая точка, K /kPa | Плотность жидкий /газ, кг/м³ | |
|---|---|---|---|---|---|
| H2 | 13.95 | 20,39 | 13,96 /7,3 | 32,98 /1,31 | 70,811 /1,316 |
| HD | 16,60 | 22,13 | 16,60 /12,8 | 35,91 /1,48 | 114,80 /1,802 |
| HT | 22,92 | 17,63 /17,7 | 37,13 /1,57 | 158,62 /2,310 | |
| D2 | 18,62 | 23,67 | 18,73 /17,1 | 38,35 /1,67 | 162,50 /2,230 |
| DT | 24.38 | 19,71 /19,4 | 39,42 /1,77 | 211,54 /2,694 | |
| T2 | 25,04 | 20,62 /21,6 | 40,44 /1,85 | 260,17 /3,136 |
Дейтерий и тритий также имеют орто- и пара- модификации: p-D2, o-D2, p-T2, o-T2. Гетероизотопный водород (HD, HT, DT) не имеют орто- и пара- модификаций.
Химические свойства
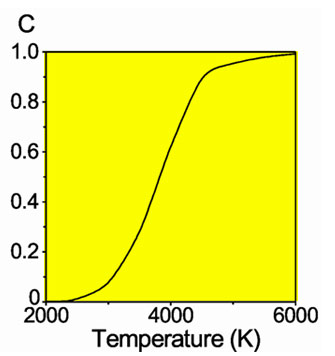
Доля диссоциировавших молекул водорода
Молекулы водорода Н2 довольно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия:
Поэтому при обычных температурах водород реагирует только с очень активными металлами, например с кальцием, образуя гидрид кальция:
и с единственным неметаллом— фтором, образуя фтороводород:
С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например при освещении:
Записанное уравнение отражает восстановительные свойства водорода.
С галогенами образует галогеноводороды:
F2 +H2 → 2HF, реакция протекает со взрывом в темноте и при любой температуре, Cl2 +H2 → 2HCl, реакция протекает со взрывом, только на свету.
С сажей взаимодействует при сильном нагревании:
Взаимодействие со щелочными и щёлочноземельными металлами
При взаимодействии с активными металлами водород образует гидриды:
Гидриды— солеобразные, твёрдые вещества, легко гидролизуются:
Взаимодействие с оксидами металлов (как правило, d-элементов)
Оксиды восстанавливаются до металлов:
Гидрирование органических соединений
Молекулярный водород широко применяется в органическом синтезе для восстановления органических соединений. Эти процессы навзывают реакциями гидрирования. Эти реакции проводят в присутствии катализатора при повышенных давлении и температуре. Катализатор может быть как гомогенным (напр. Катализатор Уилкинсона), так и гетерогенным (напр. никель Ренея, палладий на угле).
Так, в частности, при каталитическом гидрировании ненасыщенных соединений, таких как алкены и алкины, образуются насыщенные соединения — алканы.
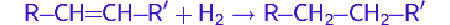
Геохимия водорода
На Земле содержание водорода понижено по сравнению с Солнцем, гигантскими планетами и первичными метеоритами, из чего следует, что во время образования Земля была значительно дегазирована и водород вместе с другими летучими элементами покинул планету во время аккреции или вскоре после неё.
Свободный водород H2 относительно редко встречается в земных газах, но в виде воды он принимает исключительно важное участие в геохимических процессах.
В состав минералов водород может входить в виде иона аммония, гидроксил-иона и кристаллической воды.
В атмосфере водород непрерывно образуется в результате разложения воды солнечным излучением. Имея малую массу, молекулы водорода обладают высокой скоростью диффузионного движения (она близка ко второй космической скорости) и, попадая в верхние слои атмосферы, могут улететь в космическое пространство.
Особенности обращения
Водород при смеси с воздухом образует взрывоопасную смесь— так называемый гремучий газ. Наибольшую взрывоопасность этот газ имеет при объёмном отношении водорода и кислорода 2:1, или водорода и воздуха приближённо 2:5, так как в воздухе кислорода содержится примерно 21%. Также водород пожароопасен. Жидкий водород при попадании на кожу может вызвать сильное обморожение.
Взрывоопасные концентрации водорода с кислородом возникают от 4% до 96% объёмных. При смеси с воздухом от 4% до 75(74)% объёмных.
Применение водорода
Атомарный водород используется для атомно-водородной сварки.
Химическая промышленность
При производстве аммиака, метанола, мыла и пластмасс
Пищевая промышленность
Авиационная промышленность
Водород очень лёгок и в воздухе всегда поднимается вверх. Когда-то дирижабли и воздушные шары наполняли водородом. Но в 30-х гг. XXв. произошло несколько катастроф, когда дирижабли взрывались и сгорали. В наше время дирижабли наполняют гелием.
Топливо
Водород используют в качестве ракетного топлива. Ведутся исследования по применению водорода как топлива для легковых и грузовых автомобилей. Водородные двигатели не загрязняют окружающей среды и выделяют только водяной пар.
В водородно-кислородных топливных элементах используется водород для непосредственного преобразования энергии химической реакции в электрическую.
Изотопы водорода были открыты в 30-x годах текущего столетия и быстро приобрели большое значение в науке и технике. В конце 1931 г. Юри, Брекуэдд и Мэрфи исследовали остаток после длительного выпаривания жидкого водорода и обнаружили в нем тяжелый водород с атомным весом 2. Этот изотоп назвали дейтерием (Deuterium, D) от греч.— другой, второй. Спустя четыре года в воде, подвергнутой длительному электролизу, был обнаружен еще более тяжелый изотоп водорода 3Н, который назвали тритием (Tritium, Т), от греч.— третий.
Периодическая система химических элементов Менделеева
Классификация хим. элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
198095, г.Санкт-Петербург, ул.Швецова, д.23, лит.Б, пом.7-Н, схема проезда
Водород имеет молекулярное строение. Его молекула H 2 состоит из двух атомов, соединённых ковалентной неполярной связью.
При комнатной температуре водород представляет собой бесцветный газ без запаха и вкуса. Это самое лёгкое вещество на Земле. Его плотность равна примерно \(0,9\) г/дм³. Водород в \(14,5\) раз легче воздуха.
В воде водород растворяется плохо (примерно \(2\) объёма на \(100\) объёмов воды), но может поглощаться некоторыми металлами. Например, \(1\) объём палладия может растворить до \(900\) объёмов водорода.
Молекулы водорода благодаря своей малой массе и размерам могут проникать сквозь стенки сосуда, в котором он содержится. Заполненный водородом шарик через некоторое время сдувается. При температуре \(300\)–\(600\) °С водород способен диффундировать сквозь стенки стеклянного или металлического сосуда.
При комнатной температуре химическая активность водорода низкая. Она значительно повышается при нагревании.

Водород химический элемент, первый по порядковому номеру в периодической системе Д. И. Менделеева. Атомная масса 1,00792. При обычных условиях водород - газ без цвета, запаха и вкуса, в 14,38 раза легче воздуха. Плотность 0,089870 г/л при нулевой температуре и нормальном давлении. Критическая температура -240°С. Химическая формула – H. В обычных условиях молекула водорода двухатомная - H2.
Содержание
При горении водорода в кислороде образуется чистое, некоптящее и не имеющее четких границ пламя температурой до 2800°С.
Теоретически для полного сгорания 1 мг водорода требуется 0,5 мг кислорода. Практически в горелку на 1 мг водорода подается 0,25 мг кислорода.
История открытия водорода
В 1794 г. к водороду возник чисто военный интерес. В то время уже были изобретены воздушные шары, наполненные горячим воздухом, - монгольфьеры Их называли так в честь братьев французов Монгольфье, совершивших первый полет на таком аэростате в 1783 г.
Преимущества водорода перед нагретым воздухом были очевидны. Нагретый воздух обладал подъемной силой, пока он не остывал до температуры окружающего воздуха. Следовательно, чтобы совершить более или менее длительный полет, надо было под отверстием аэростата в гондоле пилота поддерживать огонь, подогревать воздух. Конечно, это было опасно и приводило к трагическим катастрофам. А водород всегда будет легче воздуха более чем в 14 раз. И его не надо нагревать, наоборот - беречь от огня.
Избыток водяных паров, непрерывно поступающих в трубу, проходил через холодильник, а водород по трубам направлялся в аэростат и надувал его.
Когда железо израсходуется, его опять можно получить из накаленной окалины, если через трубу пропустить светильный газ. Уравнение показывает, что 3?56=168 г железа могут вытеснить 8 г водорода, или 4?22,4=89,6 л водорода.
Аэростаты, наполненные водородом, применили впервые революционные войска Франции в битве при Флёрюсе в 1794 г.
В войнах 1904-1905 и 1914-1918 гг. привязанные канатами аэростаты служили главным образом для наблюдения за прицельностью артиллерийского огня, за передвижением войск. Во время Великой Отечественной войны 1941-1945 гг. они защищали военные объекты от авиации противника. Летчики, опасаясь столкновений с аэростатом и канатами, летали на большой высоте, поэтому их бомбовые удары в значительной мере теряли прицельность.
Первый в мире полет на аэростате с научной целью совершил ученый Захаров Яков Дмитриевич в 1804 г. А в 1887 г. для наблюдения солнечного затмения и изучения воздуха поднялся в воздух Менделеев Дмитрий Иванович.
Получение водорода

В промышленности технический водород получают:
- электролизом воды;
- методом глубокого охлаждения газовых смесей, содержащих водород;
- железо-паровым способом;
- из водяного газа путем окисления содержащейся в нем окиси углерода водяным паром в присутствии катализатора;
- в специальных водородных генераторах воздействием серной кислоты на железную стружку и цинк.
Получение водорода из кислот
На первых порах источником для получения водорода служили кислоты. Так и в наше время в лабораториях часто получают его средневековым способом - действием цинка на серную кислоту. Реакция протекает по уравнению:
Вместо цинка можно взять железо в виде стружек или алюминий. Водород получается, загрязненный побочными продуктами разложения серной кислоты, и, если это требуется, его приходится очищать.
Добыча водорода из промышленных газов
Огромные количества водорода, необходимые современной промышленности, получают сейчас электролизом раствора щелочи и извлекают из промышленных газов - коксовальных печей, газов, получаемых при переработке нефти и др.
При переработке каменного угля на кокс дополнительно получается деготь и коксовый газ. В состав газа входит до 50-60% водорода (H2), 20-25% метана (СН4), окись углерода (СО), азот (N) и др.
В статье о свойствах гелия и способах его производства описан процесс получения гелия методом фракционной конденсации. Так же поступают и с коксовым газом. Но чтобы отделить водород от других составных частей, требуется очень глубокое охлаждение из-за низкой критической температуры водорода.
Производство водорода из воды
Наиболее широко распространенным способом производства водорода является - электролиз дистиллированной воды. В результате чего получают водород, кислород и некоторые примеси.
Единственным исходным сырьем для добычи водорода электролитическим методом служит вода. Чистая, дистиллированная вода обладает огромным сопротивлением и почти совершенно не проводит электрический ток. Вот почему для того чтобы сделать воду электропроводной, в ней нужно растворить какую-нибудь соль, кислоту или основание, которые дают ионы.
Через водный раствор щелочи (например: каустическая сода) пропускают постоянный электрический ток. При этом вода разлагается, и на отрицательном электроде (катоде) выделяется водород, а на положительном электроде (аноде) - кислород, также являющийся важным промышленным продуктом.
Большой расход электроэнергии является главным недостатком данного способа, поэтому применение водорода полученного при помощи электролиза целесообразно при одновременном использовании вместе с кислородом. В связи с этим в последнее время портативные водородные сварочные аппараты для газовой сварки и пайки пользуются все большей популярностью.
Применение водорода

Основными направлениями применения водорода являются:
- химическая промышленность – синтез аммиака, метанола, углеводородов;
- пищевая промышленность – получение пищевых белков;
- нефтехимия – нефтепереработка (гидрогенезационная очистка нефтепродуктов);
- автотранспорт – автомобили на газообразном и жидком водороде;
- машиностроение – для сварки и резки металлов.
Применение водорода в сварке
Водород использовался в качестве защитного газа еще при первых попытках защиты дугового пространства от воздуха. Однако водород может оказать в ряде случаев вредное воздействие. Это объясняется тем, что при применении водорода в металле сварных швов образуются дефекты в виде пор, а также является одним из главных факторов образования холодных трещин. С увеличением толщины свариваемых элементов пористость в металле сварных швов становится значительной. Поэтому его использование в дальнейшем было значительно ограничено. В чистом виде (и в виде водородно-азотных смесей, получаемых при диссоциации аммиака) он в настоящее время применяется при атомно-водородной сварке (хотя и сам этот способ заменен теперь другими, в частности сваркой неплавящимся электродом).
Несмотря на то, что атмосфера, окружающая металл, при атомно-водородной сварке представляет собой смесь молекулярного и атомарного водорода, при отсутствии на металле значительного количества окислов швы получаются достаточно плотными и применительно к низкоуглеродистой стали не имеют большого количества диффузионно-подвижного и остаточного водорода.
При струйной защите иногда используется водяной пар. Однако в этом случае получается значительно меньшая стабильность качества сварных швов, чем при сварке с защитой дуги углекислым газом. В связи с этим такой процесс широкого распространения не получил.
При TIG сварке аустенитной нержавеющей стали с целью увеличения напряжения дуги, увеличения теплоэффективности и снижения оксидирования используют аргоно-водородные смеси газов (15% Н2). Более высокая температуру и сжатие дуги, в свою очередь увеличивает глубину проплавления металла. Однако при этом необходимо учитывать возможность вредного влияния растворяющегося в металле водорода. Более широко водород применяют в специальных областях сварки и металлургии, например в порошковой металлургии при спекании изделий из порошковых материалов.
В других случаях применение водорода и водородосодержащих газов, как защитных при дуговой сварке, нецелесообразно.
Применяют водород для составления плазмообразующих смесей при плазменной сварке и резке. Так, для защиты сварочной ванны от окисления при плазменной сварке легированной стали, меди, никеля и сплавов на его основе используют смесь аргона с 5-8% водорода.
Аргоно-водородную смесь, имеющую до 20% Н2, применяют при микроплазменной сварке. Наличие водорода в смеси обеспечивает сжатие столба плазмы, делает его более сконцентрированным. Кроме того, водород создает необходимую в ряде случаев восстановительную атмосферу.
Взрывоопасность водорода
При работе с водородом особое внимание следует обращать на герметичность аппаратуры и газовых коммуникаций, так как водород способен проникать через мельчайшие неплотности, образовывать с воздухом взрывоопасные концентрации. В смеси с кислородом (2:1) образует взрывчатую смесь, называемую гремучим газом.
Температура самовоспламенения 510°С. Водород физиологически инертен, при высоких концентрациях вызывает удушье. При высоком давлении проявляется наркотическое действие. При работе в среде водорода необходимо пользоваться изолирующим противогазом (кислородным или шланговым).
Хранение и транспортировка водорода
Характеристика водорода
Характеристики H2 представлены в таблицах ниже:
Коэффициенты перевода объема и массы H2 при Т=15°С и Р=0,1 МПа
| Масса, кг | Объем | |
|---|---|---|
| Газ, м 3 | Жидкость, л | |
| 0,0841 | 1 | 1,188 |
| 0,0708 | 0,842 | 1 |
| 1 | 11,891 | 14,126 |
Коэффициенты перевода объема и массы H2 при Т=0°С и Р=0,1 МПа
| Масса, кг | Объем | |
|---|---|---|
| Газ, м 3 | Жидкость, л | |
| 0,09 | 1 | 1,258 |
| 0,0708 | 0,975 | 1 |
| 1 | 11,124 | 14,126 |
Водород в баллоне
| Наименование | Объем баллона, л | Масса газа в баллоне, кг | Объем газа (м 3 ) при Т=15°С, Р=0,1 МПа |
|---|---|---|---|
| H2 | 40 | 0,54 | 6,0 |
Благодаря этой таблице теперь можно легко дать ответы на вопросы, которые очень часто задают сварщики:
- Сколько кубов (м 3 ) водорода в 40 литровом баллоне?
Ответ: 6,0 м 3 - Сколько кг водорода в баллоне?
Ответ: 0,54 кг - Сколько весит баллон с водородом?
Ответ:
58,5 кг - масса пустого баллона из углеродистой стали согласно ГОСТ 949;
0,54 - кг масса водорода в баллоне;
Итого: 58,5 + 0,54 = 58,94 кг вес баллона с водородом.
Рекомендуем к просмотру видео об открытии водорода, его характеристиках и производстве.
Водород (лат. Hydrogenium; обозначается символом H) — первый элемент периодической системы элементов. Широко распространён в природе. Катион (и ядро) самого распространённого изотопа водорода 1 H — протон. Свойства ядра 1 H позволяют широко использовать ЯМР-спектроскопию в анализе органических веществ.
Три изотопа водорода имеют собственные названия: 1 H — протий (Н), 2 H — дейтерий (D) и 3 H — тритий (радиоактивен) (T).
Простое вещество водород — H2 — лёгкий бесцветный газ. В смеси с воздухом или кислородом горюч и взрывоопасен. Нетоксичен. Растворим в этаноле и рядеметаллов: железе, никеле, палладии, платине.
История
Происхождение названия
Распространённость
Водород — самый распространённый элемент во Вселенной. На его долю приходится около 92 % всех атомов (8 % составляют атомы гелия, доля всех остальных вместе взятых элементов — менее 0,1 %). Таким образом, водород — основная составная часть звёзд и межзвёздного газа. В условиях звёздных температур (например, температура поверхности Солнца ~ 6000 °C) водород существует в виде плазмы, в межзвёздном пространстве этот элемент существует в виде отдельных молекул, атомов и ионов и может образовывать молекулярные облака, значительно различающиеся по размерам, плотности и температуре.
Земная кора и живые организмы
Массовая доля водорода в земной коре составляет 1 % — это десятый по распространённости элемент. Однако его роль в природе определяется не массой, а числом атомов, доля которых среди остальных элементов составляет 17 % (второе место после кислорода, доля атомов которого равна ~ 52 %). Поэтому значение водорода в химических процессах, происходящих на Земле, почти так же велико, как и кислорода. В отличие от кислорода, существующего на Земле и в связанном, и в свободном состояниях, практически весь водород на Земле находится в виде соединений; лишь в очень незначительном количестве водород в виде простого вещества содержится в атмосфере (0,00005 % по объёму).
Водород входит в состав практически всех органических веществ и присутствует во всех живых клетках. В живых клетках по числу атомов на водород приходится почти 50 %.
Получение
Промышленные способы получения простых веществ зависят от того, в каком виде соответствующий элемент находится в природе, то есть что может быть сырьём для его получения. Так, кислород, имеющийся в свободном состоянии, получают физическим способом — выделением из жидкого воздуха. Водород же практически весь находится в виде соединений, поэтому для его получения применяют химические методы. В частности, могут быть использованы реакции разложения. Одним из способов получения водорода служит реакция разложения воды электрическим током.
Основной промышленный способ получения водорода — реакция с водой метана, который входит в состав природного газа. Она проводится при высокой температуре (легко убедиться, что при пропускании метана даже через кипящую воду никакой реакции не происходит):
В лаборатории для получения простых веществ используют не обязательно природное сырьё, а выбирают те исходные вещества, из которых легче выделить необходимое вещество. Например, в лаборатории кислород не получают из воздуха. Это же относится и к получению водорода. Один из лабораторных способов получения водорода, который иногда применяется и в промышленности, — разложение воды электротоком.
Обычно в лаборатории водород получают взаимодействием цинка с соляной кислотой.
В промышленности
1.Электролиз водных растворов солей:
2.Пропускание паров воды над раскаленным коксом при температуре около 1000 °C:
3.Из природного газа.
Конверсия с водяным паром:
Каталитическое окисление кислородом:
4. Крекинг и риформинг углеводородов в процессе переработки нефти.
В лаборатории
1.Действие разбавленных кислот на металлы. Для проведения такой реакции чаще всего используют цинк и разбавленную соляную кислоту:
2.Взаимодействие кальция с водой:
4.Действие щелочей на цинк или алюминий:
5.С помощью электролиза. При электролизе водных растворов щелочей или кислот на катоде происходит выделение водорода, например:
Физические свойства
Водород может существовать в двух формах (модификациях) — в виде орто- и пара- водорода. В молекуле ортоводорода o-H2 (т. пл. −259,10 °C, т. кип. −252,56 °C) ядерные спины направлены одинаково (параллельны), а у параводорода p-H2 (т. пл. −259,32 °C, т. кип. −252,89 °C) — противоположно друг другу (антипараллельны). Равновесная смесь o-H2 и p-H2 при заданной температуре называется равновесный водород e-H2.
Разделить модификации водорода можно адсорбцией на активном угле при температуре жидкого азота. При очень низких температурах равновесие между ортоводородом и параводородом почти нацело сдвинуто в сторону последнего. При 80 К соотношение форм приблизительно 1:1. Десорбированный параводород при нагревании превращается в ортоводород вплоть до образования равновесной при комнатной температуре смеси (орто-пара: 75:25). Без катализатора превращение происходит медленно (в условиях межзвездной среды - с характерными временами вплоть до космологических), что даёт возможность изучить свойства отдельных модификаций.
Водород — самый лёгкий газ, он легче воздуха в 14,5 раз. Очевидно, что чем меньше масса молекул, тем выше их скорость при одной и той же температуре. Как самые лёгкие, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому. Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в семь раз выше теплопроводности воздуха.
Молекула водорода двухатомна — Н2. При нормальных условиях — это газ без цвета, запаха и вкуса. Плотность 0,08987 г/л (н.у.), температура кипения −252,76 °C, удельная теплота сгорания 120.9×10 6 Дж/кг, малорастворим в воде — 18,8 мл/л. Водород хорошо растворим во многих металлах (Ni, Pt, Pd и др.), особенно в палладии (850 объёмов на 1 объём Pd). С растворимостью водорода в металлах связана его способность диффундировать через них; диффузия через углеродистый сплав (например, сталь) иногда сопровождается разрушением сплава вследствие взаимодействия водорода с углеродом (так называемая декарбонизация). Практически не растворим в серебре.
Жидкий водород существует в очень узком интервале температур от −252,76 до −259,2 °C. Это бесцветная жидкость, очень лёгкая (плотность при −253 °C 0,0708 г/см 3 ) и текучая (вязкость при −253 °C 13,8 спуаз). Критические параметры водорода очень низкие: температура −240,2 °C и давление 12,8 атм. Этим объясняются трудности при ожижении водорода. В жидком состоянии равновесный водород состоит из 99,79 % пара-Н2, 0,21 % орто-Н2.
Твердый водород, температура плавления −259,2 °C, плотность 0,0807 г/см 3 (при −262 °C) — снегоподобная масса, кристаллы гексогональной сингонии,пространственная группа P6/mmc, параметры ячейки a=3,75 c=6,12. При высоком давлении водород переходит в металлическое состояние.
Изотопы
Водород встречается в виде трёх изотопов, которые имеют индивидуальные названия: 1 H — протий (Н), 2 Н — дейтерий (D), 3 Н — тритий (радиоактивный) (T).
Протий и дейтерий являются стабильными изотопами с массовыми числами 1 и 2. Содержание их в природе соответственно составляет 99,9885 ± 0,0070 % и 0,0115 ± 0,0070 %. Это соотношение может незначительно меняться в зависимости от источника и способа получения водорода.
Изотоп водорода 3 Н (тритий) нестабилен. Его период полураспада составляет 12,32 лет. Тритий содержится в природе в очень малых количествах.
В литературе также приводятся данные об изотопах водорода с массовыми числами 4 — 7 и периодами полураспада 10 −22 — 10 −23 с.
Природный водород состоит из молекул H2 и HD (дейтероводород) в соотношении 3200:1. Содержание чистого дейтерийного водорода D2 ещё меньше. Отношение концентраций HD и D2, примерно, 6400:1.
Из всех изотопов химических элементов физические и химические свойства изотопов водорода отличаются друг от друга наиболее сильно. Это связано с наибольшим относительным изменением масс атомов.
Читайте также:

