Почему первое начало термодинамики можно назвать законом сохранения и превращения энергии кратко
Обновлено: 17.05.2024
Закон сохранения и превращения энергии является фундаментальным законом природы, имеющим всеобщий характер. Этот закон гласит: энергия не исчезает и не возникает вновь, она лишь переходит из одного вида в другой в различных физических и химических процессах. Иными словами, для любой изолированной системы (т.е. такой термодинамической системы, которая не обменивается с окружающей средой ни теплотой, ни работой, ни веществом) количество энергии, заключенной в этой системе, сохраняется неизменным. Закон сохранения энергии был давно известен в механике применительно к механической (кинетической и потенциальной) энергии. После того как работами Джоуля и других ученых был установлен принцип эквивалентности теплоты и работы, закон сохранения был распространен на другие виды энергии и в соответствии с его содержанием стал называться законом сохранения и превращения энергии. В настоящее время известны различные виды энергии: энергия теплового движения микрочастиц, составляющих тело; кинетическая энергия всего тела в целом; энергия гравитационного поля (в частности, потенциальная энергия тела, поднятого над землей); энергия электрического поля; магнитного поля; электромагнитного излучения; внутриядерная энергия и др. Закон сохранения и превращения энергии устанавливает однозначную связь между всеми видами энергии в процессе их взаимопревращений. Закон сохранения и превращения энергии носит также название первого закона термодинамики. Следует еще раз подчеркнуть, что первый закон термодинамики имеет всеобщий характер.
В общем случае, когда в результате подвода теплоты к телу температура тела повышается и вследствие увеличения объема тела производится внешняя работа, подведенная к телу теплота расходуется на увеличение внутренней энергии тела U и на совершение работы L. Сказанное может быть выражено уравнением:
где Q(1-2) — теплота, сообщенная телу при нагревании от состояния 1 до состояния 2; ΔU(1-2) — изменение внутренней энергии тела в том же процессе; L(1-2) — работа, совершаемая телом в процессе 1—2. Уравнение представляет собой выражение первого закона термодинамики, являющегося частным случаем более общего закона сохранения энергии.
Является ли функцией процесса внутренняя энергия или же эта величина обладает иными свойствами? Для ответа на этот вопрос нам придется вернуться к рассмотрению опыта Джоуля . Предварительно введем понятие о цикле. Круговым процессом , или циклом , называют такой термодинамический процесс, в результате осуществления которого система возвращается в то же состояние, в котором она находилась к моменту начала этого процесса.
Рассмотрим теперь процессы, которые осуществляются в системе, используемой в опыте Джоуля. Эта система (см. предыдущую статью) состоит из груза 4 с барабаном 5 и из заполненного водой сосуда 1 с мешалкой 2 и лопатками 3. Исходное состояние этой системы к моменту начала опыта таково: груз 4 массой G находится на некоторой высоте z0 (это тот уровень, до которого должен опуститься груз в опыте), а сосуд 1 имеет некоторую исходную температуру t1. Это состояние системы обозначим индексом 1.
Затем груз поднимают на высоту (z0 + z), совершая тем самым работу, и подвешивают к тросу, соединенному с мешалкой. Эта работа подводится к рассматриваемой системе от какого-либо внешнего источника (например, экспериментатор поднимает этот груз своими руками). Состояние, в котором находится система после подъема груза на высоту, обозначим индексом 2.
Что же касается сосуда, то поскольку в процессе 1-2 он не претерпел никаких изменений, очевидно, что t1 = t2. Затем груз, подвешенный к соединенному с мешалкой тросу, вновь опускается на уровень z0, и рассматриваемая нами система приходит в состояние 3. Очевидно, что в процессе 2-3 к системе не подводится и от нее не отводится ни теплота, ни работа, а лишь происходит превращение работы в теплоту внутри системы груз—сосуд. В состоянии 3 груз, как мы видим, находится на том же уровне z0, что и в исходном состоянии 1. Что же касается сосуда, то его состояние отличается от исходного: за счет превращения внутри системы работы в теплоту в процессе 2-3 вода в сосуде, мешалка, лопатки и стенки сосуда нагреты до температуры t3 > t1 . Отсюда очевидно, что для того чтобы привести систему в исходное состояние I, нужно осуществить процесс 3-1— процесс отвода из сосуда 1 теплоты, выделившейся при превращении работы в теплоту в процессе 2-3. После осуществления процесса 3-1 система возвратилась в исходное состояние 1; таким образом, система осуществила замкнутый процесс (цикл) 1-2-3-4. В соответствии с установленным Джоулем принципом эквивалентности теплоты и работы очевидно, что
Таким образом, в отличие от Q и L внутренняя энергия не является функцией процесса. Величина U подобно, например, удельному объему является функцией состояния — ее значение однозначно определяется параметрами системы в данном состоянии.
Спасибо за прочтение материала. В следующий раз материал будет про второй закон термодинамики, который так же необходимо знать для понимания термодинамических ограничений в работе двигателей.
Первое начало (первый закон) термодинамики — это закон сохранения и превращения энергии для термодинамической системы.
Первое начало (первый закон) термодинамики — это закон сохранения и превращения энергии для термодинамической системы.
Согласно первому началу термодинамики, работа может совершаться только за счет теплоты или какой-либо другой формы энергии. Следовательно, работу и количество теплоты измеряют в одних единицах — джоулях (как и энергию).
Первое начало термодинамики было сформулировано немецким ученым Ю. Л. Манером в 1842 г. и подтверждено экспериментально английским ученым Дж. Джоулем в 1843 г.
Первый закон термодинамики формулируется так:
Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе:
где ΔU — изменение внутренней энергии, A — работа внешних сил, Q — количество теплоты, переданной системе.
При любых процессах, происходящих в изолированной системе, ее внутренняя энергия остается постоянной.
Если работу совершает система, а не внешние силы, то уравнение (ΔU = A + Q) записывается в виде:

,
где A' — работа, совершаемая системой (A' = -A).
Количество теплоты, переданное системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами.
Первое начало термодинамики может быть сформулировано как невозможность существования вечного двигателя первого рода, который совершал бы работу, не черпая энергию из какого-либо источника (т. е. только за счет внутренней энергии).

Действительно, если к телу не поступает теплота (Q - 0), то работа A', согласно уравнению , совершается только за счет убыли внутренней энергии А' = -ΔU. После того, как запас энергии окажется исчерпанным, двигатель перестает работать.
Следует помнить, что как работа, так и количество теплоты, являются характеристиками процесса изменения внутренней энергии, поэтому нельзя говорить, что в системе содержится определенное количество теплоты или работы. Система в любом состоянии обладает лишь определенной внутренней энергией.
Применение первого закона термодинамики к различным процессам .
Рассмотрим применение первого закона термодинамики к различным термодинамическим процессам.
Изохорный процесс.
Зависимость р(Т) на термодинамической диаграмме изображается изохорой.

Изохорный (изохорический) процесс — термодинамический процесс, происходящий в системе при постоянном объеме.
Изохорный процесс можно осуществить в газах и жидкостях, заключенных в сосуд с постоянным объемом.

При изохорном процессе объем газа не меняется (ΔV= 0), и, согласно первому началу термодинамики ,
т. е. изменение внутренней энергии равно количеству переданного тепла, т. к. работа (А = рΔV=0) газом не совершается.
На рисунке 3 . 9 . 1 условно проиллюстрированы энергетические потоки между выделенной термодинамической системой и окружающими телами. В случае, если тепловой поток направлен к термодинамической системе, то некоторая величина Q > 0 , если же система совершает положительную работу над окружающими ее объектами, то справедливо неравенство A > 0 .
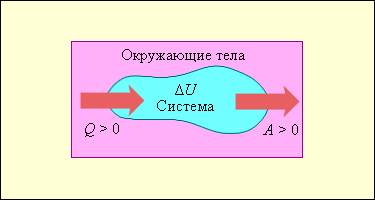
Рисунок 3 . 9 . 1 . Обмен энергией между термодинамической системой и окружающими телами в результате теплообмена и совершаемой работы.
Состояние системы меняется, когда происходит процесс ее обмена теплом с окружающими объектами, и она совершает положительную или отрицательную работу. Изменяются макроскопические параметры системы, такие как температура, объем и давление. По причине того, что внутренняя энергия U всецело определяется макроскопическими параметрами, которые характеризуют состояние системы, процессы совершения работы и теплообмена провоцируют изменения внутренней энергии данной системы Δ U .
Определение 1 -го закона термодинамики
Первый закон термодинамики представляет собой некое обобщение закона сохранения и превращения энергии для термодинамической системы, и формулируется следующим образом:
Изменение Δ U внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q , переданной системе, и работой A , совершенной системой над внешними телами.
Формула первого закона термодинамики, зачастую записывается в ином виде:
Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами.
Первый закон термодинамики представляет из себя, по сути, обобщение опытных фактов. Если руководствоваться им, то можно заявить, что энергия не возникает и не исчезает бесследно, а передается от одной системы к другой, меняя свои формы. Невозможность создания вечного двигателя (perpetuum mobile) первого рода, то есть машины, которая может совершать полезную работу, не потребляя энергию извне и не претерпевая каких-либо изменений во внутренней конструкции агрегата, являлась важным следствием первого закона термодинамики. В подтверждение этого выступает тот факт, что каждая из огромного множества попыток создания такого устройства неизменно заканчивалась неудачей. Реальная машина может совершать положительную работу A над внешними объектами, только получая некоторое количество теплоты Q от окружающих тел или уменьшая Δ U своей внутренней энергии.
Первый закон термодинамики в процессах газов
Первый закон термодинамики может применяться к изопроцессам в газах.
В изохорном процессе, то есть в условиях неизменного объема ( V = c o n s t ) , газ не совершает работы, A = 0 .
В этом случае справедливой будет формула внутренней энергии газа:
Q = ∆ U = U ( T 2 ) - U ( T 1 ) .
В данном выражении U ( T 1 ) и U ( T 2 ) представляют внутренние энергии газа в начальном и конечном состояниях. Внутренняя энергия идеального газа зависит лишь от температуры, что исходит из закона Джоуля. При изохорном нагревании газ поглощает тепло ( Q > 0 ) , чем провоцирует увеличение его внутренней энергии. В условиях охлаждения тепло отдается внешним объектам ( Q 0 ) .
В изобарном процессе, предполагающем постоянность значения давления ( p = c o n s t ) , работа, совершаемая газом, выражается в виде соотношения:
A = p ( V 2 - V 1 ) = p ∆ V .
Первый закон термодинамики для изобарного процесса дает:
Q = U ( T 2 ) - U ( T 1 ) + p ( V 2 - V 1 ) = ∆ U + p ∆ V .
При изобарном расширении Q > 0 тепло поглощается газом, и он совершает положительную работу. При изобарном сжатии Q 0 тепло переходит внешним телам. В таком случае A 0 . При изобарном сжатии уменьшаются температура газа T 2 T 1 и значение внутренней энергии Δ U 0 .
В изотермическом процессе температура газа не меняет своей величины, следовательно, не изменяется и внутренняя энергия газа, Δ U = 0 .
Первый закон термодинамики для изотермического процесса выражается соотношением
Теплота Q , приобретенная газом в процессе изотермического расширения, превращается в работу, совершаемую над внешними объектами. И наоборот, изотермическое сжатие приводит к преобразованию уже работы внешних сил, произведенной над газом, в передающееся окружающим телам тепло.
Вместе с изохорным, изотермическим и изобарным процессами в термодинамике нередко исследуют процессы, происходящие в условиях отсутствующего теплообмена с окружающими объектами.
Адиабатическая оболочка – это сосуд с теплонепроницаемыми стенками.
Процессы сжатия или расширения газа в подобных емкостях называют адиабатическими.

Рисунок 3 . 9 . 2 . Модель адиабатического процесса.
В адиабатическом процессе Q = 0 . По данной причине первый закон термодинамики принимает вид:
Выходит, что газ производит работу за счет падения значения его внутренней энергии.
Расширение или сжатие газа на плоскости p , V проиллюстрирована кривой, называемой адиабатой.
В процессе адиабатического расширения газом совершается положительная работа A > 0 , что является причиной понижения значения внутренней энергии Δ U 0 . Данное явление провоцирует падение его температуры. Исходя из этого, можно заявить, что величина давления газа при адиабатическом расширении понижается быстрее, чем это происходит в изотермическом (рис. 3 . 9 . 3 ).

Рисунок 3 . 9 . 3 . Семейства изотерм (красные кривые) и адиабат (синие кривые) идеального газа.
В условиях координат ( p , V ) выводящееся в термодинамике уравнение адиабатического процесса для идеального газа принимает следующий вид:
p V γ = c o n s t .
Данное выражение, в котором γ = C p C V – показатель адиабаты, C p и C V – теплоемкости газа в процессах с постоянным давлением и с постоянным объемом, называется уравнением Пуассона. В условиях одноатомного газа γ = 5 3 = 1 , 67 , двухатомного γ = 7 5 = 1 , 4 , многоатомного γ = 1 , 33 .
Работа газа в адиабатическом процессе выражается через температуры начального T 1 и конечного T 2 состояний и принимает вид:
A = C V ( T 2 - T 1 )
Адиабатический процесс относится к изопроцессам.
В термодинамике важное место занимает физическая величина, называемая энтропией. Изменение энтропии в том или ином квазистатическом процессе эквивалентно некоторому обретенному системой теплу Δ Q T . Так как на каждом участке адиабатического процесса Δ Q = 0 , энтропия в нем не претерпевает изменений.
Любые изопроцессы, в том числе и адиабатические, являются квазистатическими. Промежуточные состояния газа в таких процессах близки к состояниям термодинамического равновесия. Каждая точка, принадлежащая адиабате, описывает равновесное состояние. Однако, процесс, который проводится в адиабатической оболочке, то есть при отсутствующем теплообмене с окружающими объектами, не обязательно удовлетворяет данному условию.
Примером неквазистатического процесса, в котором промежуточные состояния не находятся в состоянии равновесия, служит расширение газа в пустоту. На рисунке 3 . 9 . 3 иллюстрируется жесткая адиабатическая оболочка, состоящая из двух разделенных вентилем K сообщающихся емкостей. В изначальном состоянии газом заполнен один из сосудов, в это же время во втором находится лишь вакуум. Открытие вентиля запускает процесс расширения газа. Он заполняет оба сосуда, и устанавливается новое равновесное состояние.
В таком процессе Q = 0 , по той причине, что исключен теплообмен с окружающими телами, и A = 0 , так как оболочка недеформируема. Первый закон термодинамики позволяет сказать, что Δ U = 0 , то есть внутренняя энергия газа не претерпела никаких изменений. Так как внутренняя энергия идеального газа зависит лишь от температуры, температура газа в начальном и конечном состояниях одинакова. Изображающие эти состояния точки на плоскости ( p , V ) лежат на одной изотерме. Все промежуточные состояния газа не являются равновесными и не могут быть изображены на диаграмме.
Расширение газа в пустоту – пример необратимого процесса. Его нельзя провести в противоположном направлении.
Первый закон термодинамики - есть закон сохранения энергии: при любых физических взаимодействиях энергия не возникает и не исчезает, а только передается от одних тел другим или превращается из одной формы в другую.
Общая форма закона сохранения и превращения энергии имеет вид


Но изучая тепловые процессы, мы будем рассматривать формулу
Согласно первому закону термодинамики, изменение внутренней энергии термодинамической системы при переходе из одного состояние в другое равно сумме работы, выполненной внешними силами, и количества теплоты, переданной системе извне
Сформулировать первый закон термодинамики можно иначе: количество теплоты, получаемое системой извне при ее переходе из одного состояния в другое, расходуется на повышение внутренней энергии системы и на работу, которую она выполняет против внешних сил

Например, вы кипятите чайник с водой. Количество тепла расходуется на их нагревание (увеличивается энергия частиц, то есть внутренняя энергия системы), а затем происходит приподнимание крышки - это работа, которую выполняет система.
Внешняя работа над системой равна работе системы, но с противоположным знаком

Адиабатический (адиабатный) процесс
Процесс при тепловой изоляции системы от окружающей среды, то есть

Изменение внутренней энергии происходит только за счет работы внешних сил. Или совершаемая системой работа происходит за счет убыли внутренней энергии.
Практически все реальные процессы происходят с теплообменом: адиабатические процессы - это редкое исключение.
Первый закон термодинамики для изопроцессов
При изотермическом процессе температура не изменяется, значит не изменяется внутренняя энергия
Первый закон принимает вид
Все количество теплоты, которую получает газ расходуется на выполнение им работы против внешних сил. Или, если газ сжимается, при этом не изменяется температура, работу выполняют внешние силы, а газ отдает некоторое количество теплоты в окружающую среду.
При изохорном процессе объем не изменяется, значит работа нулевая
Первый закон термодинамики принимает вид
Если газ изохорно охлаждается, его внутренняя энергия уменьшается, и он отдает теплоту в окружающую среду.
Читайте также:
- Какие уроки человечество должно извлечь из второй мировой войны кратко
- Какие сведения содержит пояснительная записка к проекту 7 класс технология ответ кратко
- Презентация мини музей в доу как средство патриотического воспитания дошкольников
- Что такое рисунок кратко
- Консультация организация проектной деятельности в доу с учетом фгос

