Медь цинк хром железо марганец как простые вещества их физические и химические свойства кратко
Обновлено: 07.07.2024
Перечень вопросов, рассматриваемых в теме: урок посвящён изучению основных металлов побочной подгруппы или Б-группы: меди, цинка, титана, хрома, железа, никеля и платины, их физическим и химическим свойствам, способам получения и применению.
Катализатор – вещество, которое ускоряет химическую реакцию.
Пассивация – переход металла в неактивное состояние из-за образования на его поверхности оксидной плёнки. Может усиливаться концентрированными кислотами.
Проскок электрона – отступление от общей для большинства элементов последовательности заполнения электронных оболочек.
Хромирование/никелирование – покрытие поверхности металла другим, более устойчивым, для предотвращения коррозии.
Цинковая обманка (ZnS) – сложно идентифицируемое соединение цинка, подверженное сильному влиянию примесей на ее внешний вид.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Медь является металлом, расположенным в I группе побочной подгруппе и имеет следующую электронную конфигурацию:

Рисунок 1 – Электронная конфигурация атома меди
Мы видим, что у меди наблюдается проскок электрона – отступление от общей для большинства элементов последовательности заполнения электронных оболочек. По принципу наименьшей энергии электронные орбитали должны заполняться в следующем порядке:
1s → 2s → 2p → 3s → 3p → 4s → 3d …
Но для некоторых атомов энергетически более выгодно иметь наполовину (5 электронов, дальше увидим у хрома) или полностью заполненную (10 электронов, как у меди) 3d-орбиталь.
Медь имеет две валентности: 1 и 2 и проявляет степени окисления +1 и +2.
Медь обладает следующими физическими свойствами
Таблица 1 – Основные физические свойства меди
Тягучая, вязкая, легко прокатывается
Температура плавления, °С
Нахождение в природе
В природе медь встречается в самородном виде, а также в составе некоторых минералов:
Способы получения меди
Основными способами получения меди являются:
- Восстановление коксом и оксидом углерода (II). Таким образом получают медь из куприта:
Cu2O + С = 2Сu + CO
- Обжиг в специальных печах до оксидов. Данный способ подходит для сульфидных и карбонатных руд.
- Электролиз. Единственный из перечисленных способов, который позволяет получить медь без примесей.
При комнатной температуре медь не вступает в реакции с большинством соединений. При повышенной температуре ее реакционная способность резко возрастает.
Реакции с простыми веществами:
Реакции со сложными веществами:
Широкое применение находит как сама медь, так и её соединения. В чистом виде она используется для производства проводов, кабелей, теплообменных аппаратов, а также входит в состав многих сплавов.
Соединения меди, например, медный купорос CuSO4∙5H2O используется для защиты растений, а гидроксид меди является качественным реагентом для определения альдегидной группы у органических соединений, а также наличия глицерина (дает голубое окрашивание раствора).
Цинк является металлом, расположенным в II группе побочной подгруппе, и имеет следующую электронную конфигурацию:

Рисунок 2 – Электронная конфигурация атома цинка
В связи с тем, что 4s-орбиталь заполнена, цинк может находиться в единственной степени окисления, равной +2.
Цинк обладает следующими физическими свойствами
Таблица 2 – Основные физические свойства цинка
Температура плавления, °С
Нахождение в природе
В природе цинк встречается только в связанном состоянии, а именно в цинковом шпате ZnCO3 и цинковой обманке ZnS. Свое название цинковая обманка получила за то, что его сложно идентифицировать, поскольку он может выглядеть совершенно по-разному: быть различного цвета и структуры в зависимости от посторонних примесей.
Способы получения цинка
Чистый цинк получают обжигом с последующим восстановлением:
Цинк является довольно устойчивым металлом, поскольку на воздухе покрывается оксидной пленкой, и в дополнение практически не взаимодействует с водой при нормальных условиях. Но так же, как и медь, становится более активным при повышении температуры.
Реакции с простыми веществами:
Реакции со сложными веществами:
Цинк является коррозионно-устойчивым металлом, поэтому он нашёл применение в производстве защитных покрытий металлов, гальванических элементов, а также как компонент сплавов.
Титан является элементом IV группы побочной подгруппы и имеет следующее электронное строение:

Рисунок 3 – Электронная конфигурация атома титана
Данная конфигурация позволяет атому титана проявлять две степени окисления: +2 и +4.
Титан обладает следующими физическими свойствами:
Таблица 3 – Основные физические свойства титана
Высокая прочность и взякость
Температура плавления, °С
Нахождение в природе
В природе титан можно найти в составе таких минералов, как:
Способы получения титана
В связи с тем, что в природе не существует титановых руд, человеку приходится извлекать его путём хлорирования рудных концентратов с их последующим восстановлением с помощью магния или натрия.
Для удаления примесей магния и его соли полученную смесь продуктов нагревают под вакуумом.
Реакции с простыми веществами:
Азотная кислота действует на титан только в форме порошка, в то время как разбавленная серная кислота реагирует с металлом:
Титан и его сплавы отличает не только коррозионная стойкость, но и лёгкость, прочность. В связи с этим он активно используется при построении космических ракет, самолётов, подлодок и морских судов. Титан не взаимодействует с тканями организмов, из-за чего используется в хирургии.
Хром находится в IV группе побочной подгруппе и имеет следующее электронное строение:

Рисунок 4 – Электронная конфигурация атома хрома
Так как для атома хрома энергетически более выгодно иметь наполовину заполненную 3d-орбиталь, у него, как и у меди, наблюдается проскок электрона, что позволяет ему находиться в степенях окисления от +1 до +6, но наиболее устойчивыми являются +2, +3, +6.
Хром обладает следующими физическими свойствами:
Таблица 4 – Основные физические свойства хрома
Серебристо-белый с металлическим блеском
Температура плавления, °С
Нахождение в природе
В природе большая часть хрома заключена в составе хромистого железняка Fe(CrO2)2. Иногда может встречаться в виде оксида хрома (III) и других соединениях.
Способы получения хрома
Из хромистого железняка путем восстановлением углем при высоких температурах получают смесь железа и хрома – феррохром:
FeO + Cr2O3 + 3C = Fe + 2Cr + 3CO↑
Для получения чистого хрома проводят восстановление оксида хрома (III) алюминием:
Как и все вышеописанные металлы, хром покрыт оксидной плёнкой, которую трудно растворить даже сильными кислотами. Благодаря ней он обладает высокой стойкости к коррозии, поэтому начинает реагировать с разбавленными растворами кислот лишь спустя время. Концентрированные кислоты, такие как HNO3 и H2SO4, пассивируют оксидную пленку (укрепляют ее).
Благодаря своей коррозионной стойкости, хром используют в качестве защитных покрытий (хромируют поверхности металлов и сплавов). Также используется для создания легированных сталей, речь о которых пойдет в следующем уроке.
Железо – металл, с которым мы чаще всего сталкиваемся в нашей жизни, поэтому переоценить его значимость для человека невозможно. Он является самым распространенным после алюминия и составляет 5% земной коры. Теперь перейдем к рассмотрению его строения и свойств.
Железо находится в VII группе Б-подгруппе и имеет такое электронное строение, которое позволяет ему находиться в двух степенях окисления: +2 и +3. Конечно, в теории железо может выступать в качестве шестивалентного металла, но из-за пространственных затруднений ему не удается образовать такое количество связей. Поэтому такое состояние является неустойчивым для данного металла.

Медь находится в четвертом периоде, группе IБ. Ее электронная формула 29 Cu 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 , наиболее устойчивые степени окисления +2 и +1. Медь в промышленности получают пирометаллургическим методом, что можно описать следующим уравнением:

Полученную медь называют черновой (содержание меди 95–98%). Затем медь подвергают электролитическому рафинированию для получения меди высокой чистоты. Металл малой активности, в ряду напряжений металлов медь расположена после водорода. Ее химические свойства:

Йодид меди (II) не существует. Попытки получить его реакциями обмена приводят к иодиду меди (I) и йоду, например:

В электрохимическом ряду напряжений металлов медь расположена после водорода, поэтому с разбавленной соляной кислотой она не реагирует. Однако с концентрированной соляной кислотой она взаимодействует с образованием дихлоркупрата (I) водорода:

Кроме того, медь способна взаимодействовать с соляной кислотой в присутствии кислорода воздуха:

Медь образует оксиды состава Cu2O, CuO. Первый проявляет основные, а второй амфотерные с преобладанием основных свойства. Оба оксида легко восстанавливаются до меди под действием различных восстановителей:

Гидроксид меди (II) Cu(OH)2 разлагается при нагревании, проявляет амфотерные свойства с преобладанием основных:

Серебро находится в пятом периоде, группе IБ. Его электронная формула 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 1 . В промышленности серебро получают комплексной переработкой полиметаллических руд. Химические реакции, характерные для серебра:


Оксид серебра Ag2O — термически нестабильный, типичный основный оксид. Его химические свойства:

Цинк находится в четвертом периоде, группе IIБ. Его электронная формула 30 Zn 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 . В промышленности цинк получают либо электролизом водного раствора его сульфата, либо пирометаллургическим методом: сернистые руды подвергают обжигу с последующим восстановлением оксида цинка коксом:

Цинк относится к металлам средней активности, в своих соединениях проявляет единственную степень окисления +2. Характерные для цинка химические реакции:

Особенностью цинка являются его реакции с серной и азотной кислотами различной концентрации. При этом в зависимости от концентрации кислот образуются различные продукты реакции:

Оксид и гидроксид цинка являются амфотерными. Их характерные реакции:

Хром расположен в четвертом периоде, группе VIБ. Его электронная формула 24 Cr 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1 . Металл средней активности. В своих соединениях хром проявляет степени окисления +2, +3 и +6. В промышленности чистый хром получают восстановлением оксида хрома методом алюминотермии:

Его характерные химические реакции:


Хром образует ряд оксидов: CrO — основный оксид, Cr2O3 — амфотерный оксид, CrO3 — кислотный оксид, следовательно, рост степени окисления сопровождается усилением кислотных свойств. Все оксиды хрома вступают в окислительно-восстановительные реакции.
Ниже приведены характерные для этих соединений химические реакции:

Гидроксид хрома (III) проявляет амфотерные свойства, вступает в окислительно-восстановительные реакции:


Особо чистый марганец получают электролизом водного раствора сульфата марганца (II).
Химические свойства марганца:

Марганец образует пять оксидов: MnO, Mn2O3, MnO2, MnO3, Mn2O7. MnO проявляет основные свойства. Mn2O3 при взаимодействии с разбавленными растворами кислот диспропорционирует, а при нагревании с концентрированными растворами кислот выделяет кислород:

MnO2 не взаимодействует ни со щелочами, ни с разбавленными растворами кислот. С концентрированными кислотами при нагревании реагирует так же, как и Mn2O3:

Mn2O7 — единственный среди оксидов марганца, который является жидкостью при нормальных условиях. Кислотный оксид. Разлагается уже при температуре 55 °С, при ударе может взорваться.

Железо находится в четвертом периоде, группе VIIIБ. Его электронная формула 26 Fe 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2 . Металл средней активности, в своих соединениях проявляет степени окисления +2 и +3. Известны ряд соединений железа со степенью окисления +6. Они являются сильными окислителями. Химически чистое железо получают разложением его пентакарбонила:

Основная масса железа используется не в чистом виде, а в виде сплавов с углеродом (сталь, чугун) и другими элементами. Эти сплавы получают в доменных печах. Упрощенно этот процесс можно описать уравнением:

Характерные для железа химические реакции:

FeO проявляет основные, а Fe2O3 — амфотерные с преобладанием основных свойства. Оба оксида вступают в окислительно-восстановительные реакции:


Для двойного оксида железа (II) — железа (III) Fe3O4 (магнетит) характерны в первую очередь окислительно-восстановительные реакции, а также реакции обмена, которые идут также, как и у входящих индивидуально в его состав оксидов:

Гидроксид железа (II) практически проявляет только основные свойства, при нагревании разлагается, вступает в окислительно-восстановительные реакции:

Гидроксид железа (III) проявляет амфотерные с преобладанием основных свойства, при нагревании разлагается, вступает в окислительно-восстановительные реакции:

Йодид железа (III) не существует. Попытки получить его обменными реакциями приводят к йодиду железа (II) и йоду:
Кодификатор ЕГЭ. Раздел 1.2.3. Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов.
У атомов переходных элементов (меди, цинка, хрома и железа) происходит заполнение энергетического d-подуровня.
Рассмотрим строение электронной оболочки этих элементов. У атомов цинка и железа заполнение электронной оболочки происходит согласно энергетическому ряду орбиталей (подуровней), который рассмотрен в статье Строение атома. Электронная конфигурация атома железа:
+26Fe [Ar]3d 6 4s 2 [Ar] 4s 3d
У атома цинка на происходит полное заполнение 3d-подуровня:
+30Zn [Ar]3d 10 4s 2 [Ar] 4s 3d
Мы используем, конечно же, реальную электронную конфигурацию меди и хрома, теоретическая будет неверной.
Обратите внимание! У всех 3d-элементов внешним энергетическим уровнем считается четвертый уровень и 4s-подуровень. При образовании катионов атомы металлов отдают электроны с внешнего энергетического уровня.
| Атом | Электронная конфигурация | Характерные валентности | Число электронов на внешнем энергетическом уровне | Характерные степени окисления |
| Хром | [Ar]3d 5 4s 1 | II, III. VI | 1 | +2, +3, +6 |
| Железо | [Ar]3d 6 4s 2 | II, III. VI | 2 | +2, +3, +6 |
| Медь | [Ar]3d 10 4s 1 | I, II | 1 | +1, +2 |
| Цинк | [Ar]3d 10 4s 2 | II | 2 | +2 |
Рассмотрим характеристики хрома, железа, меди и цинка:
Свойства соединений железа, меди, цинка и хрома.
Для хрома характерны степени окисления +2, +3 и +6. Оксид и гидроксид хрома (II) (CrO и Cr(OH)2) проявляют основные свойства. Степени окисления +3 соответствуют амфотерные оксид и гидроксид: Cr2O3 и Cr(OH)3 соответственно. Соединения хрома +6 проявляют сильные кислотные свойства: оксид CrO3 и сразу две сильных кислоты: хромовая H2CrO4 и дихромовая H2Cr2O7. Соединения хрома (II) проявляют сильные восстановительные свойства, соединения хрома (VI) проявляют только сильные окислительные свойства.
Характерные степени окисления железа : +2 и +3. Оксид и гидроксид железа (II) — основные (FeO и Fe(OH)2), а соединения железа (III) проявляют амфотерные свойства (Cr2O3 и Cr(OH)3 соответственно) с преобладанием основных. Соединения железа (II) проявляют также восстановительные свойства.
Для меди характерны степени окисления +1 и +2. Оксид меди (I) CuO и гидроксид меди (I) CuOH — основные. Оксид и гидроксид меди (II) проявляют амфотерные свойства с преобладанием основных: CuO и Cu(OH)2.
Характерная степень окисления цинка +2. Соединения цинка (II) проявляют амфотерные свойства: ZnO и Zn(OH)2.
Твердый металл голубовато-белого цвета. Этимология слова "хром" берет начало от греч. χρῶμα — цвет, что связано с большим разнообразием цветов соединений хрома. Массовая доля этого элемента в земной коре составляет 0.02% по массе.

Для хрома характерны степени окисления +2, +3 и +6. У соединений, где хром принимает степень окисления +2, свойства основные, +3 - амфотерные, +6 - кислотные.
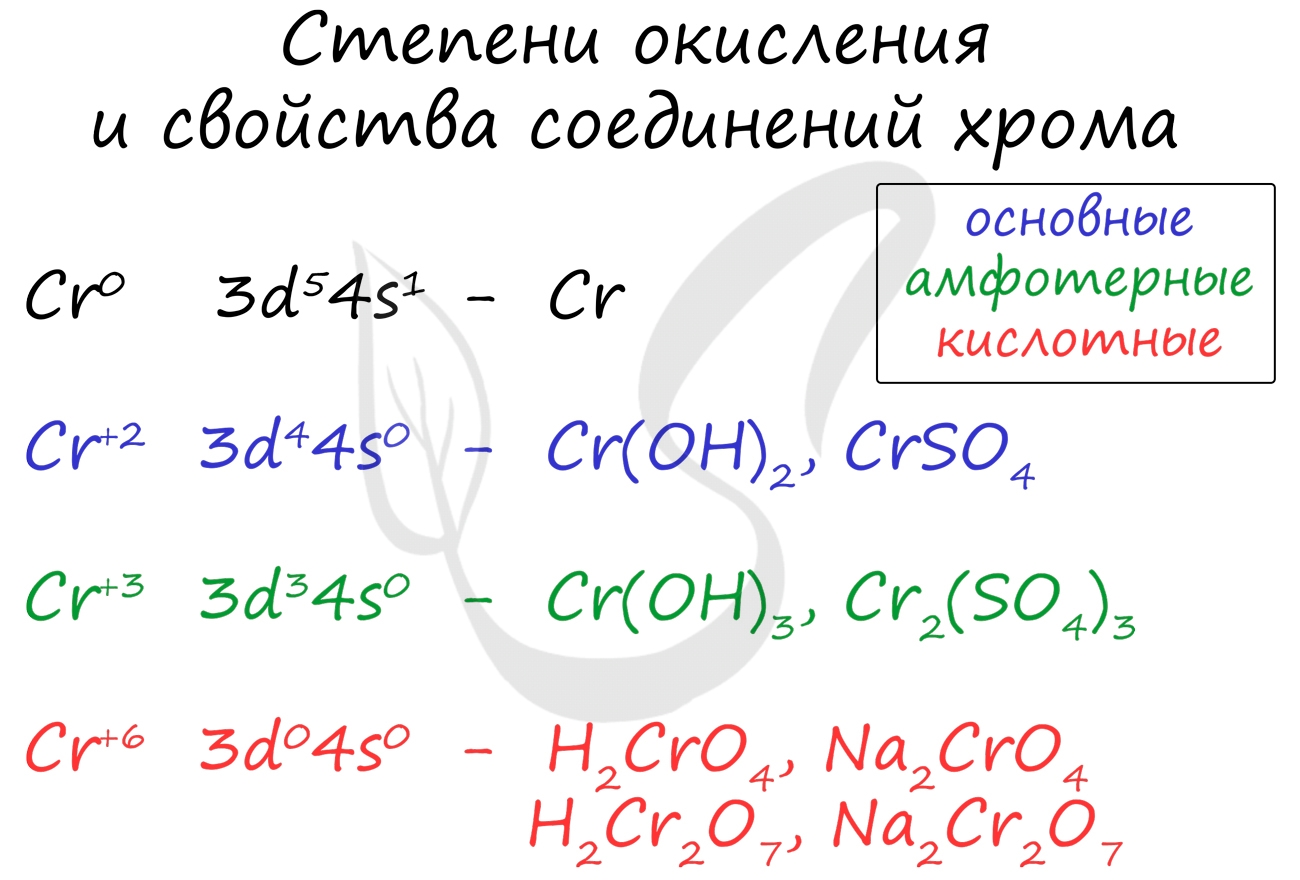
- Fe(CrO2)2 - хромистый железняк, хромит
- (Mg, Fe)Cr2O4 - магнохромит
- (Fe, Mg)(Cr, Al)2O4 - алюмохромит

В промышленности хром получают прокаливанием хромистого железняка с углеродом. Также применяют алюминотермию для вытеснения хрома из его оксида.
-
Реакции с неметаллами
Уже на воздухе вступает в реакцию с кислородом: на поверхности металла образуется пленка из оксида хрома (III) - Cr2O3 - происходит пассивирование. Реагирует с неметаллами при нагревании.

Протекает в раскаленном состоянии.

С холодными концентрированными серной и азотной кислотой реакция не идет. Она начинается только при нагревании.
Хром способен вытеснить из солей металлы, стоящие в ряду напряжений правее него.
Соединения хрома (II)
Соединение хрома (II) носят основный характер. Оксид хрома (II) окисляется кислородом воздуха до более устойчивой формы - оксида хрома (III), реагирует с кислотами, кислотными оксидами.

Гидроксид хрома (II), как нерастворимый гидроксид, легко разлагается при нагревании на соответствующий оксид и воду, реагирует с кислотами, кислотными оксидами.

Соединения хрома (III)
Это наиболее устойчивые соединения, которые носят амфотерный характер. К ним относятся оксид хрома (III) гидроксид хрома (III).

Оксид хрома (III) реагирует как с щелочами, так и с кислотами. В реакциях с щелочами при нормальной температуре (в растворе) образуются комплексные соли, при прокаливании - смешанные оксиды. С кислотами оксид хрома (III) образует различные соли.
H2O + NaOH + Cr2O3 → Na3[Cr(OH)6] (в растворе, гексагидроксохромат натрия)
Cr2O3 + 2NaOH → (t°) 2NaCrO2 + H2O (прокаливание, хромит натрия)
Cr2O3 + HCl = CrCl3 + H2O (сохраняем степень окисления Cr +3 )

Оксид хрома (III) реагирует с более активными металлами (например, при алюминотермии).
При окислении соединение хрома (III) получают соединения хрома (VI) (в щелочной среде).
Соединения хрома (VI)
В этой степени окисления хром проявляет кислотные свойства. К ним относится оксид хрома (VI) - CrO3, и две кислоты, находящиеся в растворе в состоянии равновесия: хромовая - H2CrO4 и дихромовая кислоты - H2Cr2O7.
Принципиально важно помнить окраску хроматов и дихроматов (часто она бывает дана в заданиях в качестве подсказки). Хроматы окрашивают раствор в желтый цвет, а дихроматы - в оранжевый цвет.

Хроматы переходят в дихроматы с увеличением кислотности среды (часто в реакциях с кислотами). Цвет раствора меняется с желтого на оранжевый.
Если же оранжевому раствору дихромата прилить щелочь, то он сменит свой цвет на желтый - образуется хромат.
Разложение дихромата аммония выглядит очень эффектно и носит название "вулканчик" :)
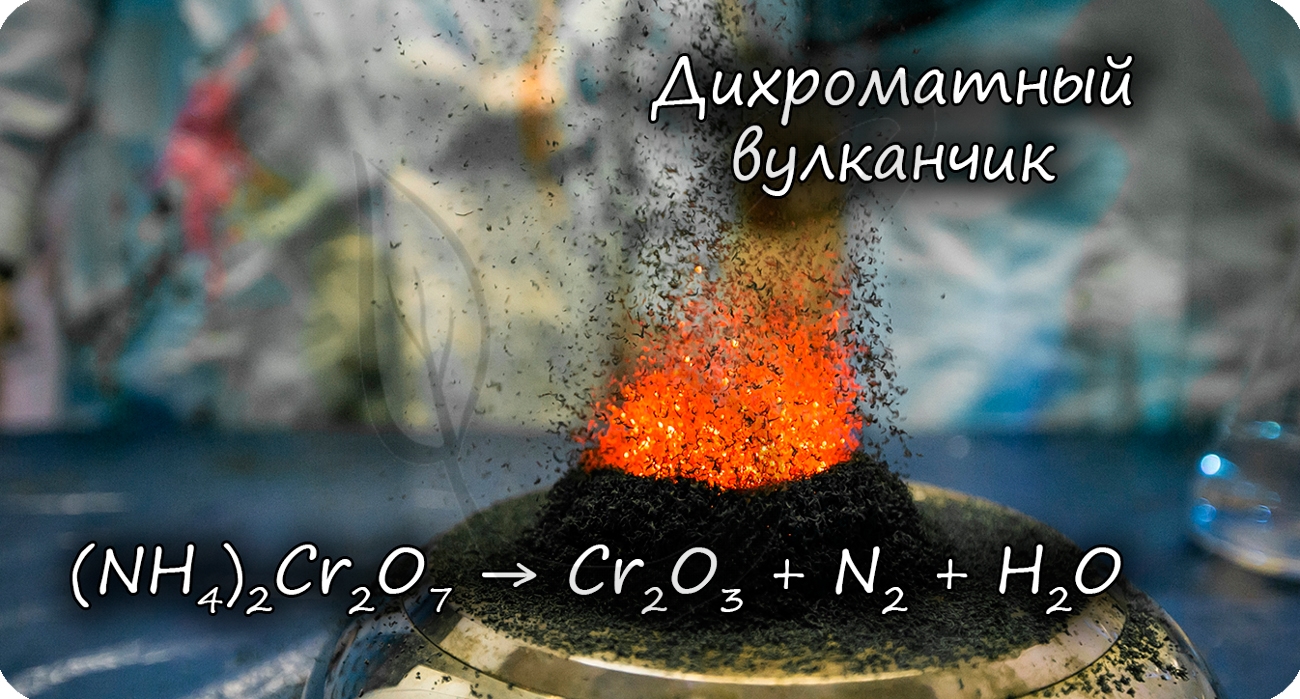
В степени окисления +6 соединения хрома проявляют выраженные окислительные свойства.
Железо
Является одним из самых распространенных элементов в земной коре (после алюминия), составляет 4,65% ее массы.

Для железа характерны две основные степени окисления +2, +3, +6.

- Fe2O3 - красный железняк, гематит
- Fe3O4 - магнитный железняк, магнетит
- Fe2O3*H2O - бурый железняк, лимонит
- FeS2 - пирит, серый или железный колчедан
- FeCO3 - сидерит

Получают железо восстановлением из его оксида - руды. Восстанавливают с помощью угарного газа, водорода.
Основными сплавами железа являются чугун и сталь. В стали содержание углерода менее 2%, меньше содержится P, Mn, Si, S. Чугун отличается бо́льшим содержанием углерода (2-6%), содержит больше P, Mn, Si, S.

-
Реакции с неметаллами
Fe + S = FeS (t > 700°C)
Fe + S = FeS2 (t 2+ в растворе является реакция с красной кровяной солью - K3[Fe(CN)6] - гексацианоферратом (III) калия. В результате реакции образуется берлинская лазурь (прусский синий).
Качественной реакцией на ионы Fe 2+ также является взаимодействие с щелочью (гидроксидом натрия). В результате выпадает осадок зеленого цвета.
Соединения железа (III) проявляют амфотерные свойства. Оксид и гидроксид железа (III) реагирует и с кислотами, и с щелочами.
Fe(OH)3 + KOH = K3[Fe(OH)6] (гексагидроксоферрат калия)
При сплавлении комплексные соли не образуются из-за испарения воды.
Гидроксид железа (III) - ржавчина, образуется на воздухе в результате взаимодействия железа с водой в присутствии кислорода. При нагревании легко распадается на воду и соответствующий оксид.

Качественной реакцией на ионы Fe 3+ является взаимодействие с желтой кровяной солью K4[Fe(CN)6]. В результате реакции образуется берлинская лазурь (прусский синий).
Реакция хлорида железа (III) с роданидом калия также является качественной, в результате нее образуется характерный раствор ярко красного цвета.

И еще одна качественная реакция на ионы Fe 3+ - взаимодействие с щелочью (гидроксидом натрия). В результате выпадает осадок бурого цвета.
Соединения железа (VI) - ферраты - соли несуществующей в свободном виде железной кислоты. Обладают выраженными окислительными свойствами.
Ферраты можно получить в ходе электролизом щелочи на железном аноде, а также действием хлора на взвесь Fe(OH)3 в щелочи.

Один из первых металлов, освоенных человеком вследствие низкой температуры плавления и доступности получения руды.

Основные степени окисления меди +1, +2.

- CuFeS2 - медный колчедан, халькопирит
- Cu2S - халькозин
- Cu2CO3(OH)2 - малахит

Пирометаллургический метод получения основан на получении меди путем обжига халькопирита, который идет в несколько этапов.
Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте и дальнейшем вытеснении меди более активными металлами, например - железом.

Медь, как малоактивный металл, выделяется при электролизе солей в водном растворе на катоде.
CuSO4 + H2O = Cu + O2 + H2SO4 (медь - на катоде, кислород - на аноде)
-
Реакции с неметаллами
Во влажном воздухе окисляется с образованием основного карбоната меди.
При нагревании реагирует с кислородом, селеном, серой, при комнатной температуре с: хлором, бромом и йодом.
4Cu + O2 = (t) 2Cu2O (при недостатке кислорода)
2Cu + O2 = (t) 2CuO (в избытке кислорода)

Медь способна реагировать с концентрированными серной и азотной кислотами. С разбавленной серной не реагирует, с разбавленной азотной - реакция идет.
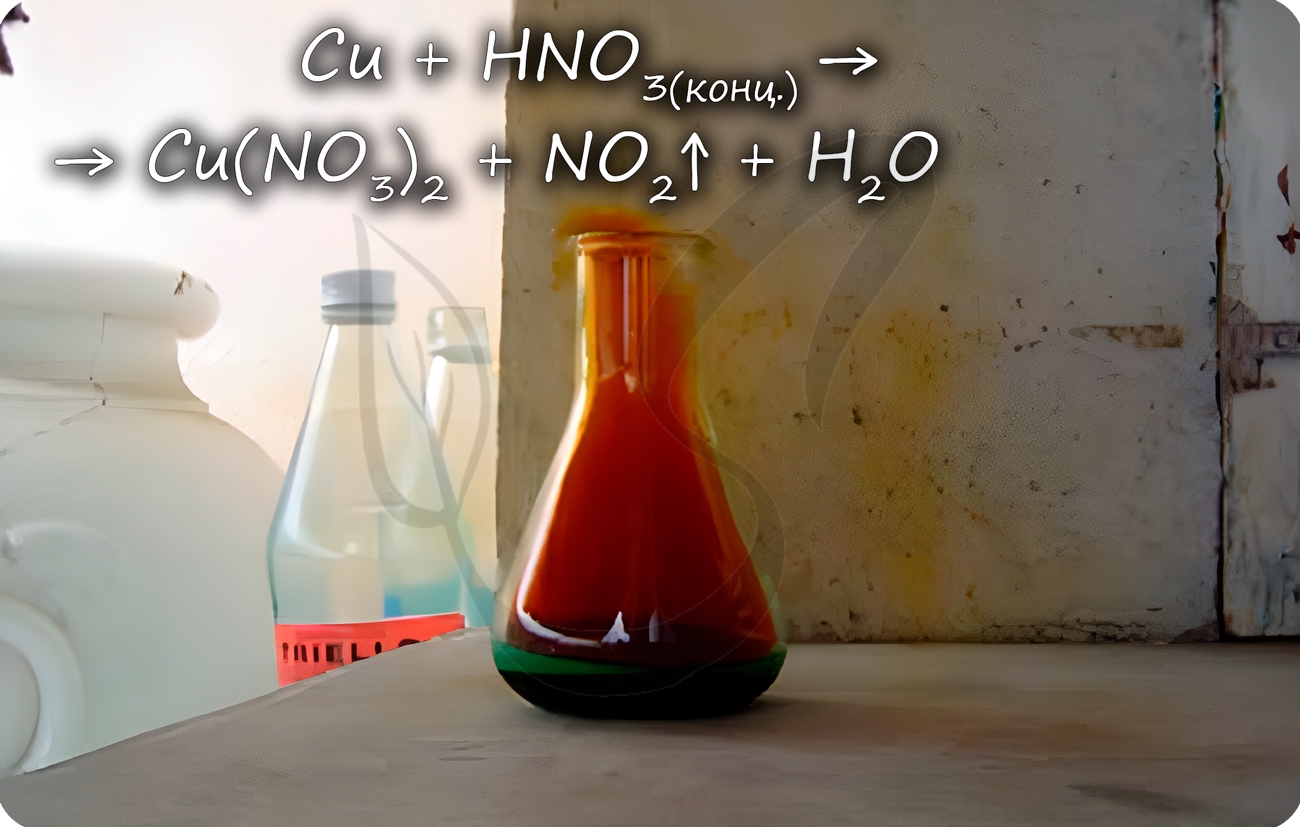
Реагирует с царской водкой - смесью соляной и азотной кислот в соотношении 1 объем HNO3 к 3 объемам HCl.
Медь способна восстанавливать неметаллы из их оксидов.
Cu + SO2 = (t) CuO + S
Cu + NO = (t) CuO + N2↑
Соединения меди I
В степени окисления +1 медь проявляет основные свойства. Соединения меди (I) можно получить путем восстановления соединений меди (II).
Оксид меди (I) можно восстановить до меди различными восстановителями: угарным газом, алюминием (алюминотермией), водородом.
Оксид меди (I) окисляется кислородом до оксида меди (II).
Оксид меди (I) вступает в реакции с кислотами.
Гидроксид меди CuOH неустойчив и быстро разлагается на соответствующий оксид и воду.
Соединения меди (II)
Степень окисления +2 является наиболее стабильной для меди. В этой степени окисления у меди есть оксид CuO и гидроксид Cu(OH)2. Данные соединения проявляют преимущественно основные свойства.
Оксид меди (II) получают в реакциях термического разложения гидроксида меди (II), реакцией избытка кислорода с медью при нагревании.
-
Реакции с кислотами
CuO + CO = Cu + CO2
Гидроксид меди (II) - Cu(OH)2 - получают в реакциях обмена между растворимыми солями меди и щелочью.

При нагревании гидроксид меди (II), как нерастворимое основание, легко разлагается на соответствующий оксид и воду.
Как сказано выше, гидроксид меди (II) носит преимущественно основный характер, однако способен проявлять и амфотерные свойства. В растворе концентрированной щелочи он растворяется, образуя гидроксокомлпекс.
Обратите особое внимание на реакцию взаимодействия соли меди (II) - сульфата меди (II), карбоната натрия и воды.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Читайте также:
- Анализ документов вто еэс оэср нато и др международных организаций в сфере глобализации кратко
- Почему антибиотики убивают клетки бактерий и не уничтожают клетки человека кратко
- Почему флора и фауна различаются на разных материках кратко
- В чем причины огромной трудоспособности сердца кратко
- Когнитивно поведенческая терапия что это простыми словами кратко и понятно

