Классификация органических веществ план урока 11 класс
Обновлено: 06.07.2024
Свидетельство и скидка на обучение каждому участнику
Зарегистрироваться 15–17 марта 2022 г.
Гидролиз неорганических и органических веществ
11 класс, базовый уровень
Цель урока: познакомить с сущностью гидролиза солей; научить составлять уравнения реакций гидролиза солей в молекулярном и ионном виде, определять среду водного раствора электролита.
Задачи:
Образовательные задачи:
-повторить понятие о диссоциации неорганических веществ;
-выработать умения по составлению уравнений гидролиза солей в молекулярном и ионном виде;
-выработать умения определять среду водного раствора электролита на основании состава соли;
Развивающие задачи :
-формирование умений анализировать, сопоставлять и обобщать знания по теме;
-совершенствовать логическое мышление;
-научить делать выводы.
Воспитательные задачи:
-воспитание осознанной потребности в знаниях;
-создать положительную мотивацию изучения химии через ознакомление учащихся с ролью гидролиза в жизни человека;
-проявлять творческий подход к выполнению заданий
Оборудование:
Интерактивная доска, слайды с заданиями для проверки первичного усвоения знаний, тестовые задания.
На столах обучающихся : штатив с пробирками, набор растворов солей, растворы индикаторов, мыло.
Тип урока – урок изучения нового материала, комбинированный.
1. Организационный момент.
2. Актуализация опорных знаний обучающихся.
- На предыдущем уроке мы с вами повторяли реакции ионного обмена в растворах электролитов.
-Вспомните, при каких условиях реакции ионного обмена протекают до конца.
3. Изучение нового материала .
А.Гидролиз неорганических веществ
Постановка проблемы.
Наш сегодняшний урок мы начнем с решения задачи
(Текст задачи-на интерактивной доске)
При сливании раствора, содержащего 0,1моль хлорида железа ( III ), с избытком раствора кальцинированной соды выделяется газ и выпадает осадок. Определить массу выпавшего осадка.
Задача решается на доске:
При записи уравнения реакции выясняется,(по таблице растворимости),что вещество Fe 2 ( CO ) 3 не существует или разлагается водой
Выполнение лабораторного опыта
(Повторение правил техники безопасности)
Ученики выполняют химический эксперимент: сливают растворы хлорида железа ( III ) и карбоната натрия.
Признаки реакции: выделяется бесцветный газ и выпадает осадок коричневого цвета
-Но по уравнению реакции газ невыделялся, а осадка Fe 2 ( CO ) 3 - не существует!
-Следовательно, мы что-то не учли, составляя уравнение реакции к задаче
Формулировка темы урока
Обучающиеся выписывают из учебника определение, что такое гидролиз.
Вспомним, что вода – слабый электролит и в чистой воде происходит процесс: НОН ↔ Н + + ОН – и существует равенство концентрации:
[ H + ] = [ OH – ] = 10 – 7 моль/л, pH = 7, среда нейтральная (индикатор лакмус остаётся фиолетовым).
-Что произойдет, если к дистиллированной воде прибавить НС l ? (Концентрация (ОН - ) останется прежней, зато концентрация (Н + ) увеличится.) Какая будет среда? Записываем ответ на доске: (Н + ) > (ОН - ) – среда кислая(индикатор лакмус становится красным).
- Какая будет среда, если в дистиллированной воде растворить гидроксид натрия? Почему? (Н + ) - ) – среда щелочная (индикатор лакмус становится синим).
Изменится ли значение водородного показатель среды, если в воде растворить соль?
Далее с помощью лакмусовой бумажки обучающиеся лабораторным путём проверяют характер среды растворов AlCl 3 , Na 2 CO 3 и NaCl и убеждаются , что среда в растворе AlCl 3 -кислая, pH Na 2 CO 3 -щелочная, pH >7 и только в растворе NaCl -нейтральная
Какой вывод мы можем сделать на основе этих наблюдений?
Выслушиваются мнения обучающихся, обобщаются, и далее учитель объясняет новый материал, предлагая алгоритм составления уравнений гидролиза солей(На интерактивной доске).
Алгоритм составления гидролиза солей, образованных слабым основанием и сильной кислотой.
1.Составить уравнение диссоциации соли, определить ион слабого электролита.
AlCl 3 ↔ Al 3+ +3Cl -
Al 3+ - катион алюминия, слабое основание, гидролиз по катиону.
2.Составить уравнение его взаимодействия с водой, определить продукты гидролиза в виде ионов.
Al 3+ +H + OH − ↔ (AlOH) 2+ +H +
3.Сделать вывод о среде электролита. Среда кислая, т.к. [ H + ]>[ OH − ].
4.Составить уравнение в молекулярном и ионном виде.
Al Cl 3 + HOH ↔ ( AlOH ) 2+ Cl 2 + HCl
Al 3+ +3 Cl − + HOH ↔ ( AlOH ) 2+ +3 Cl − + H +
Al 3+ + HOH ↔ ( AlOH ) 2+ + H +
Алгоритм составления гидролиза солей, образованных сильным основанием и слабой кислотой
1 . Na 2 CO 3 ↔ 2 Na + + CO 2− 3
CO 2− 3 – карбонат-анион, слабая кислота, гидролиз по аниону.
2 . CO 2− 3 + HOH ↔ HCO − 3 + OH −
3.Среда щелочная, т.к. [ OH − ]> [ H + ]
4 .Na 2 CO 3 + HOH ↔ NaHCO 3 +NaOH
2Na + + CO 2− 3 +H + OH − ↔ HCO − 3 + 2Na ⁺ +OH −
CO 2− 3 + HOH ↔ HCO − 3 + OH −
Соли, образованные слабой кислотой и слабым основанием, гидролизу не подвергаются
Na + + Cl – + HOH ↔ Na + + OH – + H + + Cl –
HOH ↔ OH – + H +
pH=7, [H + ] = [OH – ]. Среда нейтральная .
Далее учитель предлагает вернуться к задаче.
-Чем образована соль Fe 2 ( CO ) 3 ?
(Слабым основанием и слабой кислотой)
-Что же в таком случае происходит ?
Обратимся за помощь к тексту учебника на странице 96 . (Учащиеся читают текст учебника и выписывают уравнение реакции гидролиза карбоната алюминия).
Такому же необратимому гидролизу подвергается соль карбоната железа ( III ): Fe 2 ( CO 3 ) 3 + 3 HOH → 2 Fe ( OH ) 3 ↓+ 3 CO 2 ↑
Разрешение проблемы (решение задачи).
На доске правильно записывается уравнение реакции с учётом необратимого гидролиза, и решение задачи:
n ( Fe ( OH ) 3 ) = n ( FeCl 3 ) = 0,1 моль .
m ( Fe ( OH ) 3 ) = M x n = 107 x 0,1 = 10,7 г.
Ответ: масса осадка 10,7г.
Полному необратимому гидролизу также подвергаются такие бинарные
Соединения как карбиды, галогениды, фосфиды.
Б.Гидролиз органических веществ
Учитель предлагает вспомнить гидролиз сложных эфиров, жиров и углеводов и записать уравнения реакций на примере гидролиза этилацетата, крахмала и целлюлозы.В случае,если обучающиеся испытывают затруднения, предлагается воспользоваться учебником, с.93.
4. Первичное закрепление пройденного материала .
Устные вопросы:
Что такое гидролиз?
На какие группы мы разделили все соли?
Как происходит гидролиз каждой группы?
Выполнение тестовых заданий:
1. Гидролизу в водном растворе не подвергается
1) карбонат натрия
2) фосфат натрия
3) сульфид натрия
4) нитрат натрия
2. Среда раствора фосфата калия
1) щелочная 2) кислая 3) слабокислая 4)нейтральная
3. Среда раствора хлорида цинка
1) щелочная 2) кислая 3) слабощелочная 4) нейтральная
4 . Установите соответствие между формулой соли и типом гидролиза.
5. Установите соответствие между названием соли и способностью ее к гидролизу.
г) Гидросульфат натрия.
4) Гидролизу не подвергается.
6. Установите соответствие между названием соли и средой ее водного раствора.
г) Сульфид лития.
7. Установите соответствие между формулой соли и молекулярно-ионным уравнением гидролиза

Образовательная – изучить классификацию органических соединений, общие формулы, функциональные группы.
Развивающая – развивать знания учащихся по основным классам органическим соединениям.
Воспитательная – воспитывать культуру речи.
КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ.
Образовательная – изучить классификацию органических соединений, общие формулы, функциональные группы.
Развивающая – развивать знания учащихся по основным классам органическим соединениям.
Воспитательная – воспитывать культуру речи.
Тип урока: репродуктивный
Ход урока: 1) Организационный момент
2) Классификация органических соединений
А) ациклические соединения (не содержат замкнутых цепей);
Б) карбоциклические соединения (содержат циклы);
В) гетероциклические соединения (замкнутая цепь с другими атомами).
Функциональная группа – группа атомов, которая определяет наиболее характерные химические свойства вещества и его принадлежность к определенному классу.
Ациклические соединения – органические соединения, состоящие из нормальных и разветвленных цепей.
1. Алканы – углеводороды, в молекулах которых атомы связаны одинарными связями и соответствующие общей формуле:
2.Алкены – углеводороды, содержащие в молекуле двойную связь (=) и соответствующие общей формуле:
3. Алкадиены – углеводороды, содержащие в молекуле две двойные связи (=, =) и соответствующие общей формуле:
4.Алкины – углеводороды, содержащие в молекуле одну тройную связь и соответствующие общей формуле:
5. Галогенопроизводные углеводороды – органические соединения, содержащие в молекуле, кроме атомов углерода и водорода, атомы галогена:
6. Спирты – углеводороды, содержащие функциональную группу спиртов (- ОН):
R – OH
7. Альдегиды – углеводороды, содержащие карбонильную группу и соответствующие общей формуле:


8. Кетоны – углеводороды, содержащие карбонильную группу и соответствующие общей формуле:
R – C – R
9. Карбоновые кислоты – углеводороды, содержащие карбоксильную группу:


R – C
10. Простые эфиры – продукт замещения атома водорода в гидроксильной группе спиртов на у/в радикал
R – O – R
11. Сложные эфиры – у/в содержащие сложноэфирную группу
R – C
O - R
12. Нитросоединения – у/в, содержащие нитрогруппу (- NO2)

В этом видеофрагменте собран материал по основным признакам классификации органических веществ, приведены примеры названия веществ по тривиальной, международной номенклатуре ИЮПАК.
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Классификация органических веществ"
Существует несколько критериев классификации органических соединений.
1. Классификация по составу. Согласно этой классификации, все органические вещества делятся на: углеводороды, которые состоят только из атомов углерода и водорода, например, в молекуле пропана содержатся только атомы углерода и водорода; кислородсодержащие соединения, которые состоят не только из атомов углерода и водорода, но и ещё и из кислорода, например, спирт этанол содержит атомы углерода, водорода и кислорода. Азотсодержащие соединения содержат кроме углерода и водорода ещё и атомы азота, как в молекуле метиламина есть атомы углерода, водорода и азота.
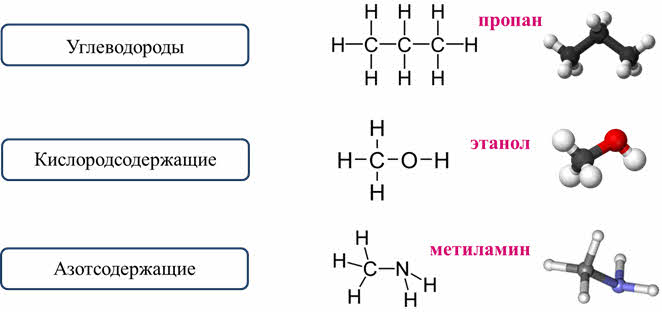
Но такая классификация является неточной, потому что в одну группу могут попадать вещества, имеющие совершенно разные свойства. Например, диметиловый эфир, как и этанол является кислородсодержащим соединением, но диметиловый эфир относится к классу простых эфиров и представляет собой газ, а этанол относится к классу спиртов и представляет собой жидкость.

Поэтому более совершенной классификацией является классификация по строению. В этой классификации можно ещё выделить несколько признаков классификации: по типу скелета молекулы, по наличию (или отсутствию) в молекуле кратных связей и бензольных колец, по наличию (или отсутствию) функциональных групп.
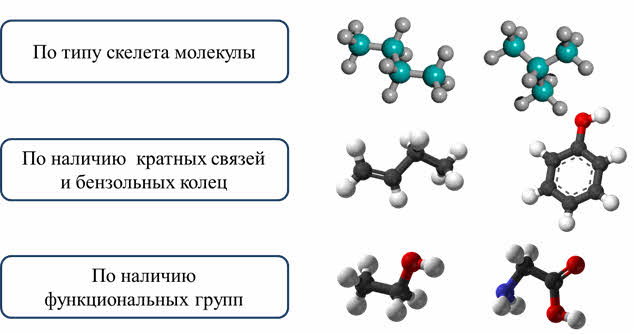
Разберём классификацию веществ по типу скелета молекулы. Как известно, в состав молекул, кроме атомов углерода и водорода, могут входить атомы O, S, N.
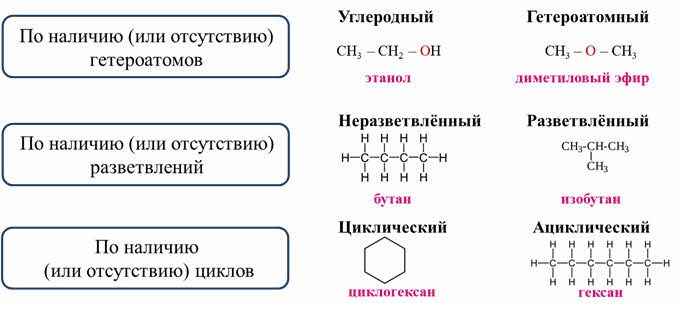
Поэтому по наличию или отсутствию гетероатомов различают скелет молекулы углеродный и гетероатомный. Так в молекуле этанола скелет считается углеродным, потому что атом кислорода не включён в скелет молекулы, а в молекуле диметилового эфира атом кислорода включён в скелет молекулы, поэтому его скелет считается гетероатомным.
Скелет молекулы может быть неразветвлённым, когда все атомы углерода соеденены последовательно, как в молекуле бутана, а также разветвлённым, как в молекуле изобутана.
Цепь из атомов углерода может быть замкнутой, тогда эту систему называют циклом, или цепь может быть незамкнутой, тогда такую молекулу называют ациклической (алифатической). Например, циклической является молекула циклогексана, а молекула гексана, является ациклической.
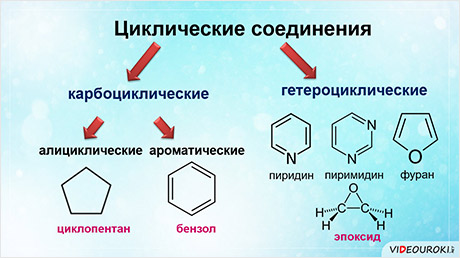
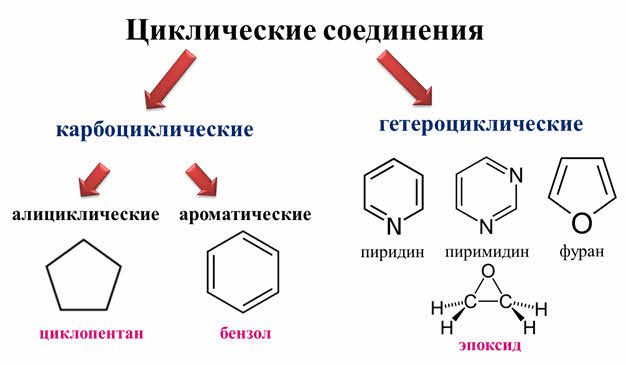
В свою очередь, циклические соединения бывают карбоциклическими и гетероциклическими.
Карбоциклические соединения делят на алициклические, в циклах которых содержатся атомы углерода (например, молекула циклопентана) и ароматические, у которых есть ещё ароматическое кольцо, как в молекуле бензола.
Гетероциклические соединения в цикле вместо атомов углерода содержат атом или несколько атомов других химических элементов. К таким соединениям относят пиридин и пиримидин, в циклах которых содержатся атомы азота, а также фуран и эпоксид, в их циклах кроме атомов углерода содержатся атомы кислорода.
Ещё одним признаком классификации является наличие (или отсутствие) в молекуле кратных связей и бензольных колец. Алифатические соединения не содержат бензольных колец, их иногда ещё называют соединениями жирного ряда. Но от того содержат они кратные связи или нет их подразделяют на предельные, или насыщенные и на непредельные, или ненасыщенные.
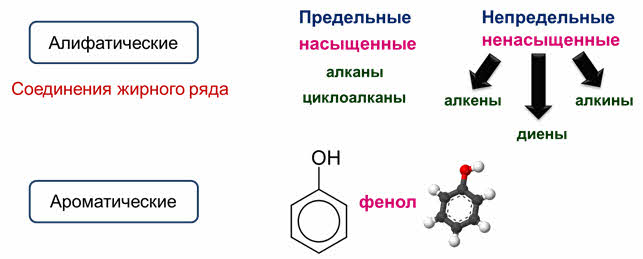
Предельные, или насыщенные соединения содержат только простые (одинарные) связи, к таким соединениям относятся алканы и цикоалканы, а непредельные, или ненасыщенные содержат кроме простых ещё и кратные связи – двойные или тройные, к ним относятся алкены, алкины и диены.
Ароматические соединения содержат бензольное кольцо, например, фенол является ароматическим соединением.
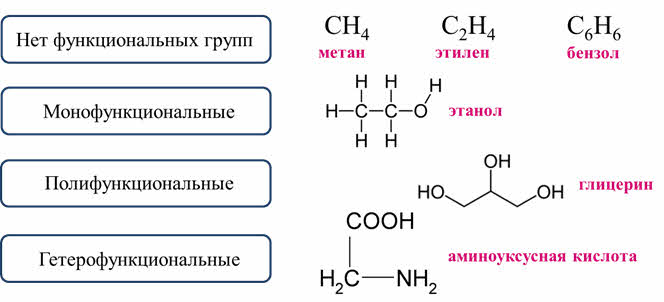
Есть ещё и классификация соединений по наличию (или отсутствию) функциональных групп. Есть вещества, которые не содержат функциональных групп, как метан, этилен, бензол, а есть вещества, которые содержат одну или несколько функциональных групп.
Если в составе молекулы одна функциональная группа, то это соединение относится к монофункциональным соединениям. Например, этанол – это монофункциональное соединение, потому что содержит только одну группу ОН. Полифункциональные соединения содержат несколько одинаковых групп, например, глицерин – трёхатомный спирт, является полифункциональным соединением, потому что содержит три одинаковых группы – ОН. Гетерофукциональные соединения содержат разные функциональные группы. Например, аминоуксусная кислота содержит две различные функциональные группы – аминогруппу и карбоксильную группу.
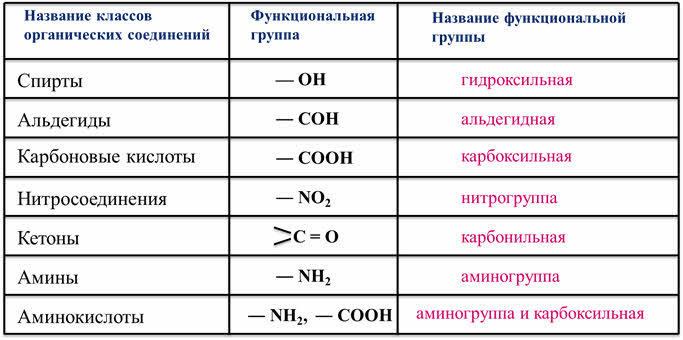
Рассмотрим соединения, имеющие функциональные группы. Спирты содержат гидроксильную группу, как и фенолы, альдегиды – альдегидную, карбоновые кислоты — карбоксильную, нитросоединения – нитрогруппу, кетоны – карбонильную группу, амины содержат аминогруппу, а аминокислоты – амино- и карбоксильную группу.
Как извстно, в углеродном скелете различают первичный, вторичный, третичный и четвертичный атомы углерода.
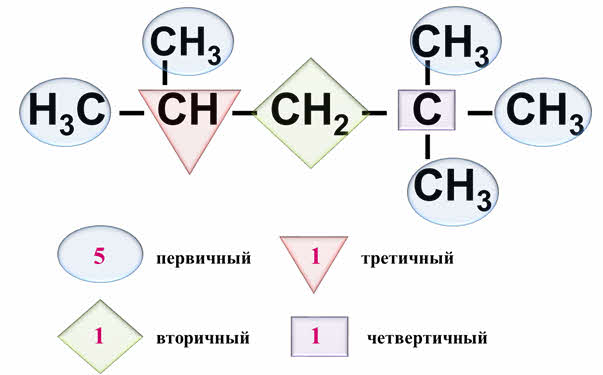
Первичным называют атом углерода, который связан только с одним другим атомом углерода, вторичный атом углерода всегда связан с с двумя другими атомами углерода, третичный – с тремя другими атомами углерода, а четвертичный – с четырьмя другими атомами углерода. Таким образом, в приведённом соединении 5 первичных, 1 вторичный, 1 третичный и 1 четвертичный атом углерода.
Таким образом, различают следующие основные виды классификаций: по составу и по строению. К соединениям, которые имеют функциональные группы относятся: спирты, альдегиды, карбоновые кислоты, нитросоединения, кетоны, амины и аминокислоты. Одно и тоже соединение можно классифицировать по нескольким признакам классификации.

Вашему вниманию предлагается методическая разработка комбинированного урока по химии для учащихся 10 класса по теме "КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ ВЕЩЕСТВ, ОСНОВЫ НОМЕНКЛАТУРЫ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ" Цель урока : познакомить учащихся с принципами классификации органических соединений по строению углеродной цепи и по функциональным группам и на этой основе дать первоначальный обзор основных классов органических соединений. Дать общее представление об основных принципах формирования названий органических соединений по международной номенклатуре. Формирование научной картины мира, воспитание чувства патриотизма на примере Бутлерова. Развивать умения учащихся сравнивать, обобщать, проводить аналогию.
Тема: КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ ВЕЩЕСТВ, ОСНОВЫ НОМЕНКЛАТУРЫ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
образовательные: Сформировать понятия изомерии, структурной формулы, изомеров. Познакомить с принципами классификации органических соединений по строению углеродной цепи и по функциональным группам и на этой основе дать первоначальный обзор основных классов органических соединений. Дать общее представление об основных принципах формирования названий органических соединений по международной номенклатуре.
воспитательные: Формирование научной картины мира, воспитание чувства патриотизма на примере Бутлерова.
развивающие: Развивать умения учащихся сравнивать, обобщать, проводить аналогию.
Тип урока: урок комбинированный
Методы ведения:
общие: объяснительно-иллюстративный
частные: словесно-наглядный
конкретные: беседа
Оборудование: схема классификации органических соединений
1.Организационный момент – 5 мин
2.Проверка домашнего задания – 25 мин
3.Объяснение и закрепление нового материала – 55 мин
4.Домашнее задание - 3 мин
5.Итоги урока – 2 мин
1.Организационный момент: Приветствие, проверка посещаемости.
2. Проверка домашнего задания
? какая связь называется сигма связью?
Назовите механизмы разрыва химической связи
3.Объяснение нового материала:
Классификация органических веществ
Классифицировать вещества можно по разным признакам, например, по составу, строению, свойствам, применению — по столь привычной логической системе признаков. Т. к. в состав всех органических соединений входят атомы углерода, то, очевидно, важнейшим признаком классификации органических веществ может служить порядок их соединения, т. е. строение. По этому признаку все органические вещества разделены на группы в зависимости от того, какой остов (скелет) образуют углеродные атомы, включает ли этот остов какие-либо иные атомы, кроме углерода.
Давайте рассмотрим более подробно данную классификацию, используя следующую схему:

В основе классификации лежит строение молекулы.
Ациклические соединения – соединения с открытой (незамкнутой) цепью углеродных атомов. Такие соединения называют также алифатическими соединениями или соединениями жирного ряда.
Предельные соединения – соединения, имеющие в своём составе одинарные связи.
Непредельные соединения – соединения, в которых присутствуют двойные или тройные (кратные) связи.
Циклические соединения – соединения, в которых углеродные атомы образуют циклы, бывают карбоциклическими и гетероциклическими.
Карбоциклические – циклические соединения, образованные только углеродными атомами, бывают алициклическими и ароматическими.
Гетероциклические соединения – циклы, в состав которых кроме атомов углерода входят и другие атомы – гетероатомы (азот, сера, кислород)
Основные классы органических соединений
Углеводороды – наиболее простые органические соединения, в состав которых входят только углерод и водород. Они бывают предельными (алканы), непредельными (алкены, алкины, алкадиены и др.) и ароматическими (арены).
При замене атомов водорода в углеводороде на другие атомы или группы атомов – функциональные группы – образуются многочисленные классы органических соединений (спирты, альдегиды, кетоны, карбоновые кислоты, эфиры, амины, аминокислоты и др).
Читайте также:
- Медико педагогический контроль на физкультурном занятии в школе
- Школьная олимпиада по географии 7 класс какой из представленных масштабов самый крупный
- Обязательно ли ходить на подготовку к школе форум
- Анализ стиха брюсова каменщик кратко
- Е пермяк как огонь воду замуж взял краткое содержание для читательского дневника

