Какие спирты относят к предельным одноатомным как формируют их названия какие виды изомерии кратко
Обновлено: 02.07.2024
ХИМИЯ – это область чудес, в ней скрыто счастье человечества,
величайшие завоевания разума будут сделаны
именно в этой области.(М. ГОРЬКИЙ)
Таблица
Менделеева
Универсальная таблица растворимости
Коллекция таблиц к урокам по химии
Предельные одноатомные спирты: строение, изомерия. номенклатура, физические свойства. Водородная связь
Рис. а) этанол б) метанол
Спиртами называют соединения, содержащие одну или несколько гидроксильных групп, непосредственно связанных с углеводородным радикалом.
I. Классификация спиртов
Спирты классифицируют по различным структурным признакам.
1. По числу гидроксильных групп
Современное название многоатомных спиртов - полиолы (диолы, триолы и т.д). Примеры:
двухатомный спирт – этиленгликоль (этандиол): HO–СH2–CH2–OH
трехатомный спирт – глицерин (пропантриол-1,2,3): HO–СH2–СН(ОН)–CH2–OH
Двухатомные спирты с двумя ОН-группами при одном и том же атоме углерода R–CH(OH)2 неустойчивы и, отщепляя воду, сразу же превращаются в альдегиды R–CH=O. Спирты R–C(OH)3 не существуют.
2. В зависимости от того, с каким атомом углерода (первичным, вторичным или третичным) связана гидроксигруппа , различают спирты

В многоатомных спиртах различают первично-, вторично- и третичноспиртовые группы. Например, молекула трехатомного спирта глицерина содержит две первичноспиртовые (HO–СH2–) и одну вторичноспиртовую (-СН(ОН)–) группы.
3. По строению радикалов, связанных с атомом кислорода
Непредельные спирты с ОН-группой при атоме углерода, соединенном с другим атомом двойной связью, очень неустойчивы и сразу же изомеризуются в альдегиды или кетоны.
Например, виниловый спирт CH2=CH–OH превращается в уксусный альдегид CH3–CH=O
II. Гомологический ряд предельных одноатомных спиртов
Предельные одноатомные спирты – кислородсодержащие органические вещества, производные предельных углеводородов, в которых один атом водорода замещён на функциональную группу (-OH)
Общая формула:
CnH2n+1OH или ROH или CnH2n+2O

Простейшие спирты
Метиловый спирт
(метанол)
Этиловый спирт
(этанол)
III. Номенклатура спиртов
Систематические названия даются по названию углеводорода с добавлением суффикса -ол и цифры, указывающей положение гидроксигруппы (если это необходимо). Например:
Нумерация ведется от ближайшего к ОН-группе конца цепи.
Цифра, отражающая местоположение ОН-группы, в русском языке обычно ставится после суффикса "ол".
По другому способу (радикально-функциональная номенклатура) названия спиртов производят от названий радикалов с добавлением слова "спирт". В соответствии с этим способом приведенные выше соединения называют: метиловый спирт, этиловый спирт, н-пропиловый спирт СН3-СН2-СН2-ОН, изопропиловый спирт СН3-СН(ОН)-СН3.
IV. Изомерия спиртов
1. Cтруктурная изомерия
1) Изомерия положения ОН-группы (начиная с С3)
2) Изомерия углеродного скелета (начиная с С4)
2. Межклассовая изомерия с простыми эфирами
Например,
этиловый спирт СН3CH2–OH и диметиловый эфир CH3–O–CH3
3. Пространственная изомерия – оптическая
Например, бутанол-2 СH3 C H(OH)СH2CH3, в молекуле которого второй атом углерода (выделен цветом) связан с четырьмя различными заместителями, существует в форме двух оптических изомеров.
V. Строение спиртов
Строение самого простого спирта — метилового (метанола) — можно представить формулами:
Из электронной формулы видно, что кислород в молекуле спирта имеет две неподеленные электронные пары.
Свойства спиртов и фенолов определяются строением гидроксильной группы, характером ее химических связей, строением углеводородных радикалов и их взаимным влиянием.
Связи О–Н и С–О – полярные ковалентные. Это следует из различий в электроотрицательности кислорода (3,5), водорода (2,1) и углерода (2,4). Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
Атому кислорода в спиртах свойственна sp 3 -гибридизация. В образовании его связей с атомами C и H участвуют две 2sp 3 -атомные орбитали, валентный угол C–О–H близок к тетраэдрическому (около 108°). Каждая из двух других 2 sp 3 -орбиталей кислорода занята неподеленной парой электронов.
Подвижность атома водорода в гидроксильной группе спирта несколько меньше, чем в воде. Более "кислым" в ряду одноатомных предельных спиртов будет метиловый (метанол).
Радикалы в молекуле спирта также играют определенную роль в проявлении кислотных свойств. Обычно углеводородные радикалы понижают кислотное свойства. Но если в них содержатся, электроноакцепторные группы, то кислотность спиртов заметно увеличивается. Например, спирт (СF3)3С—ОН за счет атомов фтора становится настолько кислым, что способен вытеснять угольную кислоту из ее солей.
VI. Физические свойства
МЕТАНОЛ (древесный спирт) – жидкость (tкип=64,5; tпл=-98; ρ = 0,793г/см 3 ), с запахом алкоголя, хорошо растворяется в воде. Ядовит – вызывает слепоту, смерть наступает от паралича верхних дыхательных путей.
ЭТАНОЛ (винный спирт) – б/цв жидкость, с запахом спирта, хорошо смешивается с водой.
Первые представители гомологического ряда спиртов — жидкости, высшие — твердые вещества. Метанол и этанол смешиваются с водой в любых соотношениях. С ростом молекулярной массы растворимость спиртов в воде падает. Высшие спирты практически нерастворимы в воде.
Особенности строения спиртов – спирты образуют водородные связи (обозначают точками) за счёт функциональной группы (-ОН)
а) Водородная связь между молекулами спиртов
2) Способность спиртов образовывать межмолекулярные водородные связи не только влияет на их температуры кипения, но и увеличивает их растворимость в воде. Все алканы нерастворимы в воде, а низкомолекулярные спирты (метиловый, этиловый, н-пропиловый и изопропиловый) растворяются в воде неограниченно.
3) Отсутствие газов в гомологическом ряду предельных одноатомных спиртов.
Одноатомные спирты (алкоголи) – это производные алканов, молекула которых имеет одну функциональную гидроксильную группу. Она связана с насыщенным атомом углерода.
В учебниках химии можно встретить определение спиртов – это обширный класс химических соединений, выполняющих важнейшие функции в живых организмах. Рассматриваемые вещества широко применяются в промышленном производстве и повседневной жизни.
Описание и общая формула одноатомных спиртов
В таких спиртах атом водорода замещается гидроксильной группой ОН. Они имеют формулу CnH2n+1OH.
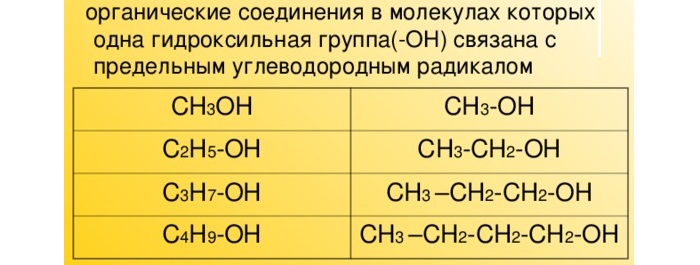
В современной номенклатуре их названия связаны с гомологическим рядом предельных алканов с суффиксом –ол (этанол, пропанол, бутанол, пропанол, гексанол и проч).
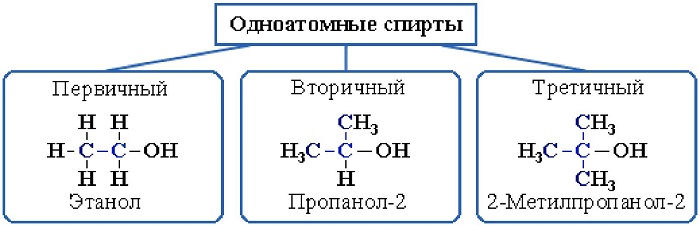
В зависимости от размещения группы ОН, существует классификация алкоголей:
первичные –группа ОН присоединена к первому атому С;
вторичные – гидроксильная группа присоединена ко второму атому этого элемента;
третичные – группа ОН присоединена к третьему атому углерода.
Изомерия одноатомных спиртов
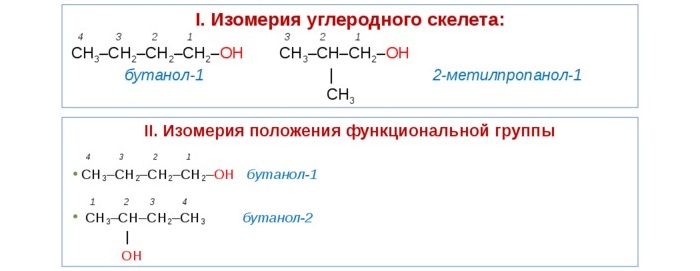
Для этих веществ характерны разные виды изомерии:
Структурная – изменение расположения ОН начиная с соединений, содержащих 3 атома углерода. Так, существует пропанол 1 (н-пропиловый) и пропанол-2 (изопропиловый).
Изомерия углеродного звена – изменение положения гидроксильной группы, начиная с веществ, молекула которых содержит 4 углеродных атома. Так, бутанолу соответствует четыре разных изомера.
Межклассовая изомерия (с эфирами). Этиловому алкоголю с формулой СН3CH2–OH соответствует диметиловый эфир CH3–O–CH3.
Пространственная, или зеркальная изомерия.
Физические свойства
Вещества с количеством атомов углерода до 15 являются летучими жидкостями с резким запахом. Соединения с числом атомов углерода свыше 15 являются твердыми веществами.

Начальный член гомологического ряда (метанол) чрезвычайно токсичен для человека.
Чем выше спирт, тем и выше его температура кипения. Различия между каждым членом гомологического ряда составляет примерно 20 градусов. По мере увеличения размера молекулы и ее массы снижается и их воспламеняемость. Следовательно, легче всех воспламеняется метанол.
Соединения, имеющие в составе молекулы 9 атомов углерода, растворяются в воде (метанол и этанол – в каком угодно соотношении). Хорошо растворяются в растворителях.
Химические свойства
Рассматриваемые вещества ведут себя и как основания, и как кислоты.
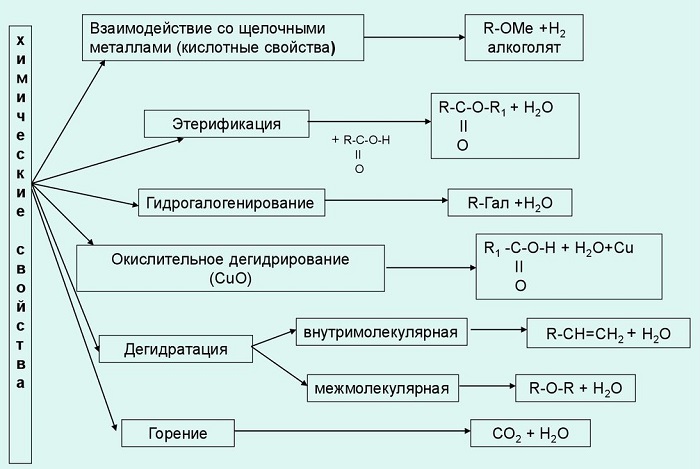
Основные химические свойства одноатомных спиртов:
Взаимодействие с щелочными металлами. При этом образуются алкоголяты или алкоксиды. В воде эти вещества подвергаются гидролизу, образуя спирт и основание.
Взаимодействие с кислотами (органическими и неорганическими). По-другому они называются реакциями этерификации, поскольку конечный их продукт - сложный эфир.
Реакция с хлористым тионилом дает в итоге галогеналкан.
В результате внутримолекулярного обезвоживания получают алкены.
При межмолекулярной дегидратации образуются простые эфиры.
Химическая реакция одноатомного алкоголя с перманганатом калия дает альдегид. Дальнейшим окислением альдегида можно получить одноатомную карбоновую кислоту.
Получение

Известно несколько методов получения простых спиртов:
1. Гидратация алкенов (с присоединением молекулы воды):
2. Гидролиз алкилгалогенидов (с добавлением водных растворов щелочей):
3. Восстановление кетонов:
4. Этанол получают путем разложения глюкозы:
5. Восстановление карбоновых кислот и сложных эфиров.
6. Присоединение металлорганических химических соединений к кетонам и альдегидам.
Применение одноатомных спиртов
Одноатомные спирты широко применяются как исходный реагент для получения альдегидов, кетонов, карбоновых кислот и эфиров. Все эти вещества широко применяются в производстве и быту.
Вот примеры использования наиболее распространенных спиртов:
Метанол является прекрасным органическим растворителем. Его применяют в производстве лаков и красок, органических смол.
Этанол широко используется в медицине как антисептик и растворитель. В пищевой промышленности его используют для получения алкогольных напитков. Он является основой для получения сложных эфиров, уксуса.
Бутанол применяется как растворитель и основа для получения веществ с приятным ароматом.
Бензиловый спирт является основой для получения душистых веществ.
Рассмотренные в статье вещества имеют широкое применение в промышленности. Без них невозможно получение многих веществ, использующихся в быту.

Двухатомные спирты с двумя и тремя гидроксогруппами у одного атома углерода R‒CH(OH)2 или R-C(OH)3 неустойчивы, от них легко отрывается вода и образуется карбонильное соединение.
Классификация по числу углеводородных радикалов у атома углерода при гидроксильной группе
- Первичные спирты – группа ОН соединена с первичным атомом углерода. Например, этанол СН3–СН2–ОН.
- Вторичные спирты – группа ОН соединена с вторичным атомом углерода. Например, пропанол-2: СН3–СН ( СН3)–ОН.
- Третичные спирты – группа ОН соединена с третичным атомом углерода. Например, 2-метилпропанол-2: (СН3)3С–ОН.
- Метанол не относится ни к первичным, ни к вторичным, ни к третичным спиртам.

Классификация по строению углеводородного радикала
- Предельные спирты – группа ОН соединена с предельным радикалом. Например, пропанол-1: СН3–СН2–СН2–ОН.
- Непредельные спирты – группа ОН соединена с непредельным радикалом. Например, алкенолы: СН2=СН–СН2–ОН.
Непредельные спирты, в которых гидроксильная группа соединена с атомом углерода при двойной связи (алкенолы), неустойчивы и изомеризуются в соответствующие карбонильные соединения.
- Ароматические спирты – содержат в радикале ароматическое кольцо, не связанное непосредственно с группой ОН. Например, бензиловый спирт.

В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
| Атом кислорода в спиртах находится в состоянии sp 3 -гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp 3 -гибридные орбитали, а еще две 2sp 3 -гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108 о .

Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:

Поэтому спирты – жидкости с относительно высокой температурой кипения (температура кипения метанола +64,5 о С). Температуры кипения многоатомных спиртов и фенолов значительно выше.
Таблица. Температуры кипения некоторых спиртов и фенола.
| Название вещества | Температура кипения |
| Метанол | 64 |
| Этанол | 78 |
| Пропанол-1 | 92 |
| Бутанол-1 | 118 |
| Этиленгликоль | 196 |
| Фенол | 181,8 |
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:

| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Низшие спирты (метанол, этанол, пропанол, изопропанол, этиленгликоль и глицерин) смешиваются с водой в любых соотношениях.
Нумерация ведется от ближайшего к ОН-группе конца цепи.

Например: СН3ОН – метиловый спирт, С2Н5ОН – этиловый спирт и т.д.
- В названиях многоатомных спиртов количество групп ОН указывают суффиксами -диол в при наличии двух ОН-групп, -триол при наличии трех ОН-групп и т.д. После этого добавляют номера атомов углерода, связанных с гидроксильными группами.
Например, пропандиол-1,2 (пропиленгликоль):

Структурная изомерия
Для спиртов характерна структурная изомерия – изомерия углеродного скелета, изомерия положения гидроксильной группы и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета характерна для спиртов, которые содержат не менее четырех атомов углерода.
| Например. Ф ормуле С4Н9ОН соответствуют четыре структурных изомера, из них два различаются строением углеродного скелета |
| Бутанол-1 | 2-Метилпропанол-1 |
 |  |
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Спирты являются межклассовыми изомерами с простыми эфирами. Общая формула и спиртов, и простых эфиров — CnH2n+2О.
| Например. Межклассовые изомеры с общей формулой С2Н6О: этиловый спирт СН3–CH2–OH и диметиловый эфир CH3–O–CH3 |
| Этиловый спирт | Диметиловый эфир |
| СН3–CH2–OH | CH3–O–CH3 |
Изомеры с различным положением группы ОН отличаются положением гидроксильной группы в молекуле. Такая изомерия характерна для спиртов, которые содержат три или больше атомов углерода.
| Например. Пропанол-1 и пропанол-2 |
| Пропанол-1 | Пропанол-2 |
 |  |
Добавить комментарий
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.

В этой статье мы разберемся, какие вещества называют спиртами, а также узнаем о них все, что требует школьная программа по химии за 10 класс.
О чем эта статья:
Спирты — это большая группа химических соединений, производные углеводородов, у которых один или несколько атомов водорода замещены на гидроксильную группу ОН − .
Гидроксильная группа является функциональной группой спиртов.
Классификация спиртов
Спирты классифицируют по различным признакам: по количеству гидроксильных групп; по типу атома углерода, с которым связана гидроксогруппа; а также по строению углеводородного радикала.
По количеству гидроксогрупп
По этому признаку выделяют одноатомные и многоатомные спирты.
У одноатомных спиртов одна группа ОН−. Пример — этиловый спирт (этанол):
У многоатомных — несколько групп ОН − .
Например, предельный двухатомный спирт этиленгликоль (этандиол):

Трехатомный спирт глицерин:

Современное название многоатомных спиртов — полиолы (диолы, триолы и т. д.).
По типу атома углерода, с которым связана гидроксогруппа
Выделяют первичные, вторичные и третичные спирты. Показали примеры каждого вида спиртов в таблице.

По строению углеводородного радикала
По строению углеводородного радикала спирты бывают:
Номенклатура спиртов
По систематической номенклатуре ИЮПАК (IUPAC)
Спиртам дают название по названию углеводорода с добавлением суффикса -ол и цифры, которая показывает положение гидроксильной группы. Для того, чтобы правильно определить, с каким по счету атомом углерода соединена гидроксильная группа, необходимо учитывать следующие правила:
Выбрать самую длинную углеводородную цепь, в состав которой входит гидроксильная группа. Таким образом устанавливают число атомов углерода и соответственно формируют название.
Нумерацию длинной цепи осуществляют с того края, к которому ближе расположена гидроксильная группа.
Местоположение гидроксогруппы в названии определяют написанием цифры после суффикса -ол.

Если в составе спирта присутствуют другие функциональные группы, то нумерация углеродного скелета начинается с того края, где расположена старшая функциональная группа. В таком случае перед названием указывают цифрой, от какого атома углерода идет ответвление.

Радикально-функциональная номенклатура
СH3—OH — метанол или метиловый спирт;
C2H5OH — этанол или этиловый спирт;
Тривиальная номенклатура
Тривиальные названия были даны спиртам по источнику природного получения. Например, метанол называют древесным спиртом, а этанол — винным спиртом. Показали некоторые тривиальные названия спиртов в таблице:
Читайте также:

