Какая связь называется водородной как она определяет физические свойства воды кратко
Обновлено: 07.07.2024
Водородная связь – связь между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом другой молекулы.
Водородная связь – связь между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом другой молекулы.
Механизм возникновения водородной связи – частично электростатический и частично донорно-акцепторный.
Характерной чертой водородной связи является расстояние между атомом водорода и другим атомом, её образующим. Оно должно быть меньше, чем сумма радиусов этих атомов.
Водородная связь подразделяется:
1. Межмолекулярная водородная связь образуется между молекулами веществ, в состав которых входят водород и сильно электроотрицательный элемент – фтор, кислород, азот, хлор, сера. Сильно смещенная общая электронная пара от водорода к атому отрицательно заряженного элемента, при этом положительный заряд водорода сконцентрирован в малом объеме, приводит взаимодействие протона с неподеленной электронной парой другого атома или иона, обобществляя её.
Водородную связь обозначают точками, указывая, что она намного слабее ковалентной связи (примерно в 15-20 раз).

Межмолекулярная водородная связь: две молекулы воды и две молекулы уксусной кислоты с образованием циклической структуры
2. Внутримолекулярная водородная связь присутствует в многоатомных спиртах, углеводах, белках и других органических веществах.

Молекула салициловой кислоты.
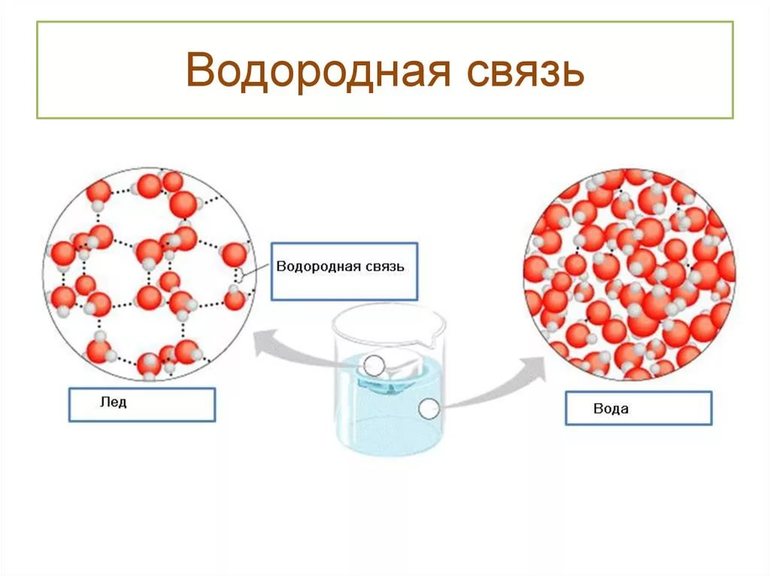
Вещества с водородной связь имеют молекулярные кристаллические решетки, в узлах которой находятся молекулы.
Физические свойства веществ с водородной связью.
Водородная связь обеспечивает низкомолекулярным веществам способность быть при обычных условиях в жидком агрегатном состоянии (этанол, метанол, вода) или сжижающимися газами (аммиак, фтороводород).
Более высокая температура кипения воды (100 о С) по сравнению с водородными соединениями элементов подгруппы кислорода (Н2S, Н2Sе, Н2Те), так как затрачивается дополнительная энергия на разрушение водородных связей.

Комментарии, вопросы по параграфу можно добавить на странице обсуждения.
Содержание

- Опишите строение молекулы воды и назовите химическую связь, за счёт которой она образуется.
Молекула воды состоит из двух атомов водорода и одного атома кислорода. Три атома образуют угол; угол H-O-H составляет приблизительно 104,5 градуса. Центр каждого атома водорода находится примерно на 0,0957 нанометра от центра атома кислорода. Структура одиночной молекулы воды показана на рис 1.
- Объясните, какая связь считается водородной и как она определяет физические свойства воды.
Так как кислород более электроотрицателен, чем водород (другими словами, электроны имеют тенденцию находиться по соседству с кислородом), атомы водорода в конечном итоге имеют частичный положительный заряд, а атом кислорода - частичный отрицательный заряд.
Эта молекулярная структура формирует водородную связь, которая представляет собой стабилизированную структуру, в которой атом водорода находится на линии между атомом кислорода на его собственной молекуле и кислородом на другой молекуле.
- Перечислите известные вам аномалии физических свойств воды. Объясните, какую роль они играют в природе.
Под аномалиями воды понимают ряд ее свойств, которые отличают воду от химических аналогов H 2 S >> (сероводород), H 3 Se >> (cеленоводород ), H 2 Te >> (теллуроводород), а также от других жидкостей. Важнейшими из них являются:
- Прежде всего стоит отметить свойства воды в её трёх агрегатных состояниях: твёрдом (в виде льда), в жидком (в виде воды) и газовом (в виде пара). Агрегатные состояния воды зависит прежде всего от внешней температуры среды. При температуре 0°C вода приобретает твёрдое состояние льда. От 1°C до 99 °C - вода находится в жидком состоянии и свыше 100 °C - вода приобретает свойства газа в состоянии пара. Все три состояния воды играют значительную роль в круговороте воды в природе, формирую климат на Земле и влияя на экологию, флору и фауну местности.
- В отличие от всех известных жидкостей, плотность которых монотонно увеличивается с понижением температуры, плотность воды максимальна при 4 градусах Цельсия, а при дальнейшем понижении температуры вновь начинает убывать. Это уникальное свойство воды делает возможной жизнь в реках и озерах — в противном случае эти относительно мелкие водоемы неизбежно промерзали бы до дна в зимний период и были бы лишены всех живых организмов, за исключением, может быть, простейших бактерий.
- Вода обладает огромной теплоемкостью — благодаря этому теплые океанические течения согревают многие северные регионы планеты, принося тепло из южных широт.
- Аномально высокое поверхностное натяжение жидкой воды не только позволяет некоторым насекомым спокойно ходить по её поверхности, но и благодаря капиллярным силам обеспечивает поступление питательных веществ к кронам гигантских деревьев, достигающих нескольких десятков метров в высоту. [1]


- Зная, что растворимость называют физико-химическим процессом, объясните, как она характеризует свойства воды. Расскажите, как по этому признаку делятся вещества (для ответа обратитесь к таблице растворимости>.
Вода, как растворитель: Вода как растворитель играет предельно важную роль далеко не только в плане нашего быта. Исследователи давно говорят, что данное волшебное соединение является основой для образования жизни вообще. И именно поэтому его наличие выступает обязательным условием для существования чего-то более сложного, нежели неживая природа. Растворимость тех или иных химических элементов напрямую связана с существованием воды, так как она чаще всего выступает той средой, которая преобразует все вокруг себя и создает новые формы органической и неорганической материи. [2]
Вода – сложное вещество, отличающееся многими уникальными характеристиками, которые нельзя встретить больше нигде. Она способна растворить большую часть существующих в природе комплексных соединений, содержащих в своей структуре молекулы как с положительными, так и отрицательными ионами одновременно.
При работе с различными веществами важно знать их растворимость в воде. Вещество считается хорошо растворимым, если при комнатной температуре в 100 г воды растворяется больше 1 г этого вещества. Если при таких условиях растворяется меньше 1 г вещества в 100 г воды, то такое вещество считается малорастворимым. К веществам практически нерастворимым относятся такие, растворимость которых меньше 0,01 г в 100 г воды. [3]
- Расскажите, какие вещества называются гидрофильными, а какие — гидрофобными, приведите примеры.
Гидрофильность характеризует величина связи адсорбционной молекул воды с молекулами вещества, при этом образуются соединения, в которых количество воды распределяется по значениям энергии связи.
Парфюмерно-косметической промышленностью производятся гидрофильные кремы и гели, которые защищают кожу от загрязнений, не растворяемых водой. В составе таких продуктов находятся гидрофильные составляющие, образующие пленку, предотвращающую проникновение водонерастворимых загрязняющих веществ в поверхностный слой кожного покрова.
Гидрофильные кремы производятся из эмульсии, которая стабилизирована подходящими эмульгаторами или с основой вода—масло—вода, масло—вода. Кроме того, к ним можно отнести дисперсные коллоидные системы, в которых стабилизированы гидрофильные поверхностно-активные компоненты, и состоящие из водно-диспергированных или водно-гликолевых смешанных растворителей жирных высших кислот или спиртов.
Гидрогели (гидрофильные гели) готовятся из основ, состоящих из воды, смешанного неводного или гидрофильного растворителя (этиловый спирт, пропиленгликоль, глицерин) и гидрофильного образователя гелей (производные целлюлозы, карбомеры). [4]
Водородная связь встречается во всех областях химии и проявляется в виде межмолекулярного или внутримолекулярного взаимодействия особых групп, одна из которых обязательно содержит реакционно-способный атом водорода с положительным зарядом. Это глобальное явление, называемое также H-связью, отличается от других объединений химических частиц тем, что образуется самопроизвольно в подходящих условиях, а не в результате направленного воздействия.
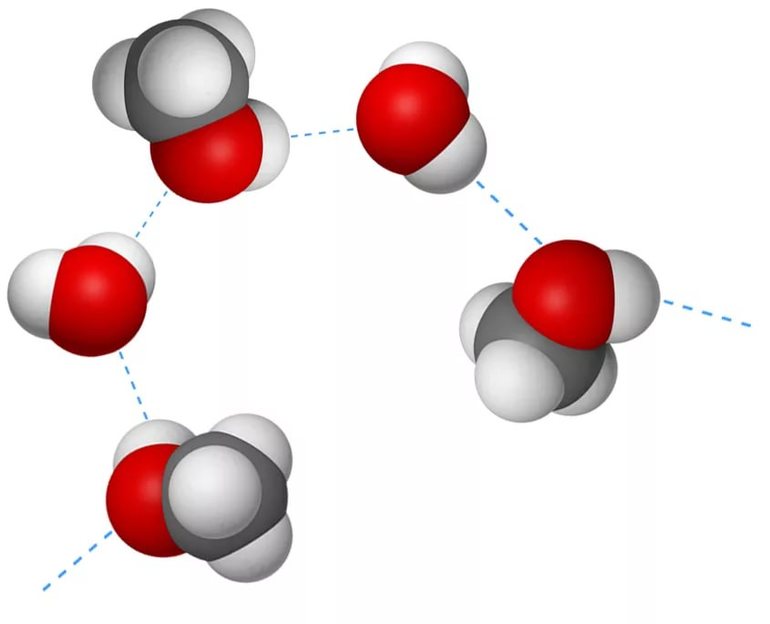
Характерные особенности
Этот тип связи возникает в молекулах, когда их атом водорода, поляризованный положительно, взаимодействует с атомом другой молекулы, имеющим заряд отрицательный. Расстояние между атомами-участниками процесса должно оказаться меньше, чем сумма их радиусов. Выделяют два вида H-связей:
- Межмолекулярная. Возникает между различными молекулами веществ: для этого необходимо присутствие водорода и одного из элементов с хорошей способностью притягивать электроны других атомов. Высокая электроотрицательность фтора (F), кислорода (O), азота (N), хлора (Cl) и серы (S) служит этому надёжной поддержкой. Общие пары взаимодействующих электронов смещаются к атомам отрицательно заряженных элементов, а положительные электрические заряды водорода концентрируются в малых объёмах. Протоны взаимодействуют с электронными парами соседних атомов, что приводит к их обобществлению.
- Внутримолекулярная. Образуется в пределах одной молекулы, для чего в ней наряду с положительно заряженными атомами водорода должны присутствовать отрицательно поляризованные группы. Явление обнаруживается в природе у многоатомных спиртов, белков, углеводов и ряда других органических соединений.
Энергия H-связи обладает низкими прочностными характеристиками: она в несколько раз ниже, чем у остальных подобных взаимодействий. Это позволяет ей существовать промежуточным звеном между основными химическими связями (ковалентной, ионной и металлической) и силами притяжения и отталкивания Ван-дер-Ваальса, стремящимися удержать частицы в твёрдом или жидком состоянии. Кристаллические решётки с молекулами в узлах — характерная особенность веществ с водородной связью. Примеры можно привести различные:

Механизм образования водородной связи считается смешанным — одновременно электростатическим и донорно-акцепторным. Решающая роль в этом принадлежит повышению электроотрицательности одного атома (A), позволяющей оттягивать в свою сторону электронную пару другого атома (H), принимающего участие в этом взаимодействии. В результате:
- первый атом приобретает частично отрицательный заряд (d-);
- второй участник заряжается положительно (d+);
- происходит поляризация химической связи (Аd-) — (Hd+).
Образовавшиеся атомы водорода, заряд которых частично положителен, обладают способностями притягивать другие молекулы, содержащие электроотрицательные группы. Эти электростатические взаимодействия и обуславливают появление Н-связей, для формирования которых необходимы три обязательных элемента:
- атом-донор протона;
- атом-акцептор протона;
- атом водорода Н.
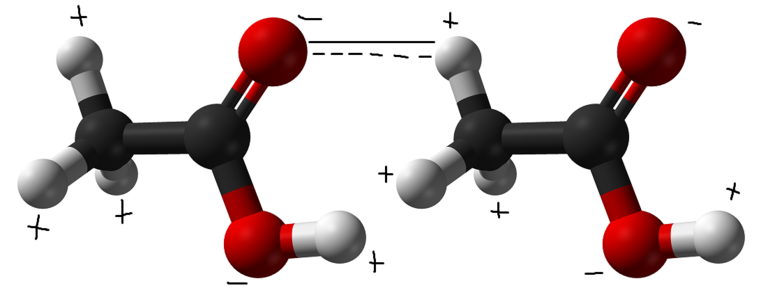
Такое донорство в обычных условиях никогда не осуществляется на все 100%. Атом-донор остается химически связанным с водородом. Графически это обозначается в виде линии из точек, указывающей, что сила взаимодействия слабее ковалентной связи. Схема записи структуры выглядит следующим образом: Б ··· Нd+ - Аd-.
Только три химических элемента полностью проявляют донорские способности, и их атомы поставляют протоны для образования Н-связей: азот (N), кислород (O) и фтор (F). В атомах-акцепторах недостатка не наблюдается. Низкомолекулярным соединениям H-связь придаёт способность в обычных условиях иметь жидкое агрегатное состояние, как это происходит у этанола (C2H5OH), метанола (CH3OH) и воды (H2O), или становиться сжижающимися при охлаждении газами — аммиаком (NH3) и гидрофторидом (HF).
Проявление в неорганической химии
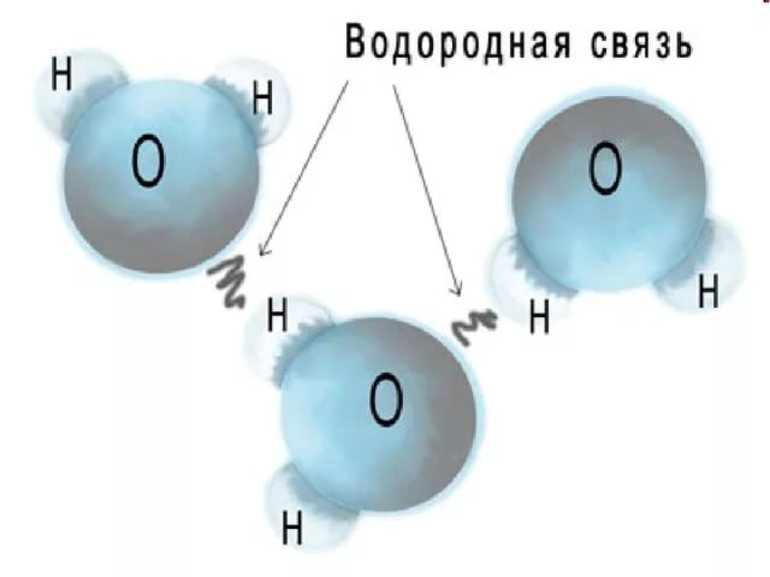
Это справедливо и для другого ряда — NH3 (аммиак), PH3 (фосфин), H3As (арсин), Н3Sb (стибин), где фактическая (-33 °C) температура кипения аммиака на 80 градусов превышает ожидаемую. Если считать, что молекулы в жидкости удерживаются исключительно Ван-дер-Ваальсовыми силами, разрушающимися при переходе в газообразную фазу, то эти скачки не должны наблюдаться, а объяснить их невозможно.
Неожиданные повышения температур кипения привели к выводам о присутствии дополнительно связывающих молекулы сил, изменяющих физические свойства. Водородной связи принадлежит роль в создании аномальных температур кипения спиртов, если их сравнивать с аналогами без гидроксильных групп (-ОН). В перечне заслуг H-связей не только изменение точек кипения веществ, но и упрочнение их кристаллических решёток, вызывающее повышение температур плавления, поверхностного натяжения и вязкости.
При помощи инфракрасной спектроскопии сегодня можно достоверно выявить любой тип межмолекулярного взаимодействия: группы с Н-связями заметно отличаются по спектральным характеристикам от остальных случаев. Исследования структуры вещества помогают измерить дистанцию между водородом и атомом-акцептором, сравнить её с суммой радиусов и, если первое значение не превышает второе, доказать существование явления.
Понятие водных кластеров

Земля — чемпион по содержанию воды среди других планет Солнечной системы. Моря и океаны, реки и озёра, средние глубины которых достигают 6 тыс. метров, занимают 70% земной поверхности, а в областях полюсов сосредоточились огромные запасы влаги в виде снегов и льдов.
Трудно переоценить влияние воды на возникновение и существование жизни на нашей планете. Это связано с особенностями, нехарактерными для соединений, считающихся её близкими аналогами. Только вода находится в жидком и твёрдом состоянии при условиях, в которых водородные соединения серы или селена с большей атомной массой становятся газообразными.
Водородные связи сообщают воде уникальную характеристику, обеспечивающую существование разнообразных форм жизни в областях, где окружающие температуры опускаются ниже нуля. Если на минуту представить, что лёд начнёт тонуть в воде, то моря зимой рано или поздно промёрзнут до самого дна, и рыбы будут обречены на вымирание. Люди могли бы растапливать лёд для получения живительной влаги, но это потребует больших энергозатрат.

Ещё одно проявление H-связей — голубая окраска чистой воды в её толще. Колебание одной молекулы воды вызывает движение соседних частиц, соединенных с ней водородными связями. Красные лучи из состава солнечного спектра будут расходоваться на поддержание этих колебаний, поскольку больше всего соответствуют им энергетически. Происходит фильтрация красных лучей — их энергия поглощается и рассеивается в виде тепла колеблющимися молекулами.
Начинает проступать голубой участок спектра, уравновешивающий отсутствие красного. Вода самостоятельно окрасится в волшебный небесный цвет. Для этого необходимо, чтобы солнечные лучи прошли через двухметровую толщу чистой воды и потеряли достаточное количество красного спектра.
Значение для органических соединений

Просматривается эмпирическая закономерность: органическое соединение будет легко растворяться в воде, если в составе его молекул на каждый атом кислорода приходится не более 3 атомов углерода. Например, бензол C6H6 в воде растворяется плохо, но замена одной группы (-СН) на (-N) даёт пиридин С5Н5N, смешивающийся с водой в любых пропорциях.
Для неводных растворов, в которых растворителями служат органические вещества, тоже характерны H-связи. В них водород частично положительно поляризован, а поблизости обнаруживается молекула с сильным акцептором — чаще всего это бывает кислород. Жирные кислоты приобретают полезную способность растворяться в хлороформе HCCl3, а растворённый в ацетоне ацетилен получил важное техническое применение. Горючий газ C2H2 под давлением чувствителен к сотрясениям и взрывоопасен, но его растворение в ацетоне C3H6O позволяет безопасно хранить и транспортировать любые объёмы.
Трудно переоценить роль H-связей в прочных полимерных и биополимерных структурах. Целлюлоза (клетчатка древесины) в строении молекулы располагает гидроксильные группы по бокам полимерной структуры, в которой чередуются циклические фрагменты. Невысокая энергия единичной Н-связи, умноженная на количество по всей длине молекулярной цепи, вызывает в итоге мощное притяжение. Из-за этого целлюлозу можно растворить только в высокополярных растворителях — дигидроксотетрааммиакате меди, известном как реактив Швейцера.
Карбонильные (=C=O) и аминогруппы (-NH2) в расположенных рядом полимерных цепочках капрона и нейлона тоже образуют связи этого типа и увеличивают механическую прочность веществ, поскольку в полиамидных структурах создаются кристаллические фрагменты. Аналогично ведут себя полиуретаны и белки: витки белковых спиралей закрепляются всё теми же H-связями, возникающими при взаимодействии функциональных групп.

Полимерная макромолекула ДНК — хранилище запасов информации о живом организме, зашифрованной в чередующихся фрагментарных циклах. Их карбонильные и аминогруппы имеют четыре типа азотистых оснований (аденин A, гуанин G, тимин T, цитозин C) и располагаются в форме боковых ответвлений по длине молекулы. От порядка их чередования зависят индивидуальные особенности всего живого на планете. Взаимодействия пар в составе аминогруппы и атома азота дают начало множеству Н-связей, которые удерживают 2 молекулы ДНК в виде классической двойной спирали.
Водородная связь весьма распространена и играет важную роль в биологических объектах. Рассмотрим ее образование подробнее.
Образование водородной связи
При возникновении подходящих условий водородная связь возникает самопроизвольно.
Какие же условия приводят к возникновению водородной связи?
Можно предположить, что в любом ряду веществ с молекулами одинаковой формы и полярности температуры плавления и кипения должны повышаться прямо пропорционально возрастанию молекулярной массы, однако существуют некоторые несоответствия.
На следующем рисунке приведены кривые зависимости температуры кипения гидридов элементов 6 группы от молекулярной массы.
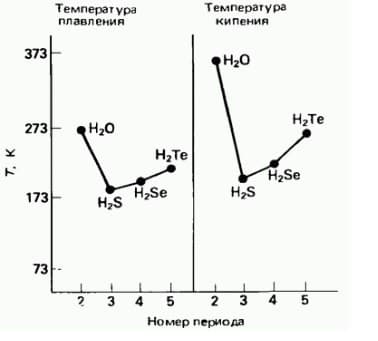
зависимость температуры кипения и температуры плавления от молекулярной массы соединений
Так, для гидридов элементов 6 группы наблюдается последовательное увеличение температур кипения и плавления с увеличением молекулярной массы (номера периода), но из этой закономерности выпадает вода.
В 5 группе аномально высокие температуры кипения и плавления наблюдаются у аммиака NH3, а в 7 группе – у HF, по сравнению с гидридами элементов соответствующих групп.
Почему вода, аммиак и фтороводород имеют аномально высокие температуры кипения и плавления?
Это связано с присутствием в воде, аммиаке и фтороводороде водородных связей.
Водородная связь — это внутри- или межмолекулярная связь, которая образуется с соединениях между атомами водорода и атомами, имеющими большую электроотрицательность (N, O, F).
Механизм образования водородной связи, вследствие электростатического притяжения атомов — электростатический. Но частично он также носит донорно–акцепторный характер.
Образуемые соединения имеют большую полярность, возникает диполь. Атом водорода находится на положительном конце диполя. Этот диполь может взаимодействовать с неподеленной электронной парой кислорода (и азота, и фтора), который принадлежит другой или этой же молекуле. Таким образом, донором электронной пары являются атомы F, O или N, а акцептором — атомы водорода.
Графически, на рисунках, водородная связь обозначается тремя точками:

Виды водородной связи
- Межмолекулярная водородная связь образуется между различными молекулами веществ. Обязательным условием образования такого вида водородной связи — это наличие водорода в одной молекуле и одного из элементов с высокой электроотрицательностью в другой молекуле (например, F, O, N, Cl, S). Связь может возникать как между одинаковыми молекулами, так и между разными. Например, это могут быть молекулы аммиака, воды, фтороводорода, спиртов (например, метанол, этанол), карбоновых кислот (например, муравьиная, уксусная кислоты), аминокислот в молекуле белка:

- Внутримолекулярная водородная связь образуется внутри одной молекулы. Условие образования внутримолекулярной водородной связи — это наличие в одной молекуле и атомов водорода и атомы с высокой электроотрицательностью. Такая связь может возникнуть, например, у многоатомных спиртов (этиленгликоль, глицерин), белков, углеводов, оксикислот (салициловая кислота) и других органических соединений:

Характеристика водородной связи
Водородная связь характеризуется
- Направленностью в пространстве и насыщаемостью.
- Водородная связь оказывает большое влияние на свойства многих веществ, особенно в биологических системах. Например, водородная связь определяет довольно некомпактную упаковку молекул воды во льду, поэтому плотность льда меньше плотности жидкой воды. Наличие водородной связи в веществах способствует аномальному росту их температур кипения и плавления.
- Водородная связь — слабая связь. Величина энергии водородной связи обычно лежит в пределах от 4 до 25 кДж/моль, это всего несколько процентов от величины энергии обычной химической связи. Теперь предположим, что водородная связь возникает в результате электростатического взаимодействия между диполем связи X-H и неподеленной электронной порой на атоме Y. Тогда прочность водородной связи увеличивается в ряду:
N-H···Y ˂ O-H···Y ˂ F-H···Y
Т.е., связь тем прочнее, чем меньше размер атома с неподеленными парами — N, O, F и больше его электроотрицательность. Среди них более прочную водородную связь образует тот, неподеленная электронная пара которого менее сильно притягивается к своему ядру.
Читайте также:
- Как пользоваться компасом для чертежей кратко
- План урока по чеченской литературе 2 класс г1иллакх хатуев 1абдул хьамид
- План урока литературного чтения на основе системно деятельностного подхода
- Кульминируют ли светила на северном полюсе земли кратко
- Почему столбик ртути не опускается если термометр вынуть из подмышки кратко


