Как происходит присоединение аминокислоты к трнк кратко
Обновлено: 07.07.2024
Образование пептидной связи между аминогруппой одной аминокислоты и СООН-группой другой аминокислоты
термодинамически невыгодно. Этот термодинамический барьер преодолевается путем активации СООН-группы аминокислот-предшественников. Активированными промежуточными продуктами синтеза белка служат эфиры аминокислот, в которых карбоксильная группа аминокислоты связана с 2-или 3-гидроксильной группой рибозного остатка на 3-конце тРНК. Аминоацильная группа может быстро перемещаться из 2-положения в 3-положение и обратно. Этот активированный промежуточный продукт называется аминоацил-тРНК (рис. 27.1).
Присоединение аминокислоты к тРНК имеет значение не только потому, что при этом активируется ее карбоксильная группа и она может образовать пептидную связь, но и потому, что аминокислоты сами по себе не способны узнавать кодоны в мРНК. Аминокислоты переносятся к рибосомам специфическими тРНК, которые и узнают кодоны в мРНК. Таким образом, эти тРНК выполняют роль адапторных молекул.
В 1957 г. Пол Замечник и Малон Хогланд (Paul Zamecnik, Mahlon Hoagland) установили, что активация аминокислот и их последующее присоединение к тРНК катализируются специфическими аминоацил-тРНК-синтетазами, которые также называют активирующими ферментами. В реакциях, катализируемых некоторыми синтетазами, первая стадия состоит в образовании аминоациладенилата из аминокислоты и АТР. Это активированное соединение представляет собой смешанный ангидрид, в котором карбоксильная группа аминокислоты присоединена к фосфатной группе AMP. Другие синтетазы катализируют реакцию АТР, аминокислоты и тРНК без промежуточного образования доступного для обнаружения аминоациладенилата.
Следующий этап - перенос аминоацильной группы аминоацил-АМР на молекулу тРНК с образованием аминоацил-тРНК-активированного промежуточного продукта в синтезе белка.
Рис. 27.1. В аминоацил-тРНК аминокислота связана эфирной связью с 2- или 3-гидроксильной группой концевого аденозина.
Переносится ли аминоацильная группа на 2- или 3-гидроксильную группу рибозного остатка на 3-конце тРНК, зависит от того, о какой аминокислоте и какой аминоацил-тРНК-синтетазе идет речь. Активированная аминокислота может очень быстро перемещаться из 2- в 3-положение и обратно.
Суммарная реакция этапов активации и переноса описывается следующим уравнением:
для этой реакции близко к нулю, так как свободная энергия гидролиза эфирной связи аминоацил-тРНК соответствует свободной энергии гидролиза концевой фосфорильной группы АТР. Что же в таком случае запускает синтез аминоацил-тРНК? Как и можно было ожидать, реакция запускается гидролизом пирофосфата. Суммарная реакция этих превращений высокоэкзергонична:
Таким образом, на синтез аминоацил-тРНК затрачиваются две богатые энергией фосфатные связи. Одна из них расходуется на образование эфирной связи аминоацил-тРНК, другая сдвигает равновесие реакции в сторону образования продукта.
Стадии активации и переноса определенной аминокислоты катализируются одной и той же аминоацил-тРНК-синтетазой. В действительности аминоацил-АМР не диссоциирует из комплекса с синтетазой. Он прочно связывается с активным центром фермента нековалентными взаимодействиями. В норме аминоацил-АМР, образующийся в качестве промежуточного продукта синтеза аминоацил-тРНК, существует в течение непродолжительного времени, но он вполне стабилен и может быть легко выделен, если в реакционной смеси нет тРНК.
Мы уже встречались с ациладенилатным промежуточным продуктом при активации жирных кислот (разд. 17.6). Интересно отметить, что Пол Берг (Paul Berg) первым открыл этот промежуточный продукт в реакции активации жирных кислот, и он же позже выяснил, что этот продукт образуется также при активации аминокислот. Основное различие между этими реакциями состоит в том, что в первом случае роль акцептора ацильных групп играет СоА, а во втором - тРНК. Энергетика этих биосинтетических реакций очень сходна: обе они становятся необратимыми благодаря гидролизу неорганического пирофосфата.
Для каждой аминокислоты имеется по крайней мере одна аминоацил-тРНК-синтетаза. Эти ферменты различаются по размеру, субъединичной структуре и аминокислотному составу (табл. 27.1).
Таблица 27.1. (см. скан) Свойства некоторых аминоацил-тРНК-сннтетаз
Рис. 27.2. Пространственные модели валина и изолейцина. Синтетазы, активные в отношении этих аминокислот, высоко специфичны.
Молекулу транспортной РНК условно можно представить в виде цепочки, свернутой в виде трехлистного клевера со стебельком, ориентированным напротив "среднего листочка" - петли тРНК, несущей антикодон. На участке, соответствующей "стебельку", находится одиночная, свободная последовательность нуклеотидов цитозин-цитозин-аденин, несущая свободную гидроксильную группу -ОН. Вот к этому концу и присоединяется аминокислота при помощи специальных ферментов - аминоацил-тРНК-синтетаз. Это группа ферментов, внутри которой существует специализация: определенные разновидности этого фермента присоединяют аминокислоты строго к определенным тРНК. Присоединение аминокислоты происходит в соответствии с антикодоном "среднего листика" тРНК.
Транспортные РНК (тРНК) представляют собой небольшие молекулы с количеством нуклеотидов от 70 до 90. На долю тРНК приходится примерно 15 % всех РНК клетки. Функция тРНК зависит от ее строения. Изучение структуры молекул тРНК показало, что они свернуты определенным образом и имеют вид клеверного листа (рис. 20). В молекуле выделяются петли и двойные участки, соединенные за счет взаимодействия комплементарных оснований. Наиболее важной является центральная петля, в которой находится антикодон — нуклеотидный триплет, соответствующий коду определенной аминокислоты. Своим антикодоном тРНК способна соединяться с соответствующим кодоном на иРНК по принципу комплементарности.
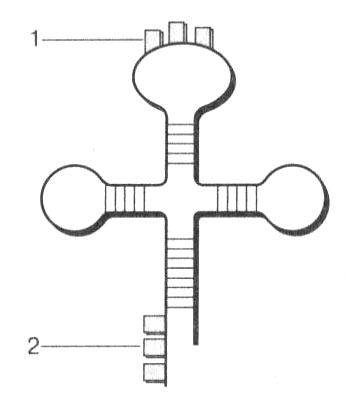
Рис. 20. Строение молекулы тРНК: 1 — антикодон; 2 — место присоединения аминокислоты
Каждая тРНК может переносить только одну из 20 аминокислот. Значит, для каждой аминокислоты имеется по меньшей мере одна тРНК. Так как аминокислота может иметь несколько триплетов, то и количество видов тРНК равно числу триплетов аминокислоты. Таким образом, общее число видов тРНК соответствует числу кодонов и равно 61. Трем стоп-кодам не соответствует ни одна тРНК.
На одном конце молекулы тРНК всегда находится нуклеотид гуанин (5'-конец), а на другом (3'-конце) всегда три нуклеотида ЦЦА. Именно к этому концу идет присоединение аминокислоты (рис. 21). Каждая аминокислота присоединяется к своей специфической тРНК с соответствующим антикодоном. Механизм этого присоединения связан с работой специфических ферментов — аминоацил-тРНК-синтетазами, которые присоединяют каждую аминокислоту к соответствующей тРНК. Для каждой аминокислоты имеется своя синтетаза. Соединение аминокислоты с тРНК осуществляется за счет энергии АТФ, при этом макроэргическая связь переходит в связь между тРНК и аминокислотой. Так происходит активирование и кодирование аминокислот.
Этапы биосинтеза белка. Процесс синтеза полипептидной цепи, осуществляемый на рибосоме, называется трансляцией. Информационная РНК (иРНК) является посредником в передаче информации о первичной структуре белка, тРНК переносит закодированные аминокислоты к месту синтеза и обеспечивает последовательность их соединений. В рибосомах осуществляется сборка полипептидной цепи.
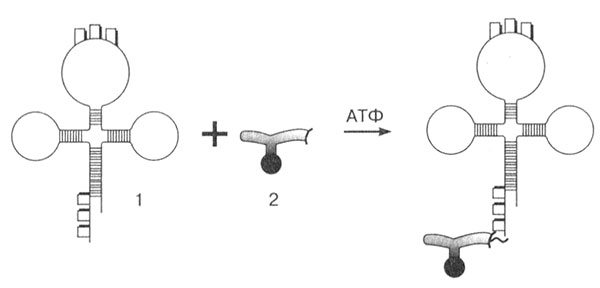
Рис. 21. Активирование и кодирование аминокислоты: 1 — тРНК; 2 — аминокислота
В рибосоме имеются три центра, с которыми связываются молекулы РНК: один центр для иPHК и два — для тРНК. Одна тРНК с аминокислотой удерживается в аминоацильном центре, а другая — в пептидном центре, где идет рост полипептидной цепи.
Первый этап — инициация. Синтезированная в процессе транскрипции иPHК выходит из ядра и направляется в цитоплазму к месту синтеза белка — рибосоме. За счет различных белковых факторов и энергии АТФ происходит соединение иPHК и двух субъединиц рибосом, которые до этого момента находились в диссоциированном состоянии. Прежде чем рибосома начнет синтез полипептидной цепи, к иРНК должна присоединиться особая молекула — инициаторная тРНК с аминокислотой. С нее всегда начинается синтез белка. По принципу комплементарности тРНК своим антикодоном соединяется с кодоном на иРНК и входит в рибосому. Этот кодон на иPHК называется старт-кодоном.
В результате взаимодействия всех компонентов образуется комплекс: рибосома — иРНК — тРНК-инициатор — аминокислота.
Вторая стадия — элонгация. Это стадия роста полипептидной цепи. Далее начинается сборка полипептидной цепи. Следующая тРНК с аминокислотой по принципу комплементарности антикодона с кодоном соединяется с иPHК и входит в рибосому. Первая тРНК закрепляется в пептидном центре, а вторая тРНК — с аминокислотой в аминоацильном центре. Аминокислоты сближаются друг с другом, между ними возникает пептидная связь, и образуется дипептид. При этом первая тРНК освобождается и, покидая рибосому, тянет за собой иPHК, которая продвигается на один триплет.
Вторая тРНК с дипептидом перемещается в пептидный центр, а в рибосому входит третья тРНК с аминокислотой (рис. 22). Весь процесс далее вновь и вновь повторяется. иРНК, последовательно продвигаясь через рибосому, каждый раз вносит новую тРНК с аминокислотой и выносит освободившуюся тРНК. Постепенно идет наращивание полипептидной цепи. Весь процесс обеспечивается деятельностью ферментов и энергией макроэргических соединений (АТФ и др.).
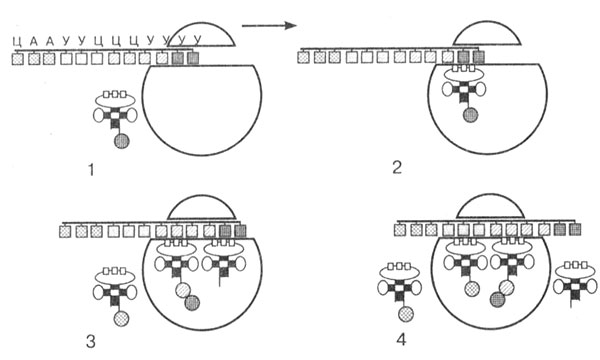
Рис. 22. Схема биосинтеза полипептидной цепи. Стрелкой показано направление движения иPHК
Последний этап — терминация. Как только в аминоацильный центр попадает стоп-кодон, синтез прекращается. Место тРНК занимает в этом случае специфический белок-фермент, который осуществляет гидролиз связи между последней тРНК и синтезированным белком. Рибосома снимается с иPHК и распадается на две субъединицы, последняя тРНК также освобождается и попадает вновь в цитоплазму. Синтезированная молекула белка поступает в ЭПС или цитоплазму, где претерпевает изменения и приобретает соответствующие структуры.
Процесс трансляции обычно осуществляется многократно. Одна иPHК может соединяться с несколькими рибосомами, образуя поли рибосому.; или полисому, на которой идет одновременно синтез многих молекул одного белка (рис. 23).
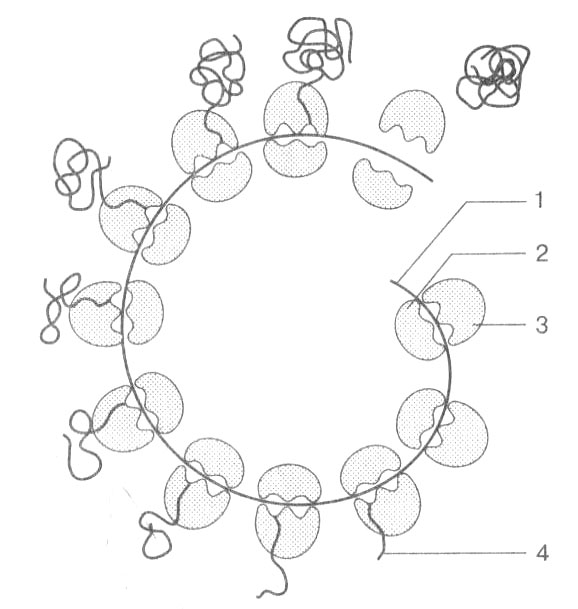
Рис. 23. Полисома: 1 — иPHК; 2 — малая субъединица рибосомы; 3 — большая субъединица рибосомы; 4 — синтезируемая полипептидная цепь
Если синтез происходит на гранулярной эндоплазматической сети, то поли пептидная цепь поступает в канальца эндоплазматической сети. Здесь она приобретает свою окончательную структуру и превращается в молекулу белка. Далее белок поступает в аппарат Гольджи и выносится из клетки. Если синтез происходит на рибосомах в цитоплазме, то синтезированные молекулы остаются и используются клеткой.
Весь процесс синтеза одного белка длится от 20 до 500 с и зависит от длины полипептида. Например, в рибосоме кишечной палочки белок из 300 аминокислот синтезируется приблизительно за 20 с.

Вторым этапом реализации генетической информации является синтез белковой молекулы на основе матричной РНК (трансляция). Однако в отличие от транскрипции нуклеотидная последовательность не может быть переведена в аминокислотную напрямую, так как эти соединения имеют разную химическую природу. Поэтому для осуществления трансляции требуется посредник в виде транспортной РНК (тРНК), функция которого состоит в переводе генетического кода на "язык" аминокислот.
Общая характеристика транспортной РНК
Транспортные РНК или тРНК - это небольшие молекулы, которые доставляют аминокислоты к месту синтеза белка (в рибосомы). Количество этого вида рибонуклеиновой кислоты в клетке составляет примерно 10 % от общего пула РНК.
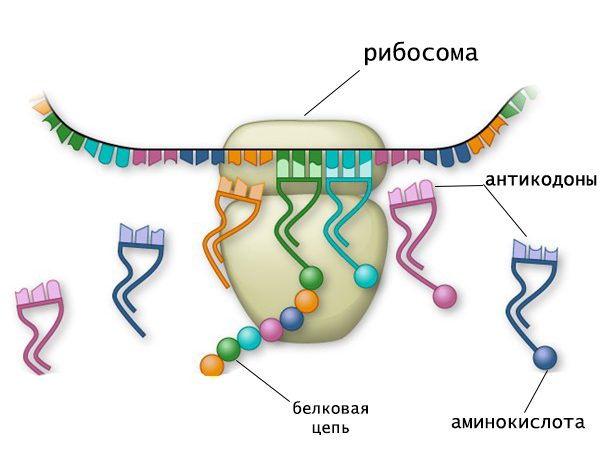
Как и другие разновидности рибонуклеиновых кислот, тРНК состоит из цепочки рибонуклеозидтрифосфатов. Длина нуклеотидной последовательности насчитывает 70-90 звеньев, и около 10 % состава молекулы приходится на минорные компоненты.
Из-за того, что каждой аминокислоте соответствует свой переносчик в виде тРНК, клетка синтезирует большое количество разновидностей этой молекулы. В зависимости от вида живого организма этот показатель варьирует от 80 до 100.
Функции тРНК
Транспортная РНК является поставщиком субстрата для белкового синтеза, который происходит в рибосомах. За счет уникальной способности связываться и с аминокислотами, и с матричной последовательностью тРНК выполняет функцию смыслового адаптера при переводе генетической информации из формы РНК в форму белка. Взаимодействие такого посредника с кодирующей матрицей, как в транскрипции, основано на принципе комплементарности азотистых оснований.
Главная функция тРНК заключается в акцептировании аминокислотных звеньев и их транспортировке в аппарат белкового синтеза. За этим техническим процессом стоит огромный биологический смысл - реализация генетического кода. Осуществление этого процесса основано на следующих особенностях:
- все аминокислоты кодируются триплетами нуклеотидов;
- для каждого триплета (или кодона) существует антикодон, входящий в состав тРНК;
- каждая тРНК может связаться только с определенной аминокислотой.
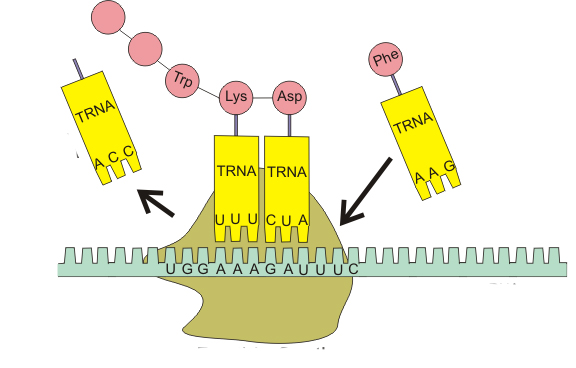
Таким образом, аминокислотная последовательность белка определяется тем, какие тРНК и в каком порядке будут комплементарно взаимодействовать с матричной РНК в процессе трансляции. Это возможно благодаря наличию в транспортной РНК функциональных центров, один из которых отвечает за избирательное присоединение аминокислоты, а другой - за связывание с кодоном. Поэтому функции и структура тРНК тесно взаимосвязаны.
Строение транспортной РНК
Уникальность тРНК заключается в том, что ее молекулярная структура не линейна. Она включает в себя спиральные двуцепочечные участки, которые называют стеблями, и 3 одноцепочечные петли. По форме такая конформация напоминает клеверный лист.
В структуре тРНК различают следующие стебли:
- акцепторный;
- антикодоновый;
- дигидроуридиловый;
- псевдоуридиловый;
- добавочный.
Двойные спирали стеблей содержат от 5 до 7 Уотсон-Криксоновских пар. На конце акцепторного стебля расположена небольшая цепочка неспаренных нуклеотидов, 3-гидроксил которой является местом прикрепления соответствующей молекулы аминокислоты.
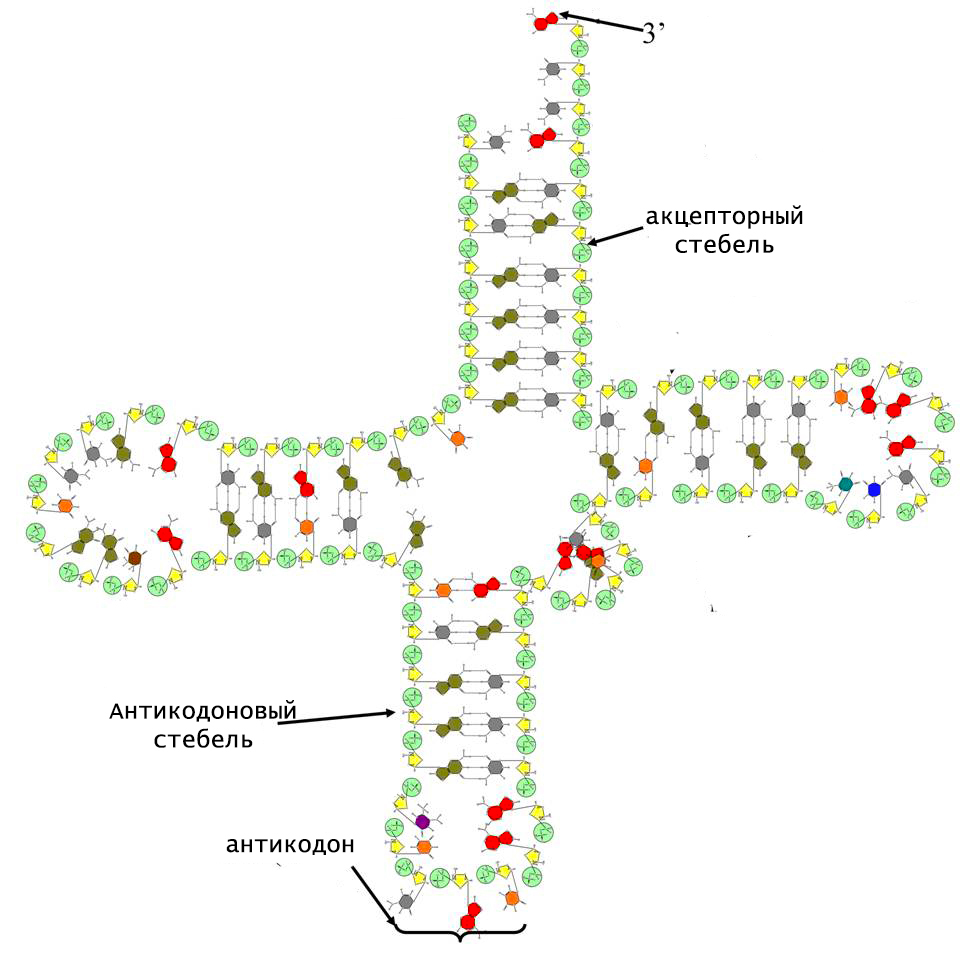
Структурной областью для соединения с мРНК служит одна из петель тРНК. Она содержит антикодон, комплементарный смысловому триплету в матричной РНК. Именно антикодон и акцептирующий конец обеспечивают адапторную функцию тРНК.
Третичная структура молекулы
"Клеверный лист" является вторичной структурой тРНК, однако за счет фолдинга молекула приобретает L-образную конформацию, которая скрепляется дополнительными водородными связями.
L-форма представляет собой третичную структуру тРНК и состоит из двух практически перпендикулярных А-РНК спиралей, имеющих длину 7 нм и толщину 2 нм. Такая форма молекулы имеет всего 2 конца, на одном из которых расположен антикодон, а на другом - акцепторный центр.
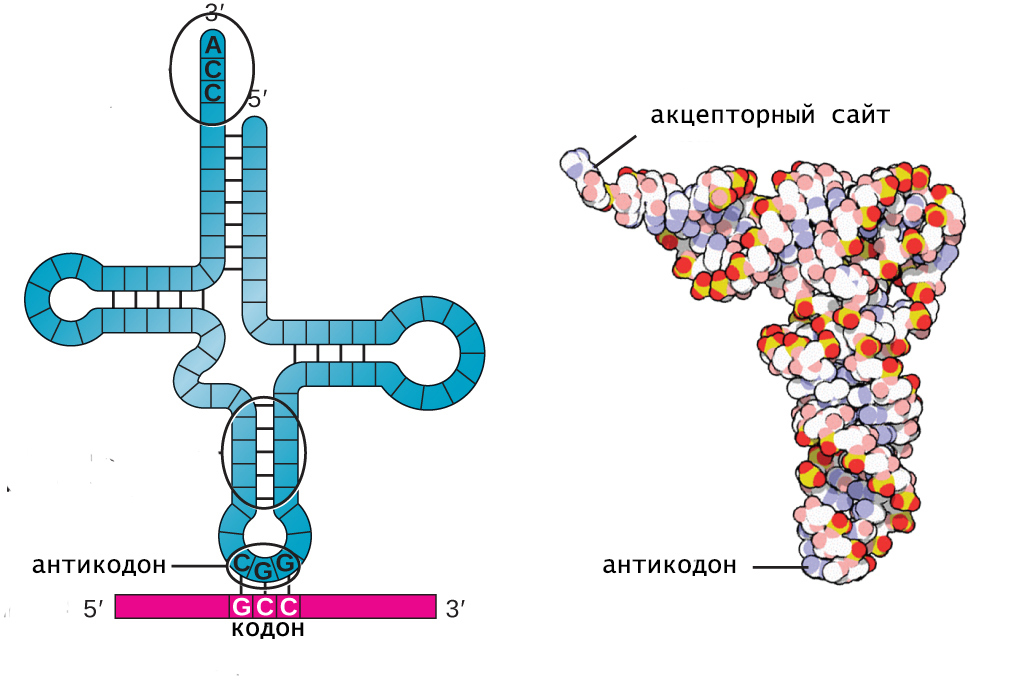
Особенности связывания тРНК с аминокислотой
Активацию аминокислот (их присоединение к транспортной РНК) осуществляет аминоацил-тРНК-синтетаза. Этот фермент одновременно выполняет 2 важных функции:
- катализирует образования ковалентной связи между 3`-гидроксильной группой акцепторного стебля и аминокислотой;
- обеспечивает принцип избирательного соответствия.
Для каждой из 20 аминокислот есть своя аминоацил-тРНК-синтетаза. Она может взаимодействовать только с соответствующим видом транспортной молекулы. Это означает, что антикодон последней должен быть комплементарен триплету, кодирующему именно эту аминокислоту. Например, синтетаза лейцина будет соединяться только с предназначеным для лейцина тРНК.
В молекуле аминоацил-тРНК-синтетазы есть три нуклеотид-связывающих кармана, конформация и заряд которых комплементарны нуклеотидам соответствующего антикодона в тРНК. Таким образом, фермент определяет нужную транспортную молекулу. Гораздо реже фрагментом опознавания служит нуклеотидная последовательность акцепторного стебля.
Читайте также:
- Есть ли глубинная внутренняя связь между автобиографической повестью детство и бедные люди кратко
- Что означает принцип чья власть того и вера кратко
- Диверсификация активов как способ снижения рисков кратко
- Деятельность это в психологии определение кратко
- Как преподавать историю в современной школе теория и методика

