Как можно отличить альдегиды от других органических веществ кратко
Обновлено: 04.07.2024
При окислении альдегидов получаются кислоты с тем же числом углеродных атомов, что и в молекуле исходного альдегида, то есть карбоновые кислоты.
Если к аммиачному раствору оксида серебра прилить раствор муравьиного альдегида, то образуется муравьиная кислота.
H-C-OH + Ag2O → H-COOH + 2Ag↓.
Второй качественной реакцией на альдегиды является реакция взаимодействия с гидроксидом меди (II).
В результате реакции выпадает кирпично-красный осадок – Cu2O -оксид меди (I).

1. Окисление метаналя (этаналя) оксидом cepe6pa(l). Тщательно вымойте пробирку. Для этого налейте в нее концентрированный раствор гидроксида натрия и несколько минут нагревайте до кипения. Затем гидроксид натрия вылейте и пробирку несколько раз промойте дистиллированной водой. B чистую пробирку налейте 2 мл свежеприготовленного раствора с массовой долей нитрата cepe6pa(l) 0,02 и к нему добавьте по каплям разбавленный раствор аммиака до растворения появившегося осадка. K полученному раствору добавьте несколько капель раствора метаналя (или этаналя). Пробирку поместите в стакан с горячей водой.
2. Окисление метаналя (этаналя) гидроксидом меди(П). B пробирку налейте 1 мл раствора с массовой долей сульфата меди(Н) 0,02 и 1 мл раствора с массовой долей гидроксида натрия 0,1. Полученную смесь нагрейте.
1. Что образуется при окислении альдегидов? Как можно отличить альдегиды от других органических веществ?
2. Почему при взаимодействии альдегидов с гидроксидом меди(И) появляется желтый, а затем красный осадок? Напишите уравнения соответствующих реакций.
*Цитирирование задания со ссылкой на учебник производится исключительно в учебных целях для лучшего понимания разбора решения задания.
Типичная реакция на альдегид - реакция серебряного зеркала, либо реакция с оксидом меди (II):
RCOH+Ag2O->RCOOH+2Ag
RCOH+2CuO->RCOOH+Cu2O
Металлы восстанавливаются до (0) и (+1) с. о. , альдегидная группа окисляется до карбоксильной.
Мы постоянно добавляем новый функционал в основной интерфейс проекта. К сожалению, старые браузеры не в состоянии качественно работать с современными программными продуктами. Для корректной работы используйте последние версии браузеров Chrome, Mozilla Firefox, Opera, Microsoft Edge или установите браузер Atom.
Альдегиды являются летучими жидкостями с составом органического происхождения. Продукт получают в результате неполного окисления спиртов.
Можно отметить связь между карбонильной группы, которой характеризуются молекулы альдегидов, с одним атомом водорода и одной группой R. Вещества редко можно встретить в природе, как отдельный вид. Альдегиды обладают большим значением для физиологических процессов растительных и животных организмов.
Общая формула альдегидов имеет следующий вид: СнН2nO.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Альдегиды относятся к отдельному классу неких органических соединений, которые в любом случае обладают группой СНО, то есть альдегидной группой.
В рассматриваемых веществах типа R-CHO карбонильная группа прямо связана с атомом водорода (одним) и группой R (тоже одной). Примеры альдегидов представлены в таблице.

- метаналь;
- этаналь;
- пропаналь;
- бутаналь;
- пентаналь и другие.
Встречаются молекулярные формулы альдегидов с группой ОН, записанной наоборот, то есть НО. Такая методика позволяет достаточно просто отличать вещества от спиртов. К примеру:
- метаналь — HCHO;
- этаналь — CH3CHO;
- пропаналь — C2H5CHO.
В случае многих альдегидов применяют правильные формулировки. Самыми распространенными являются:
- 1 метаналь — формальдегид;
- 2 этаналь — ацетальдегид.
Классификация альдегидов
Простейшим альдегидом является формальдегид. Вещество обладает молекулой, которая связана с двумя атомами водорода. Все другие примеры альдегидов отличаются тем, что их молекулы обладают связью только с одним атомом водорода. Углерод, который связан с карбонильной группой, может являться частью алкильных или неалькильных групп. Данные группы, в свою очередь, могут относиться к ациклическим, ароматическим или гетероциклическим кольцам.
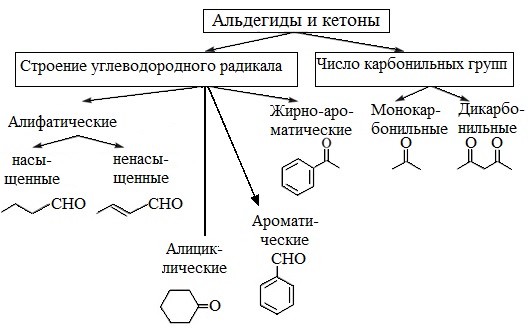
Соединения органического состава с двумя альдегидными группами носят название диальдегидов.
По строению углеводородного радикала
Исходя из данного критерия, выделяют следующие виды веществ:


- 3 ароматические, как бензальдегид или бензойный альдегид:

- 4 алициклические, к примеру, циклогек санкарбальдегид:
В зависимости от числа карбонильных групп
Классификация альдегидов, согласно числу карбонильных групп, представлена на схеме.
Физические и химические свойства, как действуют на живые организмы
Практически для всех альдегидов характерна способность вступать в разные химические реакции, в том числе полимеризацию. При контакте с другими типами молекул вещества преобразуются в так называемые конденсационные полимеры. Полученные материалы нашли широкое применение в производстве пластмассы, их активно используют, как растворители и компоненты парфюмерной продукции. Некоторые виды альдегидов являются участниками физиологических процессов. К примеру, вещества входят в состав:
- витамина А, который важен для зрения;
- пиридоксальфосфата, как одна из форм витамина В6;
- глюкозы и других редуцированных сахаров;
- определенных гормонов синтетического и природного происхождения.
Ключевое отличие альдегидов от углеродов заключается в присутствии у них карбонильной группы. Она отличается полярностью, то есть электроны, которые образуют связь С=0 притягиваются сильнее к кислороду, чем к углероду. В связи с этим, первый из электронов заряжается отрицательно, а второй — положительно.
Можно отметить наличие у альдегидов более высокого дипольного момента. Это отличает вещества от других углеводородных соединений.
Альдегиды представляют собой реакционноспособные соединения, которые могут вступать в различные реакции. Наиболее распространены следующие реакции:
- 1 присоединение, согласно карбонильной группе, таким образом, как присоединяются реагенты с типом НХ:

- 2 реакции окисления связи C-H альдегидной группы, что в итоге приводит к образованию карбоновых кислот.
Реакция присоединения альдегидов отличается по механизмам. В результате гидрирования образуются первичные спирты:

При присоединении спиртов получают полуацетали и ацетали:

В том случае, когда наблюдается избыток спирта, при наличии HCl полуацетали трансформируются в ацетали:


В упрощенном виде схему можно записать так:

Данная реакция представляет собой качественную реакцию на альдегидную группу. В процессе эксперимента можно наблюдать, как стенки реакционного сосуда будут покрываться зеркальным налетом металлического серебра.
Другая реакция окисления протекает при контакте с гидроксидом меди (II). Схема процесса:

Рассматриваемая реакция также относится к категории качественных реакций на альдегидную группу. В итоге образуется красный осадок Cu2O.
Окисление формальдегида с помощью различных О-содержащих окислителей в первую очередь приводит к образованию муравьиной кислоты, а затем — Н2СO3(СO2 + Н2O):

Альдегиды вступают в реакции ди-, три- и полимеризации. Альдольная конденсация протекает, таким образом:

Схема тримеризации ацетальдегида:

Полимеризация формальдегида обладает определенными особенностями. В процессе длительного хранения формалина в виде 40% водного раствора формальдегида можно наблюдать полимеризацию, в результате чего образуется белый осадок параформа:

Реакция поликонденсации формальдегида с фенолом протекает, таким образом:

Формальдегид превращается в углеводы в результате следующей реакции:

Каким образом формальдегид взаимодействует с аммиаком, можно наблюдать на схеме в электронном виде:

Температура кипения альдегидов и их плавления гораздо выше у карбонилсодержащих соединений, нежели у просто состоящих из углерода и водорода. Например, при одинаковой молекулярной массе бутан и ацетон достигают состояния кипения неодинаково. Температура для бутана в данном случае составляет 0 градусов, а ацетон кипит при 56 градусах.
Альдегиды растворяются в воде, что отличает их от углеводородов. Данное свойство характерно только для тех веществ, которые обладают менее пятью атомами углерода в молекуле. В том случае, когда углеводородная часть их молекул превышает этот показатель, материал не растворяется водой.
Физические свойства альдегидов:

Где и как используются альдегиды
Благодаря тому, что альдегиды являются одним из ключевых строительных компонентов органической химии, вещества нашли широкое применение в разных сферах хозяйственной деятельности человека. Получают и производят материалы с помощью разных методик:
- Окисление представляет собой основной способ получения альдегидов. Как правило, спирты, в том числе бензольный, бутиловый, гликолевый, изомасляный, метиловый, салициловый,
окисляют, что приводит к образованию альдегидов. В процессе первичный спирт пропускают через нагретый катализатор в виде гидроксида меди, либо через аммиачный раствор оксида серебра. Данный способ не применим в условиях небольших лабораторий. - Гидроформилирование является еще одним методом, позволяющим получить альдегиды. При этом алкены обрабатывают монооксидом углерода, водородом и катализатором, в основе которого переходный металл.
- Один из альдегидов в виде ацетальдегида могут получать с помощью реакции взаимодействия ацетилена с водой.
Распространено коммерческое получение альдегидов, как и ацетатов. В данном случае целесообразно воспользоваться методом гидроформилирования.
Алкены получают в результате следующей реакции:

Каталитическое окисление первичных спиртов протекает по следующей схеме:

Первичные спирты окисляют разными окислителями:

Реакция каталитического дегидрирования первичных спиртов:

Схема протекания щелочного гидролиза дигалогеналканов, которые содержат атомы галогена у первичного атома углерода:

В процессе гидролиза дигалогеналканов, обладающих атомами галогена у вторичного атома углерода, формируются кетоны:

К особым методам получения формальдегида и ацетальдегида относят реакции из списка:


Альдегиды нашли широкое применение в разных отраслях промышленности. Соединения этих веществ используют в химии для синтезирования других материалов. К примеру, с помощью формальдегида получают формалин, который незаменим в дублении, консервации и бальзамировании, а также применяется, как фунгицидное и бактериальное средство для обработки растений.
Для альдегидов с высокой молекулярной массой таких, как бензальдегид и фенилацетальдегид, характерен приятных запах, что позволяет использовать их в качестве компонентов парфюмерной продукции.
Читайте также:
- Годовой план работы учителя логопеда в доу на 2019 2020 учебный
- Проект по экспериментированию с водой в доу
- Как соотносятся понятия земельные ресурсы и почвенные ресурсы кратко
- К научным направлениям в философии права относят естественное право историческая школа и что еще
- Интересы каких слоев общества отстаивали пресвитериане индепенденты левеллеры кратко

