Из каких веществ получают водород для опытов в школе
Обновлено: 05.07.2024
Свидетельство и скидка на обучение каждому участнику
Зарегистрироваться 15–17 марта 2022 г.
АДМИНИСТРАЦИЯ ГОРОДА НИЖНЕГО НОВГОРОДА
Департамент образования
Муниципальное бюджетное общеобразовательное учреждение
603044, г. Нижний Новгород, проспект Героев, д. 20
тел. (8312) 270-19-59
Малая научно – исследовательская работа
Научный руководитель:
учитель химии Полежаева Э. Д.
г. Нижний Новгород
Содержание стр .
Глава 1 Обзор литературы 5-13
Глава 2 Методика исследования и результаты экспериментальной работы 14-15
2.1 Получение водорода в лабораторных условиях 14 2.2 Изучение свойств водорода 2.2.1 Взаимодействие с кислородом 14 2.2.2Взаимодействие с оксидом меди ( II ) 15 2.2.3 Образование мыльных пузырей 15
Выводы 16 Заключение 17
Список используемых источников и литературы 18
Что же такое водород? Водород - первый элемент периодической системы Д.И. Менделеева. Чем же так интересен и важен для человека водород? Исследования Солнца, звёзд, межзвёздного пространства показывают, что самым распространённым элементом Вселенной является водород (в космосе в виде раскалённой плазмы он составляет 70 % массы Солнца и звёзд). Превращения, которые происходят с водородом при гигантском давлении и температуре в десятки миллионов градусов, дают возможность Солнцу излучать тепло и свет. Нет опасений, что на Солнце скоро иссякнут запасы водорода. Оно существует миллиарды лет, а запас водорода в нём достаточен для того, чтобы обеспечить ещё столько же лет горения. Человек живёт в водородно-гелиевой вселенной. Поэтому водород представляет для нас очень большой интерес. Влияние и польза водорода в наши дни очень велика. На Земле водород тоже играет очень большую роль. Массовая доля водорода в земной коре составляет 1 % — это девятый по распространенности элемент. Однако его роль в природе определяется не массой, а числом атомов, доля которых среди остальных элементов составляет 17 %. Больше всего различных соединений водород образует с углеродом: нефть и горючие сланцы, бензин и черный асфальт. Такие соединения называются углеводородами. Водород широко применяется при сварке и резке металлов. Если к соединениям углерода и водорода добавить кислород, получаются новые, соединения - углеводы, например, такие не похожие друг на друга вещества, как крахмал и сахар. А если водород соединить с азотом, получится газ - аммиак. Он необходим для изготовления удобрений. Водород входит в состав всех животных и растительных организмов.
Много достоинств у водорода - экологически безвреден, энергоемок, находится в природе в изобилии и это позволяет использовать его как ракетное топливо. Те же особенности водорода делают его перспективным и в качестве топлива авиационного.
Предмет исследования - физические и химические свойства водорода
Цель работы: получение водорода и изучение его свойств .
Изучить теоретический материал, касающийся водорода и его свойств;
Выяснить, кто открыл водород и откуда появилось это название;
Расширить представления о физических и химических свойствах водорода;
Узнать, каковы области применения водорода;
Получить водород и изучить его свойства экспериментально .
Глава 1 Обзор литературы
1.1 Нахождение в природе
Водород — самый распространённый элемент во Вселенной. На его долю приходится около 88,6 % всех атомов.Водород — основная составная часть звёзд и межзвёздного газа. Он играет ключевую роль в протекающих в звездах реакциях синтеза. По некоторым расчётам, каждую секунду в глубинах Солнца примерно 564 млн. тонн водорода в результате термоядерного синтеза превращаются в 560 млн. тонн гелия, а 4 млн. тонн водорода превращаются в мощное излучение, которое уходит в космическое пространство. Водород – один из наиболее распространённых элементов и на Земле. В земной коре из каждых 100 атомов 17 – атомы водорода. Он составляет примерно 0,88 % от массы земного шара (включая атмосферу, литосферу и гидросферу). Если вспомнить, что воды на земной поверхности более 1,5∙1018 м 3 и что массовая доля водорода в воде составляет 11,19 %, то становится ясно, что сырья для получения водорода на Земле – неограниченное количество. Водород входит в состав нефти (10,9 – 13,8 %), древесины (6 %), угля (бурый уголь – 5,5%), природного газа (25,13 %). Водород входит в состав всех животных и растительных организмов. Он содержится и в вулканических газах. Основная масса водорода попадает в атмосферу в результате биологических процессов. При разложении в анаэробных условиях миллиардов тонн растительных остатков в воздух выделяется значительное количество водорода. Этот водород в атмосфере быстро рассеивается и диффундирует в верхние слои атмосферы. Имея малую массу, молекулы водорода обладают высокой скоростью диффузионного движения (она близка ко второй космической скорости) и, попадая в верхние слои атмосферы, могут улететь в космическое пространст-во. Концентрация водорода в верхних слоях атмосферы составляет 1∙10-4 %.
История открытия водорода
Странным на первый взгляд делом занялся однажды английский ученый Генри Кавендиш: он стал пускать мыльные пузыри. Но это не было развлечением. Перед этим он заметил, что, когда железные опилки обливают серной кислотой, появляется много пузырьков какого-то газа. Что это за газ?
1.3 Характеристика химического элемента водорода
Водород - это элемент первой группы главной подгруппы в первом малом периоде. Данный период состоит всего из двух атомов: гелия и рассматриваемого нами элемента. Порядковый номер водорода - 1, количество электронов такое же, соответственно, протонов столько же. Атомная масса - 1,00795. Благодаря совсем маленькой атомной массе, водород считается самым легким элементом. Кроме того, его плотность также очень мала, поэтому он также является эталоном легкости. Таким образом, очевидно, что атом водорода - это совершенно уникальный, непохожий на все остальные элемент. Следовательно, свойства его тоже особенные, а образуемые простые и сложные вещества очень важны. В одород (простое вещество) - это газ. Его эмпирическая формула записываться как Н 2.
1.4 Водород простое вещество
Молекулы водорода образованы двумя атомами химического элемента водорода. Формула его Н 2 . Относительная молекулярная масса простого вещества водорода равна: Mr ( H 2 ) =2 Ar ( H ) =2. Следовательно, молярная масса водорода равна: M ( H 2 ) =2г/моль Молярный объем водорода, как и других газов при нормальных условиях, равен: Vm ( H 2 )=22,4 л/моль. Молекула водорода самая легкая из молекул всех веществ. Поэтому газообразный водород по плотности значительно уступает воздуху и кислороду — он в 14,5 раза легче воздуха и в 16 раз легче кислорода. В виде простого вещества водород встречается на Земле лишь в небольшом количестве в вулканических и некоторых других природных газах. Молекулы водорода Н 2 обнаружены в верхних слоях земной атмосферы. В Солнечной системе простое вещество водород входит в состав атмосферы планет — Юпитера, Сатурна, Урана.
1.4.1 Физические свойства водорода.
При обычных условиях водород - это газ, не имеющий запаха, цвета и вкуса. Это самое лёгкое вещество на Земле. Его плотность равна примерно 0,9г/дм³. В воде водород растворяется плохо (примерно 2 объёма на 100 объёмов воды), но может поглощаться некоторыми металлами. Например, 1 объём палладия может растворить до 900 объёмов водорода.
Температура кипения - (-252,6 0 С). Температура плавления - (-259,1 0 С). В обозначенном интервале температур является бесцветной жидкостью, не имеющей запаха. Жидкий водород замерзает, превращаясь в бесцветные кристаллы. 2 Является горючим и взрывоопасным веществом. Кристаллическая решетка простого вещества молекулярная. Водород - неметалл.
1.4.2 Химические свойства водорода.
В соединениях водород всегда одновалентен.
Молекула водорода состоит из двух атомов. Возникновение связи между ними объясняется образованием обобщенной пары электронов Н:Н или Н 2
Благодаря этому обобщению электронов молекула Н 2 более энергетически устойчива, чем его отдельные атомы. Чтобы разорвать в 1 моль водорода молекулы на атомы, необходимо затратить энергию 436 кДж.
Этим объясняется сравнительно небольшая активность молекулярного водорода при обычной температуре.
Со многими неметаллами водород образует газообразные соединения типа RН 4 , RН 3 , RН 2 , RН.
При нагревании водород вступает в реакции соединения с простыми веществами — кислородом, хлором, азотом, серой и углеродом.
1) С галогенами образует галогеноводороды:
Н 2 + Cl 2 → 2НСl.
2) С кислородом - воду:
2Н 2 + О 2 → 2Н 2 О
При обычных температурах реакция протекает медленно, выше 550°С — со взрывом. Смесь 2 объемов Н 2 и 1 объема О 2 называется гремучим газом.
3) При нагревании энергично реагирует с серой с образованием сероводорода:
Н 2 + S → H 2 S
4) С азотом с образованием аммиака лишь на катализаторе и при повышенных температурах и давлениях:
ЗН 2 + N 2 → 2NН 3
5) С углеродом при высоких температурах образует метан:
2Н 2 + С → СН 4
6) С щелочными и щелочноземельными металлами образует гидриды :
Н 2 + 2Li → 2LiH
Со сложными веществами:
7) С оксидами металлов (используется для восстановления металлов):
CuO + H 2 → Cu + H 2 O
Fe 3 O 4 + 4H 2 → 3Fe + 4Н 2 О
1.5 Получение водорода.
Существует множество различных способов получения водорода. Одни из них применяются уже давно, другие – это современные разработки. Очевидно, что при огромных объемах промышленного производства сырьем для получения водорода должны быть легкодоступные и дешевые вещества. Такими веществами являются природный газ (метан СН 4 ) и вода. Запасы природного газа очень велики, а воды — практически неограниченны.
1.5.1 Промышленные способы получения водорода:
Паровая конверсия метана;
Газификация угля - процесс подразумевает нагревание угля до 1000 0С, в результате чего образуется водород и высокоуглеродный уголь;
Сырьем для получения водорода является природный газ, уголь и нефть. И здесь возникает самая большая проблема из-за вредных выбросов при использовании этих ресурсов. Поэтому можно с уверенностью сказать, что самый экологически чистый способ получения водорода – это электролиз водных растворов солей (например, NaCI , Na 2 SO 4 ). 3
1.5.2 Лабораторные способы получения водорода :
Действие разбавленных кислот на металлы:
Zn +2HCl → ZnCl 2 +H 2 ↑
При воздействии кислот на металлы. Как правило, используется цинк в гранулах и 10-20% раствор серной (либо соляной) кислоты. Сам процесс происходит в аппарате Киппа. Он позволяет прерывать, либо возобновлять реакцию по мере необходимости.
Взаимодействие щелочных и щелочноземельных металлов с водой:
Ca +2H 2 O → Ca(OH) 2 +H 2 ↑
Гидролиз гидридов: гидриды металлов легко разлагаются водой с образованием соответствующей щелочи и водорода:
NaH +H 2 O → NaOH +H 2 ↑
СаH 2 + 2Н 2 О = Са(ОН) 2 + 2Н 2 ↑
Действие щелочей на цинк или алюминий :
2Al +2NaOH +6H 2 O → 2Na[Al(OH) 4 ] +3H 2 ↑
Zn +2KOH +2H 2 O → K 2 [Zn(OH) 4 ] +H 2 ↑
Электролиз воды. Для увеличения электрической проводимости воды к ней добавляют электролит, например NаОН, Н 2 SO 4 или Na 2 SO 4 . На катоде образуется 2 объема водорода, на аноде — 1 объем кислорода.
2H 2 O → 2H 2 +О 2
1.6 Применение водорода
Водород получают в газообразном виде и, если для использования необходим жидкий водород, его подвергают глубокому охлаждению и ожижению. Мировое промышленное производство водорода измеряет- ся десятками миллионов тонн в год. Так как водород в 14,5 раз легче воздуха, и если им наполнить воздушные шары, они будут отдаляться от Земли со скоростью 85 км в час, что в два раза превышает скорость шаров, наполненных гелием, и в шесть раз - скорость шаров, наполнен- ных природным газом. Первыми поднялись на воздушном шаре заполненном водородом французские физики Ф. Робер и Ж. Шарль (1783). С 1852 года -- с тех самых пор, как первый дирижабль на основе водорода был создан Генри Гиффардом -- водород использовал- ся в воздухоплавании.
Глава 2 Методика исследования и результаты
экспериментальной работы
2.1 П олучения водорода и з цинка и соляной кислоты
Действие разбавленных кислот на металлы:
Zn +2HCl → ZnCl 2 +H 2 ↑
Опыт №1. Для опыта нам понадобится аппарат Кирюшкина. Поместили в аппарат несколько кусочков цинка и добавили 10% -ную соляную кислоту. Чтобы собрать выделяемый водород берем еще одну пробирку (перевернутую вверх дном) и вставляем в нее газоотводную трубку. В пробирке начинает накапливаться водород. Важно помнить, что в пробирке также присутствует и кислород (в составе воздуха), а вместе эти два газа представляют собой взрывоопасную смесь. Поэтому следует позаботиться о технике безопасности.
2.2 Изучение химических свойств водорода
2.2.1 Взаимодействие с кислородом:
2Н 2 + О 2 → 2Н 2 О
с выделением тепла. При обычных температурах реакция протекает медленно, выше 550°С — со взрывом. Смесь 2 объемов Н 2 и 1 объема О 2 называется гремучим газом.
Опыт №1 . Проверка водорода на чистоту и горение. Поднесем к пламени горящей спиртовке пробирку, в которой собран водород.
2.2.2 Взаимодействие с оксидами металлов (используется для восстановления металлов):
CuO + H 2 → Cu + H 2 O
Опыт №2 . Поместим в пробирку немного черного порошка оксида меди ( II ). В эту же пробирку внесем газоотводную трубку от аппарата Кирюшкина, в котором мы получили водород. Пробирку с оксидом нагреем на пламени спиртовки.
Результат: наблюдаем изменение окраски черного порошка на красный (это металл – медь) и образование на стенках пробирки капелек воды .
2.2.3 Образование мыльных пузырей
Источник водорода – аппарат Кирюшкина. Выделяющийся в результате реакции водород при открытом кране выходит по газоотводной трубке. Подносим конец газоотводной трубки к фарфоровой чашке в которой находится мыльный раствор. Содержимое фарфоровой чашки начинает пузыриться. Мыльные пузыри, заполненные водородом, стремятся вверх. Водород – газ, который значительно легче воздуха.
На основании изучение данной темы можно сделать следующие выводы:
2. Водород это газ, который можно получать в школьной лаборатории, н о необходимо соблюдать правила по технике безопасности, так как этот газ взрывоопасен. При горении он образует воду.
3. Водород восстанавливает металлы из их оксидов, в результате реакции нами были получены - медь ( это металл красного цвета) и вода;
4.Водород очень лёгок и в воздухе всегда поднимается вверх. Когда-то дирижабли и воздушные шары наполняли водородом. Но в 30-х гг. XX в. произошло несколько катастроф, в ходе которых дирижабли взрывались и сгорали. Во время блокады Ленинграда город защищали от бомбежек аэростатами заполненными водородом. В наше время дирижабли наполняют гелием, несмотря на его существенно более высокую стоимость.
В заключение мне хотелось бы сказать, что в одород очень важное, незаменимое и интереснейшее вещество. Он – самый распространенный элемент во Вселенной. Энергия, излучаемая Солнцем и другими звёздами, выделяется в результате ядерных реакций с участием его ядер. В земной коре он встречается почти исключительно в виде соединений: входит в состав нефти, природного газа, каменного угля, некоторых минералов. Самое известное соединение водорода – это его оксид, вода.
В ходе работы я узнал, что у нас есть возможность изменить экологическую обстановку на Земле, уменьшить выброс вредных веществ в атмосферу. Водород не без оснований называют чудесным топливом будущего. т.к, при его использовании не образуются парниковые газы и не нарушается круговорот воды в природе.
Цель работы: получить водород в реакции кислоты с металлом, собрать полученный газ и исследовать его свойства.
Реактивы и оборудование: раствор хлороводородной кислоты, гранулы цинка (или кусочки железа), части прибора для получения газов, стаканчик или пробирка с водой, пробирка для собирания водорода, спиртовка, спички, лучинка.
Опыт 1. Получение водорода.
Соберите прибор для получения водорода и проверьте его на герметичность. Положите в пробирку несколько гранул цинка и прилейте к ним небольшой объем (1-2 см 3 ) раствора хлороводородной кислоты. Быстро закройте пробирку пробкой с газоотводной трубкой, конец которой погрузите в стаканчик или пробирку с водой.

Опыт 2. Изучение свойств водорода.
Физические свойства водорода. Наблюдая за протеканием опыта 1, обратите внимание на отсутствие окраски у водорода. Растворяется ли водород в воде?
Химические свойства водорода. Соберите водород. Для этого газоотводную трубку извлеките из воды и введите в пробирку, закрепленную в штативе вверх дном. Вспомните, почему пробирка должна быть расположена именно так. Примерно через 1 минуту осторожно извлеките газоотводную трубку и к отверстию пробирки поднесите горящую лучинку или спичку. Какой признак свидетельствует о протекании химической реакции? Какое химическое свойство проявляет водород в этой реакции?
Составьте отчет о проделанной работе. Сделайте вывод о способе получения водорода в лаборатории, о его физических и химических свойствах, которые вы исследовали. Составьте соответствующие уравнения химических реакций.
ОТВЕТЫ
Опыт 1.
Для цинка
Zn + 2HCl = ZnCl2 + H2
Это реакция замещения. Её продуктами являются хлорид цинка и водород.
Для железа
Fe + 2HCl = FeCl2 + H2
Это реакция замещения. Её продуктами являются хлорид железа (II) и водород.
Опыт 2.
Водород в воде практически нерастворим.
Для собирания водорода пробирку нужно держать вверх дном потому, что водород легче воздуха.
При поднесении горящей лучины (спички) к отверстию пробирки с водородом мы слышим хлопок – происходит взрыв в результате взаимодействия кислорода воздуха с водородом. В результате этой реакции на стенках пробирки можно увидеть капельки прозрачной жидкости – воды.
2H2 + O2 = 2H2
В этой химической реакции водород проявляет свойство горючести.
Вывод: мы научились получать водород в лабораторных условиях путем взаимодействия металла (цинка или железа) с кислотой (хлороводородная кислота). При собирании водорода пробирку держат дном вверх, т.к. водород легче воздуха.
Физические свойства водорода: газ без цвета и запаха, нерастворим в воде, легче воздуха.
Химические свойства водорода: при поджигании происходит взрывная реакция горения с кислородом воздуха с образованием воды.

Водород находит широкое применение в технике и лабораторных исследованиях. Мировое промышленное производство водорода из меряется десятками миллионов тонн в год.
Выбор промышленного способа получения простых веществ зависит от того, в какой форме соответствующий элемент находится в природе. Водород находится в природе преимущественно в соединениях с атомами других элементов. Поэтому для его получения необходимо использовать химические методы. Эти же методы применяют для получения водорода и в лабораторной практике.
Получение водорода в лаборатории
В лабораториях водород получают уже известным вам способом, действуя кислотами на металлы: железо, цинк и др. Поместим на дно пробирки три гранулы цинка и прильем небольшой объем соляной кислоты. Там, где кислота соприкасается с цинком (на поверхности гранул), появляются пузырьки бесцветного газа, которые быстро поднимаются к поверхности раствора:
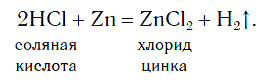
Атомы цинка замещают атомы водорода в молекулах кислоты, в результате чего образуется простое вещество водород Н2, пузырьки которого выделяются из раствора. Для получения водорода таким способом можно использовать не только хлороводородную кислоту и цинк, но и некоторые другие кислоты и металлы.
В химических лабораториях для получения относительно небольших объемов водорода обычно применяют способ разложения воды с помощью электрического тока:
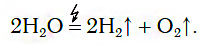
Из уравнения процесса разложения следует, что из 2 моль воды образуются 2 моль водорода и 1 моль кислорода. Следовательно, и соотношение объемов этих газов также равно:
![]()
Получение водорода в промышленности
Очевидно, что при огромных объемах промышленного производства сырьем для получения водорода должны быть легкодоступные и дешевые вещества. Такими веществами являются природный газ (метан СН4) и вода. Запасы природного газа очень велики, а воды — практически неограниченны.
Самый дешевый способ получения водорода — разложение метана при нагревании:
Эту реакцию проводят при температуре около 1000 °С.
В промышленности водород также получают, пропуская водяные пары над раскаленным углем:
![]()
Существуют и другие промышленные способы получения водорода.
Применение водорода
Водород находит широкое практическое применение. Основные области его промышленного использования показаны на рисунке 103.
В большом количестве водород расходуется на получение хлороводородной кислоты. Реакция горения водорода в
кислороде используется в ракетных двигателях, выводящих в космос летательные аппараты. Водород применяют и для получения металлов из оксидов. Таким способом получают тугоплавкие металлы молибден и вольфрам.
В пищевой промышленности водород используют в производстве маргарина из растительных масел. Реакцию горения водорода в кислороде применяют для сварочных работ. Если использовать специальные горелки, то можно повысить температуру пламени до 4000 о С. При такой температуре проводят сварочные работы с самыми тугоплавкими материалами.

В настоящее время в ряде стран, в том числе и в Беларуси, начаты исследования по замене невозобновляемых источников энергии (нефти, газа, угля) на водород. При сгорании водорода в кислороде образуется экологически чистый продукт — вода. А углекислый газ, вызывающий парниковый эффект (потепление окружающей среды), не выделяется.
Предполагают, что с середины XXI в. должно быть начато серийное производство автомобилей на водороде. Широкое применение найдут домашние топливные элементы, работа которых также основана на окислении водорода кислородом.
Краткие выводы урока:
- В лаборатории водород получают действием кислот на металлы.
- В промышленности для получения водорода используют доступное и дешевое сырье — природный газ, воду.
- Водород — это перспективный источник энергии XXI в.

Данная разработка содержит материал, исслюстрирующий основные способы получения водорода и его свойства: физические и химические.
Успешное изучение основ химии в школе совершенно невозможно без использования учебного химического эксперимента, поскольку он играет большую роль в развитии химической науки. Формирование понятий о веществах и их превращениях в курсе химии, а на основе этого и теоретических обобщений невозможно без конкретного наблюдения за веществами. В то же время для объяснения сущности наблюдаемых химических явлений и процессов, протекающих в ходе выполнения химического эксперимента, от учащихся требуется глубокое знание законов и теорий. Поэтому только в тесном взаимодействии эксперимента и теории в учебном процессе можно достигнуть высокого качества знаний у учащихся по химии.
Методическая база ученического эксперимента по химии разработана очень детально в виде подробных и конкретных указаний по технике выполнения лабораторных опытов. Что же касается школьного демонстрационного эксперимента, то его методическая обеспеченность на сегодняшний день ещё не соответствует желаемому уровню и представлена, в основном, отдельными и разрозненными публикациями в методических журналах и книгах. Богатый материал по демонстрационному эксперименту имеется в методической литературе для вузов, однако он, по понятным причинам, совершенно не адаптирован к условиям школы. Поэтому совершенно очевидна острая необходимость в такого рода методической литературе, адресованной школьным учителям.
тема (темы), при изучении которых целесообразна демонстрация опыта;
подготовка к демонстрации;
объяснение наблюдаемых явлений.
Все предлагаемые методики проверены экспериментально в условиях учебной лаборатории и не представляют опасности для учителя и учеников.
• разбавленная (1:2) хлороводородная кислота (НС1) или разбавленная (1:4) серная кислота (H2SО4);
• гранулированный цинк (Zn);
раствор любой соли меди(II) с массовой её долей 10 %;
щелочной раствор перманганата калия с массовой его долей 1—2 %;
• концентрированная серная кислота. Оборудование:
• аппарат Киппа с предохранительной воронкой Вельтера;
большая стеклянная воронка;
промывные склянки Дрекселя или Тищенко;
прямые и изогнутые стеклянные трубки;
штатив с пробирками;
кристаллизатор с водой;
• медная трубка длиной 8—10 см и внутренним диаметром 5—6 мм.
Подготовка к демонстрации
Добавьте в раствор кислоты 4—5 капель раствора соли меди(II) и перемешайте жидкость.
Демонстрация опыта
I. Зарядка аппарата и получение водорода.
Через верхний тубус с помощью пробирки загрузите в средний резервуар аппарата Киппа гранулированный цинк массой 100—150 г. Следите за тем, чтобы гранулы металла не попали в нижнее полушарие аппарата.
При открытом верхнем тубусе осторожно через химическую воронку наливайте раствор кислоты в шарообразную воронку до тех пор, пока он не заполнит нижнее полушарие и не поднимется в средний шар на 1/3 его высоты. При этом весь цинк должен быть покрыт раствором кислоты.
Внимание! Старайтесь не вдыхать газовую смесь, выходящую из верхнего тубуса!
Быстро закройте верхний тубус пробкой с газоотводной трубкой и убедитесь в герметичности прибора. Для этого закройте кран аппарата и подождите 10 секунд. Если аппарат герметичен, то раствор кислоты под давлением выделяющегося газа будет опускаться из центрального шара в
нижнее полушарие, а из него по трубке подниматься в шарообразную воронку. В противном случае следует обязательно устранить причину негерметичности или заменить прибор на другой. Откройте кран аппарата, а газоотводную трубку опустите в стакан с водой.
Если в аппарате используется соляная кислота, то в отверстие шарообразной воронки вставьте предохранительную воронку Вельтера, предварительно заполнив её водой до половины высоты шарообразных утолщений. Эта воронка предназначена для поглощения газообразной соляной кислоты, которая выделяется из нагревшегося раствора в шарообразной воронке аппарата Киппа.
II. Проверка водорода на чистоту.
Внимание! Смеси водорода с воздухом взрывоопасны! Перед демонстрацией химических свойств водорода его нужно в обязательном порядке тщательно и многократно проверить на чистоту!
На расстоянии не менее 1 м от аппарата Киппа установите спиртовку и зажгите её.
Откройте кран аппарата Киппа и через 1—2 минуты соберите выделяющийся газ в пробирку методом вытеснения воды. Для этого наполненную водой пробирку закройте пальцем, переверните вверх дном и, опустив в воду, откройте отверстие.
Изогнутую газоотводную трубку, из которой выделяется водород, подведите под отверстие пробирки и заполните её газом.
Удерживая пробирку с газом в воде, закройте кран аппарата и уберите газоотводную трубку в сторону от пламени. Под водой закройте пробирку большим пальцем и поднесите к пламени спиртовки. Держа пробирку вверх дном, откройте её и быстро пронесите в вертикальном положении через верхнюю часть пламени.
Проверку водорода на чистоту можно провести также следующим образом: наполнить пробирку методом вытеснения воздуха. Для этого газоотводную трубку введите до дна пробирки, удерживаемой вертикально вверх дном, и откройте кран. Через 15—20 с, не закрывая кран, осторожно извлеките трубку и сразу же закройте отверстие пробирки пальцем. Закройте кран и уберите трубку в сторону от пламени. Чистоту водорода определите описанным выше способом. Следует отметить, что данный метод менее надёжен, чем при собирании водорода под водой.
Объяснение наблюдаемых явлений
Гранулы цинка покрываются рыхлым красно-коричневым слоем меди:
Zn + Cu 2+ = Zn 2+ + Cu 0 .
При этом образуется гальваническая пара, в которой цинк является анодом, а медь — катодом. Восстановление катионов гидроксония и образование пузырьков водорода происходит на поверхности менее активного металла — меди, а у поверхности цинка происходит гидратация образующихся катионов Zn 2+ , которой не препятствует слой из газовых микропузырьков. В этом случае выделение газа идёт быстрее, чем без добавления соли меди(II), которую можно считать катализатором процесса.
Интенсивность окраски раствора перманганата калия в первой промывной склянке постепенно ослабевает, и из него может выделиться бурый осадок
гидратированного оксида марганца(IV). Это объясняется тем, что цинк почти всегда содержит микропримеси серы, фосфора, мышьяка или сурьмы. Они восстанавливаются атомарным водородом, образуя газообразные сероводород, фосфин, арсин или стибин. Являясь сильными восстановителями, они окисляются пермаганатом, который при этом восстанавливается до МnO2·nН20, образующего слабоокрашенный буроватый коллоидный раствор или бурый осадок:
кристаллический пентагидрат сульфата меди(II) (медный купорос);
кристаллический хлорид натрия (поваренная соль);
алюминиевая проволока диаметром 1—1,5 см и длиной 60—80 см;
щелочной раствор перманганата калия с массовой его долей 1—2 %;
концентрированная серная кислота. Оборудование:
большая стеклянная воронка;
промывные склянки Дрекселя или Тищенко;
прямые и изогнутые стеклянные трубки;
штатив с пробирками;
кристаллизатор с водой;
• медная трубка длиной 8—10 см и и внутренним диаметром 5—6 мм.
Подготовка к демонстрации
Обработайте шлифы резервуара и воронки аппарата Киппа смазкой и надёжно укрепите резиновую пробку в нижнем тубусе. Для верхнего тубуса подберите резиновую пробку соответствующего диаметра с газоотводной трубкой и исправным краном.
Приготовьте солевой раствор для зарядки аппарата из расчёта 250 г пентагидрата сульфата меди(II) и 150 г
хлорида натрия на 1 дм 3 воды. Для этого нагрейте воду до температуры 50—60 °С и растворите в ней соответствующие порции хлорида натрия и медного купороса. Приготовленный раствор охладите до комнатной температуры.
Демонстрация опыта
I. Зарядка аппарата и получение водорода.
1. Из алюминиевой проволоки сверните неплотное кольцо диаметром 5 см и поместите его через горловину в центральный шар аппарата и соедините его с шарообразной воронкой. При открытом верхнем тубусе осторожно наливайте в аппарат солевой раствор до тех пор, пока он не
заполнит нижнее полушарие и не поднимется в средний шар на 1/3 его высоты. При этом алюминиевое кольцо должно полностью покрыться солевым раствором.
Внимание! Старайтесь не вдыхать газовую смесь, выходящую из верхнего тубуса!
2. Быстро закройте верхний тубус пробкой с газоотводной трубкой и убедитесь в герметичности прибора. Для этого закройте кран аппарата и подождите 10 секунд. Если аппарат герметичен, то раствор кислоты под давлением выделяющегося газа будет опускаться из центрального шара в нижнее полушарие, а из него по трубке подниматься в шарообразную воронку. В противном случае следует обязательно устранить причину негерметичности или заменить прибор на другой. Откройте
кран аппарата, а газоотводную трубку опустите в стакан с водой.
II. Проверка водорода на чистоту.
Через 1—2 минуты тщательно проверьте выделяющийся газ на чистоту (см. опыт № 1).
Объяснение наблюдаемых явлений
В присутствии катионов Сu 2+ и Сl-анионов прочная оксидная плёнка на поверхности алюминия разрушается и он восстанавливает катионы меди(II) до металлического состояния:
2А1 + 3Cu 2+ = 2А1 3+ + 3Cu 0 .
Медь осаждается на поверхности алюминия в виде рыхлого красно-коричневого слоя. При этом образуется гальванический элемент, в котором алюминий является анодом и восстанавливает воду с образованием водорода:
Интенсивность окраски раствора перманганата калия в первой промывной склянке постепенно ослабевает и из него может выделиться бурый осадок гидратированного оксида марганца(1У). Это объясняется тем, что технический алюминий почти всегда содержит микропримеси серы и фосфора. Они восстанавливаются атомарным водородом, образуя ядовитые газообразные сероводород и фосфин. Они восстанавливают ионы Мп04~ до МnO2•nН2O, образующего слабоокрашенный буроватый коллоидный раствор или бурый осадок:
разбавленная (1:2) хлороводородная кислота (НСl) или разбавленная (1:4) серная кислота (H2SO4);
гранулированный цинк (Zn);
раствор любой соли меди(II) с массовой её долей 10 %;
• концентрированная серная кислота. Оборудование:
аппарат Киппа с предохранительной воронкой Вельтера;
большая стеклянная воронка;
2 химических стакана (0,2 дм 3 );
промывная склянка Дрекселя или Тищенко;
прямые и изогнутые стеклянные трубки;
штатив с пробирками;
• весы (технохимические или электронные).
Подготовка к демонстрации
Соберите аппарат Киппа и зарядите его для получения водорода (см. опыт № 1).
Соедините аппарат с промывной склянкой, содержащей концентрированную серную кислоту. В газоотводную трубку, отходящую от промывной склянки, вставьте изогнутую под прямым углом стеклянную трубку.
Тщательно проверьте водород на чистоту (см. опыт № 1).
На нижнюю часть каждого из двух стаканов на расстоянии 5 см от дна наденьте прочное резиновое кольцо так, чтобы оно не скользило свободно по стеклу. К этим кольцам с противоположных сторон стаканов надежно прикрепите концы тонкой проволоки так, чтобы стаканы можно было подвесить вверх дном к весам.
Подвесьте оба стакана к крючкам над чашками весов и уравновесьте их с помощью кусочков бумаги или мелкого песка. Выключите арретир.
В дне картонной коробки, имеющей размеры примерно 10x10x10 см, и в двух её противоположных стенках вырежьте по центру квадратные отверстия размером 5x5 см.
Демонстрация опыта
I. Демонстрация на технохимических весах
Включив арретир, обратите внимание учеников на то, что весы находятся в равновесии.
Под один из стаканов осторожно подведите изогнутую газоотводную трубку, не касаясь ею весов или стенок стакана, и пустите слабый ток водорода.
После того как равновесие весов нарушится и стаканы окажутся на разной высоте, ток газа прекратите и уберите газоотводную трубку в сторону от пламени спиртовки.
4. Поднесите горящую лучинку сначала к отверстию стакана, расположенного ниже, и обратите внимание, что характер её горения не меняется. Затем поднесите лучинку к отверстию стакана, расположенного выше. При этом раздастся характерный хлопок и стенки стакана запотеют.
И. Демонстрация на электронных весах
Включите весы в сеть и аккуратно поставьте на них коробку так, чтобы отверстие в её дне было направлено вверх. Сверху над отверстием коробки установите перевёрнутый вверх дном стакан. Он должен полностью закрывать отверстие коробки. Запишите показания весов.
Аккуратно через боковое отверстие в коробке введите в стакан изогнутую газоотводную трубку и пустите слабый ток водорода. Обратите внимание на то, что показания весов сразу же начинают изменяться в сторону уменьшения. Примерно через 1 минуту прекратите ток газа и уберите газоотводную трубку в сторону от пламени.
Объяснение наблюдаемых явлений
Плечо весов со стаканом, наполненным водородом, поднимается вверх. Это объясняется тем, что водород примерно в 14,5 раза легче воздуха и, поднимаясь вверх, вытесняет его из стакана. Масса стакана с водородом оказывается меньше массы того же стакана с воздухом.
Они конденсируются на холодном стекле, образуя на внутренней поверхности стакана мельчайшие капельки жидкости.
Читайте также:
- Впр как инструмент внутренней системы оценки качества образования в начальной школе
- Что включает в себя сопровождение сайта кратко
- Зона для сюжетной игры и продуктивной деятельности в детском саду
- Государственно общественные объединения учителей школы педагогический совет
- Что было при брежневе кратко

