Что такое эритропоэз кратко
Обновлено: 02.07.2024
Эритроцитопоэз. Гранулоцитопоэз. Этапы эритропоэза и гранулоцитопоэза.
Эритроцитопоэз начинается со стволовой кроветворной клетки. Через стадию колониеобразующей мультипотентной клетки (КОЕТЭММ) формируются бурстобразующая (БОЭ-Э) и далее колониеобразующая единица эритроцитов (КОЕ-Э). Клетки этих колоний чувствительны к факторам регуляции пролиферации и дифференцировки. Например, эритропоэтин, вырабатываемый клетками почки, стимулирует пролиферацию и дифференцировку клеток в эритробласты.
В IV-й класс включаются базофильный, полихроматофильный и оксифильный эритробласты. Проэритроциты, потом ретикулоциты составляют V-й класс и, наконец, формируются эритроциты (VI-й класс). В эритропоэзе на стадии оксифильного эритробласта происходит выталкивание ядра. В целом цикл развития эритроцита до выхода ретикулоцита в кровь продолжается до 12 суток. Общее направление эритропоэза характеризуется следующими основными структурно-функциональными изменениями: постепенным уменьшением размеров клетки, накоплением в цитоплазме гемоглобина, редукцией органелл, снижением базофилии и повышением оксифилии цитоплазмы, уплотнением ядра с последующим его выделением из состава клетки. В эритробластических островках эритробласты поглощают путем микропиноцитоза железо, поставляемое макрофагами, для синтеза гемоглобина.
Развитие эритроцитов происходит в миелоидной ткани красного костного мозга. В периферическую кровь поступают только зрелые эритроциты и немного ретикулоцитов.
Состояние, при котором содержание гемоглобина в крови значительно снижено, называется анемией. Оно бывает связано либо с уменьшением числа эритроцитов, либо с понижением содержания гемоглобина в них, и возникает в результате ряда причин: генетических (например, серповидноклеточная анемия, связанная с нарушением синтеза гемоглобина и распадом эритроцитов), кровопотери, воздействия гемолитических ядов, вызывающих распад эритроцитов, дефицита железа или витамина B12. В норме потребность в эритроцитах обеспечивается за счет размножения клеток IV-V-ro классов. Этот процесс называется гомопластическим гемопоэзом. При резком дефиците эритроцитов, вызванном кровопотерей или другими факторами, гомопластического гемопоэза оказывается недостаточно. Эритроциты начинают развиваться путем деления клеток I-III-го классов. Такой процесс называется гетеропластическим гемопоэзом.
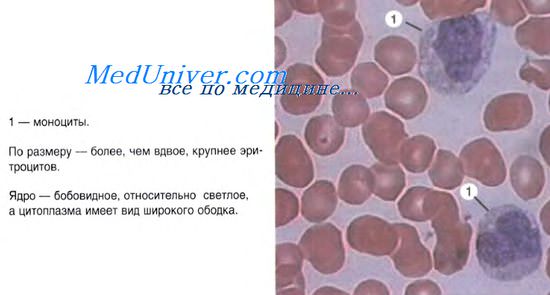
Гранулоцитопоэз.
Образование гранулоцитов происходит в миелоидной ткани красного костного мозга. Исходная стволовая клетка превращается в мультипотентную клетку — предшественник миелопоэза (КОЕ-ГЭММ) и далее под воздействием колониестимулирующих факторов дифференцируется в общую родоначальную клетку для гранулоцитов и моноцитов (КОЕ-ГМн). В дальнейшем в результате дивергенции возникают родоначальные клетки для гранулоцитов (КОЕ-Гн), которые дифференцируются в идентифицируемые миелобласты (IV-й класс клеток). В ряду дальнейшей клеточной дифференцировки (V-й класс клеток) различают стадии: промиелоцита, миелоцита, метамиелоцита. Начиная со стадии промиелоцита, клетки подразделяются на 3 разновидности: нейтрофильные, эозинофильные, базофильные. Более отчетливо это подразделение можно провести на стадии миелоцитов, когда в клетках накапливается достаточное количество специфической зернистости. До стадии миелоцитов включительно клетки гранулоцитопоэза делятся митозом. Метамиелоциты митозом уже не делятся. В этих клетках ядро приобретает вначале палочковидную, а затем сегментированную форму.
Общее направление дифференцировки клеток гранулопоэза характеризуется: постепенным уменьшением размеров клетки, снижением базофилии цитоплазмы, появлением в цитоплазме специфических гранул, уменьшением размеров ядра, появлением сегментированности ядра и его уплотнением, сдвигом ядерно-цитоплазменного отношения в сторону преобладания размеров цитоплазмы над размерами ядра.
В периферическую кровь поступают зрелые гранулоциты (VI-й класс клеток) — нейтрофилы, эозинофилы и базофилы, а также небольшое количество малодифференцированных (юных) гранулоцитов. Физиологическая регенерация обеспечивается делением преимущественно клеток V-ro класса — миелоцитов.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Эритроциты (от греч. ἐρυθρός — красный и κύτος — вместилище, клетка), так же известные под названием красные кровяные тельца — клетки крови человека, позвоночных животных и некоторых беспозвоночных (иглокожих).
Содержание
Функции
Основной функцией эритроцитов является перенос кислорода из лёгких к тканям тела, и транспорт диоксида углерода (углекислого газа) в обратном направлении.
Однако, кроме участия в процессе дыхания, они выполняют в организме также следующие функции:
- участвуют в регулировке кислотно-щелочного равновесия;
- поддерживают изотонию крови и тканей; из плазмы крови аминокислоты, липиды и переносят их к тканям.
Формирование эритроцитов
Формирование эритроцитов (эритропоэз) происходит в костном мозге черепа, ребер и позвоночника, а у детей — еще и в костном мозге в окончаниях длинных костей рук и ног. Продолжительность жизни - 3-4 месяца, разрушение (гемолиз) происходит в печени и селезенке. Прежде чем выйти в кровь, эритроциты последовательно проходят несколько стадий пролиферации и дифференцировки в составе эритрона — красного ростка кроветворения.
а) Из стволовых гемопоэтических клеток сначала появляется большая клетка с ядром, не обладающая характерным красным цветом — мегалобласт
б) Затем она окрашивается в красный цвет — теперь это эритробласт
в) уменьшается в размере в процессе развития — теперь это нормоцит
г) утрачивает ядро — теперь это ретикулоцит. У птиц, пресмыкающихся, земноводных и рыб ядро просто теряет активность, но сохраняет способность реактивации. Одновременно с исчезновением ядра по мере взросления эритроцита из его цитоплазмы исчезают рибосомы и другие компоненты, участвующие в синтезе белка.
Ретикулоциты попадают в кровеносную систему и через несколько часов становятся полноценными эритроцитами.
Структура и состав
Обычно эритроциты имеют форму двояковогнутого диска и содержат в основном дыхательный пигмент гемоглобин. У некоторых животных (например, верблюда, лягушки) эритроциты имеют овальную форму.
Содержимое эритроцита представлено главным образом дыхательным пигментом гемоглобином, обусловливающим красный цвет крови. Однако на ранних стадиях количество гемоглобина в них мало, и на стадии эритробластов цвет клетки синий; позже клетка становится серой и, лишь полностью созрев, приобретает красную окраску.
Важную роль в эритроците выполняет клеточная (плазматическая) мембрана, пропускающая газы (кислород, углекислый газ), ионы (Na, K) и воду. Плазмолемму пронизывают трансмембранные белки - гликофорины, которые, благодаря большому количеству остатков сиаловой кислоты, ответственны примерно за 60% отрицательного заряда на поверхности эритроцитов.
На поверхности липопротеидной мембраны находятся специфические антигены гликопротеидной природы — агглютиногены — факторы систем групп крови (на данный момент изучено более 15 систем групп крови: AB0, резус фактор, Даффи, Келл, Кидд), обусловливающие агглютинацию эритроцитов.
Эффективность функционирования гемоглобина зависит от величины поверхности соприкосновения эритроцита со средой. Суммарная поверхность всех эритроцитов крови в организме тем больше, чем меньше их размеры. У низших позвоночных эритроциты крупные (например, у хвостатого земноводного амфиумы — 70 мкм в диаметре), эритроциты высших позвоночных мельче (например, у козы — 4 мкм в диаметре). У человека диаметр эритроцита составляет 7,2—7,5 мкм, толщина — 2 мкм, объём — 88 мкм³.
Переливание крови
При переливании крови от донора к реципиенту возможна агглютинация(склеивание) и гемолиз(разрушение) эритроцитов. Чтобы этого не происходило стоит учитывать группы крови, открытые К. Ландштейнером и Я. Янским в 1900 г. Агглютинацию вызывают белки, находящиеся на поверхности эритроцита, - антигены (агглютиногены) и находящиеся в плазме антитела (агглютинины). Существуют 4 группы крови, для каждой характерны различные антигены и антитела. Переливание возможно лишь между представителями одной группы крови. Но например, I группа крови(0) является универсальным донором, а IV(AB) - универсальным реципиентом.
| I - 0 | II - A | III - B | IV - AB |
|---|---|---|---|
| αβ | β | α | -- |
Место в организме
Форма двояковогнутого диска обеспечивает прохождение эритроцитов через узкие просветы капилляров. В капиллярах они движутся со скоростью 2 сантиметра в минуту, что дает им время передать кислород от гемоглобина к миоглобину. Миоглобин действует как посредник, принимая кислород у гемоглобина в крови и передавая его цитохромам в мышечных клетках.
Количество эритроцитов в крови в норме поддерживается на постоянном уровне (у человека в 1 мм³ крови 4,5—5 млн эритроцитов, у некоторых копытных 15,4 млн (лама) и 13 млн (коза) эритроцитов, у пресмыкающихся — от 500 тыс. до 1,65 млн, у хрящевых рыб — 90—130 тыс.) Общее число эритроцитов снижается при анемиях, повышается при полицитемии.
Продолжительность жизни эритроцита человека в среднем 125 суток (ежесекундно образуется около 2,5 млн эритроцитов и такое же их количество разрушается). У собак — 107 дней, у кроликов и кошек — 68.
Патология

При различных заболеваниях крови возможно изменение цвета эритроцитов, их размеров, количества, а также формы; они могут принимать, например, серповидную, овальную или мишеневидную форму.
При изменении кислотно-щелочного баланса крови в сторону закисления (от 7.43 до 7.33) происходит склеивание эритроцитов в виде монетных столбиков, либо их агрегация.
Среднее содержание гемоглобина для мужчин 13,3—18 г% (или 4,0-5,0*10 12 единиц), для женщин 11,7—15,8г% (или 3,9-4,7*10 12 единиц). Единица измерения уровня гемоглобина, представляет собой процент содержания гемоглобина в 1 грамме эритроцитарной массы.

Красные кровяные тельца были описаны в 1913 году ученым из Англии Артуром Бойкоттом. Жизненный цикл эритроцитов составляет в среднем сто дней. Для поддержания их стабильного уровня в крови постоянно формируются новые эритроидные клетки. Погибающие клетки захватываются и перевариваются макрофагами. Из кроветворной ткани в кровоток каждую минуту выходит 1,8×10 9 ретикулоцитов. Кровопотеря, гемолиз и прочие факторы максимально стимулируют гемопоэз, который увеличивается в 10-12 раз.
Видео: основное об эритропоэезе и гемопоэзе
Эритроциты
Развитие эритроцитов и создание уникальной структурно-функциональной модели происходит путем дифференцировки. Красные клетки крови созревают у детей первых пяти лет жизни в костном мозге всех костей скелета. Бедренная и берцовые кости перестают участвовать в кроветворении к 24 годам. В позвонках, грудине, ребрах, черепе и прочих плоских костях клетки крови образуются всю жизнь.

Эритроциты выполняют жизненно важные функции:
- дыхательная — транспорт кислорода к тканям и выведение углекислоты из организма;
- трофическая — доставка аминокислот и прочих питательных веществ к внутренним органам, обеспечение регенерации и репарации;
- детоксикационная — адсорбция токсинов и их инактивация;
- метаболическая — содержание большого числа энзимов;
- коагуляционная — наличие на поверхности клеток плазменных факторов свертывания крови;
- буферная — регулирование КОС и водно-минерального обмена;
- депонирующая — хранение воды и микроэлементов;
- иммуномодулирующая – участие в формировании иммунитета.
Особенности физиологии красных телец:
- Эритроциты способны выпадать в осадок. Это свойство напрямую зависит от белкового состава крови – чем больше в плазме содержится грубодисперсных глобулинов, тем выше СОЭ.
- При замедлении системного кровотока и сгущении крови эритроциты начинают объединяться в крупные агрегаты. Они называются ложными, поскольку распадаются на функционально активные клетки, сохраняющие свою структуру.
- Пластичность – обратимая деформация клеток, проходящих через капилляры, артериолы и венулы. Это свойство обусловлено наличием в мембране спектрина – особого белкового соединения.
- К физиологическим свойствам красных кровяных телец также относится осмотическая устойчивость и деструкция после длительной циркуляции в кровотоке.

Структура красных кровяных телец максимально адаптирована для реализации жизненно важных функций. Эти узкоспециализированные клетки мобильны. Они обеспечивают диффузию газов, взаимодействуют с гемоглобином, быстро делятся и проникают в системный кровоток. Эритроциты на 50% состоят из протеинов, на 40% из липидов и на 10% из углеводов. Клетки способны деформироваться и циркулировать по сосудам малого калибра. Такая способность обусловлена их гибкостью и пластичность. Эритроциты имеют дисковидную форму с углубленным центром. Эти безъядерные элементы не содержат органелл – их цитоплазма наполнена гемоглобином.
Для изучения формы, структуры и размера эритроцитов проводят микроскопическое исследование мазка крови. Морфологические и тинкториальные свойства клеток помогают поставить диагноз разных видов анемии.
Физиология
Эритропоэз начинается под воздействием стимулирующих факторов. Основным из них является гипоксия тканей — нехватка кислорода и ишемия органа. В ответ на происходящие изменения в организме почки синтезируют гормон эритропоэтин. Именно он запускает процесс образования эритроцитов. Влиянием этого биологически активного вещества обусловлена пролиферация и дифференциация клеток-предшественников. Процесс кроветворения ускоряется, эритроциты массово выходят в системный кровоток. Гормоны оказывают непосредственное воздействием на процесс образования железосодержащего белка — гемоглобина. Они стимулируют синтез рибонуклеиновой кислоты, обеспечивающей секрецию необходимых энзимов. Эритропоэтины улучшают кровоснабжение кроветворной ткани и ускоряют, таким образом, гемопоэз, протекающий в эритробластических островках костного мозга.
- На начальных стадиях развития плода эритропоэз осуществляется в зародышевом органе – желточном мешке.
- С 5 недели эмбрионального развития – в печени.
- С 16 недели беременности эритроциты продуцируются в фетальной селезенке.
- С 20 недели гестации этот процесс осуществляется в костном мозге.
Процесс образования форменных элементов происходит вне синусов костного мозга и называется эктраваскуляторным. Когда ребенок появляется на свет, его кроветворная ткань уже полностью сформирована. Постнатальный гемопоэз обеспечивает физиологическую регенерацию крови – ее обновление.

Факторы, стимулирующие эритропоэз:
- физическое перенапряжение,
- кровопотеря,
- курение,
- подъем в горы,
- кардиоваскулярные патологии,
- хронические бронхолегочные заболевания,
- химиотерапия,
- длительная и интенсивная витаминотерапия.
Результатом повышенной продукции эритроцитов является эритроцитоз. Он бывает физиологическим и патологическим.
Факторы, угнетающие эритропоэз:
- стойкая дисфункция почек,
- гипопротеинемия,
- авитаминозы,
- нехватка железа в организме и прочих микроэлементов,
- хронические патологии в стадии декомпенсации,
- острые инфекции,
- неоплазии недоброкачественного течения,
- тяжелые интоксикации,
- поражение костномозговых структур,
- онкогематологические расстройства — лейкоз.
Нарушение кроветворения приводит к развитию серьезного заболевания крови – анемии.
В крайне редких случаях эритропоэз осуществляется не в костном мозге, а в печеночной ткани и селезенке. Причинами подобного отклонения являются особые состояния, патологические процессы и некоторые обстоятельства.
Схема и стадии
Эритроциты во время своего развития проходят несколько сменяющих друг друга стадий. Гемангиобласт – первичная стволовая клетка, закладывающаяся в онтогенезе. Этот предок всех эндотелиальных и кровеобразующих структур трансформируется в гемоцитобласт – плюрипотентную клетку. Из нее образуется множество различных клеточных элементов, но не целый организм. Мультипотентная стволовая клетка – общий миелоидный предшественник, способный формировать клетки тканей, из которых сам был получен, и превращаться в унипотентную клетку. Она дифференцируется в сторону эритропоэза. Именно с этого звена гемопоэза начинается эритроидная линия.

- Колониеобразующая единица эритроцитопоэза — лимфоцитоподобная клетка, не имеющая специальных морфологических характеристик, способная к самообновлению и дифференциации.
- Она непрерывно делится и дает начало базофильным клеткам — проэритробластам. Это первый визуально определяемый элемент эритроцитарного ряда, способный к образованию гемоглобина. Его круглое ядро занимает более половины клетки, окрашивается в темно-фиолетовый цвет и имеет тонкодисперсную структуру хроматина.
- В результате его деления образуются базофильные эритробласты. В отличии от своих предшественников они содержат относительно мелкие ядра, базофильную цитоплазму и много рыхлого гетерохроматина.
- Митотическое деление базофильных эритробластов заканчивается появлением полихроматофильных эритробластов, имеющих в ядре конденсированный хроматин.
- Митозы этих клеток дают начало нормобластам, которые прочным кольцом окружают ретикулярную клетку, охватывают ее своими утолщенными отростками и образуют эритробластические островки. Ортохроматические эритробласты не имеют органелл. В их цитоплазме содержится много гемоглобина, а в ядре – глыбок гетерохроматина.
- После выталкивания ядра из тела клетки образуются ретикулоциты. Они синтезируют и накапливают гемоглобин благодаря работе особого рибосомального аппарата. Ретикулоциты выходят из органа кроветворения и попадают в просвет кровеносных сосудов.
- Непосредственно в кровотоке они трансформируются в зрелые эритроцитарные клетки, не имеющие ядра, органелл и рецепторных белков на поверхности. Эритроциты доставляют кислород к органам и удаляют из низ углекислый газ. Процесс созревания длится 24 часа.
Эритроциты на каждой стадии кроветворения имеют особые морфологические, тинкториальные, микроскопические, биохимические и иммунологические свойства. Во время дифференцировки клеток уменьшается размер ядра. Оно постепенно сморщивается и полностью исчезает. Цитоплазма, наоборот, увеличивается в объеме, изменяет свой цвет, накапливает гемоглобин.
Регуляция
Существуют различные виды регуляция эритропоэза — гуморальная, нервная, с помощью ретикулярных клеток, витаминов и минералов.

Гуморальная регуляция осуществляется по принципу отрицательной обратной связи. Благодаря гормону эритропоэтину процессы образования юных эритроидных клеток и распада старых, деформированных телец четко сбалансированы и непрерывны. Уровень эритроцитов в крови сохраняется относительно стабильным и обеспечивает полноценное кровоснабжение и оксигенацию тканей. Гипоксия органов, вызванная сосудистым спазмом, малокровием или иной патологией, стимулирует секрецию эритропоэтина, который усиливает продукцию красных телец и повышает их концентрацию в крови. Когда кровоснабжение органов восстанавливается, секреция эритропоэтина понижается.
К другим гормонам, контролирующим эритропоэз, относятся: кортизол, андрогены, глюкокортикоиды, инсулин, соматотропный и тиреоидные гормоны, катехоламины, интерлейкины, плацентарный пролактин. Они увеличивают продукцию эритропоэтина или непосредственно стимулируют гемопоэз. Подавляют эритропоэз эстрогены, кейлоны, глюкагон, ацетилхолин, интерфероны, факторы некроза опухолей.
- Рост и развитие организма человека сопровождаются усилением интенсивности эритропоэза.
- При гипергликемии и гипотиреозе развивается анемия, а при тиреотоксикозе возникает эритроцитоз.
- При сильном стрессе повышается продукция эритроцитов, и улучшается кровоснабжение тканей.
- Гипофункция надпочечников сопровождается эритропенией, а гиперкортицизм — эритроцитозом.
Нервная регуляция происходит следующим образом: симпатическая система активизирует эритропоэз, а парасимпатическая – тормозит.
Ретикулярные клетки влияют на процесс кроветворения двумя способами:
- Фагоцитоз — процесс поглощения и переваривания клеточных оболочек, разрушения зрелых эритроцитов с пороками развития, прекращения метаболизма ядер эритробластов.
- Рофеоцитоз — перенос ферритина, образовавшегося после распада аномальных эритроцитов, молодым ортохроматическим эритробластам.
Макрофаги оказывают непосредственное воздействие на пролиферацию и созревание эритроидных клеток. Они поглощают ядра нормобластов, обеспечивают эритробласты железом и питательными веществами, стимулируют синтез эритропоэтина и гликозаминогликанов, которые повышают концентрацию факторов роста в островках.
Для осуществления эритропоэза критически необходимы некоторые витамины и минералы:
- кобаламин — запускает секрецию глобина,
- фолиевая кислота — принимает участие в образовании ДНК ядерных форм,
- пиридоксин – обеспечивает продукцию гема,
- рибофлавин — формирование липидной оболочки эритроцитов,
- витамин С — ускоряет усвоение железа,
- витамин РР – укрепляет строму из липидов и предотвращает гемолиз,
- медь — позволяет железу быстрее всосаться в кишечнике и включиться в структуру гема,
- никель и кобальт – образование железосодержащего белка крови,
- цинк — входит в состав жизненно необходимых энзимов,
- селен — защита клеток от свободных радикалов.
Нехватка одного из них может вызвать нарушение эритроцитопоэза, а именно дифференцировки и деления стволовых клеток.
Видео: подробные лекции о гемопоэзе
Патология
Под воздействием неблагоприятных эндогенных и экзогенных факторов эритропоэз нарушается. Основные гематологические синдромы обусловлены количественными и качественными изменениями структуры и функций эритроцитов. У больных развиваются тяжелые заболевания, в основе которых лежит эритропения или эритроцитоз.
Анемия — патологический процесс, обусловленный низким уровнем эритроцитов и гемоглобина в крови. Это самое распространенное гематологическое расстройство. Оно бывает самостоятельным — вызванным нарушением гемопоэза, а также вторичным — возникающим при заболеваниях внутренних органов.
К анемиям, обусловленным нарушением кровообразования относятся:
![]()
нормобластный и мегалобластный типы эритропоэза (при анемии)
различные изменения в созревании эритроцитов
К более редким формам анемии, обусловленной нарушением эритропоэза, относятся: метапластическая, фолиеводефицитная, сидеробластная, апластическая. Клинически все виды анемии проявляются признаками астеновегетативного синдрома – бледностью кожи, тахикардией, головокружением, слабостью, бессилием, плохим настроением.
Эритроцитоз — патологическое состояние, при котором увеличивается количество эритроцитов и гемоглобина в крови. Сама жидкость густеет, что затрудняет ее движение по сосудам и нарушает кислородный обмен. Количество эритроцитов и гемоглобина в крови увеличивается под воздействием различных факторов — физиологических и патологических.
При обезвоживании организма, связанном с профузными поносами, рвотой, гипергидрозом, или задержке жидкости, вызванной отеком легких, шоком, кардиоваскулярной недостаточностью, увеличивается концентрация красных телец в крови. Когда количество эритроцитов становится чрезмерным, повышается вязкость крови — она сгущается. Возможна агглютинация, склеивание эритроцитов и увеличение объема циркулирующей крови. У больных поднимается кровяное давление, возникает головная боль, головокружение и багровый цианоз, нарушается зрение, увеличиваются печень и селезенка, развиваются носовые кровотечения, тромбозы, инфаркты, инсульты.
![]()
3. Физиология человека / В.Ф. Киричук, О.Н. Антипова, Н.Е. Бабиченко, В.М. Головченко, Е.В. Понукалина, И.В. Смышлеева, Л.К. Токаева / Под ред В.Ф. Киричука. 2-е изд. – Саратов: Изд-во Саратовского медицинского университета, 2009. – 343 с.
4. Физиология и патофизиология красной крови: учеб. пособие / Н.П. Чеснокова, В.В. Моррисон, Е.В. Понукалина, Т.А.Невважай; под общ. ред. проф. Н.П. Чесноковой. – Саратов: Изд-во Сарат. мед. ун-та, 2013. – 80 с.
6. Механизмы развития болезней и синдромов / А.Ш. Зайчик, Л.П. Чурилов. Книга 1-я: учебник для студентов медицинских вузов. – СПб., 2007, ЭЛБИ. – 507 с.
8. Клеточные и молекулярные механизмы регуляции системы гемостаза в норме и патологии: монография / Б.И. Кузник. – Чита: Экспресс-издательство, 2010. – С. 261–368.
Эритропоэз и механизмы его регуляции
В эмбриональном периоде кроветворение осуществляется вначале в кровяных островках желточного мешка, затем примерно спустя 5 недель эмбрионального развития – в печени. Селезенка включается в процесс кроветворения с 16 недели внутриутробного развития. Первые гемопоэтические элементы появляются в костном мозге на 2-ом месяце эмбрионального развития, однако миелоидный период кроветворения начинается на 4-5-м месяцах эмбрионального развития, вытесняя постепенно кроветворение в печени и селезенке. Костномозговой эритропоэз осуществляется вне синусов, в строме костного мозга, то есть эктраваскуляторно. К моменту рождения ребенка костный мозг развивается полностью, а экстрамедуллярное кроветворение практически завершается. Постэмбриональный период кроветворения начинается после рождения ребенка и продолжается на протяжении всей жизни. Гемопоэз осуществляется в специализированных гемопоэтических тканях: миелоидной (эпифизы трубчатых костей и полости многих губчатых костей) и лимфоидной (тимус, селезенка, лимфатические узлы). В миелоидной ткани образуются эритроциты, лейкоциты, тромбоциты. В лимфоидной ткани идет дальнейшая дифференцировка и созревание лимфоцитов, а также плазматических клеток – основных продуцентов антител.
Постэмбриональный гемопоэз обеспечивает процессы физиологической регенерации крови, то есть её обновление, что компенсирует физиологические процессы разрушения дифференцированных клеток крови.
В условиях нормы функциональная активность органов кроветворения и кроверазрушения строго сбалансирована, что обеспечивает относительное постоянство содержания эритроцитов и других клеток в периферической крови. Разрушение эритроцитов происходит примерно после 120-дневного пребывания их в системной циркуляции при участии тканевых макрофагов селезенки, лимфатических узлов, печени. Гемоглобин, освобождающийся в процессе распада эритроцитов, трансформируется в билирубин в клетках моноцитарно-макрофагальной системы, а затем в гембилирубин (непрямой билирубин), вступая во взаимодействие с белками крови или липопротеидами. Гембилирубин в свою очередь элиминируется из системного кровотока печеночными клетками, где превращается в прямой билирубин (соединение билирубина с глюкуроновой кислотой). Прямой билирубин вместе с желчью поступает в кишечник, постепенно превращается в другие желчные пигменты (стеркобилиноген, уробилиноген) которые, выделяясь с калом и мочой, придают им окраску. При внутриклеточном разрушении эритроцитов основным продуктом, образующимся после распада гемоглобина, является билирубин, а при внутрисосудистом гемолизе большие количества гемоглобина соединяются с α2-гликопротеином-гаптоглобином, который не проникает в мочу.
Основным регулятором эритропоэза является эритропоэтин – гликопротеид, интенсивно вырабатывающийся в условиях гипоксии. При гипоксических состояниях различного генеза концентрация эритропоэтина возрастает в десятки раз по сравнению с нормой. Основным источником синтеза эритропоэтина являются почки (до 90 %), печень (около 10 %), а также макрофаги костного мозга и селезенки. Для эритропоэтина характерен мембранный тип рецепции эритропоэтинчувствительными клетками костного мозга с последующими активацией митоза и дифференцировки клеток, в частности, стимуляцией транспорта железа в эритрокариоцитах, синтеза цепей глобина, ферментов образования гема, синтеза мембранных белков и эритроцитарных антигенов.
Эритропоэз стимулируется под влиянием катехоламинов, глюкокортикоидов, андрогенов, гормонов щитовидной железы, инсулина, плацентарного пролактина, ИЛ-3, ИЛ-6, ИЛ-9, ИЛ-11, КСФ, фолиевой кислоты, витаминов С, В12, железосодержащих препаратов.
Эритропоэз угнетается при повышенной оксигенации тканей, когда снижается образование эритропоэтина, а также под влиянием эстрогенов, глюкагона, ацетилхолина, интерферонов, ФНО-а, ИЛ-1, ИЛ-5, эритроцитарных кейлонов.
После рождения у ребенка в течение нескольких дней отмечают эритроцитоз – содержание эритроцитов составляет 5,5⋅1012/л, в то же время имеется высокое содержание гемоглобина (156-200 г/л). В течение первого года жизни изменяется антигенная структура эритроцитов, возникает прогрессирующее снижение фетального гемоглобина. К концу первого года жизни содержание фетального гемоглобина не превышает 1 %.
Общая характеристика эритроцитов
Эритроциты – самая многочисленная популяция клеток крови, обладающих разнообразными функциями, в частности дыхательной, трофической, детоксицирующей. Количество эритроцитов довольно вариабельно в условиях нормы: так, у женщин оно колеблется от 3,7⋅1012/л до 4,7⋅1012 /л, а у мужчин – от 4,5⋅1012/л до 5,5⋅1012 /л. Сдвиг этих показателей до нижней или верхней границы нормы может быть одним из признаков болезни.
Около 85 % всех эритроцитов имеют форму двояковогнутого диска, то есть являются дискоцитами. Форма эритроцита определяет цепь ауторегулирующих процессов, направленных на поддержание движения крови, её реологических свойств. В условиях патологии появляются эритроциты различной формы, такие состояния именуют пойкилоцитозом. Среди аномальных по форме эритроцитов различают овалоциты, аннулоциты, сфероциты, акантоциты, стоматоциты, щизоциты и другие формы, имеющие в ряде случаев определённое диагностическое значение.
Обычная в условиях нормы форма дискоцита значительно увеличивает площадь диффузии газов, электролитов и других субстратов. Средний диаметр эритроцита (нормоцита) в области краёв составляет 7,5 мкм, а максимальная толщина эритроцита в области краёв составляет 2 мкм. Эритроциты с диаметром от 2 до 6 мкм – микроциты, а с диаметром от 9 до 16 мкм – макроциты. Количество макро- и микроцитов в крови здорового человека в среднем составляет 15–20 %. Резкое увеличение содержания в крови микро- и макроцитов, именуемое анизоцитозом, является одним из признаков нарушения гемопоэза, характерным для анемий, лейкоцитозов, заболеваний инфекционно-аллергической природы. За время свой жизни в периферической крови эритроцит совершает кругооборот более 1 млн. раз, что вызывает развитие механических и метаболических изменений в эритроцитах. Эритроциты обладают пластичностью, то есть способностью к деформации при прохождении через узкие извитые капилляры диаметром 2,5–7,5 мкм. По мере старения их способность к деформации снижается, они застревают в капиллярах красной пульпы селезенки и там разрушаются в процессе фагоцитоза тканевыми макрофагами. Эластичность эритроцитов определяется особенностями структуры белка спектрина, гемоглобина, а также соотношением различных фракций липидов в мембране клеток.
Эритроциты играют важную роль в регуляции кислотно-основного состояния организма, в процессах свертывания крови и фибринолиза за счет адсорбции на их мембране разнообразных ферментных факторов этих систем. Эритроциты являются регуляторами водно-солевого обмена в связи со способностью депонировать воду и минеральные соли при нахождении их в венозной крови. Одной из главных функций эритроцитов является участие в иммунологических реакциях организма за счет наличия в мембранах эритроцитов комплекса полисахаридо-аминокислотных соединений, обладающих свойствами антигенов. Следует помнить, что суммарный объем эритроцитов приблизительно в 160 раз превышает таковой лейкоцитов и тромбоцитов, а потому кровь можно рассматривать как двухфазную систему, представляющую собой взвесь (суспензию) эритроцитов в плазме. При этом эритроцит подвергается в токе крови действию напряжения сдвига – оно более значительно у края и направлено в сторону стенки и менее выражено в центре сосуда. Разница действующих векторов силы у разных краёв обеспечивает вращательное движение эритроцитов в текущей жидкости, что при столкновении с тромбоцитами, имеющими меньший размер и худшую деформируемость по сравнению с эритроцитами, приводит к отбрасыванию кровяных пластинок к стенке сосуда. Благодаря этому пристеночный слой оказывается обогащенным тромбоцитами. Указанный эффект обусловлен величиной гематокрита, размером эритроцитов и тромбоцитов и ригидностью их мембран. Увеличение любого из указанных параметров сопровождается усилением передвижения кровяных пластинок к стенке сосуда, а при наличии повреждения эндотелия – адгезией к субэндотелию.
Буферные свойства эритроцитов. Как известно, на единицу объема эритроцит связывает в 60 раз большее количество О2, чем плазма крови. О2 хорошо растворим в воде, поэтому диффузия его в растворе происходит очень быстро. Связывание О2 с эритроцитами определяется парциальным давлением газа в плазме и сорбционными свойствами Нв. В капиллярах легких, где давление О2 высоко (рО2 = 133 гПа), высоко и сродство Нв к О2, что обеспечивает трансмембранный перенос газа и связывание его с гемоглобином. В капиллярах тканей, где рО2 равно 40-50 гПа, сродство Нв к О2 резко снижается. При этом происходит выход кислорода из эритроцитов.
Транспорт СО2 через мембрану эритроцита также осуществляется за счет диффузного давления (в капиллярах легких рСО2 = 53гПа, а в капиллярах тканей – 61 гПа). Диффузия СО2 в растворах происходит примерно в 20 раз быстрее, чем О2.
Высокая скорость равновесия содержания СО2 в системе эритроцит – плазма крови обеспечивается наличием в эритроцитах особого фермента – карбоангидразы, катализирующего реакции трансформации СО2 и Н2О в углекислоту (Н2СО3), а также мощными системами трансмембранного обмена анионами.
При понижении концентрации СО2 в эритроцитах возникает отрицательный заряд Нв, что приводит к уменьшению содержания внутриклеточной воды, а при увеличении содержания СО2 в эритроцитах – они набухают.
Известно, что осмотическое давление в эритроцитах несколько выше, чем в плазме крови, что связанно с высокой внутриклеточной концентрацией белков по сравнению с плазмой крови. При этом содержание низкомолекулярных осмотически активных веществ (ионов натрия) в эритроцитах значительно меньше, чем в плазме крови. Величина осмотического давления в эритроцитах обеспечивает достаточный или нормальный тургор этих клеток. Осмотическое давление плазмы и эритроцитов в условиях нормы находится в динамическом равновесии, что обуславливает стабильность структуры эритроцитов.
При помещении эритроцитов в коллоидно-осмотическую среду с более низким осмотическим давлением (гипотонические растворы) может наступить осмотический или коллоидно-осмотический гемолиз. Последний обусловлен тем, что вода поступает в эритроциты до того момента, пока не разрывается мембрана и гемоглобин выходит в окружающую среду.
В умеренногипотонической среде эритроциты приобретают сферическую форму, их называют в связи с этим сфероцитами. Способность эритроцитов сохранять свою структуру при развитии гипоосмотических состояний или в гипоосмотической среде получила название осмотической устойчивости, или резистентности эритроцитов. Верхняя граница резистентности или максимальная устойчивость эритроцитов соответствует примерно 0,5–0,4 % раствора хлорида натрия.
При помещении эритроцитов в гипертоническую среду происходит их сморщивание в связи с потерей воды и уменьшением объема.
Эритроцитам свойственна способность к оседанию. Удельная масса цельной крови в норме для взрослого составляет в среднем 1,05–1,06. Удельная масса эритроцитов (1,085–1,096) выше, чем плазмы крови (1,02–1,027), поэтому эритроциты в пробирке с кровью, лишенной возможности свертываться, способны медленно оседать на дно. Скорость оседания эритроцитов в значительной мере определяется белковым составом плазмы крови, в частности уровнем мелкодисперсных белков-альбуминов. В связи с этим важная роль в обеспечении величины СОЭ отводится соотношению альбуминово-глобулиновых фракций белков крови. СОЭ у мужчин в среднем составляет 1–10 мм/ч, у небеременных женщин 2-15 мм/ч. При некоторых патологических процессах и заболеваниях, а также во второй половине беременности СОЭ повышается, так как увеличивается содержание в крови грубодисперсных белков глобулиновой фракции, получивших название аггломеринов, а также за счет усиления образования фибриногена.
При замедлении скорости кровотока и повышении вязкости крови эритроциты проявляют способность к агрегации. Вначале агрегация носит обратимый характер, при этом образуются ложные агрегаты, или монетные столбики. В случае быстрого восстановления кровотока они распадаются на полноценные клетки с сохраненной мембраной и внутриклеточной структурой.
Пластичность или деформируемость – это способность эритроцитов к обратимой деформации при прохождении через узкие извитые капилляры, микропоры. Данное свойство определяется особенностями структуры мембраны эритроциты, наличием в ней особого белка спектрина.
Таким образом, основными физиологическими и физико-химическими свойствами эритроцитов являются следующие:
– способность к оседанию;
– способность к агрегации;
– деструкция после определенного периода циркуляции в кровотоке.
1. Дыхательная функция заключается в захвате и переносе кислорода к тканям и экскреции СО2 из организма. Это обеспечивается содержащимся в эритроцитах белком гемоглобином. Гемоглобин – сложный белок состоит из групп гема и белкового остатка – глобина. Содержание гемоглобина у мужчин составляет 130-160 г/л, у женщин 120-140 г/л.
2. Трофическая функция эритроцитов связана с их способностью транспортировать аминокислоты, нуклеотиды, пептиды к различным органам и тканям, способствуя обеспечению репаративных процессов. В ряде случаев эту функцию называют транспортной.
3. Детоксиксицирующая функция эритроцитов обусловлена их способностью адсорбировать токсические продукты эндогенного или экзогенного происхождения и частично инактивировать их.
4. Участие в процессах свертывания крови за счет адсорбции на их мембране плазменных факторов свертывания крови
5. Участие в регуляции кислотно-основного состояния организма (буферная функция) за счет гемоглобина обеспечивающего до 70 % буферной ёмкости крови.
6.– Ферментативная функция связана с наличием в эритроцитах большого количества ферментов, в частности карбоангидразы, метгемоглобинредуктазы, ферментов гликолиза.
![]()
Эритропоэз - это жестко регулируемый и сложный , многоступенчатый процесс, начинающийся в костном мозге из мультипотентной гемопоэтической стволовой клетки ( HSC) и заканчивающийся зрелым энуклеированным эритроцитом. Каждую секунду в процессе эритропоэза организм человека генерирует 2 миллиона эритроцитов. Первые этапы дифференцировки эритроидов включают фазу вовлечения, в которой HSC дифференцируются в предшественников эритроидов, от общего миелоидного предшественника, предшественника мегакариоцитарно-эритроидного, и, наконец, формирующего взрывную единицу эритроида (BFU-E). BFU-Es являются первыми клетками-предшественниками, связанными исключительно с эритроидной линией (Gregory and Eaves 1977). Эти BFU-Es далее дифференцируются в колониеобразующий блок-эритроид (CFU-E), после чего происходит терминальная дифференцировка.
Вторая фаза созревания эритроида включает дифференцировку зародышевых предшественников от проэритробластов до базофильных, полихроматофильных и ортохроматических эритробластов. Эта фаза характеризуется постепенным накоплением гемоглобина, прогрессирующим уменьшением размера клеток и ядерной конденсацией, что в конечном итоге приводит к энуклеации. Заключительная фаза развития эритроида включает созревание ретикулоцитов в эритроциты. Именно на этой стадии эритроцит приобретает двояковогнутую форму за счет обширного ремоделирования мембран и будет циркулировать в кровотоке, пока он не будет удален макрофагами в ретикулоэндотелиальной системе (Gifford et al. 2006).
Терминальная дифференцировка эритроида происходит в анатомических нишах, известных как эритробластические острова. Эритробластические острова уникальны для эритропоэза млекопитающих и состоят из центрального макрофага, окруженного эритроидными клетками ( до 30) с различной степенью созревания эритроцитов. Клетки варьируются от CFU-Es до энуклеирующих эритробластов и являются местом синтеза гемоглобина путем терминальной дифференцировки эритробластов. Центральный макрофаг функционирует для закрепления эритробластов на острове и обеспечивает клеточные взаимодействия, необходимые для управления дифференцировкой и пролиферацией эритроидов. Кроме того, было показано, что центральный макрофаг фагоцитирует экструдированное ядро из терминально дифференцирующихся эритробластов и направляет передачу железа предшественникам эритроидов для синтеза гема.
Макрофаги внутри эритробластических островков также помогают регулировать скорость эритропоэза с помощью механизмов положительной и отрицательной обратной связи. Макрофаги секретируют цитокины, такие как инсулиноподобный фактор роста-1, который способствует пролиферации и созреванию эритроидов.
На начальном этапе эритропоэз происходит с постоянной, но низкой базальной скоростью, при этом примерно 1% циркулирующих эритроцитов ежедневно очищается и заменяется новыми клетками. Эритроциты остаются в обращении в течение приблизительно 120 дней, в течение которых они постоянно обследуются резидентными макрофагами в печени и селезенке. Макрофаги в селезенке могут обнаруживать и удалять нежелательные или поврежденные эритроциты, а также старые эритроциты в конце их жизненного цикла.
Эритропоэтин (EPO) - это гуморальный цитокин, синтезируемый главным образом в почках и секретируемый в кровоток, где он нацелен на эритроидные клетки-предшественники в костном мозге. Основной функцией EPO является регулирование доставки кислорода к периферическим тканям, и этому способствует гипоксическая индукция транскрипции гена EPO. В этом процессе участвуют несколько факторов транскрипции, включая фактор, индуцируемый гипоксией, регулируемый относительным уровнем гипоксии, и GATA-связывающие белки. Было показано, что среди белков GATA GATA-1, GATA-2 и GATA-3 негативно регулируют экспрессию мРНК EPO посредством связывания в области промотора EPO. Таким образом, скорость транскрипции гена ЕРО регулируется местной кислородной средой. В дополнение к регуляции экспрессии мРНК EPO, в частности, GATA-1 и GATA-2 играют решающую роль в регуляции экспрессии генов, ограниченных по линии происхождения, во время дифференцировки эритроидов. GATA-1 необходим для выживания и терминальной дифференцировки эритроидных предшественников, тогда как GATA-2 регулирует поддержание и пролиферацию гемопоэтических стволовых и прогениторных клеток. Именно относительная пропорция экспрессии GATA-1 и GATA-2 определяет экспрессию генов-мишеней, необходимых для стимулирования созревания эритроидов и максимальной экспрессии генов β-глобина.
EPO связывается с рецептором эритропоэтина (EPO-R), который вызывает гомодимеризацию рецептора. Регуляция эритропоэза с помощью EPO регулируется во времени, и исследования на людях показали, что EPO связывается с EPO-R от стадии CFU-E до полихроматофильной стадии. Одним из основных сигнальных путей, опосредованных взаимодействием EPO / EPO-R, является активация JAK2 , которая впоследствии фосфорилирует и активирует STAT5. Было показано, что путь JAK2 / STAT5 активирует гены, фундаментальные для выживания, пролиферации и дифференцировки эритроидных предшественников. Кроме того, фосфорилирование STAT5 необходимо для ускорения эритропоэза во время гипоксического стресса. Путь JAK2 / STAT5 хронически активируется в полицитемии и β-талассемии с помощью внутренних (соматических мутаций) и внешних механизмов, соответственно. Другие последующие пути активации включают митоген-активируемую протеинкиназу (MAPK) и фосфоинозитид-3-киназу (PI3K). Сходным образом, эти пути участвуют в дифференцировке и пролиферации предшественников эритроида.
Все дифференцирующие эритробласты экспрессируют лиганд Fas, однако только незрелые эритробласты, преимущественно проэритробласт и базофильный нормобласт, уязвимы для поперечной сшивки Fas / Fas-лиганд. Зрелые эритробласты на полихроматической и ортохроматической стадии используют эту восприимчивость к Fas-лиганд-опосредованной цитотоксичности для стимулирования продолжающейся дифференцировки эритроидов. Существует предположение, что во время периодов анемии высокие уровни экспрессии эритропоэтина защищают незрелые эритробласты от опосредованной Fas-лигандом цитотоксичности, тем самым способствуя выживанию эритроида и увеличению скорости эритропоэза через внешний, а также внутренний. пути гибели клеток.
Измененная продукция эритроцитов может быть результатом прямого нарушения медуллярного эритропоэза, как это наблюдается при синдромах талассемии, наследственной недостаточности костного мозга, а также при анемии, развившейся на фоне хронического заболевания. Альтернативно, при таких расстройствах, как серповидноклеточная анемия (SCD), а также энзимопатии и дефекты мембран, медуллярный эритропоэз непосредственно или только минимально не нарушается.
Несмотря на различия в патогенезе, методы лечения нарушения эритропоэза традиционно неспецифичны и ограничиваются симптоматическим контролем анемии, переливанием эритроцитарной массы (pRBC), что приводит к перегрузке железом и возможной необходимости в хелатировании или спленэктомии для уменьшения дефектного разрушения эритроцитов. Аналогичным образом, при истинной полицитемии перепроизводство эритроцитов связано с неспецифической миелосупрессией или флеботомией. Представляют интерес новые терапевтические мишени, включая индукцию гемоглобина плода, вмешательство в аберрантные пути передачи сигналов и генную терапию.
Повышенные уровни циркулирующих медиаторов воспаления, таких как интерлейкин 6 (IL-6), трансформирующий фактор роста-β (TGF-β), фактор некроза опухоли (TNF) и интерферон-γ (IFN-γ), обнаруживаются при множестве хронических воспалительных процессов . Эти состояния часто характеризуются анемией, которая предполагает механизм опосредованного цитокинами ингибирования эритропоэза.
Читайте также:




