Что такое аналитическая химия кратко
Обновлено: 02.07.2024
Аналитическая химия — наука о методах определения химического состава вещества и его структуры. Выделяют качественный и количественный анализ.
Качественный анализ — установление присутствия или отсутствия отдельных компонентов в анализируемом объекте.
В качественном анализе различают:
- • элементный анализ (определение входящих в пробу элементов);
- • вещественный анализ (определение химических соединений).
В зависимости от массы пробы вещества, используемого для проведения анализа, методы анализа классифицируют следующим образом:
- • макрометод (0,1 г вещества и более);
- • полумикрометод (0,1–0,01 г);
- • микрометод (10 –2 –10 –3 г);
- • ультрамикрометод (10 –3 –10 –6 г);
- • субмикрометод (10 –6 –10 –9 г).
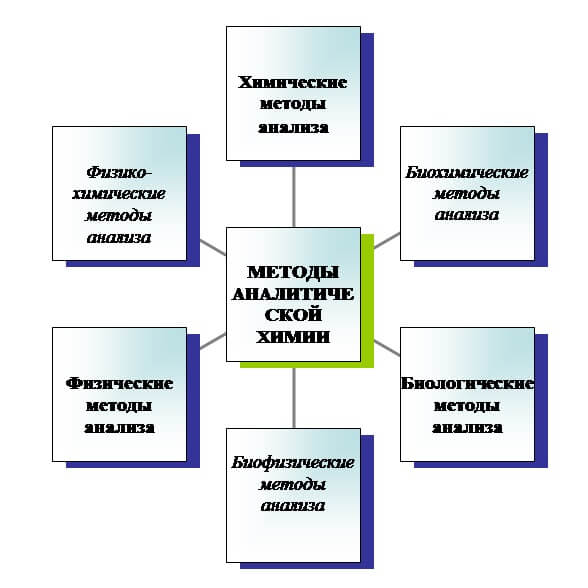
Методы анализа подразделяются на химические и физико-химические (инструментальные). Химические методы анализа основаны на способности определяемого компонента вступать в химическую реакцию с последующим определением его количества.
Достоинства химического метода анализа:
- • точность;
- • простота;
- • универсальность.
Недостатки химического метода анализа
- • требуется много времени;
- • сложная подготовка пробы.
Химические реакции, пригодные для качественного анализа, должны сопровождаться заметным внешним эффектом. Это может быть:
- выделение газа;
- изменение окраски раствора;
- выпадение осадка;
- растворение осадка;
- образование кристаллов характерной формы.
В первых четырех случаях за протеканием реакции наблюдают невооруженным глазом, кристаллы рассматривают под микроскопом. Классификация видов химического анализа по объектам определения приведена в табл. 1.1.
Таблица 1.1 Классификация видов химического анализа по объектам определения

В физико-химических методах анализа конец реакции определяют не визуально, как в химических методах, а при помощи приборов, которые фиксируют изменения физических свойств исследуемого вещества.
Качественный анализ
Для получения достоверных результатов анализа конкретного иона необходимы реакции, выполнению которых не мешает присутствие других ионов. Для этого нужны специфические реагенты (взаимодействующие только с определяемым ионом).
Примером реакции с участием специфического реагента является выделение газообразного аммиака NH 3 при действии щелочей (KOH или NaOH) на вещество, содержащее ион аммония NH4 +. Ни один катион не помешает обнаружению иона NH4+, потому что только он реагирует со щелочами с выделением аммиака:

. Еще один пример — специфические реагенты на ионы железа. Специфический реактив гексацианоферрат (III) калия К3[Fе(СN)6] (красная кровяная соль) образует синий осадок (турнбуллева синь) только с ионами двухвалентного железа Fe 2+. Гексацианоферрат (II) калия K4[Fe(CN)6] (желтая кровяная соль) образует синий осадок (берлинская лазурь) только с ионами трехвалентного железа Fe3+. Специфический реагент на ионы меди (II) — аммиак:

Окрашивание пламени горелки является также способом определения некоторых катионов, т. е. качественной реакцией на их присутствие:
Li + — окрашивание пламени в красный цвет;
Na + — окрашивание пламени в желтый цвет;
K + — окрашивание пламени в фиолетовый цвет.
Селективные реагенты — это реагенты, которые реагируют лишь с немногими веществами. Диметилглиоксим (реагент Чугаева) служит примером селективного реагента в щелочной среде он реагирует с ионами Ni +2, Co +2, Fe +2; в кислой — только с ионами Pd +2.
К сожалению, селективных, а тем более специфических реагентов очень мало. Поэтому смеси катионов и анионов разделяют на части с помощью реактива, который называется групповым реактивом.
Действуя на смесь катионов в строго определенном порядке растворами соляной кислоты HCl, серной кислоты H2SO4, аммиака NH3 и гидроксида натрия NaOH, можно разделить содержащиеся в смеси катионы на шесть аналитических групп. Эти растворы называются групповыми реагентами, а схема — кислотно-щелочной (по используемым групповым реагентам).
В сероводородной схеме групповыми реагентами являются соляная кислота HCl, сероводород H2S и карбонат аммония (NH4)2CO3.
Разделение катионов на пять аналитических групп основано на различии свойств образуемых ими хлоридов, сульфидов и карбонатов:
- I группа K +, Na +, NH +4, Mg +2 — группового реагента нет, поэтому эти катионы остаются в растворе после отделения других групп;
- II группа Ba +2, Ca +2, Sr +2 — групповой реагент (NH4) 2 CO 3 осаждает карбонаты этих катионов;
- III группа Al +3, Cr +3, Fe +3, Fe +2, Ni +2, Co +2, Mn +2, Zn +2 — групповой реагент (NH4) 2 S осаждает гидроксиды Al +3 и Cr +3 и сульфиды остальных катионов;
- IV группа Cu +2, Cd +2, Hg +2, Bi +3, As +3, Sn +2, Sn +4, Sb +2 — групповой реагент H 2 S осаждает сульфиды этих катионов;
- V группа Ag +, Pb +2 и Hg +2 — групповой реагент HCl — осаждает хлориды этих катионов.
Общепринятой классификации для разделения анионов, как для разделения катионов, не существует. Используют разделение анионов на три аналитические группы по растворимости солей бария и серебра.
Методы качественного анализа классифицируют следующим образом:
— анализ сложных смесей.
Количественный анализ
Количественный анализ проводят после проведения качественного химического анализа, т. е. после установления компонентов анализируемой пробы.
Например, общие свойства спиртов изучают химики-органики, а способы определения спиртов как класса органических соединений и каждого отдельного спирта (например, этанола) разрабатывают аналитики. Для этого они выявляют те особенности химических и физических свойств спиртов, которые отличают их от других органических соединений. Еще важнее выявить характеристические свойства отдельных спиртов (например, этанола), отличающие их друг от друга.
Изучение характеристических свойств индивидуальных объектов особенно важно в тех случаях, когда изучают материалы сложного состава, содержащие смеси родственных веществ.
Также аналитическая химия воспринимает и развивает знания, полученные в рамках смежных научных дисциплин. Разумеется, знания, полученные одной наукой и используемые другой, всегда существенно перерабатываются, подобно тому, как в организме продукты питания превращаются в новые соединения, а уже из них строятся собственные ткани организма. Эта аналогия подходит и для рассматриваемого случая. На основе творчески переработанных достижений других наук и собственных фундаментальных исследований аналитики выявляют общие закономерности химического анализа, создают новые методы и методики.
К химическим методам количественного анализа относятся:
В ходе количественного анализа можно выделить основные его этапы:
- 1) отбор средней пробы;
- 2) взятие навески;
- 3) перевод пробы в раствор;
- 4) отделение определяемого компонента и его концентрирование;
- 5) количественное измерение;
- 6) расчет результатов анализа.
Волюмометрические методы анализа основаны на измерении объема реагента, израсходованного на взаимодействие с веществом.
Кинетические методы анализа заключаются в определении зависимости скорости химической реакции от концентрации реагирующих веществ.
Методика исследования. Чтобы подобрать оптимальную (лучшую) методику химического анализа, в каждом случае следует учитывать ряд практических требований
1. Точность. Это главное требование. Оно означает, что относительная или абсолютная погрешность анализа не должна превышать некоторого предельного значения. Для разных видов анализа, безусловно, требуется разная точность. В одних случаях достаточно, чтобы результат был получен с относительной погрешностью, не превышающей 10 или даже 20%, в других — чтобы погрешность была менее 2 %. При проведении арбитражных анализов относительная погрешность не должна превышать 0,1 или даже 0,01%. Столь высокую точность могут дать лишь некоторые методы и немногие методики. 15 Не следует добиваться высокой точности, если она не требуется, ведь высокая точность обходится очень дорого.
4. Экспрессность. Речь идет о продолжительности анализа одной пробы — от пробоотбора до выдачи заключения. Чем быстрее будут получены результаты, тем лучше.
5. Стоимость. Эта характеристика методики не требует комментариев. В массовом масштабе можно применять лишь относительно недорогие анализы. Стоимость аналитического контроля в промышленности обычно не превышает 1 % стоимости продукции. Очень дорого стоят уникальные по сложности и редко выполняемые анализы.
Существуют и другие требования к методике — безопасность выполнения анализа, возможность проводить анализ без непоредственного участия человека, устойчивость результатов к случайным колебаниям условий и т. п.
Для наиболее распространенных и часто выполняемых анализов методики изложены в специальных нормативных документах, например государственных стандартах (ГОСТах). В стандартных методиках используют распространенные приборы, общеизвестные способы расчета, привычные приемы анализа. Периодически (один раз в 5–10 лет) ГОСТы обновляют и утверждают заново.
Отбор средней пробы. Это очень важная стадия анализа. С отбора проб начинается проведение химического анализа. Техника отбора средней пробы описывается в специальных инструкциях, ГОСТах. Нужно найти такую пробу по составу, чтобы она отвечала действительному среднему составу анализируемого вещества. Особенно трудно выбрать среднюю пробу твердого вещества. В этом случае используются следующие действия размалывание, высверливание, распиливание, дробление.
При санитарно-эпидемиологической экспертизе отбор проб пищевых продуктов проводит, как правило, врач по гигиене питания, при его отсутствии — помощник санитарного врача. При производственном контроле его проводит специально обученный работник данного предприятия, имеющий свидетельство о прохождении обучения.
Порядок отбора проб пищевых продуктов при экспертизе партии включает выделение однородной партии, определение числа и отбор точечных проб, составление объединенной пробы и формирование из нее средней, которая направляется на лабораторные исследования. Экспертиза партии проводится в соответствии с действующей инструкцией о порядке проведения гигиенической экспертизы пищевых продуктов в учреждениях госсанэпидслужбы. Пример отбора и хранения проб представлен на рис. 1.1.

Рис. 1.1. Отбор и хранение проб тканей и кормов
Измерения в аналитической химии
Результаты количественного химического анализа оценивают такими метрологическими характеристиками, как правильность, воспроизводимость и точность.
Правильность — качество измерений, отражающее близость к нулю систематических погрешностей.
Воспроизводимость — качество измерений, выполненных в различных условиях, но свидетельствующих о близости результатов друг другу.
Точность — качество измерений, показывающее близость их результатов к истинному значению измеряемой величины. Точность измерения соответствует малым погрешностям всех видов. Количественно она выражается обратной величиной модуля относительной погрешности. Погрешность в расчетах приводит к получению неверных результатов химического анализа. Кроме того, есть еще погрешность (ошибка) измерений (∆). Это отклонение результата измерения (Х) от истинного значения измеряемой величины (μ). Абсолютная погрешность определяется по формуле:
относительная погрешность (%) — по формуле
Истинное значение можно получить путем анализа образца множеством различных независимых методов анализа. Анализ его проводят в форме межлабораторного эксперимента (проводится анализ разными лабораториями). Затем проводят оценку массива данных. Также можно использовать стандартный образец (с известным содержанием компонента) для анализа.
Если погрешность при повторных измерениях остается постоянной, то это систематическая погрешность (имеет знак плюс или минус). Если погрешность изменяется случайным образом, то это случайная погрешность (имеет знак и плюс, и минус). Грубые погрешности, существенно отличающиеся от истинного значения, называются грубой ошибкой.
Все погрешности зависят от класса точности прибора и от профессионализма химика-аналитика. Применение статистической обработки образцов рассмотрим на примере анализа пробы сточной воды. Трижды было определено содержание фенола стандартной методикой (DIN 38 409 H 16). Найдено среднее значение содержания фенола в пробе (0,51 гл). Предельно допустимая концентрация фенола в сточных водах в странах ЕС составляет 0,5 гл. Можно ли сказать, что концентрация превышена Статистические тесты помогут учесть степень разброса данных.
Предел обнаружения — минимальная концентрация вещества, которая может быть обнаружена методом. Возможность обнаружения вещества с помощью любой аналитической методики ограничена. Особенно это важно при определении следовых количеств веществ.
Основной химической величиной является количество вещества (n), а основной единицей измерения — моль. По определению, 1 моль — количество вещества, содержащее столько частиц, сколько атомов содержится в 0,012 кг изотопно чистого простого вещества 12 C. Оно составляет приблизительно 6,02214·10 23 частиц. Таким образом, по смыслу количество вещества есть число частиц, составляющих вещество. Эту величину не следует отождествлять ни с массой, ни с объемом, ни с какими иными физическими характеристиками.
Наряду с количеством вещества в химии широко используют и производные от него величины. Важнейшая из них — концентрация (c), представляющая собой количество вещества (n) в единице объема V:
При проведении анализа часто компонент переводится в раствор. Состав раствора количественно выражается через относительные величины — доли (массовые, мольные, молярные) и размерные величины — концентрации.
Массовая доля — безразмерная относительная величина, равная отношению массы компонента к общей массе образца, раствора, смеси веществ.
Единицей измерения массовой доли является также процент (сотая доля числа — %), промилле (тысячная доля числа, 110 доля процента — ‰), ppm (миллионная доля числа), ppb (миллиардная доля числа).
1‰ = 0,1 %, 1 ppm = 10 –4 %, 1 ppb = 10 –7 %.
Концентрация показывает отношение массы или количества растворенного вещества к объему раствора или массе растворителя.
Химический эквивалент
Это условная частица, которая может присоединять или высвобождать один ион водорода в кислотно-основных реакциях или один электрон в окислительно-восстановительной реакции. Под частицей понимается молекула, ион, электрон и т. д. Фактор эквивалентности f показывает, какая доля реальной частицы вещества эквивалентна одному иону водорода в реакции или одному электрону в окислительно-восстановительной реакции. Рассмотрим реакцию:

Фактор эквивалентности соляной кислоты f экв (HCl) = 1, f экв (Na2CO3) =12.
Для окислительно-восстановительной реакции:

Для реакций комплексообразования фактор эквивалентности определяют из числа координационных мест у комплексообразователя:

Масса одного моль-эквивалента сложного вещества (Мэ), называемая молярной массой эквивалента, равна молярной массе вещества М, деленной на число реакционноспособных химических связей (n х.св):
Число реакционноспособных химических связей n х.св в зависимости от класса соединения можно определить следующим образом:
— для кислот — число протонов (n H +);
— для оснований — число гидроксильных групп (n OH –);
— для солей — произведение числа катионов на его заряд (nkt * Zkt).
Эквивалентность реагирующих и образующихся веществ отражает закон эквивалентов.
Титр раствора
Титр раствора характеризует его концентрацию. Это масса вещества в 1 мл раствора
Т = m в-ва / V р-р, г/мл.
Например, титр раствора соляной кислоты Т(HCl) = 0,003648 г/мл показывает, что в 1 мл раствора кислоты содержится 0,003648 г HCl.
Запись Т(HCl/NaOH) = 0,004000 г/мл означает, что 1 мл раствора кислоты реагирует с 0,004000 г NaOH.
Титр (Т) раствора вещества связан с молярной концентрацией вещества в растворе:

Таким образом, использование законов аналитической химии позволяет разрабатывать и идентифицировать состав пищевых продуктов, устанавливать механизм их воздействия на организм человека. Необходимость количественной и качественной оценки питания обусловлена его влиянием на здоровье и работоспособность человека. При количественной оценке суточного рациона определяется не его объем, а энергия, высвобождающаяся при метаболизме в организме основных пищевых веществ. Качественная характеристика рациона исходит из содержания в нем отдельных пищевых веществ (белков, жиров, углеводов, витаминов, минеральных веществ) и их соотношений. Только при количественной достаточности и благоприятных соотношениях пищевых веществ обеспечиваются наиболее полное проявление их биологических свойств и максимальное использование, а также оптимальное течение обменных процессов.

Человека повсюду окружают предметы, изготовленные их искусственно синтезированных материалов. Каждый из них имеет определенные свойства, обусловленные химическим составом. Его изучением занимается аналитическая химия — наука, которая анализирует вещества с точки зрения их принадлежности к определенным группам.
Аналитическая химия — описание
Перед аналитической химией стоит важная и конкретная задача — выбрать эффективные методы для определения качественного и количественного состава изучаемых веществ. В зависимости от поставленной задачи методы должны отвечать требованиям:
- точность;
- избирательность;
- оперативность;
- аналитическая составляющая;
- чувствительность.
Развитие аналитической химии как науки уходит своими корнями к алхимии, которая появилась благодаря желанию людей выяснить состав окружающих веществ и механизмов их превращения друг в друга. Примитивные методы изучения постепенно ушли в прошлое, передав цель исследований новым, опирающимся на достижения современных наук. Часть анализов сегодня проводится автоматически, для другой части разработаны математические и физические способы.
К существовавшим ранее практическим разработкам добавились теоретические обоснования происходящих реакций. Так появилась физическая химия — наука, открывшая теорию электролитов и их диссоциации, теорию растворов, постулаты химического равновесия и пр.
Таким образом, сегодня предметом изучения аналитической химии являются химический состав используемых в процессе жизнедеятельности человека материалов, а также выделение среди существующих методов его исследования наиболее корректных и достоверных.
Задачи химического анализа
Механизм химического анализа направлен на обнаружение в пробе тех или иных элементов, определение их количества и соотношения. От этого зависят химические и физические свойства веществ и предметов, изготовленных из них. Внося соответствующие корректировки в количественный и качественный состав сырья, человек добивается оптимальных параметров и характеристик.
Сегодня ученые занимаются элементным, вещественным, молекулярным анализом, а также изучением веществ на уровне их изотопного состава. В отдельных случаях необходимо проведение структурно-группового изучения. В результате таких методов добиваются полной либо частичной идентификации веществ в исследуемой пробе, выявляют примеси, оказывающие конкретное влияние на проявляемые свойства. В качестве примера можно привести различную чувствительность металлических изделий к коррозии, стойкость к химическим реагентам, снижение барьера прочности.
Анализироваться по химическому составу могут не только смеси металлов. Такой метод изучения применим к атмосферному воздуху, пищевым продуктам, питьевой воде, воде открытых водоемов, грунту, предметам бытовой химии, одежде и пр.
Наличие химических примесей в атмосферном воздухе свидетельствует о некачественной его очистке в результате определенных химических производственных процессов. Содержание некоторых химических элементов в пищевых продуктах (например, соли тяжелых металлов) делает их небезопасными для употребления.

Часто превышает предельно допустимую концентрацию содержание примесей в подземной воде, что является результатом растворения в ней залегающих под землей геологических слоев.
Сделать пользование человеком искусственными и естественными ресурсами безопасным — задача не только экологов, но и специалистов химической промышленности, а также ученых-химиков. Изучать химические реакции с целью познания свойств синтезированных веществ — значит сделать их применение максимально полезным, удобным, безопасным.
Разделы аналитической химии
Качественный анализ
Процесс качественного анализа направлен на определение присутствия какого-то компонента в исследуемом образце. Он же включает выяснение формы включения.
Предметом качественного анализа является:
- Достоверное определение факта присутствия компонентов (на уровне молекул, атомов или ионов).
- Его идентификация как компонента и определение формы.
Чтобы определить, какое химическое вещество присутствует в изучаемом материале, необходимо собрать сведения о его свойствах. При этом аналитика будет интересовать не только свойства первичного вещества, но и того, которое образовалось в результате проведенных реакций.
Механизм такого анализа включает:
Третий компонент является, по сути, химической реакцией, которая может протекать мокрым либо сухим путями.
Мокрый путь обозначает реакцию в растворе, в которой присутствует растворяемое вещество (активное начало) и растворитель. Для качественного анализа (без определения удельного веса компонентов) рассматриваются мокрые реакции, результатом которых есть изменения, заметные с помощью обычных органов чувств (зрение, обоняние, вкус и т.д.). При этом может наблюдаться изменение окраски раствора, выпадение нерастворимого осадка, выделение газообразных веществ.

Для качественного проведения химической реакции важно соблюсти необходимые условия (температура, наличие тепла, света, присутствие катализатора и пр.). Может отмечаться недостаток времени или объема.
Сухой путь применяется для определения плавкости веществ, способности изменять цветовой характер пламени, летучести, склонности к окислению или восстановлению. Чаще всего используются методы свечения в пламени.
Окислительно-восстановительные свойства изучаются с помощью сплавленной буры. То вещество, которое подвергается сухому анализу, вводится в шарики буры и подвергается нагреванию.
Количественный анализ
Вид анализа, при котором определяются массовые доли, концентрации, удельный вес или другие способы фиксации компонентов в пробе, называется количественным. С практической точки зрения, это более показательный и практически востребованный теоретический материал. Ученые не прекращают изыскивать все новые формы оценки количественных характеристик веществ, чтобы проверить их безопасность и прочность.
Однако, приступая к такой работе, специалист всегда представляет себе набор компонентов, входящих в состав исследуемого вещества, а также способы, позволяющие оценить их количественно.
Раздел количественного анализа работает по двум направлениям: весовому и объемному. Весовой показатель требует выделения нерастворимого осадка и его взвешивания. При необходимости последующие действия производятся с помощью вычисления. Объемный метод состоит в измерении единиц объема.
Химический количественный анализ может основываться и на таких способах, как:
- Электролитический (с использованием для выделения металлов электролиза).
- Колориметрический (в основе лежит сравнение окрасок растворов с известной крепостью и искомой).
- Газовый анализ (используются специальные приборы, например, газовые хроматографы, в которых различные компоненты — газы — по-разному светятся в пламени).
- Органический (в ходе исследования происходит сжигание органических веществ до углекислого газа и воды, после чего по результатам реакции определяется первоначальное содержание С и Н2.
Выделяют еще один метод — медицинский. Его цель — установить действенный контроль над составом различных органических жидкостей: крови, мочи, мокроты, слюны.
Классификация методов количественного анализа часто предусматривает перекрестные исследования. Так, контрольно-параллельно проводятся исследования пищевых продуктов, питьевой воды, клинические исследования при диагностике болезней.
Методы элементного анализа

Бывают ситуации, когда целью аналитических химических исследований является определение состава вещества либо компонентов смеси на молекулярном уровне. Тогда изучается характер межмолекулярных связей, результаты воздействия на них различного рода включений. Такой анализ называется элементным. Он применяется для дифференцировки точного состава материальных предметов.
В качестве направлений молекулярного анализа рассматривается структурное исследование — пространственное атомное изучение. В такой работе устанавливаются эмпирические формулы, определяются молекулярные и атомные массы, реже — прочие аналогичные показатели.
В работе практических химиков много внимания уделяется функциональному анализу. Это выделение в строении вещества различных функциональных групп, благодаря которым оно самостоятельно либо в соединении проявляет определенные химические и физические свойства, исполняет возложенные функции.
Современные методы аналитической химии
Изучение современных методов химического анализа имеет ряд преимуществ. Они оперативные, точные, многопрофильные, имеют специальные контрольные параметры и позволяют сравнивать результат со стандартом.
Кроме того, они имеют отличную воспроизводимость и низкий предел получение положительного результата — обнаружения конкретного компонента.
К востребованным в современном химическом деле относятся виды анализов:
- спектральные;
- электрохимические;
- оптические;
- хроматографические;
- основанные на электрофорезе;
- инструментальные, в основе которых лежит физико-химические реакции и свойства.
Нужна помощь в решении контрольных работ или тестов по химии? Выручит ФениксХелп — быстрая онлайн-помощь для школьников и студентов.
Аналити́ческая хи́мия — раздел химии, изучающий химический состав и структуру веществ. Предмет её как науки - совершенствование существующих и разработка новых методов анализа, их практическое применение, исследование теоретических основ аналитических методов. [1]
Аналитическая химия подразделяется на:
Содержание
Виды анализов
- 1 - Определение элементного состава материальных объектов называют Методы аналитической химии
Сравнение методов аналитической химии
Совокупность традиционных методов определения состава вещества путём его последовательно химического разложения получила название « инструментальными методами (оптическими, масс-спектрометрическими, электрохимическими, хроматографическими и другими физико-химическими методами) определения состава вещества. Однако у мокрой химии есть своё преимущество перед спектрометрическими методами — она позволяет путем проведения стандартизованных процедур (систематический анализ) напрямую определять состав и разные окислительные состояния элементов, таких как железо (Fe +2 , Fe +3 ), титан и др.
Аналитические методы можно разделить на валовые и локальные. Для валовых методов анализа обычно требуется отделённое, подробленное вещество ( Классификация методов аналитической химии
АНАЛИТИ́ЧЕСКАЯ ХИ́МИЯ, наука об определении химич. состава веществ и материалов и, в некоторой степени, химич. строения соединений. А. х. развивает общие теоретич. основы химич. анализа, разрабатывает методы определения компонентов изучаемого образца, решает задачи анализа конкретных объектов. Осн. цель А. х. – создание методов и средств, обеспечивающих, в зависимости от поставленной задачи, точность, высокую чувствительность, экспрессность и избирательность анализа. Разрабатываются и методы, позволяющие анализировать микрообъекты, проводить локальный анализ (в точке, на поверхности и т. д.), анализ без разрушения образца, на расстоянии от него (дистанционный анализ), непрерывный анализ (напр., в потоке), а также устанавливать, в виде какого химич. соединения и в какой физич. форме существует в образце определяемый компонент ( вещественный химический анализ ) и в состав какой фазы он входит ( фазовый анализ ). Важные тенденции развития А. х. – автоматизация анализов, особенно при контроле технологич. процессов, и математизация, в частности широкое использование компьютеров.
Читайте также:

