Что собой представляет хроматин кратко
Обновлено: 08.07.2024
В организме имеются также структуры, содержащие десятки и сотни ядер. К ним относятся симпласты и синцитии.
Симпласты образуются в результате слияния клеток и представляют собой многоядерные протоплазматические тяжи.
Синцитий формируется в результате неполного деления клеток и представляет собой соклетие, группу клеток, объединённых цитоплазматическими мостиками.
Ядро имеет различную форму, чаще – округлую, реже – палочковидную или неправильную. Следует отметить, что форма ядра стремится к повторению формы клетки и отвечает функциональному назначению. Так, например, у гладких миоцитов, имеющих веретеновидную форму, ядро палочковидное. Лимфоциты крови имеют круглую форму и ядра у них обычно круглые.
- хранение и передача наследственной информации дочерним клеткам
- регуляция синтеза белка
Хранение генетической информации обеспечивается тем, что в ДНК хромосом имеются репарационные ферменты, которые восстанавливают хромосомы ядра после их повреждения. Передача наследственной информации происходит при равномерном распределении идентичных копий ДНК между дочерними клетками при делении материнской.
Синтез белка регулируются благодаря тому, что на поверхности ДНК хромосом транскрибируются все виды РНК: информационные, рибосомные и транстпортные, которые участвуют в синтезе белка на поверхности гранулярной ЭПС.
Структурные образования ядра наиболее выражены в определённый период жизни клетки – в интерфазе.
Структурные элементы интерфазного ядра:
ХРОМАТИН
- это элемент ядра, который хорошо воспринимает красители (хромос), откуда и произошло его название. В состав хроматина входят нити – элементарные фибриллы, толщиной 20-25 нм, расположенные в ядре рыхло или компактно. На этом основано деление хроматина на 2 вида:
1) эухроматин – рыхлый (деконденсированный), слабо окрашивается основными красителями.
2) гетерохроматин – компактный (конденсированный), хорошо окрашивается основными красителями.
Эухроматин называется активным, гетерохроматин – неактивным. Активность эухроматина объясняется тем, что фибриллы ДНК при этом деспирализованы, т.е. гены, на поверхности которых происходит транскрипция РНК, открыты. Благодаря этому создаются условия для транскрипции РНК. В том случае, если ДНК хромосомы не деспирализована, то гены здесь закрыты, что затрудняет транскрипцию РНК с их поверхности. Следовательно, снижается синтез белка. Вот почему гетерохроматин неактивен. Соотношение эу- и гетерохроматина в ядре является показателем активности синтетических процессов в клетке.
Хроматин изменяет своё физическое состояние в зависимости от функциональной активности клетки. В период деления наблюдается конденсация хроматина и превращение его в хромосомы. Следовательно, хроматин и хромосомы – это различные физические состояния одного и того же вещества.
Химический состав хроматина:
Ядерные белки представлены двумя формами:
- основные (гистоновые) белки (80-85%)
- кислые (негистоновые) белки (15-20%).
Негистоновые белки формируют белковую сеть в кариоплазме (ядерный матрикс), обеспечивая внутренний порядок расположения хроматина. Гистоновые белки образуют блоки, каждый из которых состоит из 8 молекул. Эти блоки называются нуклеосомами. На нуклеосомы навёртывается фибрилла ДНК. Функции гистоновых белков:
- особая укладка ДНК хромосом
- регуляция синтеза белка.
ЯДРО И ДЕЛЕНИЕ КЛЕТКИ
Встречающиеся безъядерные структуры (эритроциты, тромбоциты, роговые чешуйки) являются результатом специфической дифференцировки ядерных форм клеток
В организме имеются также структуры, содержащие десятки и сотни ядер. К ним относятся симпласты и синцитии.
Симпласты образуются в результате слияния клеток и представляют собой многоядерные протоплазматические тяжи.
Синцитий формируется в результате неполного деления клеток и представляет собой соклетие, группу клеток, объединённых цитоплазматическими мостиками.

Ядро имеет различную форму, чаще – округлую, реже – палочковидную или неправильную. Следует отметить, что форма ядра стремится к повторению формы клетки и отвечает функциональному назначению. Так, например, у гладких миоцитов, имеющих веретеновидную форму, ядро палочковидное. Лимфоциты крови имеют круглую форму и ядра у них обычно круглые.
- хранение и передача наследственной информации дочерним клеткам
- регуляция синтеза белка
Хранение генетической информации обеспечивается тем, что в ДНК хромосом имеются репарационные ферменты, которые восстанавливают хромосомы ядра после их повреждения. Передача наследственной информации происходит при равномерном распределении идентичных копий ДНК между дочерними клетками при делении материнской.
Синтез белка регулируются благодаря тому, что на поверхности ДНК хромосом транскрибируются все виды РНК: информационные, рибосомные и транстпортные, которые участвуют в синтезе белка на поверхности гранулярной ЭПС.
Структурные образования ядра наиболее выражены в определённый период жизни клетки – в интерфазе.
Структурные элементы интерфазного ядра:
ХРОМАТИН
- это элемент ядра, который хорошо воспринимает красители (хромос), откуда и произошло его название. В состав хроматина входят нити – элементарные фибриллы, толщиной 20-25 нм, расположенные в ядре рыхло или компактно. На этом основано деление хроматина на 2 вида:
1) эухроматин – рыхлый (деконденсированный), слабо окрашивается основными красителями.
2) гетерохроматин – компактный (конденсированный), хорошо окрашивается основными красителями.
Эухроматин называется активным, гетерохроматин – неактивным. Активность эухроматина объясняется тем, что фибриллы ДНК при этом деспирализованы, т.е. гены, на поверхности которых происходит транскрипция РНК, открыты. Благодаря этому создаются условия для транскрипции РНК. В том случае, если ДНК хромосомы не деспирализована, то гены здесь закрыты, что затрудняет транскрипцию РНК с их поверхности. Следовательно, снижается синтез белка. Вот почему гетерохроматин неактивен. Соотношение эу- и гетерохроматина в ядре является показателем активности синтетических процессов в клетке.
Хроматин изменяет своё физическое состояние в зависимости от функциональной активности клетки. В период деления наблюдается конденсация хроматина и превращение его в хромосомы. Следовательно, хроматин и хромосомы – это различные физические состояния одного и того же вещества.
Химический состав хроматина:
Ядерные белки представлены двумя формами:
- основные (гистоновые) белки (80-85%)
- кислые (негистоновые) белки (15-20%).
Негистоновые белки формируют белковую сеть в кариоплазме (ядерный матрикс), обеспечивая внутренний порядок расположения хроматина. Гистоновые белки образуют блоки, каждый из которых состоит из 8 молекул. Эти блоки называются нуклеосомами. На нуклеосомы навёртывается фибрилла ДНК. Функции гистоновых белков:
Строение хроматина и его формы
• Индивидуальные хромосомы могут быть видны только в митозе
• В интерфазе основная масса хроматина находится в форме эухроматина, который по сравнению с митотическими хромосомами упакован менее плотно
• В интерфазе гетерохроматиновые области остаются плотно упакованными
Каждая хромосома содержит очень длинную двойную цепь ДНК, которая скручена в фибриллу, расположенную по всей хромосоме. Таким образом, при разработке модели структуры интерфазного хроматина и митотических хромосом, мы должны предусмотреть упаковку одной, крайне длинной молекулы ДНК в форму, которая позволяет транскрипцию и репликацию, и периодически может менять степень своей упаковки.
В клетках эукариот индивидуальные хромосомы заметны только в момент деления, когда отчетливо видна каждая из них. На рисунке ниже представлена фотография пары сестринских хроматид в метафазе, полученная в электронном микроскопе. (Сестринские хроматиды представляют собой дочерние хромосомы, образовавшиеся при репликации, но на этой стадии митоза еще остающиеся связанными друг с другом.) Каждая хроматида состоит из фибриллы мозаичного вида диаметром около 30 нм.
Плотность упаковки ДНК в хромосоме в 5-10 раз превышает плотность ее упаковки в интерфазном хроматине.
Однако в течение большей части цикла эукариотической клетки, ее генетический материал занимает в ядре пространство, в котором нельзя различить отдельные хромосомы. 30-нм фибрилла, составляющая основу хроматина, организована так же, как митотическая хромосома, или близка к ней по структуре.

Срез клетки в области клеточного ядра, окрашенный по Фельгену.
Видны области компактного гетерохроматина, расположенные преимущественно в области ядрышек и ядерной оболочки.
Хроматин обладает двумя типами структуры, каждую из которых можно наблюдать на ядерных препаратах:
• В большинстве областей фибриллы упакованы гораздо менее плотно, чем в митотических хромосомах. Эти области содержат эухроматин. Он отличается относительно менее плотной упаковкой и занимает большую часть ядра.
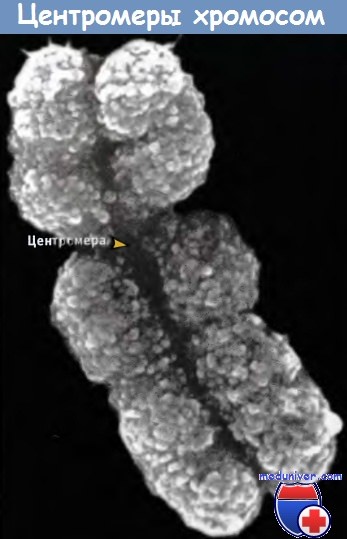
• Некоторые области, содержащие хроматин, очень плотно упакованы фибриллами, что напоминает упаковку митотических хромосом. Эти области содержат гетерохроматин. Обычно гетерохроматин локализуется в области центромеры, но также может располагаться и в других местах. На протяжении клеточного цикла степень конденсации гетерохроматина практически не изменяется. В ядре гетерохроматин расположен в виде отдельных скоплений, но чаще его области агрегируют, образуя интенсивно прокрашивающийся хромоцентр. (Этот термин применяется к областям ядра, которые всегда содержат гетерохроматин, называемый конститутивным гетерохроматином. Наряду с этим, существует другой вид гетерохроматина, который называется факультативный гетерохроматин. Для него характерна возможность перехода в эухрома-тиновое состояние.)
Одна и та же фибрилла находится в области эу- и гетерохроматина. Это позволяет предполагать, что два вида хроматина отражают различную степень конденсации генетического материала. Точно так же различной степенью конденсации характеризуются области эухроматина в интерфазе и митозе. Таким образом, генетический материал организован таким образом, чтобы обеспечить одновременное существование в хроматине альтернативных состояний и циклических изменений его упаковки между интерфазой и делением. Далее мы обсудим молекулярные основы такой организации.
Структурное состояние генетического материала коррелирует с его функциональной активностью. Конститутивный гетерохроматин характеризуется следующими особенностями:
• Он постоянно находится в конденсированном состоянии.
• В нем часто присутствуют многократные повторы небольших нетранскрибируемых участков ДНК.
• В гетерохроматиновой области плотность генов гораздо ниже, чем в эухроматине, и гены, которые транслоцируются в эту или расположенную поблизости область, часто инактивируются.
• По-видимому, из-за своей плотной упаковки гетерохроматин реплицируется позже, чем эухроматин, и отличается низкой частотой генетических рекомбинаций.
Известны некоторые молекулярные маркеры, позволяющие констатировать изменения свойств ДНК и белковых компонентов хроматина. К числу их относится снижение степени ацетилирования гистонов, усиление метилирования одного из этих белков, и гиперметилирование цитозино-вых остатков в ДНК. Эти молекулярные изменения приводят к конденсации хроматина, которая является причиной отсутствия у него метаболической активности.
Хотя в эухроматине находятся активные гены, в каждый данный момент времени транскрибируется лишь небольшое количество последовательностей ДНК Таким образом, локализация гена в эухроматине является необходимым, но недостаточным условием для его экспрессии.
Пара сестринских хроматид в митозе,
каждая из которых содержит фибриллу (диаметром 30 нм),
компактно упакованную в хромосому.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Хроматин (греч. chroma — цвет, краска и греч. nitos — нить) — это вещество хромосом — комплекс ДНК, РНК и белков. Хроматин находится внутри ядра клеток эукариот и входит в состав нуклеоида у прокариот. Именно в составе хроматина происходит реализация генетической информации, а также репликация и репарация ДНК. [1]
Основную массу хроматина составляют белки гистоны. Гистоны являются компонентом нуклеосом, — надмолекулярных структур, участвующих в упаковке хромосом. Нуклеосомы располагаются довольно регулярно, так что образующаяся структура напоминает бусы. Нуклеосома состоит из белков четырех типов: H2A, H2B, H3 и H4. В одну нуклеосому входят по два белка каждого типа — всего восемь белков. Гистон H1, более крупный, чем другие гистоны, связывается с ДНК в месте её входа на нуклеосому. [2]
Нить ДНК с нуклеосомами образует нерегулярную соленоид-подобную структуру толщиной около 30 нанометров, так называемую 30 нм фибриллу. Дальнейшая упаковка этой фибриллы может иметь различную плотность. Если хроматин упакован плотно его называют конденсированным или гетерохроматином, он хорошо видим под микроскопом. ДНК, находящаяся в гетерохроматине не транскрибируется, обычно это состояние характерно для незначащих или молчащих участков. В интерфазе гетерохроматин обычно располагается по периферии ядра (пристеночный гетерохроматин). Полная конденсация хромосом происходит перед делением клетки.
Если хроматин упакован неплотно, его называют эу- или интерхроматином. Этот вид хроматина гораздо менее плотный при наблюдении под микроскопом и обычно характеризуется наличием транскрипционной активности. Плотность упаковки хроматина во многом определяется модификациями гистонов — ацетилированием и фосфорилированием

Обзор
Автор
Редакторы

Пятерка по системной биологии
В статьях цикла наши авторы пообщаются со стипендиатами разных лет, профессорами и преподавателями Сколтеха, а также с представителями ФМИ.
Наука о хроматине: вчера, сегодня, завтра
Но давайте обо всем по порядку.
Однако попытки идентифицировать с помощью электронной микроскопии в хроматине структуры более высокого порядка дали неоднозначные результаты. Дело в том, что пробоподготовка препаратов для электронной микроскопии приводит к появлению множества артефактов, поэтому ряда структурных элементов хроматина, визуализируемых с помощью электронного микроскопа, в действительности в живой клетке просто нет.
Принципиально новая глава в изучении хроматина открылась на рубеже XX–XXI веков в связи с развитием методов высокопроизводительного секвенирования хроматина. Благодаря приходу биоинформатики в классическую цитологию биологи получили беспрецедентную возможность изучать пространственную организацию хроматина в живой клетке на уровне взаимодействий отдельных участков генома! Новые методы изучения организации хроматина, которые называют C-методами по названию первого разработанного из них — Chromosome Conformation Capture, — основываются на идее, что фрагменты генома, контактирующие друг с другом и, следовательно, располагающиеся рядом, можно сшить в одну молекулу ДНК, которую далее можно отсеквенировать [8] и узнать последовательности взаимодействующих участков.
Один из самых популярных методов для изучения пространственной организации хроматина — Hi-C (подробнее о нем см. во врезке ниже). Он позволяет изучать на полногеномном уровне взаимодействия различных участков генома.

Рисунок 1. Екатерина Храмеева, кандидат биологических наук, старший преподаватель Сколтеха
«Перелом случился с изобретением метода Hi-C в 2009 году, — рассказывает “Биомолекуле” Екатерина Храмеева, стипендиат 2016 года, которая, кстати, сейчас принимает участие в оценивании заявок на стипендию (рис. 1). — Статья с описанием метода Hi-C, вышедшая в Science [9], насчитывает около 3000 цитирований, что очень много. Hi-C — это, возможно, один из самых сложных протоколов в молекулярной биологии, в основном из-за своей многоступенчатости. Каждый отдельный шаг не вызывает запредельных трудностей, но все их нужно выполнить очень аккуратно и не допустить ошибки. И, главное, если всё же допущена ошибка на каком-то из этапов, об этом становится известно только в самом конце пути, когда потрачено много времени и денег на реактивы и секвенирование. Из-за таких трудностей на заре становления метода эксперименты Hi-C умели делать считанные лаборатории в мире (наши коллабораторы — лаборатория Сергея Владимировича Разина в Институте биологии гена РАН — была одной из них), но теперь Hi-C научились делать многие группы, и публикации о хроматине без Hi-C-данных — редкость.
Метод Hi-C — основа изучения организации хроматина
Hi-C (рис. 2) выглядит следующим образом. Сначала клетки фиксируют формальдегидом, при этом между взаимодействующими участками хроматина образуются кросс-сшивки. Далее с ДНК удаляют гистоны, которые не были сшиты с другими белковыми молекулами при фиксации, и очищенную ДНК, связанную через гистоны в местах контактов, обрабатывают рестриктазой. При этом образуются липкие концы, которые достраивают, включая в состав фрагментов нуклеотиды, меченные биотином. После этого образуются комплексы, состоящие из двух молекул ДНК, соответствующих взаимодействующим участкам генома и меченных биотином, которые ковалентно связаны с одними и теми же гистонами, которые в клетке покрывали взаимодействующие участки генома. Теперь фрагменты генома, которые в клетке находились в непосредственном контакте, можно с помощью процедуры лигирования (то есть сшивания) объединить в одну молекулу и за счет биотина, включенного в состав фрагментов, отобрать из клеточного экстракта при помощи белка стрептавидина, обладающего очень высоким сродством к биотину. В результате получается библиотека молекул ДНК, каждая из которых состоит из двух ковалентно сшитых друг с другом участков генома, которые взаимодействовали друг с другом в клетке.

После глубокого секвенирования фрагментов и биоинформатической обработки полученных прочтений на выходе получается тепловая карта взаимодействий, на которой отображена частота выявленных взаимодействий между разными участками генома. По каждой из двух осей карты откладывают крупный участок генома (например хромосому), и квадратики, получающиеся при разбиении каждой из осей на участки генома некоторой длины, закрашивают в зависимости от частоты взаимодействия двух участков генома. Такая карта симметрична относительно диагонали, и более ярко окрашенные треугольники на ней соответствуют хроматиновым доменам, которые также называют топологически-ассоциированными. Внутри этих доменов участки хроматина взаимодействуют друг с другом намного чаще, чем за их пределами. Как удалось недавно доказать, хроматиновые домены, выявленные с помощью Hi-C, примерно тождественны хроматиновым глобулам, которые можно обнаружить в живых клетках с помощью микроскопии [13].
Помимо лаборатории Сергея Разина из Институте биологии гена РАН в России есть и другие группы, освоившие метод Hi-C, например, группа Вениамина Фишмана из Новосибирского государственного университета или лаборатория Олега Гусева в Казанском федеральном университете. Лаборатория Екатерины Храмеевой, одного из пионеров новой науки о хроматине в России, анализирует экспериментальные данные Hi-C, поставляемые учеными из ИБГ РАН.
На вопрос о потенциальном практическом применении знаний о хроматине, полученных с помощью высокопроизводительных методов, Екатерина отвечает, что нарушения упаковки хроматина приводят к изменениями в экспрессии генов, и, как следствие, к тяжелым заболеваниям — нарушениям развития и онкологическим болезням: нейробластоме, лейкемии, медуллобластоме, глиоме, раку прямой кишки. Эти онкологические заболевания являются многофакторными и у каждого пациента могут быть вызваны поломками в разных местах генома. Таким образом, изучение всего многообразия нарушения упаковки хроматина необходимо для развития персональной медицины, для разработки новых методов лечения и диагностики.
— Специалисты из ФМИ пользуются подходами системной токсикологии для исследования влияния продуктов на организм человека .
Токсикология — это область медицины, изучающая ядовитые вещества. Системная токсикология интегрирует классическую токсикологию и количественный анализ разнообразных и молекулярных изменений, которые происходят в организме под действием ядов, на всех уровнях [14].
К числу этих подходов относится и эпигенетика. Исследователи ФМИ пытаются выяснить, каким образом курение сигарет и других табачных продуктов влияет на эпигеном (совокупность всех эпигенетических меток) человека и, следовательно, экспрессию генов и риск возникновения различных заболеваний.
Оценивая воздействие на организм человека бездымных продуктов с пониженным риском, специалисты ФМИ, помимо прочего, исследуют изменения в метилировании ДНК, модификациях гистонов и доступности хроматина.
Что же касается пространственной организации генома, то ученые ФМИ используют Hi-C прежде всего для сборки геномов растений. Дело в том, что метод Hi-C включает этап глубокого секвенирования с высоким покрытием. Хотя Hi-C и родственные методы позволяют изучать взаимодействия участков генома, в том числе и энхансеров с соответствующими промоторами, а также исследовать транскрипционную активность участков генома, специалисты ФМИ пользуются преимущественно методом иммунопреципитации хроматина с последующим секвенированием (ChIP-seq), поскольку этот метод больше подходит для масштабных токсикологических исследований.
У Джулии Хёнг также есть свое видение будущего 3D-геномики:
— 3D-геномика, особенно на уровне единичных клеток, — это очень молодая область, и для дальнейшего использования в биомедицине и системной токсикологии она должна пройти стандартизацию и оптимизацию. Быстрый прогресс методов высокопроизводительного секвенирования, в частности, развитие технологий длинных прочтений (секвенирование третьего поколения [15]), может привести к существенному повышению чувствительности и точности методов изучения единичных клеток до уровня, сопоставимого с биомедицинскими исследованиями [16], [17].
Как устроен хроматин мыши и дрозофилы

Стипендиат 2018 года: Александра Галицына, аспирант четвертого года Центра наук о жизни Сколковского института науки и технологий.
Биология — пожалуй, самая антропоцентричная из всех естественных наук. Подавляющее большинство научных исследований по биологии, не связанных напрямую с изучением биоразнообразия, так или иначе ставят своей целью выяснение определенных деталей функционирования человеческого организма. Даже если непосредственным объектом изучения является мышь или другой живой организм, зачастую ученые пытаются на нем воспроизвести и детально рассмотреть некоторый аспект биологии Homo sapiens или характерный для него биологический процесс, в том числе патологический. Работы, направленные на исследование разнообразных живых организмов на молекулярном уровне, встречаются существенно реже.

Рисунок 3. Работа Александры Галицыной посвящена изучению и сравнению пространственной организации хроматина у дрозофилы, мыши и человека. Подробности в тексте.
Александра Галицына о стипендии ФМИ
— Почему вы решили подать заявку на стипендию ФМИ?
— Когда я была еще студентом факультета биоинженерии и биоинформатики МГУ, я выполнила несколько курсовых работ под руководством Екатерины Храмеевой. Все они были посвящены теме, которая меня чрезвычайно интересовала, — трехмерной организации хроматина. Когда же я защитила диплом, и пришло время решать, что делать дальше, я обратилась за советом к Екатерине. У меня был ворох идей, чем же можно заняться в любимой области. Сфокусироваться на чем-то одном было не так просто. Екатерина рассказала мне о программе ФМИ. Меня впечатлил рассказ Екатерины о ее проекте и наработках, об унифицированном исследовании липидомов разных организмов, их разнообразии и эволюции . Послушав, я определилась и со своей темой — исследованием связи последовательности и трехмерной организации ДНК для разных видов эукариот, в том числе человека, дрозофилы и мыши. Уже тогда я хорошо понимала, что здесь есть свои особенности, из-за которых не обойтись без методов машинного обучения. Итак, я сформулировала идею, обсудила ее с научным руководителем (Михаилом Сергеевичем Гельфандом) и решила податься на стипендию ФМИ с проектом о применении машинного обучения для исследования структуры хроматина столь разных организмов.
— В чем, на ваш взгляд, преимущества стипендии ФМИ по сравнению с другими стипендиями для молодых ученых? Что она дала вам?
— Как вы видите свою исследовательскую деятельность после стипендии? Планируете ли вы заниматься тематикой хроматина в дальнейшем?
Вы тоже можете стать стипендиатом Systems Biology Program!
Если вы — российский биолог, вам не более 35 лет, вы занимаетесь исследованиями в области биологии и имеете не менее двух публикаций в международных рецензируемых журналах с импакт-фактором более 2,0, в том числе одну публикацию с первым или последним авторством, вы можете подать заявку на стипендию Systems Biology Program уже сейчас! Подробная информация и полный список номинаций доступны на официальном сайте стипендиальной программы. Прием заявок продлится до 1 февраля 2021 года. Желаем успеха!
Моделируя хроматин

Стипендиат 2018 года: Павел Кос, младший научный сотрудник кафедры физики полимеров и кристаллов физического факультета МГУ им. М.В. Ломоносова.
Биологи привыкли рассматривать хроматин как носитель наследственной информации, опуская, что он собой представляет с точки зрения физики. В то же время для изучения пространственной организации хроматина именно свежий взгляд со стороны физики может дать весьма интересные результаты.

Рисунок 4. Моделируя хроматин, Павел в качестве исходной модели использовал полимерную цепь, представленную в виде шариков на пружине. Длина цепи соответствует хромосоме в масштабе 1 шарик к 10 тысячам пар оснований. Затем, используя экспериментальную информацию о контактах между участками хромосомы в одиночной клетке, группа Павла получила трехмерную структуру хромосомы. Далее исследователи раскрасили ее в соответствии с экспериментальными данными об активности хроматина. Это позволило изучить распределение активного и неактивного хроматина в трехмерном пространстве внутри хромосомной территории в клеточном ядре. Оказалось, что некоторые элементы укладки хроматина повторяются в различных клетках, несмотря на большую межклеточную вариабельность пространственной организации хроматина.
иллюстрация Любови Колосовской по наброску Павла Коса
Рассказывая о результатах своей работы в рамках стипендиальной программы ФМИ, Павел отмечает:
Павел Кос о стипендии ФМИ
— На момент начала проекта я был аспирантом, а теперь являюсь сотрудником кафедры физики полимеров и кристаллов физического факультета МГУ, и область моих научных интересов тесно связана с биологией. Тематика моих исследований подходила под программу, и я захотел попробовать. После первой попытки я получил очень подробную и полезную рецензию на свой проект, доработал его, расширил. Вторая попытка была удачной.
— Что выделяет стипендию ФМИ среди других стипендий для молодых исследователей? Что она дала лично вам?
— Большое количество возможностей в плане получения гранта у молодых исследователей появилось буквально в последние два года. До этого аспиранты и молодые ученые участвовали, как правило, в больших проектах. Это не всегда позволяло работать над интересующими тебя вопросами в полной мере. Стипендия ФМИ позволила мне самостоятельно ставить и решать научную задачу. Собственно, в этом и есть, наверное, главное преимущество этой стипендии: она позволяет работать над интересными тебе задачами, а также получать ценный опыт управления проектом.
Заключение
Что же ждет науку о хроматине в ближайшие несколько лет? «Я вижу большой потенциал в развитии методов анализа, — продолжает делиться с “Биомолекулой” Екатерина Храмеева. — Данных по хроматину уже много и будет еще больше, при этом анализ отстает. Надо думать, что мы дополнительно можем полезного извлечь из этих данных, если копнем глубже и будем более аккуратными в вычислениях. Уверена, что очень многое можно сделать. Мы смотрим в направлении методов машинного обучения, нейронных сетей, пробуем применять их к анализу хроматиновых данных, а также пытаемся переносить математические методы из других областей науки на хроматин [26].
Применение новых методов для изучения структуры хроматина открывает широчайшие возможности для исследования клеток разных типов и организмов, в том числе клеток сложнейшего органа — головного мозга. Например, Екатерина Храмеева использует метод Hi-C для изучения мозга на уровне отдельных нейронов. Следующая статья нашего спецпроекта расскажет о проектах по изучению системной нейробиологии, которые ведутся в рамках стипендии ФМИ на базе Сколтеха.

До 25—40% сухого веса хроматина составляют гистоновые белки [2] . Гистоны являются компонентом нуклеосом, надмолекулярных структур, участвующих в упаковке хромосом. Нуклеосомы располагаются довольно регулярно, так что образующаяся структура напоминает бусы. Нуклеосома состоит из гистонов четырёх типов: H2A, H2B, H3 и H4. Эти гистоны называются кóровыми. В одну нуклеосому входят по два кóровых гистона каждого типа — всего восемь белков. Линкерный гистон H1, более крупный, чем кóровые гистоны, связывается с ДНК в месте её входа на нуклеосому [3] .
Нить ДНК с нуклеосомами образует нерегулярную соленоид-подобную структуру толщиной около 30 нанометров, так называемую 30-нм фибриллу. Дальнейшая упаковка этой фибриллы может иметь различную плотность. Если хроматин упакован плотно, его называют конденсированным или гетерохроматином, он хорошо видим под микроскопом. ДНК, находящаяся в гетерохроматине не транскрибируется, обычно это состояние характерно для незначащих или молчащих участков. В интерфазе гетерохроматин обычно располагается по периферии ядра (пристеночный гетерохроматин). Полная конденсация хромосом происходит перед делением клетки.
Если хроматин упакован неплотно, его называют эу- или интерхроматином. Этот вид хроматина гораздо менее плотный при наблюдении под микроскопом и обычно характеризуется транскрипционной активностью. Плотность упаковки хроматина во многом определяется модификациями гистонов — ацетилированием, фосфорилированием, метилированием и другими модификациями.
Энциклопедичный YouTube
Субтитры
Читайте также:
- Проект родительский клуб в детском саду
- Подвижные игры для детей начальной школы зачем нужны что развивают примеры игр правила
- Приведите пример в каких случаях стоит учитывать возрастные особенности в школе
- Что такое военная присяга когда она появилась и с какой целью кратко
- План урока в 9 классе по физике карточки тесты основы динамики 2 четверть

